Оксид азоту(I)
| Оксид азоту(I) | |
|---|---|
Резонансна структура оксиду
| |
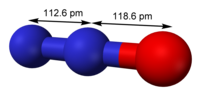
| |
| Інші назви | геміоксид азоту |
| Ідентифікатори | |
| Номер CAS | 10024-97-2 |
| Номер EINECS | 233-032-0 |
| DrugBank | 06690 |
| KEGG | D00102 і C00887 |
| Назва MeSH | D01.362.635.625, D01.625.550.550 і D01.650.550.587.650 |
| ChEBI | 17045 |
| RTECS | QX1350000 |
| Код ATC | N01AX13 |
| SMILES | N#[N+][O-][1] |
| InChI | InChI=1S/N2O/c1-2-3 |
| Номер Бельштейна | 8137358 |
| Номер Гмеліна | 2153410 |
| Властивості | |
| Молекулярна формула | N2O |
| Молярна маса | 44,012 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Запах | солодкуватий |
| Густина | 1,799 г/л[2] |
| Тпл | -90,8 °C[2] |
| Ткип | -88,49 °C[2] |
| Діелектрична проникність (ε) | 1,00104 (20 °C) |
| Показник заломлення (nD) | 1,238 |
| В'язкість | 10,0μПа·с (200 °K) 15,0μПа·с (300 °K) 19,4μПа·с (400 °K) 23,6μПа·с (500 °K) 27,4μПа·с (600 °K) |
| Структура | |
| Дипольний момент | 0,16083 D |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
81,6 кДж/моль |
| Ст. ентропія S 298 |
220,0 Дж/(моль·K) |
| Теплоємність, c p |
38,6 Дж/(моль·K) |
| Небезпеки | |
| ГДК (Україна) | 90 мг/м³ |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Окси́д азо́ту(I), нітроге́н(I) окси́д — неорганічна сполука складу N2O. За звичайних умов є безбарвним газом із солодкуватим запахом. Він може підтримувати горіння; проявляє слабкі окисні та відновні властивості.
Речовина застосовується у медицині для короткочасного наркозу, а також як піноутворювач у харчовій промисловості.
Отримання[ред. | ред. код]
Оксид азоту(I) вперше був отриманий у 1772 році Джозефом Прістлі при термічному розкладанні сухого нітрату амонію:
Розкладання починається за температури 170 °C і далі продовжується із виділенням великої кількості тепла, тому для уникнення надмірно бурхливого ходу реакції нагрівання треба припинити. В іншому випадку, при перегріванні суміші понад 250 °C, нітрат розкладатиметься із утворенням азоту або оксиду азоту(II).
Сучаснішою модифікацією методу Прістлі є розкладання водного розчину нітрату амонію у присутності хлоридів. За цим способом крізь концентровану (30–100 %) нітратну кислоту пропускається аміак. В результаті їхньої взаємодії утворюється нітрат амонію, що розкладається нагріванням. Тепло, що виділяється у подальшому, підвищує температуру реакційної суміші до 100—160 °C. Реакційна рівноважна суміш складається з 30–35 % нітратної кислоти, 30–50 % нітрату амонію, 15–55 % води. В реактор також додають незначну кількість (0,01–0,1 %) хлоридів та, за необхідності, сполуки мангану, нікелю, свинцю, бісмуту, церію — вони виступають в ролі каталізатора реакції.
Хімічні властивості[ред. | ред. код]
При нагріванні оксид азоту розкладається з виділенням азоту:
В атмосфері оксиду деякі метали і неметали згоряють так само активно, як і в кисні, але для ініціювання реакції необхідне високотемпературне нагрівання:
Із воднем та аміаком оксид N2O утворює вибухонебезпечні суміші:
Окрім окисних властивостей, може також проявляти і відновні:
Застосування[ред. | ред. код]
Основна частина синтезованого оксиду азоту(I)[en] використовується у медицині як знеболювальне. У харчовій промисловості речовина застосовується як піноутворювач.
При коронавірусній хворобі 2019[ред. | ред. код]
Опубліковані дані відносно лікування хворих на тяжкий гострий респіраторний синдром 2002–2004 років свідчать про потенційну роль оксиду азоту, що вдихається, як допоміжний захід для лікування пацієнтів з легеневими ускладненнями. Лікування ним знизило легеневу гіпертензію, зменшило виражену гіпоксію та скоротило тривалість вентиляційної підтримки порівняно з відповідними контрольними пацієнтами з ГРВІ. Наразі проводиться 2 фаза клінічного дослідження дії препарату у пацієнтів з коронавірусною хворобою 2019 з метою запобігання прогресування хвороби у хворих з тяжким перебігом[3].
Див. також[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Оксид азоту(I) |
Примітки[ред. | ред. код]
- ↑ nitrous oxide
- ↑ а б в За тиску 101,3 кПа
- ↑ What is the role of nitric oxide in the treatment of coronavirus disease 2019 (COVID-19)? [1] [Архівовано 1 листопада 2020 у Wayback Machine.] (англ.)
Джерела[ред. | ред. код]
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Handbook of Preparative Inorganic Chemistry / G. Brauer. — 2nd. — New York : Academic Press, 1963. — Vol. 1. — 1859 p. (англ.)
- Thiemann M., Scheibler E., Wiegand K. W. Nitric Acid, Nitrous Acid, and Nitrogen Oxides // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 42—43. — DOI: (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
Посилання[ред. | ред. код]
- ЗАКИС АЗОТУ [Архівовано 13 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- Веселящий газ // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |








