Колоректальний рак
| Колоректальний рак | |
|---|---|
 Видалена частина товстої кишки з карциномою (кратероподібне утворення бурого кольору та неправильної форми) | |
| Спеціальність | онкологія |
| Метод діагностики | колоноскопія, virtual colonoscopyd, ректороманоскопія, lower gastrointestinal seriesd, КТ, МРТ, позитрон-емісійна томографія, RAS testd і біохімічний аналіз крові |
| Препарати | Іринотекан[1] |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 2B91 |
| МКХ-10 | C18-C20/C21 |
| МКХ-О | M8140/3 (95 % випадків) |
| OMIM | 114500 |
| DiseasesDB | 2975 |
| MedlinePlus | 000262 |
| eMedicine | med/413 med/1994 |
| | |
| Вікісховище має мультимедійні дані за темою: Колоректальний рак |
Колоректальний рак (КРР) — злоякісна пухлина товстої кишки включно з прямою кишкою у людини, яка походить з епітеліальних клітин, які вистилають внутрішню поверхню товстої та прямої кишок. КРР — одна з найпоширеніших злоякісних пухлин, котра посідає 3 місце за частотою після раку легень, простати або раку молочної залози залежно від статі хворого. В Україні захворюваність КРР становить ≈37 нових випадків на 100 тис. населення на рік, в інших європейських країнах: найвища розповсюдженість в Чехії (60.3 — чоловіки, 32 — жінки), Угорщині (60 та 35), Словаччині (51 27), Німеччині (45 і 32). Найнижча захворюваність на КРР спостерігається в Греції (17.4 і 14), Румунії (21,1 і 14,3), Литві (25 і 17), Фінляндії (25,2 i 21,2) і Латвії (26 i 19,1).[2]
Класифікація КРР[ред. | ред. код]
КРР може виникати як спадкова, спорадична або фамільна форма, кожна з яких має певні особливості.
Спадкова форма[ред. | ред. код]
У разі спадкової форми, КРР спостерігається у хворих молодого віку, у родичів яких було діагностовано КРР. При цій формі часто фоновим захворюванням є фамільний аденоматозний поліпоз товстої кишки або спадковий неполіпозний КРР.
Спорадична форма[ред. | ред. код]
Спорадичний КРР діагностується за відсутності даних КРР в сімейному анамнезі, часто уражає пацієнтів старших 60 років та являє собою ізольовану пухлину товстої або прямої кишок. При цій формі генетичні аномалії визначаються власне в клітинах пухлини, на відміну від спадкової форми, де мутаціями уражені усі клітини.
Сімейна форма[ред. | ред. код]
Концепція сімейної форми КРР була представлена нещодавно. Вважається, що ризик розвитку КРР зростає в два рази, якщо пацієнт має члена родини першого ступеня спорідненості віком менш як 50 років з діагнозом КРР. Пацієнти зі сімейною формою КРР мають різні генетичні аномалії: генетичний поліморфізм, модифікатори генів, дефекти тирозинкіназ.
Молекулярно-генетичні аномалії[ред. | ред. код]
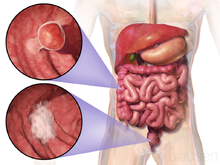
Генетичні дослідження КРР показали схожі генетичні аномалії при раку товстої та прямої кишок.[3]
КРР — це злоякісна пухлина, яка найчастіше виникає внаслідок мутацій в генах сигнального шляху Wnt. Ці мутації можуть бути спадковими або спорадичними, та найчастіше виникають в генах клітин інтерстиціальних крипт.[4],[5] Одним з таких генів Wnt є ген APC, який кодує однойменний протеїн APC. Цей протеїн супресує акумуляцію протеїну β-катеніну, що є одним з центральних компонентів Wnt. Мутований АРС не виконує своє призначення, що призводить до накопичення β-катеніну та міграції останнього до ядра клітини, зв'язування з ДНК та активацію транскрипції генів, що за нормальних умов регулюють відновлення та диференціацію стовбурових клітин, проте в таких умовах відбувається розвиток раку. У деяких випадках КРР може мати дикий тип APC, але високі рівні β-катеніну внаслідок мутацій в гені, який кодує цей протеїн. Також описані мутації в інших генах-супресорах β-катеніну: AXIN1, AXIN2, TCF7L2, NKD1.[6]
Крім елементів сигнального шляху Wnt, мутації в інших генах також можуть виникати та призводити до КРР. Зокрема, мутації можуть виникати в гені TP53, який кодує білок p53 та регулює процеси клітинного поділу та апоптозу, якщо в клітині виникають дефекти сигнального шляху Wnt. При мутаціях в ТР53, порушується регуляція цих процесів та може бути трансформація аденоми в КРР.[6]
Інші протеїни, які часто деактивовані при КРР є TGF-бета та DCC (Deleted in Colorectal Cancer). TGF-бета деактивується внаслідок мутації, що спостерігається в приблизно 50 % всіх КРР. DCC часто деактивований внаслідок делеції.[7]
При КРР також спостерігається посилена експресія онкогенів: KRAS, C-Raf, та PI3K, які стимулюють проліферацію.[8] Іншим геном, мутації в якому можуть призводити до КРР, є супресор пухлин PTEN, який регулює пригнічення експресії PI3K.[6] При КРР також можуть виникати мутації в гені BRAF.
Патологічна анатомія[ред. | ред. код]

КРР з правого боку товстої кишки (висхідна ободова та сліпа кишки) характеризується екзофітним типом росту — тобто пухлина проростає поза межі стінки кишки в напрямку черевної порожнини. Унаслідок цього правосторонні КРР супроводжуються анемією, але зрідка явищами кишкової непрохідності.
Лівосторонній КРР часто проростає в просвіт товстої кишки та може бути причиною кишкової непрохідності.
КРР — аденокарцинома, тобто епітеліальна пухлина, яка походить із залозистого епітелію, що формує мукозний шар стінки товстої кишки. КРР демонструє інвазію в стінку кишки, підслизовий шар та м'язовий шар. Клітини КРР мають неправильні тубулярні структури та бідну строму.
Діагноз[ред. | ред. код]

Залежно від місця локалізації КРР та метастатичного поширення пухлини можуть спостерігатись різні ознаки та симптоми. Класичними симптомами є: закрепи, кров та/або слиз у випорожненнях, зменшення калібру калу, втрата апетиту, зниження ваги тіла, нудота, блювання.[9] Також ректальна кровотеча або анемія є частими ознаками КРР, особливо у хворих, старших 50 років, а інші ознаки, разом з утратою ваги та розладами травлення, часто пов'зуються з наявністю цього патологічного явища.[10]
Для діагностування КРР застосовуються ендоскопічні методи дослідження: колоноскопія та ректороманоскопія, під час яких лікар-ендоскопіст визначає підозріле утворення товстої кишки. Під час ендоскопічного дослідження виконується біопсія підозрілого на КРР утворення з подальшим патогістологічним аналізом біоптату.[11] Менш чутливим способом, є пасаж барію з подальшим рентгенологічним дослідженням товстої кишки. Комп'ютерна томографія, МРТ та ПЕТ застосовуються при підозрі наявності віддалених метастазів КРР.
Лікування[ред. | ред. код]
Лікування КРР може бути хірургічним, хімієтерапевтичним, променевим або паліативним (при неоперабельних пухлинах та неможливості проведення інших видів лікування). Застосування того чи іншого типу лікування залежить від багатьох факторів, наприклад, віку хворого та загального стану його здоров'я, стадії КРР та операбельності пухлини.[12]
Хірургічне лікування[ред. | ред. код]
Більшість хворих з КРР потребує оперативного лікування: видалення карциноми з адекватними краями резекції (видаляється макроскопічно здорова частина кишки з метою попередження можливого проростання карциноми). Видалення карциноми може бути виконане відкритим доступом (лапаротомія) до товстої кишки або з застосуванням мініінвазивного доступу за допомогою лапароскопічного обладнання. Перед операцією хворому проводять дослідження інших органів черевної та грудної порожнини, зокрема печінки та легень, де найчастіше можуть виникати віддалені метастази. Іноді проводиться курс неоад'ювантної (передопераційної) хімієтерапії.[11]
Хімієтерапія[ред. | ред. код]
Хімієтерапія при КРР може проводитись до операції (неоад'ювантна) або після (ад'ювантна). Показаннями до проведення хімієтерапії при КРР є наявність метастазів КРР, які не можуть бути видалені хірургічним шляхом або заради зменшення маси пухлини. Основними хімічними препаратами, які застосовуються для лікування КРР є фторурацил або капецитабін.
Променева терапія[ред. | ред. код]
Неоад'ювантна або ад'ювантна променева терапія проводиться в поєднанні з хімієтерапією переважно при КРР з локалізацією в прямій кишці. При пухлинах у товстій кишці променева терапія застосовується зрідка через ризик ушкодження здорових відділів кишки, які чутливі до радіації.[13]
Паліативне лікування[ред. | ред. код]
Паліативне лікування проводиться пацієнтам з неоперабельними карциномами за неможливості проведення хіміє- або радіотерапії через загальний стан здоров'я. Паліативне лікування направлено на відчутне зменшення болю, виконання колоностомії, видалення пухлини або радіотерапія, стентування при кишковій непрохідності для попередження ускладнення та забезпечення адекватної якості життя пацієнтів.[14],[15]
Запобігання[ред. | ред. код]
Профілактика КРР можлива та нескладна. Зміни стилю життя та харчування дозволяють значно знизити ризик виникнення КРР.[16],[17]
Поточні дієтичні дослідження показали, що збільшення споживання фруктів та овочів, а також зменшення червоного м'яса в харчуванні знижує ризик розвитку КРР.[18] Регулярна фізична активність також розглядається як фактор зниження ризику утворення КРР.[19]
Примітки[ред. | ред. код]
- ↑ Inxight: Drugs Database
- ↑ С.М. Ткач, А.Ю. Иоффе (червень 2005). Колоректальний рак: поширеність, головні чинники ризику
та сучасні підходи до профілактики. Український терапевтичний журнал. 2: 83—88. Bibcode:616.348/.35_006.6_036.2_084 УДК 616.348/.35_006.6_036.2_084.
{{cite journal}}: Перевірте довжину|bibcode=(довідка) - ↑ Cancer Genome Atlas Network (19 July 2012). Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407): 330—337. Bibcode:2012Natur.487..330T. doi:10.1038/nature11252. PMC 3401966. PMID 22810696.
{{cite journal}}: Недійсний|displayauthors=30(довідка) - ↑ Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M (1993). Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature. 363 (6429): 558—61. doi:10.1038/363558a0. PMID 8505985.
- ↑ Srikumar Chakravarthi, Baba Krishnan, Malathy Madhavan (1999). Apoptosis and expression of p53 in colorectal neoplasms. Indian J Med Res. 86 (7): 95—102.
- ↑ а б в Markowitz SD, Bertagnolli MM (December 2009). Molecular Origins of Cancer: Molecular Basis of Colorectal Cancer. N. Engl. J. Med. 361 (25): 2449—60. doi:10.1056/NEJMra0804588. PMC 2843693. PMID 20018966.
- ↑ Mehlen P, Fearon ER (August 2004). Role of the dependence receptor DCC in colorectal cancer pathogenesis. J. Clin. Oncol. 22 (16): 3420—8. doi:10.1200/JCO.2004.02.019. PMID 15310786.
- ↑ Vogelstein, B; Kinzler, KW (2004). Cancer genes and the pathways they control. Nature Medicine. 10 (8): 789—99. doi:10.1038/nm1087. PMID 15286780.
- ↑ al.], edited by Tadataka Yamada ; associate editors, David H. Alpers ... [et (2008). Principles of clinical gastroenterology. Chichester, West Sussex: Wiley-Blackwell. с. 381. ISBN 978-1-4051-6910-3. Архів оригіналу за 6 жовтня 2014. Процитовано 3 травня 2014.
- ↑ Adelstein BA, Macaskill, P, Chan, SF, Katelaris, PH, Irwig, L (2011). Most bowel cancer symptoms do not indicate colorectal cancer and polyps: a systematic review. BMC gastroenterology. 11: 65. doi:10.1186/1471-230X-11-65. PMC 3120795. PMID 21624112.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N (2010). Colorectal cancer. Lancet. 375 (9719): 1030—47. doi:10.1016/S0140-6736(10)60353-4. PMID 20304247.
- ↑ Stein A, Atanackovic, D, Bokemeyer, C (Sep 2011). Current standards and new trends in the primary treatment of colorectal cancer. European journal of cancer (Oxford, England : 1990). 47 Suppl 3: S312—4. doi:10.1016/S0959-8049(11)70183-6. PMID 21943995.
- ↑ authors, editors, Vincent T. DeVita, Jr., Theodore S. Lawrence, Steven A. Rosenberg ; associate scientific advisors, Robert A. Weinberg, Ronald A. DePinho ; with 421 contributing (2008). DeVita, Hellman, and Rosenberg's cancer : principles & practice of oncology (вид. 8th). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. с. 1258. ISBN 978-0-7817-7207-5. Архів оригіналу за 11 січня 2014. Процитовано 4 травня 2014.
- ↑ Wasserberg N, Kaufman HS (December 2007). Palliation of colorectal cancer. Surg Oncol. 16 (4): 299—310. doi:10.1016/j.suronc.2007.08.008. PMID 17913495.
- ↑ Amersi F, Stamos MJ, Ko CY (July 2004). Palliative care for colorectal cancer. Surg. Oncol. Clin. N. Am. 13 (3): 467—77. doi:10.1016/j.soc.2004.03.002. PMID 15236729.
- ↑ Searke, David (2006). Cancer Epidemiology and Prevention (вид. 3). Oxford University Press. с. 809. ISBN 9780199747979. Архів оригіналу за 4 травня 2014. Процитовано 4 травня 2014.
- ↑ Rennert, Gad (2007). Cancer Prevention. Springer. с. 179. ISBN 9783540376965. Архів оригіналу за 4 травня 2014. Процитовано 4 травня 2014.
- ↑ Campos FG, Logullo Waitzberg, AG, Kiss, DR, Waitzberg, DL, Habr-Gama, A, Gama-Rodrigues, J (Jan 2005). Diet and colorectal cancer: current evidence for etiology and prevention. Nutricion hospitalaria : organo oficial de la Sociedad Espanola de Nutricion Parenteral y Enteral. 20 (1): 18—25. PMID 15762416.
- ↑ Harriss DJ, Atkinson, G, Batterham, A, George, K, Cable, NT, Reilly, T, Haboubi, N, Renehan, AG, Colorectal Cancer, Lifestyle, Exercise And Research, Group (Sep 2009). Lifestyle factors and colorectal cancer risk (2): a systematic review and meta-analysis of associations with leisure-time physical activity. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland. 11 (7): 689—701. doi:10.1111/j.1463-1318.2009.01767.x. PMID 19207713.