Онієві сполуки
О́нієві сполу́ки — сполуки, утворені протонуванням (або алкілюванням тощо) сполук елементів 14–17 (IVa–VIIa) груп.
Застосовуються як агенти алкілювання, каталізатори, поверхнево-активні речовини.
Онієві сполуки утворюються катіонами, які зазвичай мають склад, що описується як ERn+1+, де E — центральний атом у вихідній сполуці, R — замісник, n — ступінь окиснення, яка проявляється в елементу E у сполуці. Однак, залежно від протонованої сполуки, кількість центральних атомів може збільшуватися (наприклад, при протонуванні гідразину N2H4 утворюється гідразоній N2H5+). Також зустрічаються сполуки, що мають склад ERn+22+.
Назва онієвого катіона складається з кореня назви центрального атома (або протонованої сполуки) та кінцівки -оній (запозиченої з назви амоній), наприклад фосфор — фосфоній. Ряди сполук мають власні умовні назви, залежно від елементу-комплексоутворювача: якщо таким елементом є оксиген, то сполуки іменуватимуться оксо́нієвими, сульфур — сульфо́нієвими, елементи ряду галогенів — галогено́нієвими, фосфор — фосфо́нієвими тощо.
Замісниками найчастіше є гідроген та алкільні групи (а тому числі ароматичні, наприклад, феніл), рідше аміногрупи, гідросульфат-іон. Залежно від кількості введених замісників розрізняють первинні, вторинні, третинні та четвертинні похідні відповідного катіону.

Прості онієві сполуки утворені незаміщеними катіонами. Їх синтезують протонуванням відповідних гідридів. До цієї групи належать представники різних груп.
| Група | Назва | Склад | Протонований гідрид |
|---|---|---|---|
| 17 | Флуороній | H2F+ | фтороводень |
| Хлороній | H2Cl+ | хлороводень | |
| Бромоній | H2Br+ | бромоводень | |
| Йодоній | H2I+ | йодоводень | |
| 16 | Оксоній | H3O+ | вода |
| Сульфоній | H3S+ | сірководень | |
| Селеноній | H3Se+ | селеноводень | |
| Телуроній | H3Te+ | телуроводень | |
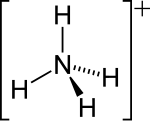
| 15 | Амоній | NH4+ | амоніак |
| Фосфоній[en] | PH4+ | фосфін | |
| Арсоній | AsH4+ | арсин | |
| Стибоній | SbH4+ | стибін | |
| Бісмутоній | BiH4+ | бісмутин | |
| 14 | Метоній | CH5+ | метан |
| Етоній | C2H5+ | етан | |
| Силаній | SiH5+ | силан | |
| Дисиланій | Si2H7+ | дисилан | |
| Гермоній | GeH5+ | герман |

Онієві катіони можуть приймати групу замісника на місце гідрогену. Це дає можливість утворювати сполуки, що значно відрізняються за своїми властивостями від сполук простих онієвих катіонів.
Заміщені катіони класифікують за кількістю приєднаних однодентатних замісників. При іменуванні сполук за основу назви береться простий катіон із додаванням до нього назв замісників та числівника, що позначає їхню кількість:
- диметилсульфоній (CH3)2SH+
- триметилоксоній (CH3)3O+
- тетрафенілфосфоній (C6H5)4P+

Заміщені катіони зустрічаються у живій природі. До вітамінів групи B належить холін (вітамін B4) — тетраалкілзаміщена амонієва сполука. З нього синтезується похідна ацетилхолін — сполука, що є передавачем у нервовій системі організмів.
Деякі замісники мають здатність приєднуватися за подвійними та потрійними зв'язками, заміщуючи відповідну кількість атомів у вихідному гідриді. Такі катіони є малопоширеними й вони нерідко мають власні, тривіальні назви, які перегукуються з органічними відповідниками, наприклад:
- сполуки іміній-катіону R1R2C=N+R3R4
- сполуки нітрилій-катіону RC≡NH+
- сполуки гідрокарбілідиноксонію RC≡O+
- сполуки нітронію O=N+=O
Зазвичай онієві сполуки є білими, гігроскопічними кристалічними речовинами. Вони добре розчиняються у воді, нижчих спиртах та деяких інших полярних розчинниках, малорозчинні в етерах та вуглеводнях.
Галогенонієві сполуки є відносно стійкими лише у розчинах (у розчинниках на кшталт рідкого SO2), при температурі не вище -40 °C.
Із солей фосфонію стійкими є лише його четвертинні похідні, інші легко гідролізуються.
Алкілзаміщені онієві катіони отримують алкілюванням гідридів або їхніх похідних. Реакція відбувається у присутності каталізаторів AlCl3 або NiBr2[en]
Для синтезу арилпохідних беруться відповідні оксогалогеніди:
Як алкілюючі агенти можна також використовувати реактив Гріньяра:
Оксонієві сполуки вдається отримати протонуванням спиртів та етерів у середовищі флуоросульфатної кислоти, SO2 і SbF5.
Основним застосуванням онієвих сполук є алкілювання в органічному синтезі.
Галогенонієві солі є каталізаторами полімеризації. Фосфонієві солі, зокрема, четвертинні, застосовуються як поверхнево-активні речовини, екстрагенти, емульгатори, флотореагенти.
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
- Olah George A. Onium Ions. — New York : John Wiley & Sons, 1998. — 509 p. — ISBN 0-471-14877-6. (англ.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)

|
Це незавершена стаття з хімії. Ви можете допомогти проєкту, виправивши або дописавши її. |




