Перманганат калію
| Перманганат калію | |
|---|---|

| |

| |
| |
| Назва за IUPAC | Манганат калію (VII) |
| Систематична назва | Перманганат калію |
| Інші назви | Марганцовка |
| Ідентифікатори | |
| Номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Номер EINECS | 231-760-3 |
| Номер EC | 231-760-3 |
| DrugBank | DB13831 |
| KEGG | D02053 |
| Назва MeSH | D01.530.700 і D01.745.750 |
| RTECS | SD6475000 |
| Код ATC | V03AB18 і D08AX06 |
| SMILES | [O-][Mn](=O)(=O)=O.[K+][1] |
| InChI | InChI=1S/K.Mn.4O/q+1;;;;;-1 |
| Властивості | |
| Молекулярна формула | KMnO4 |
| Молярна маса | 158,034 г/моль |
| Зовнішній вигляд | темно-фіолетові кристали з металевим блиском |
| Запах | без запаху |
| Густина | 2,7 г/см³ |
| Тпл | 240 °C (розкладається) |
| Розчинність (вода) | 76 г/л (25 °C)
250 г/л (65 °C) |
| Розчинність (спирти) | розкладається |
| Тиск насиченої пари | 1Па при 20 °C |
| Показник заломлення (nD) | 1.59 |
| Структура | |
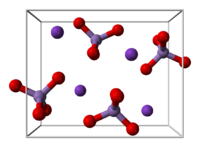
| Кристалічна структура | Ромбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
−813,4 кДж/моль |
| Ст. ентропія S 298 |
171,7 Дж/(моль·К) |
| Теплоємність, c p |
119,2 Дж/(моль·К) |
| Небезпеки | |
| ЛД50 | 750 мг/кг (перорально, щури) 500 мг/кг (підшкурно, миші)[2] |
| ГГС піктограми |    
|
| NFPA 704 | |
| Пов'язані речовини | |
| Інші аніони | Пертехнетат калію Перренат калію |
| Інші катіони | Перманганат натрію Перманганат амонію Перманганат кальцію Перманганат срібла |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Пермангана́т ка́лію — неорганічна сполука з формулою , що складається з іонів калію () та перманганату ().
У розчині перманганат-іони мають яскраво-фіолетовий колір, а тверда речовина має вигляд пурпурово-чорних кристалів.
Сполука має сильні властивості окисника, а ступінь окиснення мангану в перманганаті дорівнює +7.
В Україні перманганат калію внесено до переліку прекурсорів[3], що обмежує його продаж в аптеках.
Фізичні властивості[ред. | ред. код]
Зовнішній вигляд: темно-фіолетові кристали з металевим блиском. Показник заломлення σ 1,59 (при 20 °C). Розчиняється у воді (див. таблицю), рідкому аміаку, ацетоні (2:100), метанолі, піридині.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
| Розчинність, г/100 г води | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
| Стандартна ентальпія утворення ΔH | −813,4 кДж/моль |
| Стандартна енергія Гіббза G | −713,8 кДж/моль |
| Стандартна молярна ентропія S | 171,71 Дж/моль·K |
| Теплоємність Cp | 119,2 Дж/моль·K |
Отримання[ред. | ред. код]
Хімічна або електрохімічне окислення сполук марганцю, диспропорціонування калію. Наприклад:
Остання реакція відбувається при електролізі концентрованого розчину манганату калію і є ендотермічною. Вона є основним промисловим способом отримання перманганату калію.
Хімічні властивості[ред. | ред. код]
Є сильним окисником. Залежно від pH розчину, окислює різні речовини, відновлюючись до сполук марганцю різного ступеня окислення: у кислому середовищі — до сполук марганцю (II), в нейтральній — до сполук марганцю (IV), у сильно лужному — до сполук марганцю (VI).
| Окиснена форма | Відновлена форма | Середовище | E0, В |
|---|---|---|---|
| MnO− 4 |
MnO2− 4 |
OH− | +0,56 |
| MnO− 4 |
H2MnO4 | H+ | +1,22 |
| MnO− 4 |
MnO2 | H+ | +1,69 |
| MnO− 4 |
MnO2 | OH− | +0,60 |
| MnO− 4 |
Mn2+ | H+ | +1,51 |
Приклади реакцій наведено нижче (на прикладі взаємодії з сульфітом калію):
- В кислому середовищі:
- в нейтральному середовищі:
- в лужному середовищі:
- в лужному середовищі: на холоді:
Однак треба зазначити, що остання реакція (у лужному середовищі) протікає за зазначеною схемою тільки при недоліку відновлення і високої концентрації лугу, який забезпечує уповільнення гідролізу манганату калію.
При зіткненні з концентрованою сірчаною кислотою перманганат калію вибухає, однак при акуратному з'єднанні з холодною кислотою реагує з утворенням нестійкого оксиду марганцю (VII):
При цьому, як проміжний продукт може утворюватися сполука — оксосульфат марганцю .
По реакції з фторидом йоду (V) можна отримати аналогічний оксофторид марганцю:
При нагріванні розкладається з виділенням кисню (цим способом користуються в лабораторії для отримання чистого кисню). Схему реакції спрощено можна подати рівнянням:
Насправді реакція протікає набагато складніше, наприклад, при не дуже сильному нагріванні її можна приблизно описати рівнянням:
Реагує з солями двовалентного марганцю, наприклад:
Ця реакція в принципі обернена дисмутації:
- на та .
Водні розчини перманганату калію термодинамічно нестабільні, але кінетично досить стійкі. Їх збереження різко підвищується при зберіганні в темряві.
Застосування[ред. | ред. код]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Застосування цієї солі найчастіше засноване на високій окиснювальної здатності перманганат-йона, що забезпечує антисептичну дію.
Медичне застосування[ред. | ред. код]
Перманганат калію (лікарський засіб)[en]
Розбавлені розчини (близько 0,1 %) перманганату калію знайшли найширше застосування в медицині як антисептичний засіб, для полоскання горла, промивання ран, обробки опіків. Як блювотний засіб для прийому всередину при деяких отруєннях використовують розведений розчин.
Фармакологічна дія[ред. | ред. код]
Антисептичний засіб з групи окисників. При зіткненні з органічними речовинами виділяє атомарний кисень. Утворений при відновленні препарату оксид утворює з білками комплексні сполуки — альбумінати (за рахунок цього калію перманганат в малих концентраціях має в'яжучу, а в концентрованих розчинах — дражливу, припікаючу і дубильну дію). Дезодорує. Ефективний при лікуванні опіків і виразок. Здатність калію перманганату знешкоджувати деякі отрути лежить в основі використання його розчинів для промивання шлунку при отруєннях невідомою отрутою і харчових токсикоінфекціях. При попаданні всередину всмоктується, діючи (призводить до розвитку метгемоглобінемії). Використовується також в гомеопатії.
Показання[ред. | ред. код]
Змазування виразкових і опікових поверхонь — інфіковані рани, виразки і опіки шкіри. Полоскання порожнини рота та ротоглотки — при інфекційно-запальних захворюваннях слизової оболонки порожнини рота і ротоглотки (у тому числі при ангінах). Для промивання та спринцювання при гінекологічних та урологічних захворюваннях — кольпіти і уретрити. Для промивань — шлунку при отруєннях, викликаних прийомом всередину алкалоїдів (морфін, аконітин, нікотин), синильною кислотою, фосфором, хініном; шкіри — при попаданні на неї аніліну; очей — при ураженні їх отруйними комахами.
Протипоказання[ред. | ред. код]
Гіперчутливість.
Побічні дії[ред. | ред. код]
Алергічні реакції, при використанні концентрованих розчинів — опіки і подразнення. Передозування. Симптоми: різкий біль у порожнині рота, по ходу стравоходу, в животі, блювота, діарея; слизова оболонка порожнини рота і глотки — набрякла, темно-коричневого, фіолетового кольору, можливий набряк гортані, розвиток механічної асфіксії, опікового шоку, рухового збудження, судом, явищ паркінсонізму, геморагічного коліту, нефропатії, гепатопатії. При зниженій кислотності шлункового соку можливий розвиток метгемоглобінемії з вираженим ціанозом і задишкою. Смертельна доза для дітей — близько 3 г, для дорослих — 0,3–0,5 г/кг.
Лікування: метиленовий синій (50 мл 1 % розчину), аскорбінова кислота (в/в — 30 мл 5 % розчину), ціанокобаламін — до 1 мг, піридоксин (в/м — 3 мл 5 % розчину).
Спосіб застосування та дози[ред. | ред. код]
Зовнішньо, у водних розчинах для промивання ран (0,1–0,5 %), для полоскання рота і горла (0,01–0,1 %), для змазування виразкових і опікових поверхонь (2–5 %), для спринцювання (0,02–0,1 %) в гінекологічній і урологічній практиці, а також промивання шлунку при отруєннях.
Взаємодія[ред. | ред. код]
Хімічно несумісний з деякими органічними речовинами (вугілля, цукор, танін) і з речовинами, які легко окислюються — може статися вибух.
Інші сфери застосування[ред. | ред. код]
- Застосовується для визначення перманганатної окислюваності при оцінці якості води згідно з ГОСТ 2761-84 (ГОСТ 23268.12-78) за методом Кубеля[4][5].
- Лужний розчин перманганату калію добре відмиває лабораторний посуд від жирів і інших органічних речовин.
- Розчини (концентрації приблизно 3 г/л) широко застосовуються для тонування фотографій.
- У піротехніці застосовують як сильний окислювач.
- Застосовують як каталізатор розкладу перекису водню в космічних рідинно-ракетних двигунах.
- Водний розчин перманганату калію використовується для травлення дерева, як морилки.
- Водний розчин застосовується також для виведення татуювань. Результат досягається за допомогою хімічного опіку, при якому відмирають тканини, в яких міститься барвник. Цей метод мало чим відрізняється від простого зрізання шкіри, зазвичай він менш ефективний і неприємніший, оскільки опіки гояться набагато довше. Татуювання не видаляється повністю, на його місці залишаються шрами.
- Перманганат калію або біхромат натрію використовуються як окислювач при отриманні метану, і парафталевих кислот з мета- і пара-ксилолу відповідно.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ POTASSIUM PERMANGANATE
- ↑ перманганат калію. PubChem [Інтернет]. Bethesda (MD): Національна медична бібліотека (США), Національний центр біотехнологічної інформації. Процитовано 2 квітня 2023.
- ↑ Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів. Офіційний вебпортал парламенту України (укр.). Процитовано 3 квітня 2023.
- ↑ Мураєва О. О. КОНСПЕКТ ЛЕКЦІЙ з дисципліни «АНАЛІТИЧНА ХІМІЯ» (С.9), 2009
- ↑ Економіка водокористування: стан, проблеми, перспективи: монографія/ Н. Л. Авраменко, І. С. Сагайдак, Т. М. Чорна. — К. : ТОВ «7БЦ», 2018. — 138 с. ISBN 978-617-7625-48-2 Ел.джерело [Архівовано 13 серпня 2021 у Wayback Machine.] (4, 44, 50-51, 53, 58, 84)
Джерела[ред. | ред. код]
- Вульфсон Н. С. — Препаративная органическая химия. —перевод с польского В. В. ШПАНОВА и В. С. ВОЛОДИНОЙ. — М., 1959. — С.656,657.(рос.)
- Казанский Б. А. (ред.) — Синтезы органических препаратов (Сборник 3) с.145.(рос.)
- Реми Г. — Курс неорганической химии (Том 1) с.817.(рос.)
Література[ред. | ред. код]
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
- Фармакологія: підручник (ВНЗ І—ІІІ р. а.) / І. В. Нековаль, Т. В. Казанюк. — 7-е вид., переробл. і допов. — «Медицина», 2016 — 552 с. ISBN 978-617-505-507-6 (С.?)
Посилання[ред. | ред. код]
- КАЛІЮ ПЕРМАНГАНАТ [Архівовано 17 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- National Pollutant Inventory: Manganese and compounds Fact Sheet(англ.)
- The Use of Potassium Permanganate in Fish Ponds[Архівовано 6 червня 2011 у Wayback Machine.]
- Sugar, NaOH and KMnO4(англ.)
| Це незавершена стаття про лікарські засоби. Ви можете допомогти проєкту, виправивши або дописавши її. |
| Це незавершена стаття про неорганічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
















![{\displaystyle {\ce {2KMnO4 ->[{t}] K2MnO4 + MnO2 + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e465243276dcd85fc06695d4e121b4c8c6c1a96)
![{\displaystyle {\ce {5KMnO4 ->[{t}] K2MnO4 + K3MnO4 + 3MnO2 + 3O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/94f47521a42bbe11a12bd413bdae578722ed8586)


