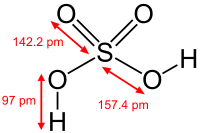
Сульфатна кислота
| Сульфатна кислота | |
|---|---|

| |
| |
| Інші назви | Купоросне масло |
| Ідентифікатори | |
| Номер CAS | 7664-93-9 |
| Номер EINECS | 231-639-5 |
| DrugBank | DB11309 |
| KEGG | D05963 і C00059 |
| ChEBI | 26836 |
| RTECS | WS5600000 |
| SMILES | OS(O)(=O)=O[1] |
| InChI | InChI=1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) |
| Номер Бельштейна | 2037554 |
| Номер Гмеліна | 2122 |
| Властивості | |
| Молекулярна формула | H2SO4 |
| Молярна маса | 98,08 г/моль |
| Зовнішній вигляд | Прозора оліїста рідина |
| Густина | 1,8356 г/см³ |
| Тпл | 10,38 °C |
| Ткип | 279,6 °C 296,2°C* ( 100% ) 336,5°C* ( 98,3% ) 268,9°C* ( 90% ) 210,2°C* ( 80% ) 141,8°C* ( 60% ) *760тор [2] |
| Небезпеки | |
| Класифікація ЄС | |
| S-фрази | (S1/2) S26 Шаблон:S30 S45 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Сульфа́тна кислота́ (сірчана кислота, IUPAC — дигідрогенсульфат, застаріла назва — купоросна олія) — сполука сірки з формулою H2SO4. Безбарвна масляниста, дуже в'язка і гігроскопічна рідина. Сірчана кислота — одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються два або один атоми гідрогену на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Вона використовується в основному у формі водних розчинів для виробництва добрив, як каталізатор в органічних синтезах, а також у виробництві інших неорганічних кислот.
Історія

Сульфатна кислота (або стара назва — купоросна олія) була відома з давніх часів. Перші згадки про неї можна знайти в текстах алхіміка Джабіра ібн Хайяна 8-го століття. Можливі методи виробництва описані в працях Альберта Великого (1200–1280) і Василя Валентина (1600). В основі цього методу лежить утворення кислоти з хальканинту та галунів. Застаріла назва походить від застарілої назви мінералів з яких вона отримувалася — купороси. Перші наукові дослідження за допомогою сірчаної кислоти провів Йоганн Рудольф Глаубер. Він провів реакцію між сірчаною кислотою і сіллю та отримав соляну кислоту і сіль, яка була названа на його честь — глауберова сіль[3]. Методи, у яких були використані сульфати, були дуже складними і дорогими. Для отримання великих кількостей цієї речовини в 18-му столітті розробили процес, в якому використовувалося спалення сірки й селітри у скляній тарі. Через те, що скляні посудини були дуже крихкими, перша реакція була проведена в 1746 році Джоном Робаком у свинцевих контейнерах. Сірчана кислота створена методом Джона Робака мала концентрацію тільки 35-40 %. Пізніше поліпшення методу французьким хіміком Жозефом Луї Гей-Люссаком і англійським Джоном Гловером дало вихід речовини 78 % концентрації. Тим не менше, виробництво деяких барвників та інших хімічних речовин вимагає більш концентрованого продукту. Протягом 18-го століття сірчана кислота отримувалася сухою перегонкою мінералів, процес схожий на оригінальні алхімічні процеси. Пірит (дисульфід заліза, FeS2) нагрівали в повітрі для отримання заліза(II)сульфат, FeSO4, який окислюється при подальшому нагріванні до заліза(III)сульфат Fe2(SO4)3, який, при нагріванні до 480 ° С, розкладається до заліза(III)оксид і триоксида сірки, який може бути використаний для отримання сірчаної кислоти в будь-якої концентрації. У 1831 році британський купець Перегрін Філліпс запатентував контактний процес, який був набагато більш економічний. Сьогодні майже вся сірчана кислота у світі виробляється з використанням цього методу.
Знаходження в природі
Земля

Вільна сірчана кислота зустрічається в природі дуже рідко. В атмосфері вона утворюється з діоксиду сірки, який утворюється при згоранні сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється гідроксильними радикалами та киснем з утворенням триоксиду сірки, який вступаючи в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також можна знайти в деяких вулканічних джерелах, які називаються сольфатари. Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати, зустрічається в природі набагато частіше. Існує багато різних мінералів сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 · 2 H2O), барит (BaSO4), халькантит (CuSO4 · 5 H2O) і глауберова сіль (Na2SO4 · 10 H2O).
Знаходження поза межами землі

Сірчана кислота знаходиться за межами Землі в верхніх шарах атмосфери Венери. Вона утворюється в результаті фотохімічних реакцій діоксиду сірки і води, які утворюють краплі 80-85 % кислоти. У більш глибоких шарах, кислота розпадається через високі температури знову на діоксид сірки, і воду, які піднімаючись догори знову можуть утворювати сірчану кислоту.[4] Інфрачервоні спектри які були отримані апаратом Галілео показують різні ступені поглинань на супутнику Юпітера, які були віднесені до одного або кількох видів гідратів сульфатної кислоти.[5]
Виробництво


Сировиною для виробництва сірчаної кислоти є елементарна сірка, яку отримують в величезних кількостях на нафто- та газовопереробних заводах, з сірководню, за допомогою процесу, який відомий як процес Клауса. Потім сірку окислюють до діоксиду сірки:
- Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцеві сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
- Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн тонн піриту для виробництва сульфатної кислоти. В Азії ця цифра більша, оскільки і запаси його більші.[6] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту. Для подальшого виробництва потребується сірчаний ангідрид. При низьких температурах реакція проходить повільно, оскільки вимагає порівняно рідкісних в газовій фазі потрійних зіткнень, а при високих рівновага зміщена в бік розкладу сірчаного ангідриду . Тому для проведення цієї реакції потрібні каталізатори. На ранніх порах використовували платину, пізніше перейшли на ванадієвий ангідрид V2O5 або ванадати лужних металів KVO3. В[7] як каталізатор згадується Fe2O3 з домішкою CuO утворені в результаті випалювання сульфідної руди (температура каталізу нижча за температуру відпалу, тому каталізатор існуватиме в формі суміші сульфатів). В більш пізніх виданнях цього автора такий каталізатор не згадується, зате у виданнях, мабуть, всіх років приводиться порівняння залежності каталітичної ефективності від температури для Pt, Ag3VO4 та V2O5. Ефективність зростає з ціною каталізатора (каталіз гетерогенний, отже швидкість реакції віднесена до одиниці поверхні; каталізатор в таких процесах стараються зробити якомога більш дрібнозернистим).
- Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж: через занадто бурхливу початкову реакцію в контакті з водою утворюється плівка туману сульфатної кислоти, що перешкоджає подальшій реакції. Спочатку його вводять у концентровану сірчану кислоту, цей розчин називають — олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
- Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
- Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло, в основному, в Китаї, у той час як в європейських країнах, виробництво скоротилося.
В домашніх умовах невеликі кількості розведеної сульфатної кислоти можна отримати електролізом розчину мідного купоросу із свинцевим анодом (напруга має бути вищою за 2 В через велику перенапругу виділення кисню на двоокисі свинцю, який утворюється на поверхні аноду, але не більше 5 В, щоб не перегрівати).
Фізичні властивості
100%-ва сірчана кислота («моногідрат») при кипінні втрачає SO3 та невелику кількість води з утворенням 98,3 % кислоти (азеотропна суміш). 98 % кислота є стабільнішою при зберіганні, і зазвичай також називається концентрованою. Інші концентрації використовуються для різних цілей. Дані про різні концентрації:
| Масова частка H2SO4 |
Щільність (кг/л) |
Концентрація (моль/л) |
Назва |
|---|---|---|---|
| 10 % | 1,07 | ~1 | Розведена сульфатна кислота |
| 29-32 % | 1,25-1,28 | 4,2-5 | акумуляторна кислота (використовується в свинцево-кислотних акумуляторних батареях) |
| 62-70 % | 1,52-1,60 | 9,6-11,5 | Фотопаратна кислота Добривна кислота |
| 78-80 % | 1,70-1,73 | 13,5-14 | Вежова кислота Гловерова кислота |
| 95-98 % | 1,83 | ~18 | Концентрована сульфатна кислота |
Хімічно чиста сульфатна кислота є важкою безбарвною маслянистою рідиною. Продають, зазвичай, 96,5 % водний розчин густиною 1,84 г/см3 або так званий «олеум», тобто розчин SO3 в H2SO4. У воді H2SO4 розчиняється дуже добре (змішується з водою в необмежених кількостях). При цьому виділяється тепло, і розчин дуже сильно нагрівається (навіть до кипіння води). Тому при додаванні води до концентрованої сульфатної кислоти остання розбризкується внаслідок швидкого перетворення води в пару. Через це при розведенні концентрованої H2SO4 треба кислоту вливати у воду (а не навпаки!) тонким струменем при старанному розмішуванні розчину скляною паличкою. Концентрована сульфатна кислота як і чиста вода погано проводить струм внаслідок малої дисоціації, питома електропровідність 1,044 · 10−2 S/см
Хімічні властивості
Дисоціація у водному розчині йде в декілька етапів:
- Перший етап дисоціації;K1 = 2.4 x 106 (сильна кислота)
Це значення кислотності взяте як основне при визначенні суперкислот.
- Друга стадія дисоціації;K2 = 1.0 x 10−2

Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо. Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля.

При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом та деякими іншими металами через їх пасивацію. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.
- Реакція міді з концентрованою сульфатною кислотою

Застосування
Сірчана кислота є дуже важливим товаром хімічної промисловості і є індикатором її промислової потужності.[8][9] Світове виробництво в 2004 році становило близько 180 млн тонн, при такому географічному розподілі: Азія 35 %, Північна Америка 24 %, Африка 11 %, Західна Європа 10 %, Східна Європа і Росія 10 %, Австралія і Океанія 7 %, Південна Америка 7 %.[10] Більша частина виробленої кислоти (~ 60 %) витрачається на виробництво добрив, суперфосфату, фосфату амонію, сульфатів, сульфату амонію. Близько 20 % використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, а також для різних технічних процесів. Близько 6 % використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовується також як осушувач газів.
Електроліт
Сірчана кислота діє як електроліт в свинцево-кислотних акумуляторах: На негативному електроді :
На позитивному електроді:
Загалом:
Каталізатор
Сірчана кислота використовується також для інших цілей в хімічній промисловості. Наприклад, вона є кислотним каталізатором для перетворення циклогексанону оксиму в капролактам, який використовується для виготовлення капрону. Вона використовується для виготовлення соляної кислоти з солі. Сульфатна кислота використовується в нафтопереробній промисловості, як каталізатор реакції ізобутану та ізобутилену, для утворення ізооктану, сполуки, що має еталонне октанове число, і придатної для створення високооктанового бензину без металовмісних присадок.
Водопідготовка
Сірчану кислоту нараду з соляною можуть використовувати для підкислення води, особливо у замкнених контурах для зменшення відкладення карбонату кальцію. Також, сірчану кислоту використовують для виробництва сульфовугілля та для регенерації катіонообмінних смол.[11]
Безпека
Сірчана кислота їдка, хоча через значну в'язкість опік може статись за час, достатній для змивання кислоти, що потрапила на шкіру. В цьому сенсі більш небезпечні олеум та хлорсульфонова кислота, які можуть швидко спричинити сильні опіки. За корозійними властивостями менш небезпечна, ніж соляна чи азотна кислоти, оскільки менш летка і не дуже активний окисник при звичайних температурах. Найбільш небезпечне потрапляння на відкриті слизові оболонки. Потрапляння в очі може статись при спробі розбавлення концентрованої кислоти доливанням до неї води (пряме порушення правил поводження з концентрованою сульфатною кислотою), при цьому вода закипає і розбризкується разом з кислотою. Вражені ділянки промивають великою кількістю води і 5 % розчином питної соди.
Примітки
- ↑ sulfuric acid — EBI.
- ↑ "Справочник химика" , 3-Т , 2-ге вид.,1965р.
- ↑ Walter Jansen: Zum Gedenken: Johann Rudolph Glauber, in: Chemikon, 2004, 11, 3, S. 155; DOI:10.1002/ckon.200490022.
- ↑ V. A. Krasnopolsky, V. A. Parshev: Chemical composition of the atmosphere of Venus, in: Nature, 1981, 292, S. 610-613; DOI:10.1038/292610a0.
- ↑ Orlando, T. M.; McCord, T. B.; Grieves, G. A. (2005). The chemical nature of Europa surface material and the relation to a subsurface ocean. Icarus (journal). 177 (2): 528—533. Bibcode:2005Icar..177..528O. doi:10.1016/j.icarus.2005.05.009.
- ↑ E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5, S. 503.
- ↑ Некрасов Б.В. Основы общей химии. — М. : «Химия», 1965. — Т. 1-й. (рос.)
- ↑ Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. с. 45—57. ISBN 0471010774.
- ↑ «Цікава хімія», М. Д. Василега, К., «Радянська школа» , 1980
- ↑ Davenport, William George and King, Matthew J. (2006). Sulfuric acid manufacture: analysis, control and optimization. Elsevier. с. 8, 13. ISBN 978-0-08-044428-4. Процитовано 23 грудня 2011.
- ↑ В.О.Шадура; Н.В.Кравченко (2018). Водопостачання та водовідведення (PDF). с. 183-184.
{{cite book}}: Вказано більш, ніж один|pages=та|page=(довідка)
Література
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Посилання
- Сірчана кислота // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- КИСЛОТА СІРЧАНА //Фармацевтична енциклопедія
- КИСЛОТА СУЛЬФАТНА //Фармацевтична енциклопедія








![{\displaystyle {\ce {Pb + 3SO_4^2- <->[{ел. струм}] PbSO_4 + 2{е}^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0faac974038edc1530eb703fbbfc095e5a3e0e70)
![{\displaystyle {\ce {PbO_2 + 4H^+ + SO_4^2- + 2{e}^- <->[{ел. струм}] PbSO_4 + 2 H_2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/924705cff7b6b2362612ce1d2a44259c9be953ca)
![{\displaystyle {\ce {Pb + PbO_2 + 4 H^+ + 2SO_4^2- <->[{ел. струм}] 2PbSO_4 + 2H_2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06e3426567741b8cc30b8db9f51bdbbf018dcc29)

