Кукурбітурил

Кукурбітурили — макроциклічні молекули, утворені з гліколурилових[en] мономерів, з’єднаних метиленовими містками . Атоми кисню розташовані по краях циклу і нахилені всередину, утворюючи частково закриту порожнину. Назва походить від схожості молекул цієї групи з гарбузом, родина лат. Cucurbitaceae.
Назви кукурбітурилів зазвичай подаються у наступному вигляді — кукурбіт[n]урил, де n — кількість повторень гліколурилових залишків. Дві поширені абревіатури — CB[n], або просто CBn.
Ці сполуки становлять особливий інтерес для хіміків, оскільки вони є підхожими "господарями" для ряду нейтральних молекул та катіонів. Вважається, що взаємодія відбувається через гідрофобні взаємодії у випадку з нейтральними молекулами, а у випадку з катіонами і через катіон-дипольні взаємодії також. Порядок розміру кукурбітирилів є, як правило, 10 Å. Наприклад, порожнина кукурбіт[6]урила має висоту ~ 9,1 Å, зовнішній діаметр ~ 5,8 Å і внутрішній діаметр ~ 3,9 Å.[1]
Вперше кукурбітурили були синтезовані в 1905 році Робертом Берендом[en] шляхом конденсації гліколурилу з формальдегідом,[2] але їх структура не була встановлена до 1981 року.[3]

У 2008 році CB[5], CB[7] та CB[8] виявив та ізолював Кім Кімун (Kim Kimoon).[6] На сьогоднішній день було ізольовано кукурбітурили, що складаються з 5, 6, 7, 8 і 10 гліколурилових залишків,[7][8] об’єм їх внутрішніх порожнин становить 82, 164, 279, 479 та 870 Å3, відповідно. CB[14] був виділений також, однак його внутрішня порожнина менша від CB[7] та CB[8] (CB[14] не може вмістити всередині молекули, що поміщаються в CB[7] та CB[8]). Причиною цьому є те, що CB[14] має не фому "ідеального" кола, як інші кукурбітурили, а утворює петлю.[4] Кукурбіт[9]урил ще не виділений (станом на 2020 рік). Інші поширені молекулярні капсули, які мають подібну молекулярну форму з кукурбітурилами, містять циклодекстрини, каліксарени та пілларарени[en].
Синтез[ред. | ред. код]
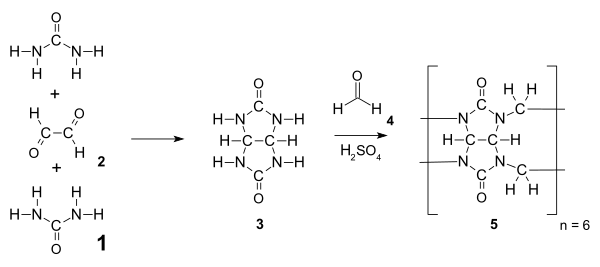
Кукурбітурили є амідалами і синтезуються з сечовини 1 та діальдегіду (наприклад, гліоксалю 2 ) шляхом нуклеофільного приєднання, як результат утворюється проміжний продукт, гліколурил 3. Цей проміжний продукт 3 конденсується з формальдегідом 4, як результат утворюється гексамеровий кукурбіт[6]урил, за умови, що температура реації вище 110°С. Зазвичай багатофункціональні мономери, такі як 3, зазнають ступеневої полімеризації, яка дає розподіл продуктів (полімерів різної маси), але завдяки сприятливому геометричному напруженню в молекулі та великій кількості водневих зв'язків гексамер 5 є єдиним продуктом реакції, виділеним після осадження.[7]
Використання нижчої температури синтезу (75-90 °C) дає можливість отримати кукурбітурили інших розмірів, включаючи CB[5], CB[7] ,CB[8] та CB[10]. CB[6] все рівно буде отриманий як основний продукт заа цих умов; але інші кукурбітурили будуть сформовані також, хоча і у меншій кількості. Ізоляція кукурбітурилів відмінних від CB[6], вимагає дробової кристалізації та розчинення. CB[5], CB[6], CB[7] та CB[8] зараз є комерційно доступними. Отримання кукурбітурилів більших розмірів є активною областю досліджень, оскільки вони можуть захоплювати більші та цікавіші гостьові молекули, розширюючи тим самим їх потенційне застосування.

Кукурбіт[10]урил особливо важко виділити. Вперше він був виявлений у 2002 році шляхом дробової кристалізації реакційної суміші. Він сформував комплекс включення, тобто CB[10] містив у своїй порожнині CB[5].[9] Комплекс CB[10]•CB[5] був однозначно ідентифікований за допомогою рентгенівського структурного аналізу на кристалі, який виявив, що комплекс нагадує молекулярний гіроскоп. Вільне обертання CB[5] всередині порожнини CB[10] імітує незалежне обертання маховика у гіроскопі.
Виділення чистого CB[10] неможливо здійснити методами прямого розділення, оскільки сполука має високу спорідненість до CB[5]. Сильну спорідненість до CB[5] можна пояснити розміром CB[5], який відповідає розміру та формі порожнини CB[10]. Чистий CB[10] був виділений у 2005 р., з використанням меламін діаміну, що міг більш міцно зв’язатись з CB[10], і таким чином витіснити CB[5].[8] Потім меламіндіамін був відокремлений від СВ[10] реакцією з оцтовим ангідридом, який перетворив позитивно заряджені аміногрупи меламіндіаміну в нейтрально заряджені аміди. Кукурбітурили мають міцний зв'язок з позитивно зарядженими молекулами, але втрата позитивного заряду меламін діаміну зменшила константу асоціації двох молекул до такої міри, що меламіндіамін можна було видалити промиванням метанолом, ДМСО та водою. CB[10] має надзвичайно велику порожнину (870 Å3), яка є вільною і здатною приймати надзвичайно великі молекули, "гості", включаючи позитивно заряджений калікс[4]арен.
Використання[ред. | ред. код]
Кукурбітурили цікавлять хіміків у різних контекстах, включаючи доставку ліків, асиметричний синтез, молекулярні перемикачі та модифікацію барвників.

Супрамолекулярні комплекси господар-гість[ред. | ред. код]
Кукурбітурили є ефективними молекулами господарями в молекулярному розпізнаванні і мають особливо високу спорідненість до позитивно заряджених (катіонних) сполук. Високі константи асоціації з позитивно зарядженими молекулами забезпечуються карбонільними групами, які взаємодіють з катіонами подібно до краун-етерів. Спорідненість кукурбітирилів може бути дуже високою. Наприклад, константа рівноваги спорідненості курбурбіт[7]урилу з позитивно зарядженим гідрохлоридом 1-аміноадамантану була експериментально визначена, вона становить 4.23*1012.[11]
Взаємодії типу господар-гість суттєво впливають на розчинність кукурбітурилів. Кукурбіт[6]урил погано розчиняється майже в будь-якому розчиннику, але його розчинність значно покращується в присутності гідроксиду калію або в кислому розчині. Так, кукурбіт[6]урил формує позитивно заряджений комплекс включення (кавітанд) з іоном калію або іоном гідронію відповідно. Сформований комплекс має розчинність набагато більшу ніж некомплексована нейтральна молекула кукурбіт[6]урилу.[12]
CB[10] є достатньо великим для вміщення інших молекулярних господарів, таких як молекула каліксарену. Каліксарен може мати різні хімічні конформації, які перебувають у швидкій рівновазі. Алостеричний контроль забезпечується включенням молекули адамантану до каліксарену, яка змушує каліксарен набути конформації конуса.[8]
Ротаксанові макроцикли[ред. | ред. код]
Враховуючи високу спорідненість до утворення комплексів включення, кукурбітурили використовувались як макроциклічний компонент ротаксану. Наприклад, кукурбіт[6]урил може виступати як макроциклічний компонент, а гексаметилендіамін як центральна ланка. Після утворення супрамолекулярного комплексу між ними, аміногрупи на кінцях молекули центральної ланки реагують з ацилхлоридом утворюючи об'ємні закінчення, що діють як пробки та перешкоджають роз'єднанню двох молекул.[13]
В іншій ротаксановій системі з макроциклом CB[7] віссю (центральна ланкою) виступає 4,4'-біпіридин з двома аліфатичними N-замісниками, що закінчуються карбоновою кислотою.[14] У воді з концентрацією вище 0,5 мМ комплексоутворення є кількісним без необхідності "пробок". При рН = 2 карбоксильні групи протонізуються, а CB[7] рухається від одного кінця молекули центральної ланки до іншого, що підтверджується спектром ЯМР протону. При рН = 9 макроцикл замикається навколо 4,4'-біпіридинового центру молекули. Зовсім недавно був синтезований ротаксан з макроциклом CB[8]. Цей ротаксан може зв’язувати нейтральні гостьові молекули.[15]
Носій для доставки ліків[ред. | ред. код]
Властивості кукурбітурила формувати комплекси господар-гість може бути використана для адресної доставки ліків в організмі. Потенціал у цій сфері був досліджений на кукурбіт[7]урилу, який утворює сполуку включення з оксаліплатином, важливим препаратом, що бореться з раком. CB[7] застосовували, незважаючи на те, що його важче ізолювати, оскільки він має ліпшу розчинність у воді ніж інші кукурбітурили, а його більший розмір порожнини дозволяє вмістити молекулу оксаліплатину. Встановлено, що отриманий комплекс має підвищену стабільність та більшу селективність, що може призвести до меншої кількості побічних ефектів.[16]
Супрамолекулярні каталізатори[ред. | ред. код]
Кукурбітурили також досліджувались як супрамолекулярні каталізатори. Більші кукурбітурили, такі як кукурбіт[8]урил, можуть зв’язувати декілька гостьових молекул одночасно. CB[8] утворює 2:1 комплекс (гість:господар) з (E)-діаміностилбеном дигідрохлоридом, дві молекули якого можуть розміститися в CB[8] завдяки значному внутрішньому діаметру і висоті макроцикла (8,8 Å і 9,1 Å відповідно).[17] Просторова близькість та оптимальна орієнтація гостьових молекул у порожнині підвищує швидкість фотохімічної циклізації з отриманням димеру циклобутану зі стереоселективністю 95:5 для конфігурації syn. За відсутності CB[8] реакція циклізації не відбувається, а спостерігається лише ізомеризація вихідного продукту з транс-ізомеру до цис-ізомеру.[18][19]
Модифікація барвників[ред. | ред. код]
Можливість модифікації властивостей барвників кукурбітурилами була досліджена останніми роками. Було встановлено, що низькополярне середовище, що забезпечуються кукурбітурилами, може призводити до підвищеної яскравості та фотостабільності, збільшення часу флуоресценції та сольватохромізму.[20][21][22][23]
Споріднені сполуки[ред. | ред. код]
Інвертовані кукурбітурили або iCB[n] є аналогами CB з однією інвертованою молекулою гліколурилу. У інвертованому гліколурилі два протони метину (>CH-) спрямовані в порожнину, що робить її менш просторою. Інвертовані кукурбітирили утворюються як побічний продукт у реакціях синтезу CB, з виходом між 0,4 та 2%. Їх можливо ізолювати, оскільки вони мають нижчу спорідненість при утворенні комплексів включення порівняно із звичайними СВ. Вважається, що інвертовані кукурбітурили є кінетично контрольованими (проміжними) продуктами реакції, оскільки їх нагрівання у кислому середовищі призводить до формування суміші звичайних кукурбітурилів.[24]
Кукурбітурил, "розрізаний" навпіл уздовж екватора, називається гемікукурбітурилом.
Систематична назва[ред. | ред. код]
Систематична назва кукурбіт[6]урила є Додекагідро-1Н, 4Н, 14Н, 17Н-2, 16:3, 15-диметано-5Н, 6Н, 7Н, 8Н, 9Н, 10Н, 11Н, 12Н, 13Н, 18Н, 19Н, 20H, 21H, 22H, 23H, 24H, 25H, 26H-2, 3, 4a, 5a, 6a, 7a, 8a, 9a, 10a, 11a, 12a, 13a, 15, 16, 17a, 18a, 19a, 20a, 21а, 22а, 23а, 24а, 25а, 26а-тетракозаазабіспенталено[1'', 6'':5'', 6'', 7'']циклоокти[1'', 2'', 3'':3', 4']пенталено(1', 6':5, 6, 7) -циклоокта (1, 2, 3-gh:1', 2', 3'-g'h ') циклоокта (1, 2, 3-cd: 5, 6, 7-c'd ') дипентален-1, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25-додекон.[25]
Список літератури[ред. | ред. код]
- ↑ Review: The Cucurbit[n]uril Family Jason Lagona, Pritam Mukhopadhyay, Sriparna Chakrabarti, Lyle Isaacs Angewandte Chemie International Edition Volume 44, Issue 31, Pages 4844 - 4870 2005 Abstract
- ↑ Ueber Condensationsproducte aus Glycoluril und Formaldehyd, Robert Behrend, Eberhard Meyer, Franz Rusche, Justus Liebig's Annalen der Chemie 1905, 339, 1–37. DOI:10.1002/jlac.19053390102
- ↑ Cucurbituril W. A. Freeman, W. L. Mock, and N.-Y. Shih J. Am. Chem. Soc., 1981, 103, 7367. Article [Архівовано 2 червня 2020 у Wayback Machine.]
- ↑ а б Cheng, Xiao-Jie; Liang, Li-Li; Chen, Kai; Ji, Ning-Ning; Xiao, Xin; Zhang, Jian-Xin; Zhang, Yun-Qian; Xue, Sai-Feng; Zhu, Qian-Jiang (2013). Twisted Cucurbit[14]uril. Angewandte Chemie. Т. 125, № 28. с. 7393—7396. doi:10.1002/ange.201210267. ISSN 1521-3757. Архів оригіналу за 13 жовтня 2020. Процитовано 8 жовтня 2020.
- ↑ Diamond - Crystal and Molecular Structure Visualization. www.crystalimpact.com (англ.) . Crystal Impact - Dr. H. Putz & Dr. K. Brandenburg GbR, Kreuzherrenstr. 102, 53227 Bonn, Germany. Архів оригіналу за 11 жовтня 2020. Процитовано 8 жовтня 2020.
- ↑ Kim, Jaheon; Jung, In-Sun; Kim, Soo-Young; Lee, Eunsung; Kang, Jin-Koo; Sakamoto, Shigeru; Yamaguchi, Kentaro; Kim, Kimoon (2000). New Cucurbituril Homologues: Syntheses, Isolation, Characterization, and X-ray Crystal Structures of Cucurbit[n]uril(n=5, 7, and 8). Journal of the American Chemical Society. 122 (3): 540—541. doi:10.1021/ja993376p.
- ↑ а б Lee, Jae Wook; Samal, S.; Selvapalam, N.; Kim, Hee-Joon; Kim, Kimoon (1 серпня 2003). Cucurbituril Homologues and Derivatives: New Opportunities in Supramolecular Chemistry. Accounts of Chemical Research. Т. 36, № 8. с. 621—630. doi:10.1021/ar020254k. ISSN 0001-4842. Процитовано 24 вересня 2020.
- ↑ а б в Cucurbit[10]uril Simin Liu, Peter Y. Zavalij, and Lyle Isaacs J. Am. Chem. Soc.; 2005; 127(48) pp 16798 - 16799; (Communication) DOI:10.1021/ja056287n Abstract
- ↑ а б A Cucurbituril-Based Gyroscane: A New Supramolecular Form AnthonyI. Day, Rodney J. Blanch, Alan P. Arnold, Susan Lorenzo, Gareth R. Lewis, and Ian Dance Angew. Chem. Int. Ed.; 2002; 41(2) pp 275-277.
- ↑ Freeman, Wade A. (1984). Structures of the p-xylylenediammonium chloride and calcium hydrogensulfate adducts of the cavitand 'cucurbituril', C36H36N24O12. Acta Crystallogr B. 40 (4): 382—387. doi:10.1107/S0108768184002354.
- ↑ Liu, Simin; Ruspic, Christian; Mukhopadhyay, Pritam; Chakrabarti, Sriparna; Zavalij, Peter Y.; Isaacs, Lyle (2005). The Cucurbit[n]uril Family: Prime Components for Self-Sorting Systems. Journal of the American Chemical Society. 127 (45): 15959—67. doi:10.1021/ja055013x. PMID 16277540.
- ↑ U.S. Patent 6 365 734
- ↑ Buschmann, Hans-Jürgen (2011). From Small Cucurbituril Complexes to Large Ordered Networks. Israel Journal of Chemistry (англ.). Т. 51, № 5-6. с. 533—536. doi:10.1002/ijch.201100036. ISSN 1869-5868. Процитовано 24 вересня 2020.
- ↑ Sindelar, Vladimir; Silvi, Serena; Kaifer, Angel E. (2006). Switching a molecular shuttle on and off: Simple, pH-controlled pseudorotaxanes based on cucurbit[7]uril. Chemical Communications (20): 2185—7. doi:10.1039/b601959e. PMID 16703149.
- ↑ Ramalingam, Vijayakumar; Urbach, Adam R. (16 вересня 2011). Cucurbit[8]uril Rotaxanes. Organic Letters. Т. 13, № 18. с. 4898—4901. doi:10.1021/ol201991e. ISSN 1523-7060. Процитовано 24 вересня 2020.
- ↑ Wheate, Nial J.; Limantoro, Christina (2 жовтня 2016). Cucurbit[n]urils as excipients in pharmaceutical dosage forms. Supramolecular Chemistry. Т. 28, № 9-10. с. 849—856. doi:10.1080/10610278.2016.1178746. ISSN 1061-0278. Процитовано 24 вересня 2020.
- ↑ A facile, stereoselective [2 + 2] photoreaction mediated by cucurbit[8]uril Sang Yong Jon, Young Ho Ko, Sang Hyun Park, Hee-Joon Kim and Kimoon Kim Chemical Communications, 2001, (19), 1938 - 1939 DOI Abstract [Архівовано 30 вересня 2007 у Wayback Machine.]
- ↑ Template directed photodimerization of trans-1,2-bis(n-pyridyl)ethylenes and stilbazoles in water Mahesh Pattabiraman, Arunkumar Natarajan, Raja Kaliappan, Joel T. Mague and V. Ramamurthy Chemical Communications, 2005, (36), 4542 - 4544 DOI Abstract [Архівовано 30 вересня 2007 у Wayback Machine.] Full Article [Архівовано 30 вересня 2007 у Wayback Machine.]
- ↑ Maddipatla, Murthy V. S. N.; Kaanumalle, Lakshmi S.; Natarajan, Arunkumar; Pattabiraman, Mahesh; Ramamurthy, V. (2007). Preorientation of Olefins toward a Single Photodimer: Cucurbituril-Mediated Photodimerization of Protonated Azastilbenes in Water. Langmuir. 23 (14): 7545—54. doi:10.1021/la700803k. PMID 17539667.
- ↑ Koner, Apurba L.; Nau, Werner M. (1 березня 2007). Cucurbituril Encapsulation of Fluorescent Dyes. Supramolecular Chemistry. Т. 19, № 1-2. с. 55—66. doi:10.1080/10610270600910749. ISSN 1061-0278. Процитовано 24 вересня 2020.
- ↑ Nau, Werner M.; Mohanty, Jyotirmayee (2005). Taming fluorescent dyes with cucurbituril. International Journal of Photoenergy (англ.). doi:10.1155/s1110662x05000206. Архів оригіналу за 21 січня 2022. Процитовано 24 вересня 2020.
{{cite web}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Montes-Navajas, Pedro; Corma, Avelino; Garcia, Hermenegildo (4 квітня 2008). Complexation and Fluorescence of Tricyclic Basic Dyes Encapsulated in Cucurbiturils. ChemPhysChem. Т. 9, № 5. с. 713—720. doi:10.1002/cphc.200700735. ISSN 1439-4235. Архів оригіналу за 17 травня 2020. Процитовано 24 вересня 2020.
- ↑ Shaikh, Mhejabeen; Mohanty, Jyotirmayee; Singh, Prabhat K.; Nau, Werner M.; Pal, Haridas (3 квітня 2008). Complexation of acridine orange by cucurbit[7]uril and β-cyclodextrin: photophysical effects and pKa shifts. Photochemical & Photobiological Sciences (англ.). Т. 7, № 4. с. 408—414. doi:10.1039/B715815G. ISSN 1474-9092. Архів оригіналу за 7 травня 2021. Процитовано 24 вересня 2020.
- ↑ Isaacs, Lyle; Park, Sang-Kyu; Liu, Simin; Ko, Young Ho; Selvapalam, Narayanan; Kim, Youngkook; Kim, Hyunuk; Zavalij, Peter Y. та ін. (2005). The Inverted Cucurbit[n]uril Family. Journal of the American Chemical Society. 127 (51): 18000—1. doi:10.1021/ja056988k. PMID 16366540. Архів оригіналу за 24 листопада 2020. Процитовано 24 вересня 2020.
- ↑ Meschke, Claudia (1998). Mono-, Oligo- und Polyrotaxane mit Cucurbituril und gemischte Polyrotaxane mit Cucurbituril und alpha-Cyclodextrin mittels Selbstorganisation. undefined (англ.). Процитовано 24 вересня 2020.

