Оцтовий ангідрид
| Оцтовий ангідрид | |
|---|---|

| |
| Назва за IUPAC | оцтовий ангідрид |
| Систематична назва | етаноатний ангідрид |
| Інші назви | ангідрид оцтової кислоти |
| Ідентифікатори | |
| Номер CAS | 108-24-7 |
| Номер EINECS | 203-564-8 |
| Назва MeSH | D02.113.075 і D02.241.081.018.193 |
| ChEBI | 36610 |
| RTECS | AK1925000 |
| SMILES | CC(=O)OC(=O)C[1] |
| InChI | InChI=1S/C4H6O3/c1-3(5)7-4(2)6/h1-2H3 |
| Номер Бельштейна | 385737 |
| Номер Гмеліна | 26415 |
| Властивості | |
| Молекулярна формула | (CH3CO)2O |
| Молярна маса | 102,089 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 1,082 г/см³ (20 °C) |
| Тпл | -73,13 °C |
| Ткип | 139,5 °C[2] |
| Розчинність (вода) | 10,7% |
| Діелектрична проникність (ε) | 22,45 |
| Показник заломлення (nD) | 1,39038 |
| В'язкість | 0,843 мПа·с |
| Дипольний момент | 2,8 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
-624,4 кДж/моль (рідина) -572,5 кДж/моль (газ) |
| Ст. ентропія S 298 |
268,8 Дж/(моль·K) |
| Теплоємність, c p |
168,2 Дж/(моль·K)[3] |
| Небезпеки | |
| ЛД50 | 1780 мг/кг (пацюки, орально) 4000 мг/кг (кролики, шкіра) |
| Температура спалаху | 49 °C |
| Температура самозаймання | 316 °C |
| Вибухові границі | 2,7—10,3% |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
О́цтовий ангідри́д, ангідри́д о́цтової кислоти́ — органічна сполука, представник ряду ангідридів карбонових кислот складу (CH3CO)2O. За звичайних умов є безбарвною рідиною із неприємним запахом та сльозогінною дією. При взаємодії з водою утворює оцтову кислоту.
Вперше оцтовий ангідрид був синтезований французьким хіміком Шарлем Фредеріком Жераром у 1852 році шляхом взаємодії бензоїлхлориду із розплавленим ацетатом калію.
Ангідрид широко використовується як агент ацилювання — для добування ацетилцелюлози, деяких лікарських засобів, вибухівки гексогену. Також він є складовою нітрувальних сумішей у виробництві барвників.
Фізичні властивості[ред. | ред. код]
Він змішується із полярними розчинниками, розчиняється у воді, зазнаючи гідролізу, розчиняється у холодних спиртах із незначним розкладанням. Розкладання, яке каталізується мінеральними кислотами, веде до утворення оцтової кислоти.
| 0 °C | 15 °C | 25 °C | 30 °C | 50 °C | 75 °C | 100 °C |
|---|---|---|---|---|---|---|
| 1,241[4] | 0,971[5] | 0,843[4] | 0,783[5] | 0,614[5] | 0,472[5] | 0,377[5] |
Теплопровідність при 20 °C складає 2,209 мДж/(см·с·K).[6]
Отримання[ред. | ред. код]
Історичні методи отримання[ред. | ред. код]
Найперші методи отримання оцтового ангідриду базувалися на взаємодії ацетатів лужних металів із надлишком агентів хлорування (SOCl2, POCl3). За цим методом половина вихідного ацетату утворює ацетилхлорид, який взаємодіє із іншою половиною, що ще не прореагувала:
В подальшому був розробений метод синтезу ангідриду шляхом взаємодії оцтової кислоти із фосгеном (у присутності хлориду алюмінію):
Сучасні методи[ред. | ред. код]
Отримання з кетену[ред. | ред. код]
Отримання оцтового ангідриду за кетеновим процесом включає в себе дві стадії: термічне розкладання оцтової кислоти із утворенням кетену і його взаємодію з кислотою:
Тепловий ефект реакції складає 147 кДж/моль. Розкладання пари кислоти відбувається при температурі 700–750 °C і тиску 15–20 кПа у присутності органічних похідних ортофосфатної кислоти (відіграють роль поглиначів вологи). Низький тиск сприяє підвищенню виходу продукту, але не ефективності процесу.
На першій стадії методу мають місце також побічні реакції:
Обладнання, що використовується для піролізу оцтової кислоти, не має містити нікелевмісних сплавів, оскільки нікель сприяє утворенню сажі і коксу (серйозна втрата у ефективності методу), а також взаємодіє із побічним монооксидом вуглецю, формуючи токсичні карбоніли.
Після розкладання кислоти до піролізних газів додається аміак для запобігання взаємодії кетену із залишковою кислотою чи водою, після чого газова суміш охолоджується, оцтова кислота відокремлюється зрудженням, а кетен подається на газоочисник для подальшої взаємодії із кислотою за другим етапом.
Окиснення етаналю[ред. | ред. код]
Синтез оцтового ангідриду окисненням етаналю (оцтового альдегіду) відбувається у присутності каталізаторів і проходить через стадію утворення пероксооцтової кислоти. Реакції проводяться за температути 45–60 °C і тиску 100–300 кПа; каталізаторами є солі кобальту, міді, мангану (добавки солей мангану перешкоджають утворенню вибухонебезпечних кількостей пероксооцтової кислоти).
Розчинниками можуть бути оцтова кислота або етилацетат. За необхідного тиску і температури 55–56 °C розкладання ацетальдегідпероксоацетату в присутності каталізатору (ацетатів кобальту і міді) відбувається майже кількісно. Також використовуються добавки солей марганцю для зниження вибухонебезпечності пероксооцтової кислоти. Через присутність води в реакційній суміші гідроліз ангідриду і, відповідно, втрати синтезу є невідворотними.
Очистка кінцевого продукту є доволі легкою і проводиться шляхом дистиляції.
Карбонілювання метилацетату[ред. | ред. код]
Отримання оцтового ангідриду шляхом карбонілювання метилацетату (метод Гелкона) було запатентоване у 1973 році, але застосоване у виробництві тільки у 1983. За цим методом метилацетат обробляється у рідкій фазі монооксидом вуглецю (парціальний тиск 2–5 МПа) при температурі 160–190 °C у присутності родієвого каталізатору:
Вихідна сировина метилацетат може бути отримана естерифікацією оцтової кислоти метанолом, а також як побічний продукт у виробництві оцтової кислоти з метанолу та CO.
Хімічні властивості[ред. | ред. код]
Оцтовий ангідрид легко гідролізується водою, а також лугами:
- (CH3CO)2O + 2 NaOH → 2 CH3COONa + H2O
Він бере участь у реакціях естерифікації спиртів, які проходять із труднощами у випадку оцтової кислоти. Також здатен ацилювати аміни (в тому числі третинні):
Слабкою стороною використання оцтового ангідриду як агенту ацилювання є те, що лише половина молекули здійснює ацилювання, інша ж перетворюється на кислоту.
Ангідрид здатен також ацилювати неорганічні кислоти, наприклад, фосфітну:
При дії на нього пероксиду водню утворюється пероксооцтова кислота:
Токсичність[ред. | ред. код]
Оцтовий ангідрид швидко проникає крізь шкіру, залишаючи серйозні опіки та пухирці, які важко піддаються лікуванню. Особливо небезпечною є його дія на чутливі ділянки тіла: очі, ніс, вуха, рот. Присутність ангідриду у повітрі за запахом відчувається при його концентрації вище 0,49 мг/м³, але очі отримують ушкодження вже при 0,36 мг/м³. До таких наслідків відносяться: сльозотеча, кон'юнктивіт, боязнь світла, ірит, опіки рогівки опіки з подальшою втратою зору.
При використанні ангідриду у роботі обов'язковими є гумові рукавиці, щільні окуляри для захисту очей або маска, що закриватиме усе обличчя включно з вухами.
Застосування[ред. | ред. код]
Оцтовий ангідрид використовується переважно як агентацилювання та осушувача. У великих масштабах ангідрид застосовується в ацилюванні целюлози, у синтезі лікарських засобів (ацетилсаліцилової кислоти, ацеклідину, омепразолу, теофіліну), для отримання вибухівки гексогену.
Через потенційну можливість використання ангідриду для синтезу наркотику героїну, його обіг у деяких країнах, в тому числі і в Україні, є суттєво обмеженим. Так, постановою Кабінету Міністрів України оцтовий ангідрид віднесено до групи «прекурсори, обіг яких обмежено і стосовно яких встановлюються заходи контролю».[7]
Див. також[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Оцтовий ангідрид |
Примітки[ред. | ред. код]
- ↑ ACETIC ANHYDRIDE
- ↑ За тиску 101,3 кПа.
- ↑ При температурі 30 °C.
- ↑ а б CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- ↑ а б в г д Held H., Rengstl A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- ↑ Lange's Handbook of Chemistry / John A. Dean. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- ↑ Постанова Кабінету Міністрів України від 5 січня 2011 р. N 4. «Про внесення змін до постанов Кабінету Міністрів України від 6 травня 2000 р. N 770 і від 10 жовтня 2007 р. N 1203»
Джерела[ред. | ред. код]
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Frank S. Wagner Jr. Acetic Anhydride // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / John A. Dean. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Held H., Rengstl A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — С. ?. — ISBN 966-7065-87-4.
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
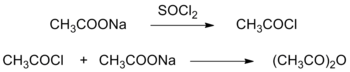













![{\displaystyle \mathrm {(CH_{3}CO)_{2}O+H_{3}PO_{3}\longrightarrow CH_{3}C(OH)[PO(OH)_{2}]_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2a53f75a791373888ddacebbe580ade7abf001e)
