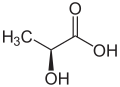
Молочна кислота
Моло́чна кислота́ — α-оксіпропіонова одноосновна оксикарбонова кислота, хімічна формула СН3-СН(ОН)-СООН. Важливий проміжний продукт обміну живих організмів. Була відкрита шведським хіміком Карлом Шеєле у 1780 році.
Загальні відомості[ред. | ред. код]
Молочна кислота — безбарвні кристали, легко розчинні у воді. Існує у вигляді двох оптично-активних форм (+) та (−) (tпл 25—26 °C), а також у вигляді рацемату (tпл 18 °C). Рацемація (+) та (−) форм відбувається при 130—150 °C. Утворює солі — лактати та ефіри. Якісна реакція — взаємодія з n-оксидифенілом та сірчаною кислотою.
Дуже поширена у природі, бо є кінцевим продуктом молочнокислого бродіння, яке проходить при прокисанні цукровмісних речовин (молоко, сік рослин тощо). При цьому залежно від виду бактерій та цукру утворюється або рацемат, або одна з оптичних форм кислоти.
У м'язових клітинах тварин утворюється (+)-молочна кислота внаслідок безкисневого ферментативного розкладу глікогену під час скорочення м'язів (процес має назву гліколіз). Накопичення кислоти обумовлює біль та втому в м'язах. Особливістю метаболізму молочної кислоти у тварин є те, що вона з м'язів може транспортуватись до печінки, де в присутності кисню та затратах енергії відновлюватись до глюкози, яка, своєю чергою, транспортується в м'язи та відновлюється до глікогену (цикл Корі).
-
(+)-стереоізомер
-
(−)-стереоізомер
Використання[ред. | ред. код]
Як продукт бродіння, який здатний стримувати розвиток бактерій та плісняви, широко застосовується у харчовій промисловості: перероблення молока (виготовлення сиру, кефіру тощо), консервування овочів (квашена капуста); у сільському господарстві (виготовлення силосу). Як хімічну сполуку молочну кислоту застосовують у шкіряній промисловості для дублення. Солі цієї кислоти використовують для друку, ефіри — для розчинення лаків.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ Dawson, R. M. C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ а б в Шаблон:SigmaLink
Джерела[ред. | ред. код]
- Молочна кислота [Архівовано 20 червня 2008 у Wayback Machine.] у Великій радянській енциклопедії (рос.)
Посилання[ред. | ред. код]
- КИСЛОТА МОЛОЧНА [Архівовано 15 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
| Це незавершена стаття з біохімії. Ви можете допомогти проєкту, виправивши або дописавши її. |