Естери
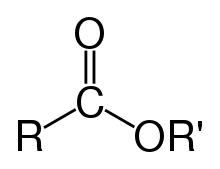
Есте́ри (також складні́ ефі́ри) — клас органічних сполук, похідні кислоти (органічної або неорганічної), в якій атом водню (H) принаймні однієї кислотної гідроксильної групи (-OH) цієї кислоти заміщений на органільну групу (-R).
Аналоги, отримані з кисню, заміщеного іншими халькогенами, також належать до категорії естерів[1]. На думку деяких авторів, органопохідні кислотного водню інших кислот також є естерами (наприклад, аміди), але не згідно з IUPAC[1].
Важливо пам‘ятати, що естери відрізняються від простих ефірів (етерів), у яких два вуглеводневі радикали з'єднані атомом кисню (R1-O-R2).
Загальна характеристика[ред. | ред. код]
Похідні карбонових кислот, в яких атом водню в карбоксильній (COOH) групі заміщено на органічний радикал (R').
Назва естер походить від нім. Essig-Aether — оцтовий ефір.
За своєю будовою естери на перший погляд схожі з солями. Насправді ж схожість тут лише формальна. Зв'язок між вуглеводневим радикалом, тобто залишком, який виходить, якщо відняти від молекули вуглеводню один атом Гідрогену, і рештою частини молекули в естері ковалентний, а не іонний, як у солях.
Естери, на відміну від більшості солей, нерозчинні у воді, але розчиняються в органічних розчинниках. Розчини їх не проводять електричного струму.
Реакція утворення естеру зі спирту і кислоти є оборотною: пряма реакція називається естерифікацією, а зворотна — омиленням естеру.
Номенклатура[ред. | ред. код]
Назва складається таким чином: спочатку вказується група R', приєднана до кислоти, потім — назва кислоти із суфіксом ат. Наприклад, етилацетат (як в назвах неорганічних солей, наприклад, карбонат натрію).
Естери зазвичай розглядають як продукт реакції кислоти зі спиртом, наприклад, етилацетат можна сприймати як результат взаємодії оцтової кислоти і етанолу. Досить часто вживають тривіальну назву естерів. Етилацетат за нею можна назвати етиловим естером оцтової кислоти. Так само називають естери мінеральних кислот: диметиловий естер сірчаної кислоти — диметилсульфат.
Фізичні властивості[ред. | ред. код]
Багато естерів карбонових кислот мають характерні фруктові або квіткові запахи, через що їх використовують як штучні ароматизатори. Наприклад:
- Бутилацетат має грушевий аромат
- Метиловий естер масляної кислоти — яблуневий
- Етиловий естер масляної кислоти — ананасовий або абрикосовий
- Етиловий естер ізовалер'янової кислоти — малиновий
- Етиловий естер валер'янової кислоти — виноградний
- Ізоаміловий естер ізовалер'янової кислоти — банановий
- Октиловий естер оцтової кислоти — помаранчевий
- Етилсаліцилат — м'ятний
- Бензилацетат — жасминовий
- Бензилбензоат — квітковий
При збільшенні розмірів складових органічних груп естерів, до С15—C30 вони набувають консистенції пластичних речовин. Цю групу називають восками, вони, зазвичай, не мають запаху. Бджолиний віск містить суміш різних естерів, один з компонентів воску, що удалося виділити і визначити його склад, являє собою мірициловий етер пальмітинової кислоти. Китайський віск (продукт виділення кошенілі — комах Східної Азії) містить цериловий етер церотинової кислоти. Крім того, воски містять вільні карбонові кислоти і спирти. Воски не змочуються водою, розчинні в бензині, хлороформі, бензолі.
Жири — це естери гліцерину. Карбонові кислоти, що входять до складу жирів, мають вуглеводневий ланцюг з 9-19 атомами вуглецю. Тваринні жири, в основному, складаються із суміші гліцеридів стеаринової і пальмітинової кислоти. Рослинні олії містять гліцериди кислот із трохи меншою довжиною вуглецевого ланцюга: лауринової та міристинової. Лляна олія містить гліцерид ненасиченої лінолевої кислоти. При нанесенні тонким шаром на поверхню така олія під дією кисню повітря висихає в ході полімеризації по подвійних зв'язках, при цьому утворюється еластична плівка, не розчинна у воді й органічних розчинниках. На основі лляної олії виготовляють натуральну оліфу.
Естери фосфорної кислоти ДНК, РНК та фосфоліпіди відіграють важливу роль у життєдіяльності живих організмів.
Отримання[ред. | ред. код]
Основний спосіб синтезу — взаємодія карбонової кислоти і спирту, що каталізується кислотою і супроводжується виділенням води. Існує велика кількість різновидів прямої естерифікації карбонових кислот, які відрізняються один від одного деякими характерними деталями.
Одним із старих і розповсюджених методів залишається естерифікація за Фішером. Суміш карбонової кислоти і великого надлишку безводного спирту, що містить хлороводень, сульфатну чи p-толуенсульфокислоту, витримують протягом кількох годин при 70—80°C. Надлишок спирту зміщує рівновагу в сторону утворення складного ефіру. Метод Фішера використовують для одержання складних ефірів метилового, етилового й інших нижчих спиртів. В інших випадках ефективна модифікація цього методу, де в якості розчинника використовують бензен або толуен із азеотропною відгонкою води в апараті Діна-Старка. Каталізатором в цьому випадку є ефірат трифтористого бору, p-толуенсульфокислота або різні сильнокислі катіообмінні смоли.
Пряма естерифікація карбонових кислот дає найкращі результати в випадку первинних спиртів. Складні ефіри вторинних спиртів отримують із сильно зниженим виходом, а для синтезу складних ефірів третинних спиртів такий метод не годиться. Складні ефіри вторинних і третинних спиртів отримують ацилюванням цих спиртів хлороангідридами або ангідриди кислот, кетенами.
Нуклеофільне SN2-заміщених галогену в первинних і вторинних алкілгалогеніду під дією карбоксилат-іона в якості нуклеофільного реагенту широко використовується зараз для отримання складних ефірів. Раніше ця звичайна реакція бімолекулярного нуклеофільного заміщення мала вкрай обмежену сферу застосування через низький вихід складних ефірів в протонних розчинниках (вода, спирти), де карбоксилат-іон сильно сольватованих за допомогою водневого зв'язку і тому має низьку реакційною здатністю. Метод міжфазного каталізу дозволяє усунути цей недолік за рахунок розчинності тетраалкіламмоніевих солей карбонових кислот в полярних і малополярних апротонних розчинниках, і в даний час цей спосіб часто застосовується для отримання складних ефірів найрізноманітніших, в тому числі і просторово ускладнених кислот, де він особливо корисний. В ролі каталізаторів міжфазного переносу доцільно використовувати 18-краун-6 поліефір.
Хімічні властивості[ред. | ред. код]
Реакції нуклеофільного заміщення[ред. | ред. код]
У реакціях нуклеофільного заміщення нуклеофіл заміщує OR:
Найбільше характерним для естерів карбонових кислот є гідролітичне (під дією води) розщеплення етерового зв'язку. Тоді нуклеофілом є OH. У нейтральному середовищі воно протікає повільно і помітно прискорюється в присутності основ або кислот, які каталізують цей процес.
Гідроліз у присутності лугів називають омиленням. Процес омилення жирів проводять у промисловому масштабі, при цьому одержують гліцерин і солі вищих карбонових кислот, що являють собою мило.
Вони також взаємодіють зі спиртами, утворюючи інші естери, з аміаком та амінами (первинними та вторинними), утворюючи аміди карбонових кислот.
Взаємодія з третинними амінами[ред. | ред. код]
Естери можуть алкілювати третинні аміни. При цьому до аміну приєднується радикал, і утворюється комплексна сіль:
Конденсація Кляйзена[ред. | ред. код]
Під впливом сильних основ α-карбон може депротонуватися:
Утворений карбоаніон може реагувати з іншою молекулою естеру, утворюючи естер β-оксокислоти. Ця реакція є конденсацією Кляйзена:
Застосування[ред. | ред. код]
Етилформіат та етилацетат використовуються як розчинники целюлозних лаків. Естери на основі нижчих спиртів і кислот використовують у харчовій промисловості при створенні фруктових есенцій, а на основі ароматичних спиртів — у парфумерній промисловості.
Воски входять до складу косметичних кремів і лікарських мазей. Тваринні жири і олії являють собою сировину для одержання вищих карбонових кислот, мийних засобів і гліцерину.
На основі рослинних олій виготовляють оліфи, що складають основу олійних фарб.
Нітрогліцерин — відомий лікарський препарат і вибухова речовина, основа динаміту.
Складні ефіри сульфатної кислоти використовують в органічному синтезі як алкілюючі реагенти, а ортофосфатної — як інсектициди.
Див. також[ред. | ред. код]
Джерела[ред. | ред. код]
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- John McMurry: Chemia organiczna. Wyd. 3. Warszawa: PWN, 2005. ISBN 83-01-14406-8.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
Посилання[ред. | ред. код]
- Складні ефіри // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- ЕСТЕРИ [Архівовано 12 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- An introduction to esters [Архівовано 3 листопада 2015 у Wayback Machine.]
- Molecule of the month: Ethyl acetate and other esters [Архівовано 23 вересня 2015 у Wayback Machine.]
- An example of esters commercial application
| ||||||||||||||||||||||||||
- ↑ а б Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - esters (E02219). goldbook.iupac.org. Процитовано 13 січня 2024.
![{\displaystyle {\ce {R-CO-OR + NuH ->[H_2SO_4]R-CO-Nu + ROH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ca96d64c974835d952325c5d6189c4160cdbdd5)
![{\displaystyle {\ce {R-CO-OR^1 + NR3 -> R-CO-O- [R^1-NR3]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d112a32e34cbf690a0638b8916c131abe224e75)


