Ізобаричний процес
| Частина серії статей на тему: |
| Термодинаміка |
|---|
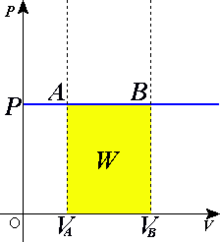 Графік ізобаричного процесу. Жовта ділянка відповідає роботі газу |
|
|
Ізобарний проце́с (від грец. ísos — рівний, báros — вага) — термодинамічний процес, який відбувається при сталому тиску. Прикладом ізобаричного процесу може бути нагрівання води у відкритій посудині, або розширення газу у циліндрі з поршнем, який може вільно пересуватися. В обох випадках тиск дорівнює атмосферному.
При ізобаричному процесі об'єм ідеального газу прямопропорційний температурі (див. Закон Гей-Люссака).
На графіках процес зображується лініями, які називаються ізобарами. Для ідеального газу вони є прямими у всіх діаграмах, які пов'язують параметри T (температура), V (об'єм) і P (тиск).
З визначення роботи слідує, що макроскопічна робота при нескінченно малій зміні об'єму на величину dV при ізобаричному процесі дорівнює:
Повна робота процесу визначається інтегралом від даного виразу:
- ,
де ΔV — зміна об'єму.
Розглядаючи графік ізобаричного процесу у координатах (p, V) отримати цей результат простіше. Графічно робота є площа фігури під кривою. У випадку ізобаричного процесу це площа прямокутника, яку знаходять за формулою, яку отримано в результаті інтегрування.
Якщо в останній формулі використати рівняння стану ідеального газу, то можна отримати такий результат:
Де, ν — кількість речовини, R — універсальна газова стала, ΔT — зміна температури.
Зміна внутрішньої енергії ідеального газу може бути знайдена за формулою:
- ,
де і — число ступенів вільності, яке залежить від кількості атомів у молекулі (3 для одноатомної (наприклад, водень), 5 для двоатомної (наприклад, кисень) і 6 для триатомної і більше (наприклад, молекула водяної пари)).
З визначення та формули теплоємності, формулу для внутрішньої енергії можна переписати у вигляді:
- ,
де — молярна теплоємність при сталому об'ємі.
Застосувавши перше начало термодинаміки можна знайти кількість теплоти при ізобаричному процесі:
Тепер до цієї формули підставимо значення роботи та зміни внутрішньої енергії:
Застосувавши рівняння Роберта Майєра () отримаємо:
- ,
де — молярна теплоємність при сталому тиску.
Теплоємність системи при ізобаричному процесі більша, ніж при ізохоричному, оскільки теплота потрібна не тільки для зміни внутрішньої енергії термодинамічної системи, а й для виконання цією системою роботи.
Всі формули, які подано вище виводилися з урахуванням незмінної маси речовини під час процесу, або відсутності параметра порядку при хімічній реакції.
Ізохоричний процес проходить без виконання роботи. Таким чином перше начало термодинаміки для такого процесу записується так: . Тобто кількість теплоти, які отримала чи втратила система, дорівнює зміні функції стану, у цьому випадку внутрішньої енергії. Було б зручно, якщо б для ізобаричного процесу існувало схоже рівняння.
Ще раз перепишемо перший закон термодинаміки для ізобаричного процесу у загальному диференціальному вигляді:
За властивістю диференціала (сума диференціалів дорівнює диференціалу суми) перепишемо це рівняння у такому вигляді:
- .
Визначена функція стану (термодинамічний потенціал), яка виражається формулою називається ентальпією і позначається символом H (іноді Е). Отже, ізобаричний процес можна описати рівнянням:
- .
Оскільки у системі при ізобаричному процесі відбувається теплообмін із зовнішнім середовищем, то відбувається зміна ентропії. З визначення ентропії випливає:
Вище вже було виведено формулу для визначення кількості теплоти. Перепишемо її у диференціальному вигляді:
- ,
де ν — кількість речовини, — молярна теплоємність при сталому тиску. Отже, мікроскопічна зміна ентропії при ізобаричному процесі може бути визначена за формулою:
Або, якщо проінтегруємо останній вираз, повна зміна ентропії після проходження процесу:
У цьому випадку виносити вираз молярної теплоємності при сталому тиску за знак інтегралу не можна, оскільки вона є функцією, яка залежить від температури.
Оскільки маса газу залишається незмінною, але об'єм змінюється, то змінюється його густина. Таким чином, рівняння стану ідеального газу можна переписати так:
- ,
де m — маса речовини, R — універсальна газова стала, T — температура, P — тиск, V — об'єм, μ — молярна маса речовини, ρ — густина речовини.
Оскільки тиск, молярна маса та газова стала — незмінні величини, то з останньої рівності випливає, що:
Отже, при ізобаричному процесі густина ідеального газу обернено-пропорційна температурі. Для реального газу таке твердження несправедливе.
- Сивухин Д. В. «Общий курс физики». — Издание 3-е, исправленное и дополненное. — М.: Наука, 1990. — Т. II. Термодинамика и молекулярная физика. — 592 с. — ISBN 5-02-014187-9
- Ландау Л. Д., Лившиц Е. М. (1976). «Теоретическая физика». т. V. Статистическая физика. Часть 1., Москва: Наука.




































