Гліцеральдегід-3-фосфатдегідрогеназа
Гліцеральдегід-3-фосфатдегідрогеназа (англ. Glyceraldehyde-3-phosphate dehydrogenase) – білок, який кодується геном GAPDH, розташованим у людей на короткому плечі 12-ї хромосоми. [3] Довжина поліпептидного ланцюга білка становить 335 амінокислот, а молекулярна маса — 36 053[4].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MGKVKVGVNG | FGRIGRLVTR | AAFNSGKVDI | VAINDPFIDL | NYMVYMFQYD | ||||
| STHGKFHGTV | KAENGKLVIN | GNPITIFQER | DPSKIKWGDA | GAEYVVESTG | ||||
| VFTTMEKAGA | HLQGGAKRVI | ISAPSADAPM | FVMGVNHEKY | DNSLKIISNA | ||||
| SCTTNCLAPL | AKVIHDNFGI | VEGLMTTVHA | ITATQKTVDG | PSGKLWRDGR | ||||
| GALQNIIPAS | TGAAKAVGKV | IPELNGKLTG | MAFRVPTANV | SVVDLTCRLE | ||||
| KPAKYDDIKK | VVKQASEGPL | KGILGYTEHQ | VVSSDFNSDT | HSSTFDAGAG | ||||
| IALNDHFVKL | ISWYDNEFGY | SNRVVDLMAH | MASKE |
Цей білок за функціями належить до оксидоредуктаз, трансфераз. Задіяний у таких біологічних процесах як апоптоз, гліколіз, регуляція трансляції. Білок має сайт для зв'язування з НАД. Локалізований у цитоплазмі, цитоскелеті, ядрі, мембрані.
Участь у гліколізі[ред. | ред. код]
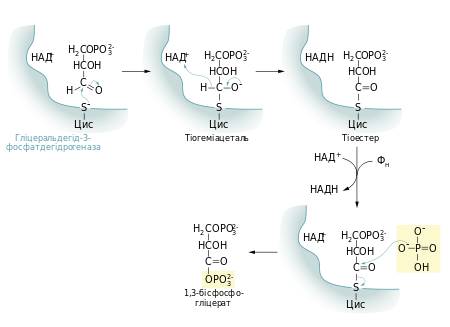
Гліцеральдегід-3-фосфатдегідрогеназа каталізує реакцію окиснення гліцеральдегід-3-фосфату із одночасним його фосфорилюванням. Це перша реакція гліколізу в якій виділяється енергія. В ході цієї реакції альдегід перетворюється не на вільну кислоту, а на змішаний ангідрид із фосфатною кислотою (1,3-бісфосфогліцерат). Сполуки такого типу — ацилфосфати — мають дуже велику від'ємну зміну вільної енергії гідролізу (ΔG0 = −49,3 кДж/моль)[5].
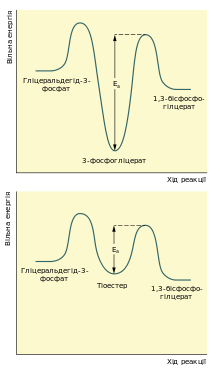
Реакцію перетворення гліцеральдегід-3-фосфату в 1,3-бісфосфогліцерат можна розглядати як два окремі процеси: окиснення альдегідної групи за допомогою НАД+ та приєднання фосфатної групи до утвореної карбонової кислоти. Перша реакція термодинамічно вигідна (ΔG0 = −50 кДж/моль), друга, навпаки, невигідна. Зміна вільної енергії для другої реакції майже така сама, тільки ця зміна додатна. Якби вони відбувались послідовно одна за одною, то друга реакція вимагала б надто великої енергії активації, щоб перебігати в клітині з достатньою швидкістю. Але обидва процеси є спряженими тому, що проміжна сполука — 3-фосфогліцерат — ковалентно зв'язана із залишком цистеїну тіоестерним зв'язком в активному центрі ферменту. Такий тип зв'язку дозволяє «законсервувати» частину енергії, яка виділяється під час окиснення гліцеральдегід-3-фосфату, та використати її для реакції із ортофосфатною кислотою[6].
Примітки[ред. | ред. код]
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:4141 (англ.) . Архів оригіналу за 23 жовтня 2016. Процитовано 30 січня 2017.
- ↑ UniProt, P04406 (англ.) . Архів оригіналу за 27 лютого 2017. Процитовано 30 січня 2017.
- ↑ Nelson et al, 2008, с. 536.
- ↑ Berg et al, 2007, с. 442.
Література[ред. | ред. код]
- Arcari P., Martinelli R., Salvatore F. (1984). The complete sequence of a full length cDNA for human liver glyceraldehyde-3-phosphate dehydrogenase: evidence for multiple mRNA species. Nucleic Acids Res. 12: 9179—9189. PMID 6096821 DOI:10.1093/nar/12.23.9179
- Tso J.Y., Sun X.-H., Kao T.-H., Reece K.S., Wu R. (1985). Isolation and characterization of rat and human glyceraldehyde-3-phosphate dehydrogenase cDNAs: genomic complexity and molecular evolution of the gene. Nucleic Acids Res. 13: 2485—2502. PMID 2987855 DOI:10.1093/nar/13.7.2485
- Ye Z., Connor J.R. (2000). cDNA cloning by amplification of circularized first strand cDNAs reveals non-IRE-regulated iron-responsive mRNAs. Biochem. Biophys. Res. Commun. 275: 223—227. PMID 10944468 DOI:10.1006/bbrc.2000.3282
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14: 2121—2127. 2004. PMID 15489334 DOI:10.1101/gr.2596504
- Nowak K., Wolny M., Banas T. (1981). The complete amino acid sequence of human muscle glyceraldehyde 3-phosphate dehydrogenase. FEBS Lett. 134: 143—146. PMID 7030790 DOI:10.1016/0014-5793(81)80587-X
- Tisdale E.J. (2002). Glyceraldehyde-3-phosphate dehydrogenase is phosphorylated by protein kinase Ciota /lambda and plays a role in microtubule dynamics in the early secretory pathway. J. Biol. Chem. 277: 3334—3341. PMID 11724794 DOI:10.1074/jbc.M109744200
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5. (англ.)
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257. Архів оригіналу за 3 березня 2011. Процитовано 2 травня 2017. (англ.)
- Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings. ISBN 978-0805359091. (англ.)
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1. (англ.)
Див. також[ред. | ред. код]
| Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |