Виразка Бурулі
| Виразка Бурулі (інфекція, яку спричинює Mycobacterium ulcerans) | |
|---|---|
 Типова виразка Бурулі на лівій руці у 17-річного хворого з Нігерії. | |
| Спеціальність | інфекційні хвороби |
| Симптоми | некроз[1] |
| Причини | інфекція |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 1B21.20 |
| МКХ-10 | A31.1 |
| DiseasesDB | 8568 |
| MeSH | D054312 |
| | |
Ви́разка Буру́лі (англ. Buruli ulcer або Mycobacterium ulcerans infection, також іноді описують як виразка Бернсдейла, виразка Сьорла, виразка Дейнтрі, виразка Моссмана, виразка Кумусі, мексиканська виразка) — інфекційне захворювання, збудником якого є Mycobacterium ulcerans. Хворобу відносять до так званих «забутих тропічних хвороб».
Можливо, що відомий шотландський дослідник екваторіальної Східної Африки Джеймс Огастас Грант під час своїх подорожей у 1860-ті роки захворів на виразку Бурулі та описав її перебіг у себе[2]. У 1897 році сер Альберт Кук[en], британський лікар та місіонер, який працював у лікарні Менго в Кампалі, Уганда, описав шкірні виразки у людей з графства Бурулі, клінічно схожі з сучасним описом хвороби — виразки Бурулі[3], але перший докладний опис хвороби, яку спричинює Mycobacterium ulcerans, приписують П. МакКаллуму з співавторами в Австралії в 1948 році, які виділили збудника, дали йому сучасну назву[4] У 1950 році, у Бельгійському Конго (нині Демократична Республіка Конго) зареєстрували перший африканський випадок, і в цьому ж році, Ф. Феннер остаточно ідентифікував збудника хвороби, ввів до медичного вжитку оригінальний метод культивування його в організмі мишей[5]. Цей мікобактеріоз отримав кілька назв залежно від місця, де його виявляли. Зокрема, він має назву виразка Бернсдейла в Австралії (відповідний район штату Вікторія), виразка Бурулі в Уганді, виразка Кумусі в Папуа Новій Гвінеї, мексиканська виразка відповідно в Мексиці[6].

За кількістю захворілих на виразку Бурулі це третя в світі людська мікобактеріальна інфекція після туберкульозу та прокази. З часу виділення збудника виявили багато пацієнтів з цим захворюванням в тропічних і субтропічних регіонах Центральній і Західній Африці, зокрема у таких країнах як Уганда, Бенін, Камерун, Кот-д'Івуар, Демократична Республіка Конго, Гана. У Північній і Південній Америці це досить рідкісне захворювання, і дуже небагато випадків виявили до цього часу. Відносно часто хворобу реєструють в Австралії. У 1998 році, після міжнародної конференції, організованої ВООЗ, з питань контролю і дослідження виразки Бурулі, що відбулась в Ямусукро (Кот-д'Івуар), була запропонована «Глобальна ініціатива по виразці Бурулі» (англ. Global Buruli Ulcer Initiative (GBUI)). Ініціатива залишається активною досі, в тому числі у кількох науково-дослідних проектах в різних африканських країнах, де виразка Бурулі є ендемічним захворюванням. На сьогодні у 33 країнах тропічної та субтропічної Африки, Південної Америки та Східного Тихоокеанського регіону хвороба є ендемічною. У 2014 році в цих регіонах зареєстрували загалом 2200 хворих на виразку Бурулі, переважно це були діти до 15 років. Виразка Бурулі створює відчутний економічний тягар населенню Африки. Зокрема у Гані тривалість лікування хворого сягає 90—120 днів, коштує в перерахунку 780 доларів США, при середній заробітній платі жителя країни у 2 долари США на день.
| Mycobacterium ulcerans | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||
| Біологічна класифікація | ||||||||||||||
| ||||||||||||||
| Mycobacterium ulcerans | ||||||||||||||
Посилання
| ||||||||||||||
|
Mycobacterium ulcerans відносять до роду Mycobacterium, родини Mycobacteriaceae. Це аеробні нерухомі бактерії, кислотостійкі, вони не утворюють спори та капсули. Хоча вони і не забарвлюються за Грамом, але їх класифікують як кислотостійкі грам-позитивні бактерії через відсутність у них зовнішньої мембрани. Для розвитку їм потрібна температура у діапазоні 29—33 °C, через що вони розмножують в шкірі кінцівок, де на поверхні саме є така температура. Розвиток Mycobacterium ulcerans іде при низький концентрації кисню у 2,5 %. Їм властива унікальна структура клітинної стінки, яка є товстішою за більшість бактерій, гідрофобною, воскоподібною, багатою на міколову кислоту та її солі. Головними шарами клітинної стінки є шари гідрофобних міколатів та шар пептидоглікану, зв'язаний з молекулами полісахариду-арабіногалактану. Клітинна стінка у великій мірі впливає на стійкість представників цього роду, в результаті її компоненти є звичайними мішенями для медичних препаратів проти виразки Бурулі[7].
M. ulcerans вивільнює токсин, відомий як некротизуючий імуносупресивний цитотоксин — міколактон, який зменшує імунну відповідь та призводить до загибелі тканини. Відомі 5 варіантів міколактону:
- A/B (M. ulcerans, які поширені у Африці, Малайзії, Японії);
- C (M. ulcerans, які поширені в Австралії);
- D (M. ulcerans, які поширені в Китаї);
- E (M. liflandii[8], які поширені у СубСахарській Африці);
- F (M. pseudoshottsii[9] and M. marinum[10], які зустрічаються повсюдно в світі).
На сьогодні механізм дії міолактону до кінця ще не прояснений.
Бактерії родини Mycobacteriaceae спричинюють також туберкульоз і проказу (M. tuberculosis та M. leprae, відповідно).
Джерела інфекції на сьогодні до кінця не прояснені. Від людини до людини хвороба, навіть при тісному контакті, передається вкрай рідко[11]. Зараженими у водоймах з переважно стоячою водою є малі водні тварини. У Австралії резервуарами можуть слугувати природно заражені коали та опосуми.
Механізм передачі цієї хвороби достеменно невідомий. Ймовірно хвороба передається контактним механізмом передачі. Не виключають того, що поширення відбувається через водні джерела, тому що велика кількість випадків відбувається біля води. Але проведені дослідження не підтвердили зв'язок хвороби з діями, які торкаються чи стосуються води. Тобто не виявлено кореляції з вибиранням води з водойм, рибальством, купанням, пранням тощо. Є припущення, що хворобу можуть переносити певні комахи (зокрема, великі водні жуки родини Belostomatidae; клопи Hemiptera; Odonata, Coleoptera) і передавати людині через укуси. При цьому було показано, що дрібна річкова риба містить у собі Mycobacterium ulcerans[12]. При проведенні біологічних експериментів було показано, що M. ulcerans може виживати і розмножуватися в слинних залозах водних жуків Naucoris cimicoides, і ці комахи змогли передати М. ulcerans мишам[13]. Також існує думка, про можливість передавання Mycobacterium ulcerans з акантоамебами — представниками роду Acanthamoeba з царства Amoebozoa[14]. Є певні спостереження. які свідчать, що кількість захворілих на виразку Бурулі збільшується у посушливі сезони або після повеней, що теоретично пов'язують із збільшенням і покращенням умов мешкання у тих регіонах, які відвідують люди, для певних переносників, які ще до сьогодні достеменно не визначені[15]. Є підтверджені результати визначення Mycobacterium ulcerans у великих концентраціях у прибережних та болотяних рослинах Echinocloa pyramidalis. Припускають, що зараження можливе в результаті поранення кінцівок цими рослинами, під час чого відбувається своєрідне впорскування Mycobacterium ulcerans в рани[16]. також було підтверджено. що носіння довгих штанів є захисним засобом попередження виникнення виразки Бурулі на нижніх кінцівках[17].

Найчастіше у ендемічних зонах хворіють діти 5—15 років, окрім Австралії, де частіше хворіють особи, старші від 50 років. Хвороба є проблемою для мандрівників у ендемічні країни, особливо при тривалій подорожі. Є спостереження, що можлива генетична сприйнятливість до виразки Бурулі, адже часто хворобу спостерігають у декількох поколіннях сімей, зокрема в Африці[18]. Таку спадковість пов'язують з наявністю певного поліморфізму у гені SCLC11A1 (NRAMP1) D543[19] Травми шкіри від малих до серйозних є фактором, що сприяють розвитку виразки Бурулі[20].
Багато ланок патогенезу виразки Бурулі на сьогодні не вивчено. Головним чинником хвороби вважають міолактон, який виділяє Mycobacterium ulcerans. Ця речовина спричинює місцевий некроз шкіри у місці вкорінення збудника. Це відбувається внаслідок неконтрольованої збірки актину в цитоплазмі, порушення організації кератинів, що призводить до подальшого потоншення верхнього шару епідермісу. Є припущення, що міолактон своєю ціллю має так званий гематопротеїн синдрому Віскотта-Олдріча[en][21] та невральний протеїн при цьому синдромі.[22] Культуральні особливості Mycobacterium ulcerans диктують необхідність зберігати на шкірі низьку температуру <33 °C, тому особливістю хвороби є переважна відсутність значного запалення та системних проявів: гарячки, нездужання, ліфмаденопатії. Сам міолактон спричинює ще й значну імунодепресію. Тому при певних фонових хворобах, які перебігають з імунодефіцитом, зокрема при ВІЛ-інфекції, виразка Бурулі є вкрай злоякісною, з ураженням великих поверхонь шкіри. Імунодепресія є фактором частого залучення в некротичний процес периферичних нервів, скелетних м'язів тощо. Найбільш тяжко виразка Бурулі перебігає в Африці через те, що саме тут поширені ті штами Mycobacterium ulcerans, які продукують найагресивніші варіанти міолактону — А та В.
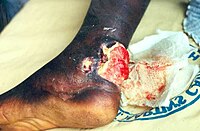
Інкубаційний період становить від 1-го до 9 місяців, в середньому, близько 4,5. Згідно МКХ-10 виразку Бурулі класифікують до A31.1 «Шкірні мікобактеріальні інфекції».
Рання (превиразкова) стадія зараження характеризується появою безболісної, зрідка сверблячої папули на руках чи ногах розміром 1—2 см в діаметрі, іноді на обличчі. Нечастим є ураження у вигляді набряклої ділянки, яке в перспективі може призвести до поширеного виразкового некрозу кінцівки.
Папула в подальшому може перетворитися на виразку протягом 1—2 місяців. Таким чином розвивається виразкова стадія. Всередині виразка може бути більше, ніж на поверхні шкіри, тобто має підірвані краї. Таким чином, виразка виглядає менших розмірів, аніж вона є в дійсності. Навколо неї можливе виникнення набряку. Виразка також безболісна, якщо не відбулось приєднання вторинної інфекції. Некроз йде вглиб на кшталт панікуліту, але особливості дії міолактону призводять до прогресування хвороби без гарячки та збільшення регіонарних лімфатичних вузлів. Коли захворювання прогресує, ураження може поширитися на прилеглі нерви, придатки шкіри, кровоносні судини, кістки. Кістки уражені у 15 % хворих на виразку Бурулі. Нерідким є виникнення остеомієліту. Метастатичні ураження можуть відбуватися в шкіру, м'які тканини або кістки через судинну або лімфатичну систему далеко за межі первинного вогнища.

Зцілення — це дуже повільний процес при виразці Бурулі. Хвороба часто призводить до утворення великих, часто потворних шрамів та значних функціональних порушень. Смерть при виразці Бурулі вкрай рідка, тоді як інвалідізація є дуже частою.
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Клінічна діагностика ґрунтується на появі характерних виразок і проживанні у ендемічних по виразці Бурулі районах. Але наявність у цих регіонах шкірного лейшманіозу, фрамбезійного виразкового ураження, дефектів шкіри, які спричинюють Haemophilus ducreyi, потребує ретельного розмежування і проведення специфічної лабораторної діагностики.
Для вивчення глибини уражень та реагування на антибіотикотерапію використовують ультразвукову діагностику (УЗД). При підозрі на ураження кісток проводять рентгенологічне дослідження.
Скупчення мікобактерій можна знайти при проведенні гістологічного дослідження виразок — їх зазвичай виявляють в дні виразки або у місцях хронічного запального інфільтрату. Патоморфологічні ознаки при виразці Бурулі не є специфічними.
ВООЗ вважає стандартними для діагностики виразки Бурулі 4 методи специфічної діагностики:
- ПЛР тонкоголкових аспіраційних біоптатів або тампонів з виразки;
- пряма мікроскопія з фарбуванням некротичної маси з виразки, папули або з набрякової тканини за Ціль-Нельсеном;
- патогістологія при проведенні оперативного втручання;
- бактеріологічний метод — посів вмісту виразки на живильне середовище Левенштейна-Йєнсена з інкубацією при температурі 30—32 °C.
17 лабораторій у ендемічних та неендемічних країнах сертифіковані ВООЗ для проведення досліджень на виразку Бурулі.
У лабораторіях для вивчення властивостей збудника, його стійкості до ліків широко використовують біологічний метод — зараження мишей під подушечку лапок, методику якої запропонував Ф. Феннер у 1950 році.
Головним на сьогодні в лікуванні виразки Бурулі вважають етіотропну терапію (тобто дію на збудника). Головним напрямком її є антибіотикотерапія. Антибіотики призводять до загибелі збудника і, таким чином, зменшують дію міколактону. Вони здатні обривати перебіг хвороби, зменшити необхідність хірургічного втручання. У 2004 році ВООЗ рекомендувала протокол лікування, який передбачає поділ уражень на 3 категорії:
- I — малі ранні ураження діаметром менше від 5 см. Антибіотикотерапія має тривати 8 тижнів;
- II — невиразкові, набрякові ураження або поодинокі виразки 5—15 см в діаметрі. Антибіотикотерапія має тривати 10 тижнів;
- III — ураження на шиї, голові та, особливо, обличчі; наявність великих виразок більших від 15 см в діаметрі; наявність остеомієліту та інших уражень кісток; поєднання декількох виразок; наявність дисемінованих форм. Антибіотикотерапія має тривати 20 тижнів.
ВООЗ рекомендувала, щоб усі ці категорії отримували парентеральний курс рифампіцину та стрептоміцину (чи амікацину). Частота рецидивів після лікування антибіотиками становить 2—3 %. Використання рифампіцину та стрептоміцину залишається стандартом медичної допомоги цим хворим. Але на сьогодні проводять дослідження із заміни парентерального введення на пероральний прийом. Пропонують об'єднання рифампіцину з кларитроміцином або фторхінолонів (моксифлоксацин, ципрофлоксацин) протягом 3-х місяців. Фторхінолони, стрептоміцин не рекомендують вагітним жінкам і дітям.
Запропонована гіпербарична оксигенація (ГБО)[23], озонотерапія[24]. За необхідності проводять реконструктивне оперативне втручання.
Через невизначеність із джерелами інфекції та механізмом передачі конкретних рекомендацій з профілактики на сьогодні не вироблено. Мандрівникам у ендемічні країни слід уникати непевних водойм, контакту з дрібними тваринами, рослинами тощо. У разі отримання пошкоджень шкіри їх слід одразу обробити антибіотиками, бактерицидними плівками тощо. На рану необхідно накласти захисну пов'язку.
Станом на 2016 рік ефективної вакцини немає. Є спостереження, що вакцина проти туберкульозу — БЦЖ, хоча не захищає від виникнення виразки Бурулі, але зменшує кількість ускладнень на кшталт остеомієліту.
- ↑ Disease Ontology — 2016.
- ↑ A walk across Africa; or, Domestic scenes from my Nile journal by Grant, James Augustus. Publisher Edinburgh, London, W. Blackwood and sons. Year 1864. Pages 481
- ↑ Cook A. Mengo Hospital Notes, 1897, Makerere Medical School Library, cited in leading articles. Br Med Jt 1970; 2:378-9.
- ↑ Maccallum P, Tolhurst JC, Buckle G, Sissons HA. A new mycobacterial infection in MA. J Path Bact. 1948;60:93-122.
- ↑ Fenner F. The significance of the incubation period in infectious diseases. Med J Aust. 1950;2:813-8.
- ↑ Coloma JN, Navarrete-Franco G, Iribe P, López-Cepeda LD. Ulcerative cutaneous mycobacteriosis. Int J Leprosy. 2005;73:5-12.
- ↑ Bhamidi S (2009). Mycobacterial Cell Wall Arabinogalactan. Bacterial Polysaccharides: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-45-5.
- ↑ Ця бактерія спричинює виразкові ураження в жаб'ячих.
- ↑ Ця бактерія спричинює мікобактеріоз у смугастого окуня (Morone saxatilis).
- ↑ Ця бактерія здатна спричинити опортуністичні ураження у людей з імунодефіцитом, а також так звану акваріумну гранульому.
- ↑ Jacobsen KH, Padgett JJ. Risk factors for Mycobacterium ulcerans infection. Int J Infect Dis. 2010 Aug. 14(8): e677-81.
- ↑ Portaels, F.; Elsen, P.; Guimaraes-Peres, A.; Fonteyne, P.A.; Meyers, W.M. (1999). «Insects in the transmission of Mycobacterium ulcerans infection». Lancet 353 (9157): 986. doi:10.1016/S0140-6736(98)05177-0. PMID 10459918
- ↑ Marsollier, L., T. Severin, J. Aubry, R. W. Merritt, J.-P. Saint-Andre, P. Legras, A.-L. Manceau, A. Chauty, B. Carbonnelle, & S. T. Cole. 2004a. Aquatic snails, passive hosts of Mycobacterium ulcerans. Applied and Environmental Microbiology 70:In Press.
- ↑ Wilson MD, Boakye DA, Mosi L, Asiedu K. In the case of transmission of mycobacterium ulcerans in buruli ulcer disease acanthamoeba species stand accused. Ghana Med J. 2011 Mar. 45(1):31-4.
- ↑ Darie, H., T. Le Guyadec, and J. E. Touze (1993). «Aspects épidémiologiques et cliniques de l'ulcère de Buruli en Côte-d'Ivoire». Bull Soc Pathol Exot Filiales 86: 272-6.
- ↑ Barker, D. J. P. 1972. The distribution of Buruli disease in Uganda. Transactions of the Royal Society of Tropical Medicine and Hygiene 66:867-874.
- ↑ Marston, B.J., M.O. Diallo, C.R. Horsburgh Jr., I. Diomande, M. Z. Saki, J. Kanga, G. Patrice, H.B. Lipman, S.M. Ostroff & R.C. Good. 1995. Emergence of Buruli ulcer disease in the Daloa region of Cote D'ivoire. Am. J. Trop. Med. Hyg. 52: 219—224.
- ↑ Muelder, K. and A. Nourou (1990). «Buruli ulcer in Benin.». Lancet 336 (8723): 1109—1111. doi:10.1016/0140-6736(90)92581-2
- ↑ Stienstra Y, van der Werf TS, Oosterom E, et al. Susceptibility to Buruli ulcer is associated with the SLC11A1 (NRAMP1) D543N polymorphism. Genes Immun. 2006 Apr. 7(3):185-9.
- ↑ Stienstra, Y.; van der Graaf, T.A.; te Meerman, G.J.; The, T.H.; de Leij, L.F.; van der Werf, T.S. (2001). «Susceptibility to development of Mycobacterium ulcerans disease: review of possible risk factors». Trop Med Int Health 6 (7): 554—562. doi:10.1046/j.1365-3156.2001.00746.x
- ↑ англ. Wiskott-Aldrich syndrome protein (WASP), синдром екземи-тромбоцитопенії-імунодефіциту
- ↑ Guenin-Macé L, Veyron-Churlet R, Thoulouze MI, Romet-Lemonne G, Hong H, Leadlay PF, et al. Mycolactone activation of Wiskott-Aldrich syndrome proteins underpins Buruli ulcer formation. J Clin Invest. 2013 Apr 1. 123(4):1501-12.
- ↑ Krieg RE, Wolcott JH, Confer A. Treatment of Mycobacterium ulcerans infection by hyperbaric oxygenation. Aviat Space Environ Med. 1975 Oct. 46(10):1241-5.
- ↑ Bertolotti A, Izzo A, Grigolato PG, Iabichella ML. The use of ozone therapy in Buruli ulcer had an excellent outcome. BMJ Case Rep. 2013 Jan 31. 2013:
- Aaron Z Hoover Buruli Ulcer Updated: Jul 17, 2014 Medscape. Infectious Diseases Sections. Parasitic Infections / Chief Editor: William D James [1] [Архівовано 9 березня 2016 у Wayback Machine.] (англ.)
- Walsh DS, Portaels F, Meyers WM. Buruli ulcer (Mycobacterium ulcerans infection). Trans R Soc Trop Med Hyg. 2008 Oct. 102(10):969-78. (англ.)
- Boleira M, Lupi O, Lehman L, Asiedu KB, Kiszewski AE. Buruli ulcer. An Bras Dermatol. 2010 Jun. 85(3):281-298; quiz 299—301. [2] [Архівовано 22 грудня 2015 у Wayback Machine.] (англ.)
- Merritt RW, Walker ED, Small PL, Wallace JR, Johnson PD, Benbow ME, et al. Ecology and transmission of Buruli ulcer disease: a systematic review. PLoS Negl Trop Dis. 2010 Dec 14. 4(12): e911. [3] [Архівовано 29 серпня 2021 у Wayback Machine.] (англ.)
- van der Werf TS, Stienstra Y, Johnson RC, Phillips R, Adjei O, Fleischer B, et al. Mycobacterium ulcerans disease. Bull World Health Organ. 2005;83:785-91. (англ.)
- WHO. Media centre. Buruli ulcer (Mycobacterium ulcerans infection). Fact sheet N°199. Updated February 2016 [4] [Архівовано 4 листопада 2015 у Wayback Machine.] (англ.)