Пероксисома: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
Немає опису редагування |
SoloWay (обговорення | внесок) Немає опису редагування |
||
| Рядок 1: | Рядок 1: | ||
[[Файл:Peroxisome.svg|thumb|310px|Схема будови пероксисоми]] |
|||
{{Refimprove}} |
|||
'''Пероксисо́ма''' — [[Клітина|клітинна]] [[органела]], оточена єдиною [[Клітинна мембрана|мембраною]], не містить [[Дезоксирибонуклеїнова кислота|ДНК]] і [[Рибосома|рибосом]] (на відміну від [[Мітохондрія|мітохондрій]] і [[Хлоропласт|хлоропластів]]). Пероксисоми наявні в усіх [[Ядерні|ядерних]] клітинах. Вони містять [[Окиснення|окиснювальні]] [[ферменти]], які використовують молекулярний [[Оксиген|кисень]] для вилучення [[Водень|водню]] з певних органічних речовин. У пероксисомах також перебігає {{Не перекладено|Бета-окиснення|β-окиснення|en|Beta oxidation}} [[Жирні кислоти|жирних кислот]]. У них також перебігають перші етапи утворення {{Не перекладено|Плазмалогени|плазмалогенів|en|Plasmalogen}}. У [[Рослини|рослин]] у пероксисомах перебігає {{Не перекладено|фотодихання||de|Photorespiration}}. Імпорт білків до пероксисом відбувається за участі короткого {{Не перекладено|Сигнальний пептид|сигнального пептиду|en|Signal peptide}}. |
|||
'''Пероксисома''' — [[органела]], притаманна більшості [[Еукаріоти|еукаріотичних]] [[Клітина (біологія)|клітин]], містить до 50 різних [[Фермент|ферментів]]; також '''[[гліоксисома]]''' (''в [[Рослини|рослинах]]''), '''[[глікосома]]''' (''в [[Трипаносома|трипаносомах]]'') і '''[[тільця Вороніна]]''' (''в деяких [[Гриби|видах грибів]]''). Має розміри 0.2-1.5 [[Метр|мкм]], відокремлена від [[Цитоплазма|цитоплазми]] однією мембраною. |
|||
[[Файл:Peroxisome.jpg|thumb]] |
|||
== Історія вивчення == |
|||
Тривалість життя '''П.''' незначна — всього 5-6 діб{{Fact}}. |
|||
Як окрему структуру пероксисому вперше описав 1954 року Родін у клітинах [[нирки]] [[Миша|миші]]. Ці структури були оточені однією мембраною та містили добре виражений гранулярний матрикс. Через малий розмір і невизначений вигляд дослідник назвав їх «мікротільцями». 1960 року та пізніше [[Крістіан де Дюв]] із колегами показав, що пероксисоми містять такі [[ферменти]], як {{Не перекладено|уратоксидаза||en|Urate oxidase}}, [[каталаза]], {{Не перекладено|оксидаза-D-амінокислот||en|D-amino acid oxidase}}. Виявилось, що в пероксисомах молекулярний кисень під впливом оксидази перетворюється в [[Гідроген пероксид|пероксид водню]], який каталаза розкладає на воду та кисень. Це відкриття дозволило де Дюву назвати цю органелу «пероксисомою». Водночас інша група дослідників, очолювана Біверсом, показала, що {{Не перекладено|гліоксилатний цикл||ru|Глиоксилатный цикл}} у зернах, що проростають, перебігає в невідомих доти [[Цитоплазма|цитоплазматичних]] часточках, які вони назвали «<nowiki/>[[Гліоксисома|гліоксисомами»]]. Гліоксисоми за своїми властивостями дуже нагадували пероксисоми. Було встановлено, що в гліоксисомах також перебігає β-окиснення жирних кислот. Пізніше було відкрито, що цей процес відбувається і в пероксисомах [[Печінка|печінки]] [[Пацюк|пацюка]]. Станом на нині гліоксисоми вважають видозміненими пероксисомами. |
|||
== Морфологія та розташування == |
|||
[[Файл:Peroxisome in rat neonatal cardiomyocyte.jpg|thumb|Пероксисоми в [[кардіоміоцит]]і пацюка]] |
|||
Пероксисоми є невеликими мембранними міхурцями розмірами 0,3—1,5 [[мкм]], що містять всередині гранулярний матрикс. У центрі матриксу розміщена серцевина, або нуклеоїд. У ції ділянці нерідко (особливо в клітинах печінки) видно кристалоподібні структури, що складаються з регулярних фібрил, або трубочок. |
|||
Пероксисоми наявні у всіх ядерних клітинах. Розмір, кількість і білковий склад пероксисом різниться в клітинах різних [[Тканина (біологія)|тканин]], а також може мінятись під впливом зовнішнього стимулу. Наприклад, у [[Дріжджі|дріжджів]], що ростуть на [[Цукор|цукрі]], пероксисоми маленькі. Однак у дріжджів, що ростуть на [[Метанол|метанолі]], наявні великі пероксисоми, які окиснюють метанол. Якщо дріжджі вирощують на жирних кислотах, то вони мають великі пероксисоми, в яких інтенсивно перебігає β-окиснення жирних кислот. У вищих [[Хребетні|хребетних тварин]] особливо багаті пероксисомами клітини печінки та нирок. Так, кожен {{Не перекладено|гепатоцит||en|Hepatocyte}} пацюка містить від 70 до 100 пероксисом. |
|||
== Функція == |
== Функція == |
||
| Рядок 18: | Рядок 25: | ||
'''П.''' беруть участь у [[Дихання|диханні]]. Вони споживають [[кисень]] у процесі окиснення різних класів жирних кислот — поряд з [[Мітохондрія|мітохондріями]] '''П.''' є головними споживачами O<sub>2</sub> в клітині. |
'''П.''' беруть участь у [[Дихання|диханні]]. Вони споживають [[кисень]] у процесі окиснення різних класів жирних кислот — поряд з [[Мітохондрія|мітохондріями]] '''П.''' є головними споживачами O<sub>2</sub> в клітині. |
||
== Імпорт білків == |
|||
== Будова == |
|||
Позаяк пероксисоми не містять власної ДНК і рибосом, усі їхні білки [[Хімічний синтез|синтезуються]] в [[Клітинне ядро|ядрі]] та повинні імпортуватись усередину пероксисом із цитозолю. Деякі білки пероксисом скеровуються до них за участі {{Не перекладено|C-кінець|C-кінцевого|en|C-terminus}} сигналу пероксимального адресування (PTS1). Послідовності PTS1 є значно коротшими за сигнали імпорту інших органел, і часто складаються всього з трьох [[Амінокислоти|амінокислотних]] залишків. Канонічна послідовність PTS1 містить [[серин]], [[цистеїн]] або [[аланін]], після якого йде залишок основної амінокислоти, а відтак [[лейцин]]. Наявність додаткових амінокислот поза PTS1 може посилювати адресний сигнал, особливо, якщо послідовність PTS 1 сильно відрізняється від канонічної. Набагато рідше пероксисомні білки мають сигнальну послідовність PTS2, яка розміщена на {{Не перекладено|N-кінець|N-кінці|en|N-terminus}} білка та має більшу довжину, ніж PTS1. PTS2 є частиною більшого [[Пептиди|пептиду]], який відщеплюється після завершення імпорту. Процес імпорту білків до пероксисом вивчений недостатньо, але відомо, що в ньому залучені розчинні [[Рецептор (білок)|рецептори]] в цитозолі, які впізнають сигнальну послідовність, і білки докіну на поверненому до цитозолю боці пероксисом. Процес імпорту супроводжується [[Гідроліз|гідролізом]] [[Аденозинтрифосфат|АТФ]], і ньому беруть участь близько 23 різних білків, що називаються {{Не перекладено|Пероксин|пероксинами|en|Peroxin}}. Білки з PTS1 позиціонуються на пероксисомах за участі рецептора Pex5p, а з PTS2 — Pex7p. У [[Ссавці|ссавців]] адресування білків з PTS2 відбувається за участі білка, який є варіантом [[Альтернативний сплайсинг|альтернативного сплайсинґу]] Pex5p. Комплекс із 6 різних пероксинів утворює мембранний транслокатор. |
|||
Морфологічно, '''П.''' дуже різноманітні. Вони можуть мати вигляд ізольованих сферичних тілець, трубочок, або, навіть, тісно переплетеного ретикулуму та змінюватися залежно від умов зовнішнього середовища. '''П.''' оточена однією [[Ліпіди|ліпідною]] [[Мембрана біологічна|мембраною]]. Наповнення '''П.''' формує її матрикс, часто кристалічної природи завдяки кристалізації [[Фермент|ферментів]]. '''П.''' не містить [[Генетична інформація|генетичної інформації]]. [[Білок|Білки]], що входять до складу '''П.''' кодуються [[Клітинне ядро|ядерними]] [[Ген|генами]]. |
|||
Процес імпорту білків пероксисом докорінно відрізняється від транслокації білків в [[Ендоплазматичний ретикулум|ЕПР]], мітохондрії та хлоропласти тому що білки пероксисом імпортуються після того, як вони набувають у цитозолі нативну чи навіть [[Олігомер|олігомерну]] структуру. З цього боку транспорт білків до пероксисом нагадує перенесення білків до ядра. Під час транспорту до ядра та до пероксисоми рецептор, що впізнає сигнальну послідовність, переноситься із субстратом через мембрану, відтак рецептор відділяється й експортується до цитозолю для подальшого використання. |
|||
Усі ферменти, які знаходяться в '''П.''', мають бути синтезовані на [[Рибосома|рибосомах]] поза нею — для їх перенесення з [[Цитозоль|цитозолю]] всередину органели мембрани '''П.''' мають систему вибіркового транспорту. |
|||
== Біогенез == |
== Біогенез == |
||
Механізм утворення нових пероксисом у клітині є предметом для дискусії. Достеменно невідомо, чи утворюються пероксисоми із попередніх шляхом їх росту та поділу (подібно до мітохондрій і пластидів), або ж вони утворюються шляхом відчеплення від [[Ендоплазматичний ретикулум|ендоплазматичного ретикулуму]]. Скоріш за все, обидві точки зори можуть відповідати дійсності, а механізм біогенезу пероксисом, ймовірно, виглядає ось так. Серед білків пероксисом є такі, які спочатку інтегруються в мембрану ЕПР, де вони можуть входити до складу особливих [[Везикула|везикул]]-попередників пероксисом. Відчеплення від ЕПР цих везикул і їхнє подальше злиття призводить до утворення пероксисоми, яка імпортує решту пероксисомальних білків за допомогою власного апарату імпорту. Відтак пероксисома може рости та ділитись із утворенням дочірніх пероксисом. |
|||
Існує щонайменше дві теорії щодо біогенезу '''П.''' |
|||
* Згідно з першою, вони утворюються внаслідок простого поділу та надалі збільшуються в розмірах, імпортуючи матричні білки та компоненти мембрани. [[Поділ клітини|Клітини під час поділу]] успадковують однакову кількість новоутворених '''П.''' |
|||
* Згідно з другою, до якої останнім часом схиляється дедалі більше дослідників, у процесі біогенезу бере участь [[Ендоплазматичний ретикулум|ЕПР]], який постачає первинні [[Везикула|везикули]], які містять усього кілька пероксисомних ферментів. Унаслідок кількастадійного імпорту матричних і мембранних білків у ці везикули й утворюються повноцінні '''П.''' |
|||
2017 року була запропонована нова модель утворення пероксисом ''de novo''. Відомо, що пероксисоми та мітохондрії функціонують разом у багатьох [[Обмін речовин|метаболічних шляхах]], як-от β-окиснення жирних кислот. Крім цього, за відсутності пероксисом у клітинах багато білків пероксинів імпортуються до мітохондрій. У зв'язку з цим передбачається, що пероксисоми є гібридним продуктом злиття пре-пероксисомних везикул, що відділились як від ЕПР, так і від мітохондрій. |
|||
[[Біогенез]] і дозрівання '''П.''' контролюється специфічним класом [[Білок|білків]] — [[Пероксин|пероксинами]]. |
|||
Щодо походження пероксисом існує низка альтернативних гіпотез. Позаяк пероксисоми різних організмів містять низку білків, однакових для всіх, була запропонована гіпотеза [[Ендосимбіонти|ендосимбіотичного]] походження пероксисом. Відповідно до цієї гіпотези, пероксисоми походять від внутрішньоклітинних [[Бактерії|бактерій]]. Існує версія, що пероксисоми походять від [[Актинобактерії|актинобактерій]]. Втім, останнім часом ці гіпотези були спростовані. |
|||
== Хвороби == |
|||
[[Генетика|Генетичні]] [[Мутація|мутації]], які пошкоджують гени [[Пероксин|пероксинів]], спричинюють низку важких клінічних синдромів. Зокрема, пероксисомогенні хвороби особливо поширені в генетично ізольованих [[Популяція|популяціях]], наприклад, у [[Японія|Японії]] та [[Нідерланди|Нідерландах]]. |
|||
== Клінічне значення == |
|||
== Історичний огляд == |
|||
Першим захворюванням, для якого була встановлена пов'язана з пероксисомами причина, став {{Не перекладено|синдром Зеллвеґера||en|Zellweger syndrome}}. У пацієнтів із синдромом Зельвеґера порушений процес імпорту білків у пероксисоми, що призводить до важкої пероксисомної недостатності. Їх клітини містять «порожні» пероксисоми. Пацієнти страждають від важких порушень у [[Центральна нервова система|ЦНС]], печінці та нирках і помирають невдовзі після народження. Одна форма захворювання спричинена [[Мутація|мутацією]] в пероксині Pex2, а дефект N-кінцевого сигналу імпорту зумовлює легшу форму захворювання. |
|||
Уперше '''П.''' виявив у [[1965]]-му [[Крістіан де Дюв]]. |
|||
З часу встановлення причин синдрому Зеллвеґера 1973 року було отримано багато нових свідчень про різноманітні захворювання, спричинені порушеннями функціонування пероксисом: станом на нині виявлено 14 [[Ген|генів]], мутації яких призводять до пероксисомних розладів. Їх поділяють на дві групи: захворювання, спричинені порушеннями роботи одного ферменту, та захворювання, пов'язані з [[Біогенез|біогенезом]] пероксисом. До першої групи належать такі захворювання, як X-зчеплена {{Не перекладено|адренолейкодистрофія||en|Adrenoleukodystrophy}} (АЛД) та {{Не перекладено|різомелична точкова хондродисплазія||en|Rhizomelic chondrodysplasia punctata}} (РТХП) типів 2 та 3. У пацієнтів із X-зчепленою АЛД накопичуються жирні кислоти з дуже довгими алкільними ланцюгами через мутації в [[ABC-транспортери|ABC-транспортері]] D1, який необхідний для транспорту цих сполук у пероксисоми. РТХП типів 2 та 3 спричинені дефектами двох основних ферментів біосинтезу плазмалогенів. |
|||
== Глікосоми == |
|||
Глікосома — [[клітина|Клітинна]] [[органела]] притаманна [[трипаносома]]м. Аналог [[пероксисома|пероксисом]] [[ссавці]]в, [[гліоксисома|гліоксисом]] в клітинах [[рослина|рослин]] та [[тільця Вороніна|тілець Вороніна]] в деяких [[вид]]ах [[гриби|грибів]].<ref>{{PMID|17023066}}</ref> |
|||
До другої групи належать хвороби, спричинені порушеннями біогенезу пероксиосом, тому вони характеризуються складнішою [[Етіологія (медицина)|етіологією]], ніж хвороби, спричинені порушеннями конкретних ферментів. До числа таких захворювань належить уже згаданий синдром Зеллвеґера, АЛД новонароджених, а також дитяча {{Не перекладено|хвороба Рефсума||en|Refsum disease}} |
|||
== Примітки == |
|||
{{reflist}} |
|||
== Література == |
|||
== Використана література == |
|||
{{Commonscat|Peroxisomes}} |
{{Commonscat|Peroxisomes}} |
||
* {{книга |
|||
# Alberts, B. 1994. [[Молекулярна біологія клітини (підручник)|Molecular Biology of the Cell]]. Garland Pub., New York. xliii, 1294, 67 p. |
|||
| автор = |
|||
# Titorenko, V.I., Rachubinski, R.A. 2001. The life cycle of the peroxisome. Nat. Rev. Mol. Cell Biol. 2(5):357-368. |
|||
| заголовок = Molecular Machines Involved in Peroxisome Biogenesis and Maintenance |
|||
| посилання = http://link.springer.com/book/10.1007/978-3-7091-1788-0 |
|||
| відповідальний= Cecile Brocard, Andreas Hartig |
|||
| місто = |
|||
| видавництво = Springer Vienna |
|||
| рік = 2014 |
|||
| том = |
|||
| сторінок = |
|||
| сторінки = |
|||
| isbn = 978-3-7091-1788-0 |
|||
| doi = 10.1007/978-3-7091-1788-0 |
|||
| ref = Brocard et al. |
|||
}} {{ref-en}} |
|||
* {{книга|автор=Кассимерис Л., Лингаппа В. Р., Плоппер Д. |заголовок=Клетки по Льюину|місто=М.|видавництво=Лаборатория знаний|рік=2016|сторінок=1056|isbn=978-5-906828-23-1|ref=Кассимерис и др.}} {{ref-ru}} |
|||
* {{книга|автор=Ченцов Ю. С.|заголовок=Введение в клеточную биологию|місто=М.|видавництво=ИКЦ «Академкнига»|рік=2005|сторінок=495|isbn=5-94628-105-4|ref=Ченцов}} {{ref-ru}} |
|||
* {{книга|автор=Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж.|заголовок=Молекулярная биология клетки: в 3-х томах. Т. 2|місто=М.: Ижевск|видавництво=НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований|рік=2013|сторінок=992|isbn=978-5-4344-0113-5|ref=Альбертс и др.}} {{ref-ru}} |
|||
* {{книга |
|||
| автор = Нельсон Д., Кокс М. |
|||
| заголовок = Основы биохимии Ленинджера |
|||
| посилання = |
|||
| відповідальний= |
|||
| місто = М. |
|||
| видавництво = БИНОМ. Лаборатория знаний |
|||
| рік = 2014 |
|||
| том = 2 |
|||
| сторінок = 636 |
|||
| сторінки = |
|||
| isbn = 978-5-94774-366-1 |
|||
| doi = |
|||
| ref = Нельсон, Кокс |
|||
}} {{ref-ru}} |
|||
{{Органели}} |
{{Органели}} |
||
{{Cell-bio-stub}} |
|||
[[Категорія:Органели]] |
[[Категорія:Органели]] |
||
Версія за 12:24, 13 лютого 2017
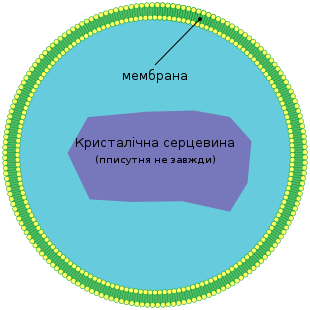
Пероксисо́ма — клітинна органела, оточена єдиною мембраною, не містить ДНК і рибосом (на відміну від мітохондрій і хлоропластів). Пероксисоми наявні в усіх ядерних клітинах. Вони містять окиснювальні ферменти, які використовують молекулярний кисень для вилучення водню з певних органічних речовин. У пероксисомах також перебігає β-окиснення[en] жирних кислот. У них також перебігають перші етапи утворення плазмалогенів[en]. У рослин у пероксисомах перебігає фотодихання. Імпорт білків до пероксисом відбувається за участі короткого сигнального пептиду[en].
Історія вивчення
Як окрему структуру пероксисому вперше описав 1954 року Родін у клітинах нирки миші. Ці структури були оточені однією мембраною та містили добре виражений гранулярний матрикс. Через малий розмір і невизначений вигляд дослідник назвав їх «мікротільцями». 1960 року та пізніше Крістіан де Дюв із колегами показав, що пероксисоми містять такі ферменти, як уратоксидаза[en], каталаза, оксидаза-D-амінокислот[en]. Виявилось, що в пероксисомах молекулярний кисень під впливом оксидази перетворюється в пероксид водню, який каталаза розкладає на воду та кисень. Це відкриття дозволило де Дюву назвати цю органелу «пероксисомою». Водночас інша група дослідників, очолювана Біверсом, показала, що гліоксилатний цикл[ru] у зернах, що проростають, перебігає в невідомих доти цитоплазматичних часточках, які вони назвали «гліоксисомами». Гліоксисоми за своїми властивостями дуже нагадували пероксисоми. Було встановлено, що в гліоксисомах також перебігає β-окиснення жирних кислот. Пізніше було відкрито, що цей процес відбувається і в пероксисомах печінки пацюка. Станом на нині гліоксисоми вважають видозміненими пероксисомами.
Морфологія та розташування

Пероксисоми є невеликими мембранними міхурцями розмірами 0,3—1,5 мкм, що містять всередині гранулярний матрикс. У центрі матриксу розміщена серцевина, або нуклеоїд. У ції ділянці нерідко (особливо в клітинах печінки) видно кристалоподібні структури, що складаються з регулярних фібрил, або трубочок.
Пероксисоми наявні у всіх ядерних клітинах. Розмір, кількість і білковий склад пероксисом різниться в клітинах різних тканин, а також може мінятись під впливом зовнішнього стимулу. Наприклад, у дріжджів, що ростуть на цукрі, пероксисоми маленькі. Однак у дріжджів, що ростуть на метанолі, наявні великі пероксисоми, які окиснюють метанол. Якщо дріжджі вирощують на жирних кислотах, то вони мають великі пероксисоми, в яких інтенсивно перебігає β-окиснення жирних кислот. У вищих хребетних тварин особливо багаті пероксисомами клітини печінки та нирок. Так, кожен гепатоцит пацюка містить від 70 до 100 пероксисом.
Функція
За визначенням, містить ферменти, які каталізують оксидативні реакції. Зокрема, ферменти необхідні для виконання таких функцій:
- α- та β- окиснення жирних кислот, амінокислот;
- біосинтез холестеролу, плазмалогену, жовчних кислот, поліненасичених жирних кислот;
- катаболізм спиртів, амінів і знешкодження перекису водню;
- біосинтез пеніциліну в грибах;
- біосинтез лізину в дріжджах;
- гліоксилатний цикл[en] у грибах і дріжджах;
- біосинтез етеровмісних ліпідів;
- побудова мієлінової оболонки нервових волокон;
- метаболізм фітанової кислоти[en].
П. беруть участь у диханні. Вони споживають кисень у процесі окиснення різних класів жирних кислот — поряд з мітохондріями П. є головними споживачами O2 в клітині.
Імпорт білків
Позаяк пероксисоми не містять власної ДНК і рибосом, усі їхні білки синтезуються в ядрі та повинні імпортуватись усередину пероксисом із цитозолю. Деякі білки пероксисом скеровуються до них за участі C-кінцевого сигналу пероксимального адресування (PTS1). Послідовності PTS1 є значно коротшими за сигнали імпорту інших органел, і часто складаються всього з трьох амінокислотних залишків. Канонічна послідовність PTS1 містить серин, цистеїн або аланін, після якого йде залишок основної амінокислоти, а відтак лейцин. Наявність додаткових амінокислот поза PTS1 може посилювати адресний сигнал, особливо, якщо послідовність PTS 1 сильно відрізняється від канонічної. Набагато рідше пероксисомні білки мають сигнальну послідовність PTS2, яка розміщена на N-кінці білка та має більшу довжину, ніж PTS1. PTS2 є частиною більшого пептиду, який відщеплюється після завершення імпорту. Процес імпорту білків до пероксисом вивчений недостатньо, але відомо, що в ньому залучені розчинні рецептори в цитозолі, які впізнають сигнальну послідовність, і білки докіну на поверненому до цитозолю боці пероксисом. Процес імпорту супроводжується гідролізом АТФ, і ньому беруть участь близько 23 різних білків, що називаються пероксинами[en]. Білки з PTS1 позиціонуються на пероксисомах за участі рецептора Pex5p, а з PTS2 — Pex7p. У ссавців адресування білків з PTS2 відбувається за участі білка, який є варіантом альтернативного сплайсинґу Pex5p. Комплекс із 6 різних пероксинів утворює мембранний транслокатор.
Процес імпорту білків пероксисом докорінно відрізняється від транслокації білків в ЕПР, мітохондрії та хлоропласти тому що білки пероксисом імпортуються після того, як вони набувають у цитозолі нативну чи навіть олігомерну структуру. З цього боку транспорт білків до пероксисом нагадує перенесення білків до ядра. Під час транспорту до ядра та до пероксисоми рецептор, що впізнає сигнальну послідовність, переноситься із субстратом через мембрану, відтак рецептор відділяється й експортується до цитозолю для подальшого використання.
Біогенез
Механізм утворення нових пероксисом у клітині є предметом для дискусії. Достеменно невідомо, чи утворюються пероксисоми із попередніх шляхом їх росту та поділу (подібно до мітохондрій і пластидів), або ж вони утворюються шляхом відчеплення від ендоплазматичного ретикулуму. Скоріш за все, обидві точки зори можуть відповідати дійсності, а механізм біогенезу пероксисом, ймовірно, виглядає ось так. Серед білків пероксисом є такі, які спочатку інтегруються в мембрану ЕПР, де вони можуть входити до складу особливих везикул-попередників пероксисом. Відчеплення від ЕПР цих везикул і їхнє подальше злиття призводить до утворення пероксисоми, яка імпортує решту пероксисомальних білків за допомогою власного апарату імпорту. Відтак пероксисома може рости та ділитись із утворенням дочірніх пероксисом.
2017 року була запропонована нова модель утворення пероксисом de novo. Відомо, що пероксисоми та мітохондрії функціонують разом у багатьох метаболічних шляхах, як-от β-окиснення жирних кислот. Крім цього, за відсутності пероксисом у клітинах багато білків пероксинів імпортуються до мітохондрій. У зв'язку з цим передбачається, що пероксисоми є гібридним продуктом злиття пре-пероксисомних везикул, що відділились як від ЕПР, так і від мітохондрій.
Щодо походження пероксисом існує низка альтернативних гіпотез. Позаяк пероксисоми різних організмів містять низку білків, однакових для всіх, була запропонована гіпотеза ендосимбіотичного походження пероксисом. Відповідно до цієї гіпотези, пероксисоми походять від внутрішньоклітинних бактерій. Існує версія, що пероксисоми походять від актинобактерій. Втім, останнім часом ці гіпотези були спростовані.
Клінічне значення
Першим захворюванням, для якого була встановлена пов'язана з пероксисомами причина, став синдром Зеллвеґера[en]. У пацієнтів із синдромом Зельвеґера порушений процес імпорту білків у пероксисоми, що призводить до важкої пероксисомної недостатності. Їх клітини містять «порожні» пероксисоми. Пацієнти страждають від важких порушень у ЦНС, печінці та нирках і помирають невдовзі після народження. Одна форма захворювання спричинена мутацією в пероксині Pex2, а дефект N-кінцевого сигналу імпорту зумовлює легшу форму захворювання.
З часу встановлення причин синдрому Зеллвеґера 1973 року було отримано багато нових свідчень про різноманітні захворювання, спричинені порушеннями функціонування пероксисом: станом на нині виявлено 14 генів, мутації яких призводять до пероксисомних розладів. Їх поділяють на дві групи: захворювання, спричинені порушеннями роботи одного ферменту, та захворювання, пов'язані з біогенезом пероксисом. До першої групи належать такі захворювання, як X-зчеплена адренолейкодистрофія[en] (АЛД) та різомелична точкова хондродисплазія[en] (РТХП) типів 2 та 3. У пацієнтів із X-зчепленою АЛД накопичуються жирні кислоти з дуже довгими алкільними ланцюгами через мутації в ABC-транспортері D1, який необхідний для транспорту цих сполук у пероксисоми. РТХП типів 2 та 3 спричинені дефектами двох основних ферментів біосинтезу плазмалогенів.
До другої групи належать хвороби, спричинені порушеннями біогенезу пероксиосом, тому вони характеризуються складнішою етіологією, ніж хвороби, спричинені порушеннями конкретних ферментів. До числа таких захворювань належить уже згаданий синдром Зеллвеґера, АЛД новонароджених, а також дитяча хвороба Рефсума[en]
Література
| Вікісховище має мультимедійні дані за темою: Пероксисома |
- Molecular Machines Involved in Peroxisome Biogenesis and Maintenance / Cecile Brocard, Andreas Hartig. — Springer Vienna, 2014. — ISBN 978-3-7091-1788-0. — DOI: (англ.)
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М. : Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1. (рос.)
- Ченцов Ю. С. Введение в клеточную биологию. — М. : ИКЦ «Академкнига», 2005. — 495 с. — ISBN 5-94628-105-4. (рос.)
- Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки: в 3-х томах. Т. 2. — М.: Ижевск : НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — 992 с. — ISBN 978-5-4344-0113-5. (рос.)
- Нельсон Д., Кокс М. Основы биохимии Ленинджера. — М. : БИНОМ. Лаборатория знаний, 2014. — Т. 2. — 636 с. — ISBN 978-5-94774-366-1. (рос.)
| ||||||||||||||||||||