Кумен (сполука)
| Кумен (сполука) | |
|---|---|
 Кулькова модель
|
 Структурна формула
|
| Інші назви | Ізопропілбензен, 2-фенілпропан, кумол |
| Ідентифікатори | |
| Номер CAS | 98-82-8 |
| Номер EINECS | 202-704-5 |
| KEGG | C14396 |
| ChEBI | 34656 |
| RTECS | GR8575000 |
| SMILES | CC(C)C1=CC=CC=C1 |
| InChI | InChI=1S/C9H12/c1-8(2)9-6-4-3-5-7-9/h3-8H,1-2H3 |
| Номер Бельштейна | 1236613 |
| Властивості | |
| Молекулярна формула | C6H5CH(CH3)2 |
| Молярна маса | 120,1916 ± 0,008 г/моль |
| Зовнішній вигляд | безбарвна рідина з характерним запахом |
| Густина | 0,8618 г/см³ |
| Тпл | −96,028 °C (при 1 атм) |
| Ткип | 152,39 °C (425,54 K) |
| Розчинність (вода) | 50 мг/л у воді[1] |
| Розчинність (етери) | розчинний |
| Розчинність (спирти) | розчинний |
| Дипольний момент | 0,79 |
| Небезпеки | |
| Температура спалаху | 31 °C (у закритому тиглі) |
| Температура самозаймання | 420 °C |
| Вибухові границі | 0,9—6,5 %об. (повітря) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Куме́н (також кумо́л, ізопропі́лбензе́н) — органічна сполука ряду ароматичних вуглеводнів складу C6H5CH(CH3)2. За звичайних умов є безбарвною горючою рідиною.
Фізичні властивості[ред. | ред. код]
Безбарвна горюча рідина з запахом бензену, практично нерозчинна у воді (менше 0,01 %), змішується зі спиртом, діетиловим ефіром, бензеном. Температура кипіння — 152,4 °С. ГДК 50 мг/м³.[2] Коефіцієнт заломлення світла n20
D = 1,4914.[3]
Отримання[ред. | ред. код]
- Методом алкілування бензолу алкенами.
- Каталізатором цього процесу може служити каталітичний комплекс (AlCl3 з HCl і алкілароматичним вуглеводнем). Процес здійснюють при 100—130 °C (тиск визначається температурою), мольне співвідношення бензол:пропілен (з урахуванням поліалкілбензолів, які повертаються в реакцію) становить 3:3,5. Отриманий кумол відмивають від каталізатора послідовно 17%-им розчином AlCl3, 3—5%-им розчином NaOH і водою, далі ректифікують. Недолік методу — необхідність використання стійкого до корозії обладнання.
- Все більшого застосування отримує метод гомофазного алкілування в присутності розчинних кількостей хлоралюмінієвого каталітичного комплексу. В цьому методі спрощується технологічна схема процесу, зростає швидкість реакції, зменшується корозійна активність реакційного середовища і знижується вихід побічних продуктів.
- Також для одержання кумолу застосовують фосфорнокислотні каталізатори на твердому носії — глині, кізельґурі, силікагелі або алюмосилікаті. Процес здійснюють при температурі близько 200 °C і тиску 2,8—4,2 МПа. Щоб запобігти дезактивації каталізатора, в реакційну зону вводять воду (0,06—0,08 % за масою від маси сировини). З метою зменшення утворення поліалкілбензолів процес ведуть при мольному співвідношенні бензол: пропілен рівному 10:1. Вихід кумолу становить 96—97 % в розрахунку на бензол і 91-92 % в розрахунку на пропілен.[4][5] Прикладом такого процесу може служити реакція алкілування бензолу пропіленом в присутності ортофосфорної кислоти при температурі близько 250 °C і тиску 400 кг/см² (~4·107):[6]
- Для одержання додаткового кумолу застосовують реакцію дезалкілування. Так при алкілування бензолу пропіленом завжди утворюється крім кумолу в знгачній кількості диізопропілбензол. Його і направляють на подальше дезалкілування.[7]
- За допомогою реакції Фріделя -Крафтса:[8]
Хімічні властивості[ред. | ред. код]
Кумол — типова ароматична сполука. Легко алкілується, хлорується, сульфується, нітрується в ядро.
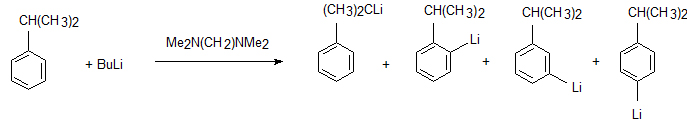
- Алкілування металорганічними сполуками:[10]
- Кумол вступає в реакцію формілювання — пряме введення альдегідної групи. В синтезі Гаттермана-Коха формілювання проходить в присутності хлористого водню і хлористого алюмінію. При проведенні цієї реакції при атмосферному тиску необхідна також присутність хлориду міді (І), але для реакції при підвищеному тиску каталізатора непотрібно. В результаті реакції утворюється п-ізопропілбензальдегід, вихід продукту 60 %.[11]
Застосування[ред. | ред. код]
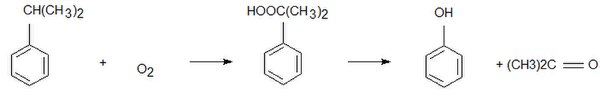
Кумол є проміжним продуктом при отриманні фенолу і ацетону одним з промислових способів.
Процес відомий під назвою реакції Удріса-Сергєєва — окиснення ізопропілбензолу киснем повітря в гідропероксид з подальшим його розкладом сірчаною кислотою:
- C6H5CH(CH3)2 + O2 → C6H5COOH(CH3)2 → C6H5OH + (CH3)2CO
Побічними продуктами розкладу є α-метилстирол, ацетофенон, диметилфенілкарбінол.[12][13][14][15]
Кумол також застосовується для отримання α-метилстиролу.[16]
Кумол є розчинником для лакофарбових матеріалів.[16] Крім цього кумол застосовується як добавка до авіаційних бензинів (підвищує антидетонаційні властивості).[17]
Примітки[ред. | ред. код]
- ↑ Mackay D, Shiu WY (1981) A critical review of Henry's law constants for chemicals of environmental interest. Journal of Physical and Chemical Reference Data, 19:1175–1199.
- ↑ Кнунянц И. Л. Химический энциклопедический словарь. — Москва: «Советская энциклопедия», 1983.
- ↑ Нейланд О. Я. «Органическая химия: Учеб. для хим. спец. вузов.» — Москва: «Высшая школа», 1990. С. 180.
- ↑ Кнунянц І. Л. «Химическая энциклопедия» том 2. — Москва «Советская энциклопедия», 1990.
- ↑ Kirk «Othmer encycloprdia» 3 ed, v. 7.—New York, 1979.
- ↑ Потапов В. М. «Органичнеская химия». — Москва: «Химия», 1979.—с. 268—269.
- ↑ Ластухін Ю. О., Воронов С. А. «Органічна хімія». — Львів: Центр Європи, 2006. — с. 615—616.
- ↑ Кери Ф., Сандберг Р. «Углубленный курс органической химии: Пер. с англ. В двух книгах/Под ред. Потапова В. М. Книга первая».—Москва, «Химия»,1981.— с. 232.
- ↑ Кери Ф., Сандберг Р. «Углубленный курс органической химии: Пер. с англ. В двух книгах/Под ред. Потапова В. М. Книга первая».—Москва, «Химия»,1981.— с. 473.
- ↑ Кери Ф., Сандберг Р. «Углубленный курс органической химии: Пер. с англ. В двух книгах/Под ред. Потапова В. М. Книга первая».—Москва, «Химия»,1981.— с. 152.
- ↑ Робертс Дж., Касерио М. «Основы органической химии», том 2. — Москва: «Мир», 1978.— с. 342.
- ↑ Кнунянц И. Л. «Химическая энциклопедия» том 2. — Москва «Советская энциклопедия», 1990. — 671 с.
- ↑ Далин М. А., Лобкина В. В. «Справочник нефтехимика» том 2. — Л., 1978.
- ↑ Лебедев Н. Н. «Химия и технология основного органического и нефтехимичкского синтеза», 2 изд. — Москва, 1975.
- ↑ Далин М. А., Лобкина В. В. «Синтез и превращения алкилароматических соединений». — Иркутск, 1979.
- ↑ а б Кнунянц И. Л. «Химический энциклопедический словарь. — Москва: „Советская энциклопедия“, 1983.»
- ↑ Потапов В. М. «Органичнеская химия». — Москва: «Химия», 1979.— с. 269.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||