Пентакарбоніл заліза
| Пентакарбоніл заліза | |
|---|---|
 |
 |
 |
 |
| Назва за IUPAC | Пентакарбонілзалізо |
| Інші назви | Карбоніл заліза |
| Ідентифікатори | |
| Номер CAS | 13463-40-6 |
| PubChem | 26040 |
| Номер EINECS | 236-670-8 |
| ChEBI | CHEBI:30251 |
| RTECS | NO4900000 |
| SMILES | [Fe].[O+]#[C-].[O+]#[C-].[O+]#[C-].[O+]#[C-].[O+]#[C-] |
| InChI | InChI=1S/5CO.Fe/c5*1-2 |
| Номер Гмеліна | 3568 |
| Властивості | |
| Молекулярна формула | Fe(CO)5 |
| Молярна маса | 195,9 г/моль |
| Молекулярна маса | 196 а. о. м. |
| Зовнішній вигляд | Рухлива світло-коричнева рідина |
| Запах | Своєрідний |
| Густина | 1,453 г/см³ |
| Тпл | −21 °C |
| Ткип | 102,5 °C |
| Розчинність (вода) | Нерозчинний |
| Показник заломлення (nD) | 1,5196 (при 20 °С) |
| В'язкість | 0,755 спз (при 20,2 °С) |
| Структура | |
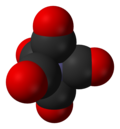
| Кристалічна структура | тригональна біпіраміда |
| Дипольний момент | 0 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
53,7 ккал/моль |
| Ст. ентальпія згоряння ΔcH 298 |
381,8 ккал/моль |
| Небезпеки | |
| ЛД50 | 25 мг/кг (миші, орально) |
| NFPA 704 | |
| Температура спалаху | −15 °C |
| Температура самозаймання | 34 °C |
| Вибухові границі | 3,7—12,5% |
| Пов'язані речовини | |
| Пов'язані речовини | Бутанон, Ізопропіловий спирт |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Пе́нтакарбоні́л залі́за — карбоксильний комплекс заліза з хімічною формулою . Це світло-коричнева рідина зі своєрідним запахом розчинна у бензині, бензолі, ацетоні та інших розчинниках. Сильна отрута.
Найбільше застосовується як сировина для отримання порошків карбонільного заліза.
Будова[ред. | ред. код]
Як відомо, існують три види молекул, що утворюються відповідно до трьох типів зв'язку — іонного, полярного і неполярного. Проте спроби застосувати ці погляди до пояснення зв'язків в карбонілах заліза виявилися невдалими.
Вивчення раман-спектрів[1] та інфрачервоних спектрів[2] цієї сполуки показало, що всі п'ять груп безпосередньо зв'язані з атомом заліза. Зараз будову карбонілів заліза та інших металів пояснюють за допомогою координаційної теорії, розробленої для комплексних сполук. Користуючись нею, в 1927 році було встановлено, що атоми-акцептори металів перехідних груп, зокрема заліза, здатні до приєднання саме такої кількості електронів, якої бракує для побудови атома інертного газу, розташованого в кінці даного періоду. Електрони забираються у молекул-донорів оксиду вуглецю.
Так, у випадку пентакарбонілу заліза, атом інертного газу криптону має 36 електронів, а атом заліза 26. При взаємодії з атом заліза доповнює свої оболонки десятьма електронами, для чого йому необхідно п'ять електронних пар, які віддають п'ять груп . Так пояснюється будова пентакарбонілу заліза .
Структура молекули пентакарбонілуа заліза була досліджена електронографічним методом[3][4][5], а також шляхом зняття раман-спектрів[1] та інфрачервоних спектрів[2]. На підставі цих досліджень твердо встановлено, що молекулярна решітка пентакарбонілу заліза має конфігурацію тригональної біпіраміди типу D3. У центрі біпіраміди знаходиться атом заліза, в її вершинах перебувають атоми кисню, а між атомами заліза і кисню розташовані атоми вуглецю.
Фізичні властивості[ред. | ред. код]
Пентакарбоніл заліза за звичайних умов є рухливою світло-коричневою рідиною зі своєрідним запахом. Він добре розчиняється в органічних розчинниках, є діамагнетиком, не має дипольного моменту.
Молярний об'єм рідкого карбонілу дорівнює 128 см³/моль при температурі плавлення −20 °С, або 149,6 ³/моль при температурі кипіння (+102,5 °С)[6].
Константа Ван-дер-Ваальса для пентакарбонілу заліза рівна 18,9, а постійна Трутона становить 20,6[7]. Кріоскопічна константа рівна 7,6 ±0,1.
Пентакарбоніл заліза повністю розчиняється в бензині, бензені, тетраліні[ru], бензальдегіді, ацетоні, бромобензені[ru], дихлоробензені та інших розчинниках. Крім того, він частково розчинний у ацетальдегіді, хлороформі і деяких інших розчинниках.
Одержання[ред. | ред. код]
Синтез пентакарбонілу заліза відбувається при взаємодії елементарного заліза з оксидом вуглецю за рівнянням:
Промисловий синтез пентакарбонілу заліза в більшості випадків здійснюється під тиском 100–200 ат при температурі 180–200 °С. При цьому як залізовмісну сировину використовують або губчасте залізо, або залізний штейн.
Хімічні властивості[ред. | ред. код]
У хімічному відношенні пентакарбоніл заліза досить активний. Вельми характерними для нього є реакції заміщення однієї або декількох груп як нейтральними молекулами (спирти, аміни), так і найрізноманітнішими радикалами.
Розведена нітратна кислота активно взаємодіє з пентакарбонілом, руйнуючи його:
тому дана реакція лежить в основі одного з методів дегазації пентакарбонілу заліза.
Сульфатна і соляна кислоти реагують з ним лише в концентрованому вигляді:
Надзвичайно характерною є реакція фотохімічного розкладу пентакарбонілу заліза під дією світла, що проходить з утворенням нонакарбонілу заліза у дві стадії:

Пентакарбоніл заліза легко окиснюється і добре горить з утворенням яскраво-рудого оксиду заліза:
Ця реакція лежить в основі промислового отримання магнітного оксиду заліза для феритів[8][9].
З сухим аміаком за відсутності повітря пентакарбоніл реагує з утворенням червоно-коричневої сполуки складу .
У спиртовому розчині карбоніл реагує з сулемою з утворенням жовтого осаду:
Ця реакція покладена в основу одного з методів аналізу карбонілу.
З лугом пентакарбоніл заліза при нагріванні реагує за відсутності повітря. При цьому утворюється кисла сіль карбоніл-гідриду:
Взаємодія пентакарбонілу з перекисом водню приводить до його окиснення з утворенням колоїдного оксиду заліза:
Відновлюючи пентакарбоніл заліза воднем, можна отримати, крім заліза, залежно від температурного режиму найрізноманітніші вуглеводні.
Взаємодія пентакарбонілу з чотирихлористим вуглецем може відбуватися за двома схемами:
У середовищі різних розчинників пентакарбоніл активно реагує з вищими хлоридами деяких елементів:
Найважливішою для техніки є реакція термічної дисоціації пентакарбонілу заліза, яка відбувається за нормального тиску і температури 250–300 °C:
На цій реакції базується промисловий метод одержання порошка заліза, який зветься карбонільним.
Застосування[ред. | ред. код]
Як антидетонаційна присадка до моторних палив[ред. | ред. код]

Присадка пентакарбонілу заліза в кількості менше 0,1% підвищує октанове число синтетичного бензину з 61 до 96% , тобто на 35 одиниць[10][11][12].
Такий ефект пентакарбонілу заліза як антидетонаційної присадки виявився приблизно в 350 разів вищим, ніж для бензену. Тому з 1926 року у Німеччині фірма «А. С. Рібек» організувала випуск нового високооктанового пального, що містить присадку під назвою «моталін» або «мотіл».
Застосування пентакарбоніла має певні переваги перед таким поширеним антидетонатором як тетраетилсвинець , якщо порівнювати їх економічність і особливо охорону праці, хоча за активністю трохи нижчий. Однак головний недолік пентакарбонілу заліза як антидетонаційної присадки полягає в тому, що при згорянні з паливом він утворює оксид заліза , який у вигляді тонкого абразивного порошку різко збільшує знос циліндрів двигуна. Це головна причина, що затримує широке застосування пентакарбонілу заліза як антидетонатора моторних палив.
Для подолання цієї проблеми розроблені спеціальні добавки, що значно знижують шкідливі наслідки застосування для зазначеної мети. До них належить, зокрема, ряд органічних кислот, ефірів, ацетилацетон, метиланілін, α-хлорнафталін та інші речовини.
Як сировина для отримання оксиду заліза[ред. | ред. код]
При спалюванні пентакарбонілу заліза з надлишком повітря утворюється дуже чистий високодисперсний оксид заліза . Отриманий продукт — це легкий ватоподібний порошок густиною 0,5 кг/м3, середній розмір його індивідуальних частинок, які мають сферичну форму, дорівнює 0,1 мкм. Порошок використовують як полірувальний засіб і барвник[6][13][14].
За кордоном процес отримання оксиду заліза при спалюванні пентакарбонілу заліза поширений досить широко.
Як світлочутливий матеріал[ред. | ред. код]
Було запропоновано просочувати папір пенткарбонілом заліза в темряві. Після експонування на світлі і промивання у воді на папері залишаються оранжево-коричневі відбитки нонакарбонілу . Якщо потім промити це зображення у підкисленому розчині гексаціаноферат(II) калію, то воно стає синім. Такий процес використовувався для отримання фотовідбитків і контактних відбитків з креслень.
Як каталізатор[ред. | ред. код]
Пентакарбоніл заліза є каталізатором при отриманні карбонових кислот з алкенів, спиртів та ефірів. За його допомогою синтезують деякі антибіотики. Так, ацетиленові карбіноли типу при додаванні пентакарбонілу заліза перетворюються на цінний антибіотик α-метиленбутиролактон.
Як сировина для отримання порошків карбонільного заліза[ред. | ред. код]
Найбільш широке застосування отримав для виготовлення карбонільного заліза, яке володіє рядом цінних властивостей, що обумовлюють його застосування в багатьох галузях сучасної техніки.
Змінюючи технологію виробництва, можна отримати карбонільне залізо у вигляді компактних блоків, що застосовуються при виплавці прецизійних сплавів, порошків різної дисперсності, що володіють цінними електромагнітними властивостями, різноманітних феромагнітних плівок і, нарешті, у вигляді металу особливої чистоти. У зв'язку з цим карбонільне залізо широко застосовується у металургії при отриманні різних сплавів, радіотехніці і дротовому зв'язку для виготовлення широкого асортименту магнітодіелектриків, машинобудуванні для виготовлення електромагнітних порошкових муфт різного призначення, електроніці при створенні елементів лічильно-обчислювальних пристроїв, магнітної дефектоскопії та в інших галузях техніки.
Фізіологічна дія[ред. | ред. код]
Токсичність[ред. | ред. код]
Пентакарбоніл заліза є сильно отруйним при вдиханні, введенні всередину чи всмоктуванні через неушкоджену шкіру. Викликає гострий набряк легенів незалежно від шляху введення. Припускається, що виділення відбувається через легені.
Смертельна доза для кроликів при введенні через рот або внутрішньовенно 1,75 мг/кг. При вдиханні парів протягом 30 хвилин для білих мишей ЛК50 = 2,19, для білих щурів 0,91 мг/л.
В умовах виробництва отруєння проходило подібно до картини інтоксикації .
У США встановлена гранично допустима концентрація на рівні 0,8 мг/м3[15].
Індивідуальний захист[ред. | ред. код]
Як попереджувальний захід слід застосовувати протигаз марки П-2 (одночасно захищає від і ). Слід врахувати, що при збільшенні маси коробки протигазу на 25 г вона більше не захищає від , а при прирості маси на 45 г коробку необхідно негайно замінити.
Для боротьби з виділеним у повітря , а також застосовується дегазація окиснювачами (, хлорамін).
Див. також[ред. | ред. код]
| Вікісховище має мультимедійні дані за темою: Пентакарбоніл заліза |
Примітки[ред. | ред. код]
- ↑ а б Duncan A., Murray J. Journal of Chemical Physics, 1934, № 2, p. 636. (англ.)
- ↑ а б Sheline R., Pitzer K. JJournal of the American Chemical Society, 1950, № 72, p. 1107. (англ.)
- ↑ Ормоит Б. Ф. Структуры неорганических веществ. Гостехтеориздат, 1950. (рос.)
- ↑ Graffunder W., Heymann Е. Zeitschrift für Physikalische Chemie, 1932, № 15, S. 37. (англ.)
- ↑ Ewens R., Lister M. Transactions of the Faraday Society, 1939, № 35, p. 681. (англ.)
- ↑ а б Moles E. Anales de la Real Sociedad Espaňola de Quimica, 1925, № 23, p. 524. (ісп.)
- ↑ Kelley K. Bui. U. S. Bur. Min., 1935, p. 383. (англ.)
- ↑ Сыркин В. Г. Химическая промышленность, 1967, № 5, с. 30. (рос.)
- ↑ Сыркин В. Г., Полушкина Н. Е. Порошковая металлургия, 1967, № 4, с. 1. (рос.)
- ↑ Німецький патент № 455525, 1924. (нім.)
- ↑ Німецький патент № 489864, 1925. (нім.)
- ↑ Німецький патент № 441179, 1925. (нім.)
- ↑ Cawood W., Rhytlaw-Glay R. Transactions of the Faraday Society, 1936, № 32, p. 1059. (англ.)
- ↑ Hieber W., Leutert F. Zeitschrift für anorganische und allgemeine Chemie, 1932, № 204, S. 145. (англ.)
- ↑ Threshold Limit Values for 1973. American Conference of Governmental Industrial Hygienists, 1973. 94 p. (англ.)
Джерела[ред. | ред. код]
- Волков В.Л., Сыркин В.Г., Толмасский И.С. Карбонильное железо. — Москва : «Металлургия», 1969. — 256 с. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Коц В. А., Либерман Н. Р., Томарченко С. Л. — 7. — Ленинград : Химия, 1977. — Т. 3. — С. 529. — 52000 прим. (рос.)










![{\displaystyle \mathrm {[Fe(NH_{3})_{3}]\cdot [HFe(CO)_{4}]_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/564e8383c082f24a8f1674f81adcba76667f7401)

![{\displaystyle \mathrm {Fe(CO)_{5}+3NaOH\longrightarrow Na[HFe(CO)_{4}]+Na_{2}CO_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/199f3aae24caff239f24dd9937624f51c872aa77)











