Вуглець
| 6 | Вуглець
|
12,011 | |
| 2s22p2 | |
Вугле́ць[11] (хімічний знак — , лат. carboneum) — хімічний елемент з атомним номером 6, що належить до 4-ї групи, 2-го періоду періодичної системи хімічних елементів; представник поліатомних неметалів.
Простими речовинами вуглецю (карбону) через його особливі хімічні властивості є кілька алотропних модифікацій із власними назвами, з яких найпоширенішими є: прозорий, дуже твердий алмаз; матово-чорний із металевим блиском, м'який графіт; мікропористе деревне вугілля; порошкоподібна сажа. Простої речовини із назвою вуглець не існує.
Вуглець є одним із поширених елементів земної кори, складаючи близько 0,1 % її маси. Сполуки вуглецю є основою всіх живих організмів.
Історія[ред. | ред. код]
Вуглець є одним із перших хімічних елементів, який відомий людині. У вигляді деревного вугілля він застосовувався в давнину для виплавки металів. Здавна відомі алотропні модифікації вуглецю — алмаз і графіт. Вуглець є одним з елементів, ім'я першовідкривача якого невідомо, невідомо й те, яка з форм елементарного вуглецю — алмаз чи графіт — була відкрита раніше. І те й інше трапилося дуже давно, ще до виникнення письма.
Відкриття[ред. | ред. код]
Ідентифікація вуглецю як хімічного елемента тісно пов'язана з розвитком уявлень про хімічну природу горіння. На межі XVII—XVIII ст. виникла теорія флогістону, висунута Йоганном Бехером і Георгом Шталем. Ця теорія визнавала наявність в кожному горючому тілі особливої елементарної речовини — невагомого флюїду — флогістону, що випаровується в процесі горіння. Оскільки при згорянні великої кількості вугілля залишається лише трохи попелу, флогістики вважали, що вугілля — це майже чистий флогістон. Саме цим пояснювали, зокрема, «флогістувальну» дію вугілля, — його здатність відновлювати метали з «вапен» і руд. Пізніші флогістики, Реомюр, Бергман та інші, вже почали розуміти, що вугілля є елементарною речовиною. Проте, вперше «чисте вугілля» було визнане елементарним Антуаном Лавуазьє, який досліджував процес спалювання в повітрі й у кисні вугілля та інших речовин.
1791 року англійський хімік Теннант першим отримав вільний вуглець у хімічній реакції. Він пропускав випари фосфору над прожареною крейдою, в результаті чого утворювалися фосфат кальцію і вуглець. Те, що алмаз при сильному нагріванні згоряє без залишку, було відомо давно. Ще 1751 року імператор Священної Римської імперії Франц I погодився дати алмаз і рубін для дослідів зі спалювання, після чого ці досліди навіть увійшли в моду. Виявилося, що згорає лише алмаз, а рубін (окис алюмінію з домішкою хрому) витримує без пошкодження тривале нагрівання у фокусі запалювальної лінзи. Лавуазьє поставив новий досвід зі спалювання алмазу за допомогою великої запалювальної машини і прийшов до висновку, що алмаз є насправді кристалічним вуглецем. Другий алотроп вуглецю, графіт, в епоху розквіту алхімії не відрізняли від молібденіту, сульфіду свинцю галеніту і називали плюмбаго (plumbago) або чорним свинцем, однак аналіз Карла Вільгельма Шлеєле 1778–1779 років довів, що це різні мінерали. Будучи флогістиком, Шлеєле визнав графіт сірчистим тілом особливого роду, особливим мінеральним вугіллям, що містить пов'язану «повітряну кислоту» (СО2) і велику кількість флогістону.
Двадцять років по тому Гітон де Морво шляхом обережного нагрівання перетворив алмаз на графіт, а потім — на вугільну кислоту.
Походження назви[ред. | ред. код]
Назва фр. carbone з'явилася у книзі Гітона де Морво[en], Лавуазьє, Бертолле та Фуркруа «Метод хімічної номенклатури[fr]» (1787) замість французького «чисте вугілля» (charbone pur). Під цією ж назвою вуглець фігурує в «Таблиці простих тіл» і в «Елементарному підручнику хімії» Лавуазьє. Латинська назва елементу Carboneum походить від слова з давнім походженням carbo — «вугілля». Традиційна українська назва хімічного елементу «вуглець» також пов'язана зі словом вугілля, а назва «карбон» — це латинська версія, рекомендована IUPAC.
Поширення[ред. | ред. код]
Вуглець у природі трапляється як у вільному стані (алмаз, графіт, карбін і лонсдейліт, фулерен, вуглецеві нанотрубки), так і у вигляді різноманітних сполук. Середній вміст вуглецю в земній корі 2,3×10−2 % (мас) (1×10-2 в ультраосновних, 1×10-2 — в основних, 2×10-2 — у середніх, 3×10-2 — у кислих гірських породах); основна маса вуглецю концентрується в осадових гірських породах. Накопичення вуглецю в основному відбувається у верхній частині земної кори, де його наявність пов'язана в основному з живою речовиною, природними карбонатами (доломітами і вапняками), паливними копалинами: антрацитом (94—97 % С), кам'яним вугіллям (76—95 % С), бурим вугіллям (64—80 % С), нафтою (82—87 % С), горючими сланцями (56—78 % С), торфом (53—56 % С), горючими природними газами (до 74% метану) а також з бітумами та ін. Відомо понад 100 мінералів вуглецю, серед яких найпоширеніші карбонати кальцію, магнію та заліза. Він входить до складу кам'яного вугілля, нафти і природного газу, а також різних мінералів: мармуру, крейди і вапняку — CaCO3, доломіту — CaCO3·MgCO3, магнезиту — MgCO3, малахіту — CuCO3·Cu(OH)2 тощо. В атмосфері і гідросфері знаходиться у вигляді діоксиду вуглецю СО2, в повітрі 0,046% СО2 по масі, в водах річок, морів і океанів у ~ 60 разів більше.
Вуглець входить до складу рослин і тварин (~ 17,5%[джерело?]). У деревині близько 30,3 %[джерело?]. В організм людини вуглець надходить з їжею (у нормі — близько 300 г на добу[джерело?]). Загальний вміст вуглецю в організмі людини досягає близько 21 % (15 кг на 70 кг маси тіла). Вуглець складає 2/3 маси м'язів і 1/3 маси кісткової тканини[джерело?]. Виводиться з організму переважно з повітрям, що видихається (вуглекислий газ), і сечею (сечовина).

Кругообіг вуглецю в природі включає біологічний цикл, виділення СО2 в атмосферу з вулканічних газів, при згорянні викопного палива, гарячих мінеральних джерел, з поверхневих шарів океанічних вод, а також при диханні, бродінні, гнитті.
Біологічний цикл полягає в тому, що вуглець у вигляді СО2 поглинається з тропосфери рослинами в процесі фотосинтезу, а потім, частково через організми тварин і людини, із біосфери вуглець знову повертається в атмосферу (у вигляді СО2) і геосферу (у вигляді решток організмів).
У газоподібному стані і у вигляді сполук із азотом і воднем вуглець виявлено в атмосфері Сонця, планет, його знайдено в кам'яних і залізних метеоритах.
На Сонці вуглець посідає 4-те місце за поширеністю після водню, гелію та кисню.
Важливу роль вуглець відіграє у процесах зоряного нуклеосинтезу (вуглецево-азотний цикл, потрійна α-реакція).
У природі трапляється мінерал шунгіт, в якому міститься як твердий вуглець (≈25%), так і значні кількості оксиду кремнію (≈35%)[значущість факту?].
Ізотопи[ред. | ред. код]
Природний вуглець складається з двох стабільних ізотопів — 12С (98,93%) і 13С (1,07%) і малої кількості радіоактивного ізотопу 14С (β--розпад з Т1⁄2 = 5730 років), зосередженого в атмосфері та верхній частині земної кори. Радіоактивний ізотоп постійно утворюється в нижніх шарах стратосфери в результаті бомбардування ядер азоту нейтронами космічних променів за реакцією: 14N + n → p 14C, а з середини 1950-х років — також як техногенний продукт роботи АЕС і випробувань ядерної зброї.
На вимірюванні відносного вмісту 14С в органічних рештках ґрунтується метод радіовуглецевого датування, що широко застосовується в археології та палеонтології. Він підходить для датування об'єктів, що мають вік приблизно до 60 000 років.
Всього відомо 15 різних ізотопів вуглецю[12].
Утворення[ред. | ред. код]
Утворення ядра вуглецю вимагає майже одночасного зіткнення трьох альфа-частинок, тобто ядер гелію. Такий процес, відомий як потрійний альфа-процес, може відбуватися тільки в надрах зір[13] із великою густиною та високою температурою (близько 100 тис. Кельвінів). Щоб потрапити на Землю вуглець спочатку мав залишити материнську зорю, де він утворився (наприклад, унаслідок вибуху наднової), та потрапити до міжзоряного простору.[14] Зоряні системи третього покоління, до яких належить Сонячна система, утворювалися з міжзоряного середовища, яке було вже збагачене елементами, важчими за гелій.
Ядра вуглецю відіграють також роль каталізатора в іншій термоядерній реакції — циклі Бете.
Алотропні модифікації[ред. | ред. код]
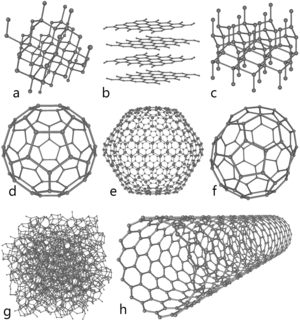

Вуглець утворює декілька алотропних видозмін. Серед них природні: алмаз, графіт, лонсдейліт, фулерен, вуглецеві нанотрубки та штучні: карбін, графен та аморфний вуглець у вигляді сажі і деревного вугілля.
Кристалічні форми[ред. | ред. код]
- Алмаз
- Графен
- Графіт
- Карбін
- Лонсдейліт
- Наноалмаз
- Фулерен
- Фулерит
- Вуглеволокно
- Вуглецеві нановолокна
- Вуглецеві нанотрубки
Аморфні форми[ред. | ред. код]
- Активоване вугілля
- Деревне вугілля
- Викопне вугілля: антрацит та ін.
- Кокс кам'яновугільний, нафтовий та ін.
- Скловуглець
- Техвуглець
- Сажа
- Вуглецева нанопіна
На практиці, як правило, перераховані вище аморфні форми є хімічними сполуками з високим вмістом вуглецю, а не чистою алотропною формою вуглецю.
Кластерні форми[ред. | ред. код]
Алмаз[ред. | ред. код]

Алмаз — прозора, безбарвна або трохи забарвлена домішками в різноманітні відтінки кристалічна речовина. Для відшліфованих алмазів, діамантів, характерна особлива гра світла, зумовлена сильним заломленням на гранях.
В алмазі кожен атом вуглецю утворює ковалентні зв'язки із чотирма іншими атомами. Як наслідок утворюється гранецентрована кубічна структура із двох підґраток, що отримала назву структури алмазу. Така структура характерна також для інших елементів 14 підгрупи періодичної таблиці: кремнію та германію.
Алмаз — найтвердіша речовина серед усіх відомих, навіть міцніша за обсидіан. Завдяки своїй надзвичайній твердості він широко застосовується при бурінні твердих гірських порід, обробці твердих металів, виробництві абразивів тощо. Відшліфовані безбарвні кристали алмазу — діаманти — коштовні прикраси.
Найбільші родовища алмазів розташовано в Південній Африці та в Якутії. Щорічний світовий видобуток алмазу становить приблизно 300 кг. В останні роки алмаз почали одержувати штучно при дуже високих тисках і високій температурі.
Графіт[ред. | ред. код]
Графіт — темно-сіра непрозора дрібнокристалічна речовина, жирна на дотик. На відміну від алмазу графіт добре проводить електричний струм та тепло і дуже м'який.
Графіт у великих кількостях одержують штучно — нагріванням коксу або антрациту в спеціальних електричних печах при температурі близько 3000 °C і підвищеному тиску без доступу повітря. Штучний графіт відзначається високою чистотою і м'якістю. За своїми властивостями він кращий за природний. Графіт широко застосовується для виготовлення електродів, в суміші з глиною для виробництва вогнетривких тиглів. З графіту роблять звичайні олівці. В суміші з мінеральними оливами його використовують як мастило для машин, що працюють при підвищених температурах.
Різка відмінність у фізичних властивостях алмазу і графіту зумовлена різною кристалічною будовою. В кристалах алмазу кожний атом вуглецю оточений чотирма іншими атомами, розміщеними на однаковій віддалі один від одного. В кристалах графіту атоми вуглецю розміщені у кутах правильних шестикутників в одній площині і утворюють окремі шари. Віддаль між окремими шарами більша, ніж між атомами в тому ж шарі. Внаслідок цього зв'язок між окремими шарами значно слабший, ніж між атомами того ж шару. Тому кристали графіту легко розщеплюються на окремі лусочки, які самі по собі досить міцні.
Графен[ред. | ред. код]
Графен за своєю будовою — двовимірна алотропна модифікація вуглецю, утворена шаром атомів вуглецю товщиною в один атом, з'єднаних за допомогою sp² зв'язків в гексагональну двовимірну кристалічну ґратку (окремий атомний шар зі структурою графіту) — атоми вуглецю утворюють сотову структуру з міжатомною віддаллю 142 пм. Без опори графен має тенденцію згортатися, але може бути стійким на підкладинці.
Карбін[ред. | ред. код]
Кристалічна модифікація вуглецю гексагональної сингонії з ланцюговою будовою молекул називається карбін. На вигляд дрібнокристалічний порошок чорного кольору (густина 1,9—2 г/см³). Карбін — лінійний полімер вуглецю. Кристалічна структура карбіну характеризується наявністю довгих ланцюжків із атомів вуглецю, розташованих паралельно. У молекулі карбіну атоми вуглецю з'єднані в ланцюжки по черзі чи потрійними і одинарними зв'язками (поліенова будова (-C≡C-)), або постійно подвійними зв'язками (полікумуленова будова (=C=C=)). Відомо кілька форм карбіну, що відрізняються числом атомів в елементарній комірці, розмірами комірок і густиною (2,68-3,30 г/см). Карбін зустрічається в природі у вигляді мінералу чаоіту (білі прожилки і вкраплення в графіті), а також отриманий штучних умовах з довгих ланцюжків атомів вуглецю, укладених паралельно один одному — окисною дегідрополіконденсацією ацетилену, дією лазерного випромінювання на графіт, з вуглеводнів або CCl4 в низькотемпературній плазмі. Ця речовина вперше була отримана радянськими хіміками В.В. Коршак, А.М. Сладкова, В.І. Касаточкіним і Ю.П. Кудрявцевим на початку 60-х рр. в Інституті елементоорганічних сполук Академії наук СРСР[15]. Карбін володіє напівпровідниковими властивостями, причому під впливом світла його провідність сильно збільшується. На цій властивості засновано перше практичне застосування — в фотоелементах.
Фулерен[ред. | ред. код]

Фулерен — специфічна структура із атомів вуглецю, відкрита в середині 1980-х, молекула якої має вигляд м'яча. Як в графіті, кожен атом вуглецю на поверхні сполучений із трьома іншими. На відміну від графіту, атоми утворюють не тільки шести, а й п'ятикутники. Внутрішня частина молекули порожня, що зумовлює широкі можливості для одержання на основі фулерену сполук включення.
Вуглецеві нанотрубки[ред. | ред. код]
Вуглецеві нанотрубки — це ще одна нещодавно відкрита специфічна структура, що складається із одного або кількох скручених у трубку графітних шарів. Діаметр таких трубок близько 1—10 нанометрів. Нанотрубки мають унікальні фізичні властивості, зокрема високу міцність на розрив, адсорбційну здатність. Вони активно досліджуються і мають великі перспективи для використання. Вуглецеві нанотрубки виявлені у природі (шунгіт), їх також штучно вирощують у лабораторіях.
Аморфний вуглець[ред. | ред. код]
В основі будови аморфного вуглецю лежить невпорядкована структура монокристалічного (завжди містить домішки) графіту. В такій видозміні він існує у вигляді сажі, коксу, деревного вугілля тощо. У природі ця алотропна видозміна не зустрічається. Її одержують штучно з різних сполук, що містять вуглець. Аморфний вуглець, або просто аморфне вугілля, насправді є кристалічним, але його кристалики такі малі, що їх не видно навіть у мікроскоп. Фізичні властивості «аморфного» вуглецю значною мірою залежать від дисперсності частинок та від наявності домішок.
Найважливішими технічними сортами аморфного вуглецю є сажа і деревне вугілля. Сажа — найчистіший аморфний вуглець. У промисловості сажу одержують здебільшого термічним розкладом метану, а також при спалюванні різних органічних речовин при недостатньому доступі повітря. Сажу широко застосовують як наповнювач у виробництві гуми з каучуку, а також для виготовлення друкарських фарб, туші тощо.
Деревне вугілля добувають нагріванням дерева без доступу повітря у спеціальних печах. Його застосовують у металургії для одержання високих сортів чавуну і сталі, в ковальській справі, для виготовлення чорного пороху і як адсорбент.
Лонсдейліт[ред. | ред. код]
Лонсдейліт виявлено в метеоритах і отримано штучно; його структура та фізичні властивості остаточно не встановлено.
Ультрадисперсні алмази (наноалмази)[ред. | ред. код]
У 1980-х рр. в СРСР було виявлено, що в умовах динамічного навантаження вуглецевмісних матеріалів можуть утворюватися алмазоподібні структури, що отримали назву ультрадисперсних алмазів (УДА). Наразі все частіше застосовується термін «наноалмази». Розмір часток в таких матеріалах складає одиниці нанометрів. Умови утворення УДА можуть бути реалізовані при детонації вибухових речовин зі значним негативним кисневим балансом, наприклад, сумішей тротилу з гексогеном. Такі умови можуть бути реалізовані також при ударах небесних тіл об поверхню Землі в присутності вуглецевмісних матеріалів (органіка, торф, вугілля та ін.). Так, в зоні падіння Тунгуського метеорита в лісовій підстилці були виявлені УДА.
Фізичні властивості[ред. | ред. код]

Вуглець існує в багатьох алотропних модифікаціях з дуже різноманітними фізичними властивостями. Різноманітність модифікацій обумовлено здатністю вуглецю утворювати хімічні зв'язки різного типу. Різні алотропні видозміни вуглецю мають різні провідні властивості. Алмаз є широкозонним напівпровідником, практично ізолятором. Завдяки широкій забороненій зоні, алмаз не поглинає видиме світло, незначне поглинання зумовлене наявністю домішок. На відміну від алмазу графіт є непоганим провідником електричного струму. Для нього також характерний металевий блиск. За нормальних умов термодинамічно стійкий лише графіт, а алмаз та інші форми метастабільні. При атмосферному тиску і температурі вище 1200 K алмаз починає переходити в графіт, вище 2100 K перетворення відбувається за секунди. ΔН0 переходу — 1,898 кДж/моль. При нормальному тиску вуглець сублімується при 3780 K. Рідкий вуглець існує лише при певному зовнішньому тиску. Потрійна точка: графіт-рідина-пара Т = 4130 K, р = 10,7 МПа. Прямий перехід графіту в алмаз відбувається при 3000 K і тиску 11—12 ГПа.
При тиску понад 60 ГПа припускають утворення вельми щільної модифікації C III (густина на 15—20 % вище густини алмазу), що має металеву провідність. При високих тисках і відносно низьких температурах (близько 1200 K) з високоорієнтованого графіту утворюється гексагональна модифікація вуглецю з кристалічною ґраткою типу вюртцита — лонсдейліт (а = 0,252 нм, с = 0,412 нм, просторова група Р63/mmc), густина 3,51 г/см³, тобто така ж, як і у алмазу.
Структура[ред. | ред. код]
Електронні орбіталі атома вуглецю можуть мати різну геометрію, залежно від ступеня гібридизації його електронних орбіталей. Існує три основних геометрії атома вуглецю:
- Тетраедрична, утворюється при змішуванні одного s- та трьох p-електронів (sp3 гібридизація). Атом вуглецю знаходиться в центрі тетраедра, зв'язаний чотирма еквівалентними σ-зв'язками з атомами вуглецю або іншими в вершинах тетраедра. Такій геометрії атому відповідають алотропні модифікації вуглецю алмаз і лонсдейліт. Такою гібридизацією володіє вуглець, наприклад, в метані та інших вуглеводнях.
- Тригональна, утворюється при змішуванні одного s- та двох p-електронів (sp2 гібридизація). Атом вуглецю має три рівноцінні σ-зв'язки, розташовані в одній площині під кутом 120° один до одного. Не беруча участі у гібридизації p-орбіталь, розташована перпендикулярно площині σ-зв'язків, використовується для утворення π-зв'язків з іншими атомами. Така геометрія вуглецю характерна для графіту, фенолу та ін.
- Дігональна, утворюється при змішуванні одного s- та одного p-електронів (sp-гібридизація). При цьому дві електронні хмари витягнуті уздовж одного напряму і мають вигляд несиметричних гантелей. Два інших р-електрона дають π-зв'язки. Вуглець з такою геометрією атома утворює особливу алотропну модифікацію — карбін.
У 2010 році співробітники університету Ноттінгема Стівен Лідл і колеги отримали сполуку (мономерний ділітіо метандій), в якому чотири зв'язки атома вуглецю знаходяться в одній площині[16]. Раніше можливість «плоского вуглецю» була передбачена Паулем фон Шлейером для речовини H2CLi2, але вона не була синтезована.
Хімічні властивості[ред. | ред. код]
За звичайних умов вуглець хімічно інертний, при високих температурах з'єднується з багатьма елементами, проявляє сильні відновні властивості. Хімічна активність різних форм вуглецю зменшується в ряді: аморфний вуглець, графіт, алмаз, на повітрі вони спалахують при температурах відповідно вище 300—501 °C, 600—700 °C і 850—1000 °C. Найважливіша властивість вуглецю — здатність його атомів утворювати міцні хімічні зв'язки як між собою, так і з іншими елементами. Здатність вуглецю утворювати 4 рівнозначні валентні зв'язки з іншими атомами дозволяє будувати вуглецеві скелети різних типів (лінійні, розгалужені, циклічні); саме цими властивостями і пояснюється виняткова роль вуглецю в будові органічних сполук і, зокрема, всіх живих організмів.
Електронна конфігурація[ред. | ред. код]
Електронна конфігурація вуглецю 1s22s22p2, тобто він має повністю заповнену внутрішню s-оболонку і 4 електрони на зовнішній оболонці: 2 s-електрони і два p-електрони. Енергії зовнішніх s- та p-орбіталей відрізняються не сильно, тому, утворюючи хімічні зв'язки, вони легко гібридизуються. У різних сполуках можливі як sp, sp2 та і sp3 гібридизації.
При sp3 гібридизації вуглець утворює 4 хімічні зв'язки. Така гібридизація характерна для алотропної видозміни вуглецю алмазу і для метану. sp2 гібридизація призводить до утворення плоских структур на зразок графіту, графену, фулеренів, нанотрубок, а також для ненасичених полімерів. Ще один електрон в цих плоских структурах займає перпендикулярну до площини π-орбіталь. Здебільшого π-орбіталі утворюють між собою додаткові π-зв'язки. sp гібридизація характерна для насичених полімерів. Ще два елекрони здебільшого утворюють додаткові зв'язки з воднем або з іншими елементами, зокрема із вуглецем у бічних відгалуженнях полімерів.
Ступені окислення вуглецю в неорганічних сполуках +4, −4, рідко +2 (З, карбіди металів), +3 (C2N2, галогенціани); спорідненість до електрона 1,27 еВ; енергія іонізації при послідовному переході від С0 до С4+ відповідно 11,2604, 24,383, 47,871 і 64,19 еВ.
Хімічна активність[ред. | ред. код]
Хімічна активність різних алотропних видозмін вуглецю різна. Алмаз і графіт майже не вступають в хімічні реакції. Вони можуть реагувати лише з чистим киснем і тільки за дуже високої температури.
Аморфний вуглець, а також вугілля за звичайної температури досить інертні, але при сильному нагріванні їх активність різко зростає і вуглець безпосередньо сполучається з багатьма елементами. Так, при нагріванні на повітрі вугілля горить, утворюючи діоксид вуглецю:
При недостатньому доступі кисню повітря він частково згоряє до монооксиду вуглецю CO:
Варто зазначити що хоч і в СО у вуглецю ступінь окиснення +2, він є насправді трьохвалентним, у зв'язку з донорно-акцепторним зв'язком, де кисень — донор, а вуглець — акцептор, хоча кисень електронегативніший.
Коли через розжарене вугілля пропускати випари сірки, то утворюється сірковуглець:
При високій температурі вугілля досить сильний відновник. Воно віднімає кисень від оксидів багатьох металів. Наприклад:
Через цю здатність, вугілля широко застосовують у металургії для добування металів із руд.
Активований вуглець — пористий вуглецевий матеріал, деревне вугілля, інколи з добавками хімічних реактивів. Такий вуглець має велику адсорбційну здатність і використовується для очистки рідин і газів та для вилучення забруднень, зокрема з води. Отримується нагріванням органічних матеріалів при високій температурі (в струмені водяної пари). Активується окисненням при високій температурі. Контролюючи процеси карбонізації та активації, одержують матеріали з різною пористістю. Може бути гранулярним або порошковим.
Сполуки[ред. | ред. код]
Атоми вуглецю утворюють міцні ковалентні зв'язки з іншими атомами вуглецю. Завдяки цьому вони можуть утворювати ланцюжки й циклічні структури, забезпечуючи велику різноманітність хімічних сполук. Сполуки вуглецю поділяють на неорганічні й органічні. Назва органічна сполука склалася історично. Так називали хімічні сполуки, що траплялися тільки в живій природі. Вважалося, що вони принципово відрізняються від неорганічних сполук. Однак, розвиток хімії та синтез органічних сполук із неорганічних складових довели, що принципової відмінності органічних сполук від неорганічних немає. Деякі прості сполуки вуглецю можна віднести як до органічних, так і до неорганічних.
Неорганічні сполуки[ред. | ред. код]
Вуглець утворює кілька різних оксидів, тобто, сполук із киснем. Діоксид вуглецю CO2, вуглекислий газ, найстабільніший із них. Монооксид вуглецю, відомий як чадний газ, утворюється при неповному згоранні через нестачу кисню. Він хімічно активніший і отруйний. Відомий також нестійкий діоксид тривуглецю С3O2 (температура плавлення –111 °C, температура кипіння 7 °C) та деякі інші оксиди вуглецю з формулами C2O3, CO3, C2O, C5O5, C6O6, C12O9, C12O12. Графіт і аморфний вуглець починають реагувати з воднем при температурі 1200 °C, із фтором — при 900 °C.
Вуглекислий газ розчиняючись у воді реагує з нею, утворюючи слабку вугільну кислоту H2CO3, солі якої називають карбонатами. На Землі найбільш поширені карбонати кальцію (мінеральні форми — крейда, мармур, кальцит, вапняк та ін.) та карбонати магнію (мінеральна форма — доломіт).
Графіт із галогенами, лужними металами та ін. речовинами утворює сполуки включення. При пропусканні електричного розряду між вугільними електродами в атмосфері азоту утворюється ціанід. Із азотом вуглець утворює потрійний зв'язок, залишаючи вільним один електрон. Якщо цей електрон зв'язується з атомом водню, утворюється синильна кислота HCN:
- . Її солі називають ціанідами.
Сполуки вуглецю з металами й деякими неметалами називаються карбідами, наприклад, карбід кальцію, карбід кремнію:
Важлива в промисловості реакція вуглецю з водяною парою:
Органічні сполуки[ред. | ред. код]

Завдяки здатності вуглецю утворювати полімерні ланцюжки, існує величезний клас сполук на основі вуглецю, яких значно більше, ніж неорганічних. Їх вивчає органічна хімія. Найбільші групи: вуглеводні, вуглеводи, білки, жири та ін.
Сполуки вуглецю складають основу земного життя, а їх властивості багато в чому визначають спектр умов, в яких подібні форми життя можуть існувати. У живих клітинах частка вуглецю за кількістю атомів становить близько 25 %, масова частка — близько 18 %.
Атом вуглецю утворює з чотирма атомами водню сполуку метан з хімічною формулою CH4. За нормальних умов це безбарвний горючий газ. Метан є найпростішою сполукою у ряді вуглеводнів.
Катіони[ред. | ред. код]
В червні 2023 року, завдяки застосуванню космічного телескопу Джеймса Вебба (JWST), вчені вперше виявили нову сполуку вуглецю в далекому космосі, відому як метиловий катіон. Метиловий катіон був виявлений у молодій зоряній системі d203-506, розташованій на відстані близько 1350 світлових років від Землі, у Туманності Оріона. Вчені підкреслюють, що сполуки вуглецю, а саме метиловий катіон, є основою для життя, яке нам відоме. Саме тому це відкриття викликало захоплення серед науковців, оскільки воно може мати важливе значення для пояснення походження і розвитку життя на Землі та підтвердити можливість його розвитку в інших куточках Всесвіту[17].
Застосування[ред. | ред. код]




Деревне вугілля має здатність адсорбувати (поглинати) на своїй поверхні різні гази та деякі речовини з розчинів. Адсорбція відбувається поверхнею вугілля, тому воно здатне поглинати (адсорбувати) тим більшу кількість речовин, чим більша його сумарна поверхня, тобто чим більше воно подрібнене або пористе. Пористість, а разом з тим і адсорбційна здатність деревного вугілля різко збільшується при попередньому нагріванні в струмені водяної пари. При цьому пори вугілля очищуються від смолистих речовин і його внутрішня поверхня дуже збільшується. Таке вугілля називається активованим.
Активоване деревне вугілля широко використовують у цукровому виробництві для очистки цукрового сиропу від домішок, що надають йому жовтого забарвлення, у спиртовому виробництві для очистки винного спирту від сивушних олій, у деяких виробництвах для вловлювання парів цінних летких речовин — бензину, ефіру, сірковуглецю, бензолу тощо з наступним видаленням їх при нагріванні.
У Першу світову війну активоване вугілля за пропозицією академіка М. Д. Зелінського було застосовано у протигазах для захисту органів дихання від отруйних газів, зокрема від хлору, який німці застосували в 1915 р. проти французьких військ. Активоване вугілля як адсорбент застосовується і в сучасних протигазах.
Графіт використовується в олівцевій промисловості, але в суміші з глиною, для зменшення його м'якості. Також його використовують як мастило при особливо високих або низьких температурах. Його неймовірно висока температура плавлення дозволяє робити з нього тиглі для заливки металів. Здатність графіту проводити електричний струм також дозволяє виготовляти з нього високоякісні електроди.
Алмаз, завдяки винятковій твердості, незамінний абразивний матеріал. Алмазне напилення мають шліфувальні насадки бормашин. Крім цього, ограновані алмази — діаманти використовуються як дорогоцінне каміння в ювелірних прикрасах. Завдяки рідкісності, високим декоративним якостям і збігу історичних обставин, діамант незмінно є найдорожчим дорогоцінним каменем. Виключно висока теплопровідність алмазу (до 2000 Вт/м·К) робить його перспективним матеріалом для напівпровідникової техніки як підкладки для процесорів. Але відносно висока ціна (близько 50 доларів/грам) і складність обробки алмазу обмежують його застосування в цій галузі.
У фармакології та медицині широко використовуються різні сполуки вуглецю — похідні вугільної кислоти та карбонових кислот, різні гетероцикли, полімери та інші сполуки. Так, карболен (активоване вугілля), застосовується для абсорбції та виведення з організму різних токсинів; графіт (у вигляді мазей) — для лікування шкірних захворювань; радіоактивні ізотопи вуглецю — для наукових досліджень (радіовуглецевий аналіз).
Вуглець є основою всіх органічних речовин. Будь-який живий організм складається значною мірою з вуглецю. Джерелом вуглецю для живих організмів зазвичай є СО2 з атмосфери або води. У результаті фотосинтезу він потрапляє в біологічні харчові ланцюги, в яких живі істоти поїдають один одного або останки один одного і тим самим здобувають вуглець для будівництва власного тіла. Біологічний цикл вуглецю закінчується або окисненням і поверненням в атмосферу, або похованням у вигляді вугілля або нафти.
Вуглець у вигляді викопного палива: вугілля і вуглеводнів (нафта, природний газ) — один з найважливіших джерел енергії для людства.
Біологічна роль[ред. | ред. код]
Сполуки вуглецю є основою всіх рослинних і тваринних організмів. Забезпечуючи життя, вуглець здійснює в природі постійний кругообіг, який називають вуглецевим циклом. У складі вуглекислого газу вуглець присутній в атмосфері Землі, а також у розчиненому вигляді у воді. Живі організми засвоюють його з атмосфери чи води завдяки процесу, який має назву фіксація вуглецю. Інші організми, нездатні засвоювати вуглець безпосередньо, отримують його через харчові ланцюжки. Вуглець частково повертається в атмосферу у вигляді вуглекислого газу як продукт дихання або горіння, однак частина вуглецю йде на утворення метану й карбонатів, наприклад карбонату кальцію. Залишки загиблих організмів входять зрештою до осадових порід, кам'яного вугілля, нафти, природного газу. Вуглець повертається в атмосферу в процесі довготривалого геологічного колообігу як наслідок дегазації порід, вулканічній діяльності тощо. Частково збільшення концентрації вуглекислого газу в атмосфері Землі зумовлене діяльністю людини — використанням викопного палива для отримання енергії.
Токсична дія[ред. | ред. код]
Вуглець входить до складу атмосферних аерозолів, в результаті чого може змінюватися регіональний клімат, зменшуватися кількість сонячних днів. Вуглець надходить у довкілля у вигляді сажі у складі вихлопних газів автотранспорту, при спалюванні вугілля на ТЕС, при відкритих розробках вугілля, підземної його газифікації, отриманні вугільних концентратів та ін. Концентрація вуглецю над джерелами горіння 100-400 мкг/м³, великими містами 2,4-15,9 мкг/м³, сільськими районами 0,5-0,8 мкг/м³. З газоаерозольними викидами АЕС в атмосферу надходить (6-15) × 109 Бк/доб 14СО2. Високий вміст вуглецю в атмосферних аерозолях веде до підвищення захворюваності населення, особливо верхніх дихальних шляхів і легень. Професійні захворювання — в основному антракоз і пиловий бронхіт. У повітрі робочої зони ГДК, мг/м³: алмаз 8,0, антрацит і кокс 6,0, кам'яне вугілля 10,0, технічний вуглець і вуглецевий пил 4,0; в атмосферному повітрі максимальна разова 0,15, середньодобова 0,05 мг/м³.
Токсична дія 14С у складі молекул білків (особливо в ДНК і РНК), визначається його радіоактивним розпадом із випромінюванням β-частинок (14С (β) → 14N), що призводить до зміни хімічного складу молекули та подальших негативних наслідків через цю зміну. Допустима концентрація 14С в повітрі робочої зони ДКБ 1,3 Бк/л, в атмосферному повітрі ДКБ 4,4 Бк/л, у воді 3,0 × 104 Бк/л, гранично допустиме надходження через органи дихання 3,2 × 108 Бк/рік.
Див. також[ред. | ред. код]
- Вуглецевий цикл
- Вуглецевий шовінізм
- Радіовуглецеве датування
- Вуглецевий слід
- Ізотропний вуглець
- Мікропористий вуглець
- Піролітичний вуглець
Примітки[ред. | ред. код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report). — Pure and Applied Chemistry, 2013. — Т. 85, вип. 5. — С. 1047-1078. — DOI:.(англ.)
- ↑ Вказано діапазон значень атомної маси в зв'язку з різною поширеністю ізотопів у природі
- ↑ Carbon: Binary compounds. Архів оригіналу за 25 листопада 2007. Процитовано 6 грудня 2007.(англ.)
- ↑ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical (PDF). Архів оригіналу (PDF) за 16 лютого 2008. Процитовано 6 грудня 2007.(англ.)
- ↑ Fourier Transform Spectroscopy of the System of CP (PDF). Архів оригіналу (PDF) за 16 лютого 2008. Процитовано 6 грудня 2007.(англ.)
- ↑ Haaland, D (1976). Graphite-liquid-vapor triple point pressure and the density of liquid carbon. Carbon. 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.(англ.)
- ↑ Savvatimskiy, A (2005). Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003). Carbon. 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.(англ.)
- ↑ [1] [Архівовано 6 січня 2004 у Wayback Machine.], ET matlprop Misc Matls.(англ.)
- ↑ а б в г д Properties of diamond [Архівовано 17 квітня 2012 у Wayback Machine.], Ioffe Institute Database(англ.)
- ↑ Magnetic susceptibility of the elements and inorganic compounds [Архівовано 12 січня 2012 у Wayback Machine.], in Handbook of Chemistry and Physics 81st edition, CRC press.(рос.)
- ↑ Національний стандарт України ДСТУ 2439:2018 «Хімічні елементи та прості речовини. Терміни та визначення основних понять, назви й символи». — [Чинний від 01.10.2019.] — К. : ДП «УкрНДНЦ», 2019. — С. 2.
- ↑ Архівована копія. barwinski.net. Архів оригіналу за 11 жовтня 2021. Процитовано 11 жовтня 2021.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ Ostlie, D.A. and Carroll, B.W. (2007). An Introduction to Modern Stellar Astrophysics. Addison Wesley, San Francisco. ISBN 0-8053-0348-0.
- ↑ Whittet, D. C. B. (2003). Dust in the Galactic Environment. CRC Press. с. 45–46. ISBN 0-7503-0624-6.
- ↑ V. I. Kasatochkin, A. M. Sladkov, et al., Dokl. Akad. Nauk SSSR, 177, No. 2, 358 (1967)
- ↑ А. Борисова (30.07.2010). Химики сплющили углерод. Gazeta.ru. Архів оригіналу за 22.08.2011. Процитовано 22 серпня 2010.(рос.)
- ↑ NASA Webb Telescope Team (26 червня 2023). Webb Makes First Detection of Crucial Carbon Molecule. NASA (англ.).
Джерела[ред. | ред. код]
- Глосарій термінів з хімії / Й. Опейда, О. Швайка, Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк : «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0.
- Деркач Ф. А. Хімія. — Л., 1968.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Саранчук В. И. и др. Углерод: неизвестное об известном. — Донецк : УК Центр, 2006.(рос.)
- Бухаркина Т. В. Химия природных энергоносителей и углеродных материалов / Т. В. Бухаркина, Н. Г. Дигуров. — Москва : РХТУ им. Д.И. Менделеева, 1999. — 195 с. — ISBN 5-7237-0139-8.(рос.)
- Ола Д. А. Химия гиперкоординированного углерода = Hupercarbon chemistry / Д. А. Ола, Г. К. С. Пракаш, Р. Е. Уильямс и др. ; пер с англ. В. И. Минкина. — Москва : Мир, 1990. — 336 с. — ISBN 5-03-001451-9.(рос.)
Посилання[ред. | ред. код]
- Вуглець [Архівовано 20 грудня 2016 у Wayback Machine.] // Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
- Карбонологія: фармакохімічний аспект, перспективи досліджень [Архівовано 20 грудня 2016 у Wayback Machine.] // І. С. Чекман, Г. О. Сирова, Т. Ю. Небесна, Л. Г. Шаповал, О. В. Шаповал / Лікарська справа. - 2012. - № 1/2. - С. 3-13.
- Нанокарбон: фармакологічні та токсикологічні властивості [Архівовано 20 грудня 2016 у Wayback Machine.] // Чекман І. С., Горчакова Н. О., Раслін К. Б. / Вісник НАН України. 2015. № 7. С. 41–52.
| Періодична система хімічних елементів | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||
| |||||||||||||||||
|















