Кетени

Кете́ни (англ. ketenes) — хімічні сполуки, в яких карбонільна група приєднана подвійним зв'язком до алкаліденової групи: R2C=C=O. Тобто вони містять групу з кумульованими С=С та С=О зв'язками.
Якщо один із замісників є атомом H, сполука є альдокетеном, якщо обидва є органічними залишками — кетокетеном.
Фізичні властивості[ред. | ред. код]
Етенон і пропенон — гази при кімнатній температурі. Інші кетени — рідини або тверді речовини від жовтого до червоно-коричневого кольору.
Хімічні властивості[ред. | ред. код]
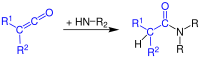
Кетени легко приєднують нуклеофільні реагенти (спирти, аміни), утворюючи відповідні похідні карбонових кислот (або саму карбонову кислоту, якщо нуклеофілом є вода).[1]
-
При реакції з водою утворюється відповідна карбонова кислота
-
При реакції зі спиртами утворюються естери
-
При реакції з амінами утворюються аміди
-
При реакції з карбоновими кислотами утворюються ангідриди
Загальна схема:
Кетени вступають у реакції (2+2)-циклоприєднання. При цьому карбонільний атом карбону з кетену приєднується до нуклеофільного атома, яким може бути, наприклад, оксиген, нітроген або карбон, а сусідній атом карбону з кетену приєднується до атома карбону, який приєднаний до нуклеофільного атома, утворюючи 4-членний цикл. Одним з прикладів циклоприєднання є димеризація кетену, де нуклеофілом є атом оксигену, який приєднується до карбонільного атому карбону з іншої молекули кетену, а карбонільний атом карбону з першої молекули приєднується до іншого атома карбону з другої. Димеризація етенону:[1]
Іншим прикладом є приєднання до імінів з утворенням β-лактамів, де нуклеофілом є атом нітрогену:[2]
Кетокетени реагують з киснем, утворюючи вибухонебезпечні пероксиди.[1]
Отримання[ред. | ред. код]
Піролізом[ред. | ред. код]
Найпростіший кетен, етенон, синтезують піролізом ацетону або оцтової кислоти:[1]
З хлорангідридів[ред. | ред. код]
Одним з найголовніших способів отримання кетенів є відщеплення хлороводню від хлорангідридів карбонових кислот. Для цієї реакції потрібна основа. Зазвичай використовують триалкіламіни (наприклад, триетиламін), тому що вони, на відміну від багатьох інших основ, не реагують з кетеном. Також може бути застосовано гідрид натрію.[3]
З галогенангідридів галогенкарбонових кислот[ред. | ред. код]
Кетени також можна синтезувати дегалогенуванням галогенангідридів α-галогенкарбонових кислот.
Наприклад, при взаємодії бромангідриду бромоцтової кислоти з цинком утворюється етенон:[1]
Аналогічно, при взаємодії бромангідриду 2-бром-2-метилпропанової кислоти з цинком в етилацетаті за температури кипіння розчинника утворюється диметилкетен. Вихід реакції становить 46—54 %.[4]
Перегрупування Вольфа[ред. | ред. код]
Перегрупування Вольфа — це перегрупування α-діазокетонів з відщепленням азоту, продуктом якого є кетени.[2]
Токсичність[ред. | ред. код]
Етенон дуже сильно подразнює дихальні шляхи, є дуже токсичним газом. Інші кетени мало досліджені, але вважається, що вони принаймні настільки ж токсичні як етенон.[1]
Джерела[ред. | ред. код]
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Примітки[ред. | ред. код]
- ↑ а б в г д е Miller, Raimund; Abaecherli, Claudio; Said, Adel; Jackson, Barry (15 вересня 2001). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Ketenes. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a15_063. doi:10.1002/14356007.a15_063. ISBN 978-3-527-30673-2.
- ↑ а б Name Reactions (англ.). Berlin, Heidelberg: Springer Berlin Heidelberg. 2006. doi:10.1007/3-540-30031-7. ISBN 978-3-540-30030-4.
- ↑ Taggi, Andrew E.; Wack, Harald; Hafez, Ahmed M.; France, Stefan; Lectka, Thomas (21 травня 2010). ChemInform Abstract: Generation of Ketenes from Acid Chlorides Using NaH/Crown Ether Shuttle-Deprotonation for Use in Asymmetric Catalysis. ChemInform. Т. 33, № 26. с. no—no. doi:10.1002/chin.200226029. ISSN 0931-7597. Процитовано 5 березня 2023.
- ↑ DIMETHYLKETENE. Organic Syntheses. Т. 33. 1953. с. 29. doi:10.15227/orgsyn.033.0029. Процитовано 5 березня 2023.
|
| ||||||||||||||||||||||||||



![{\displaystyle {\ce {RR'C=C=O + NuH -> [RR'C=CNu-OH] -> RR'CH-C(O)Nu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf10f84ba2727a1128aaae352b6fbc2f5dd6b14)







