Лікування стовбуровими клітинами
| Лікування стовбуровими клітинами | |
 | |
| |
Терапія стовбуровими клітинами – це один з різновидів клітинної терапії, що передбачає використання стовбурових клітин для лікування або профілактики хвороб чи патологічних станів[1]. Є галуззю регенеративної медицини.
Ведуться дослідження застосування стовбурових клітин для лікування офтальмологічних патологій[2][3][4], нейродегенеративних захворювань[5] і таких станів, як діабет[6][7] і хвороби серця[8][9]. З 2018 року спостерігається перехід до використання індукованих плюрипотентних стовбурових клітин (iPSC), замість ембріональних стовбурових клітин людини у дослідженнях.[10]
Основною перевагою терапії стовбуровими клітинами є її потенціал для регенерації пошкоджених тканин і органів, пропонуючи лікування станів, які наразі не виліковуються. Однак лікування стовбуровими клітинами не позбавлене ризику, зокрема, ризик відторгнення у випадку неаутологічних стовбурових клітин.
Понад 30 років трансплантація гемопоетичних стовбурових клітин (HSCT) використовується для лікування людей із такими захворюваннями, як лейкемія та лімфома; це єдина широко практикувана форма терапії стовбуровими клітинами[11][12][13]. Під час хіміотерапії більшість клітин, що ростуть, гинуть цитотоксичними агентами. Ці агенти, однак, не можуть розрізняти лейкемічні або неопластичні клітини та гемопоетичні стовбурові клітини в кістковому мозку. Це побічний ефект звичайних стратегій хіміотерапії, який трансплантація стовбурових клітин намагається усунути; здоровий кістковий мозок донора повторно вводить функціональні стовбурові клітини, щоб замінити клітини, втрачені в організмі господаря під час лікування. Трансплантовані клітини також генерують імунну відповідь, яка допомагає знищити ракові клітини; однак цей процес може зайти занадто далеко, призводячи до хвороби «трансплантат проти хазяїна», найсерйознішого побічного ефекту цього лікування[14].
Інша терапія стовбуровими клітинами під назвою Prochymal була умовно схвалена в Канаді в 2012 році для лікування гострої реакції трансплантат проти хазяїна у дітей, які не реагують на стероїди[15]. Це алогенна стовбурова терапія, заснована на мезенхімальних стовбурових клітинах (МСК), отриманих з кісткового мозку дорослих донорів. МСК очищають із кісткового мозку, культивують і упаковують до 10 000 доз, отриманих від одного донора. Дози зберігаються в замороженому вигляді до тих пір, поки вони не знадобляться[16].
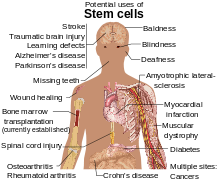
Стовбурові клітини вивчаються з кількох причин. Молекули та екзосоми, що вивільняються зі стовбурових клітин, також вивчаються з метою створення ліків[17]. На додаток до функцій самих клітин, паракринні розчинні фактори, що виробляються стовбуровими клітинами, відомі як секретом стовбурових клітин, були виявлені ще одним механізмом, за допомогою якого терапія на основі стовбурових клітин опосередковує їх вплив на дегенеративні, аутоімунні та запальні захворювання[18].
Щоб використовувати їх для досліджень або лікування, потрібна велика кількість високоякісних стовбурових клітин. Таким чином, необхідно розробити системи культивування, які виробляють чисті популяції тканиноспецифічних стовбурових клітин in vitro без втрати потенціалу стовбурових клітин. Для цього використовуються два основних підходи: двовимірна та тривимірна культура клітин[19].
Культивування клітин у двох вимірах регулярно проводиться в тисячах лабораторій по всьому світу протягом останніх чотирьох десятиліть. У двовимірних платформах клітини зазвичай піддаються впливу твердої, твердої плоскої поверхні на базальній стороні та рідини на апікальній поверхні. Заселення такого двовимірного жорсткого субстрату вимагає різкої адаптації для клітин, що вижили, оскільки їм не вистачає позаклітинного матриксу, який є унікальним для кожного типу клітин і який може змінити клітинний метаболізм і знизити його функціональність[19].
Дослідження, проведені на конях, собаках і котах, можуть сприяти розвитку лікування стовбуровими клітинами у ветеринарії та можуть бути націлені на широкий спектр травм і захворювань, таких як інфаркт міокарда, інсульт, пошкодження сухожиль і зв’язок, остеоартрит, остеохондроз і м’язова дистрофія як у великих тварин, так і у людини[20][21][22][23]. Хоча дослідження клітинної терапії загалом відображають медичні потреби людини, високий ступінь частоти та тяжкості певних травм у скакових коней поставив ветеринарну медицину на передній план цього нового регенеративного підходу[24]. Тварини-компаньйони можуть служити клінічно значущими моделями, які точно імітують захворювання людини[25][26].
Наприкінці 1990-х і на початку 2000-х років була перша хвиля компаній і клінік, які пропонували терапію стовбуровими клітинами, не обґрунтовуючи заяв про здоров’я та не маючи схвалення регуляторних органів[27]. До 2012 року з’явилася друга хвиля компаній і клінік, які зазвичай розташовані в країнах, що розвиваються, де медицина менш регулюється, і пропонують терапію стовбуровими клітинами за моделлю медичного туризму[28][29]. Як і компанії та клініки першої хвилі, вони висунули подібні серйозні, але необґрунтовані претензії, головним чином клініками в Сполучених Штатах, Мексиці, Таїланді, Індії та Південній Африці[28][29]. До 2016 року дослідження показало, що тільки в США було понад 550 клінік зі стовбуровими клітинами, які продавали загалом неперевірені методи лікування широкого спектру захворювань майже в кожному штаті країни[30], що змінило динаміку туризму зі стовбуровими клітинами. У 2018 році FDA надіслало попереджувальний лист до біологічних лабораторій StemGenex у Сан-Дієго, які продали послугу, за допомогою якої брали жир у людей, переробляли його в суміші, які, за словами, містили різні форми стовбурових клітин, і вводили його назад людині. шляхом інгаляції, внутрішньовенного введення або інфузії в спинний мозок; компанія заявила, що лікування було корисним для багатьох хронічних та небезпечних для життя станів[31].
- Серія книг Stem Cell Biology and Regenerative Medicine (Springer, 2009-2023+)
- Madonna, Rosalinda (2016). Stem cells and cardiac regeneration. Cham: Springer. ISBN 978-3-319-25427-2.
- Yilmazer, Açelya (2017). In vivo reprogramming in regenerative medicine. Cham. ISBN 978-3-319-65720-2.
- Lin, Yunfeng (2017). Cartilage regeneration. Cham, Switzerland. ISBN 978-3-319-51617-2.
- Tatullo, Marco (2017). MSCs and innovative biomaterials in dentistry. Cham: Humana Press. ISBN 978-3-319-55645-1.
- Botchkarev, Vladimir; Millar, Sarah (2018). Epigenetic regulation of skin development and regeneration. Cham, Switzerland. ISBN 978-3-319-16769-5.
- Gazouli, Maria; Theodoropoulos, George E. (2019). Digestive system diseases: stem cell mechanisms and therapies. Cham, Switzerland. ISBN 978-3-030-11965-2.
- Zarbin, Marco A.; Singh, Mandeep, MD; Casaroli-Marano, Ricardo Pedro (2019). Cell-based therapy for degenerative retinal disease. Cham, Switzerland. ISBN 978-3-030-05222-5.
- Khan, Firdos Alam (2021). Advances in application of stem cells: from bench to clinics. Cham. ISBN 978-3-030-78101-9.
- Zakrzewski, W., Dobrzyński, M., Szymonowicz, M. et al. Stem cells: past, present, and future. Stem Cell Research Therapy 10, 68 (2019). doi:10.1186/s13287-019-1165-5.
- Al Abbar, A., Ngai, S. C., Nograles, N., Alhaji, S. Y., & Abdullah, S. (2020). Induced Pluripotent Stem Cells: Reprogramming Platforms and Applications in Cell Replacement Therapy. BioResearch open access, 9(1), 121–136. doi:10.1089/biores.2019.0046.
- Kobold Sabine; Bultjer, Nils та ін. (2023-04). History and current status of clinical studies using human pluripotent stem cells. Stem Cell Reports. doi:10.1016/j.stemcr.2023.03.005.
- ↑ Mahla RS (2016). Stem cells application in regenerative medicine and disease threpeutics. International Journal of Cell Biology. 2016 (7): 1—24. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.
- ↑ Zarbin, Marco A.; Singh, Mandeep, MD; Casaroli-Marano, Ricardo Pedro (2019). Cell-based therapy for degenerative retinal disease. Cham, Switzerland. ISBN 978-3-030-05222-5. OCLC 1089253669.
- ↑ Sotiropulos, Konstadinos; Kourkoutas, Dimitrios; Almaliotis, Diamantis; Ploumidou, Katherine; Karampatakis, Vasileios (20220901). Ocular stem cells: a narrative review of current clinical trials. International Journal of Ophthalmology (англ.). Т. 15, № 9. с. 1529—1537. doi:10.18240/ijo.2022.09.17. PMC 9453397. PMID 36124200. Процитовано 30 березня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Ingrid W. Caras, Lila R. Collins, and Abla A. Creasey (грудень 2021). A stem cell journey in ophthalmology: From the bench to the clinic. academic.oup.com. doi:10.1002/sctm.21-0239. PMC 8641078. PMID 34515419. Процитовано 30 березня 2023.
{{cite web}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Lyon, Louisa (1 жовтня 2018). Stem cell therapies in neurology: the good, the bad and the unknown. Brain (англ.). 141 (10): e77. doi:10.1093/brain/awy221. ISSN 0006-8950. PMID 30202947.
- ↑ Cui, Yun Kai; Shemet, Ya A.; Ziablitsev, S. V. (30 березня 2023). THE USE OF STEM CELLS IN THE TREATMENT OF DIABETES. Medical Science of Ukraine (MSU) (англ.). Т. 19, № 1. с. 127—135. doi:10.32345/2664-4738.1.2023.16. ISSN 2664-4738. Процитовано 10 червня 2023.
- ↑ Chen, Shuai; Du, Kechen; Zou, Chunlin (8 липня 2020). Current progress in stem cell therapy for type 1 diabetes mellitus. Stem Cell Research & Therapy. Т. 11, № 1. с. 275. doi:10.1186/s13287-020-01793-6. ISSN 1757-6512. PMC 7346484. PMID 32641151. Процитовано 10 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Yap, Lynn; Chong, Li Yen; Tan, Clarissa; Adusumalli, Swarnaseetha; Seow, Millie; Guo, Jing; Cai, Zuhua; Loo, Sze Jie; Lim, Eric (26 травня 2023). Pluripotent stem cell-derived committed cardiac progenitors remuscularize damaged ischemic hearts and improve their function in pigs. npj Regenerative Medicine (англ.). Т. 8, № 1. с. 1—16. doi:10.1038/s41536-023-00302-6. ISSN 2057-3995. Процитовано 10 червня 2023.
- ↑ Madonna, Rosalinda (2016). Stem cells and cardiac regeneration. Springer. ISBN 978-3-319-25427-2.
- ↑ Kobold, Sabine; Bultjer, Nils; Stacey, Glyn; Mueller, Sabine C.; Kurtz, Andreas; Mah, Nancy (2023-04). History and current status of clinical studies using human pluripotent stem cells. Stem Cell Reports. doi:10.1016/j.stemcr.2023.03.005. ISSN 2213-6711. Процитовано 10 червня 2023.
- ↑ Ian Murnaghan for Explore Stem Cells. Updated: 16 December 2013 Why Perform a Stem Cell Transplant?
- ↑ Bone Marrow Transplantation and Peripheral Blood Stem Cell Transplantation In National Cancer Institute Fact Sheet web site. Bethesda, MD: National Institutes of Health, U.S. Department of Health and Human Services, 2010. Cited 24 August 2010
- ↑ Karanes C, Nelson GO, Chitphakdithai P, Agura E, Ballen KK, Bolan CD, Porter DL, Uberti JP, King RJ, Confer DL (2008). Twenty years of unrelated donor hematopoietic cell transplantation for adult recipients facilitated by the National Marrow Donor Program. Biology of Blood and Marrow Transplantation. 14 (9 Suppl): 8—15. doi:10.1016/j.bbmt.2008.06.006. PMID 18721775.
- ↑ Malard F, Mohty M (2014). New Insight for the Diagnosis of Gastrointestinal Acute Graft-versus-Host Disease. Mediators Inflamm. 2014: 701013. doi:10.1155/2014/701013. PMC 3964897. PMID 24733964.
- ↑ Prochymal – First Stem Cell Drug Approved. 22 травня 2012.
- ↑ A Stem-Cell-Based Drug Gets Approval in Canada. 17 травня 2012.
- ↑ Maguire, G (12 травня 2016). Therapeutics from Adult Stem Cells and the Hype Curve. ACS Medicinal Chemistry Letters. 7 (5): 441—443. doi:10.1021/acsmedchemlett.6b00125. PMC 4867479. PMID 27190588.
- ↑ Teixeira, Fábio G.; Carvalho, Miguel M.; Sousa, Nuno; Salgado, António J. (1 жовтня 2013). Mesenchymal stem cells secretome: a new paradigm for central nervous system regeneration? (PDF). Cellular and Molecular Life Sciences (англ.). 70 (20): 3871—3882. doi:10.1007/s00018-013-1290-8. ISSN 1420-682X. PMID 23456256.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ а б Mellati, Amir; Zhang, Hu (2015). Expansion of Stem Cells by Nanotissue Engineering. Stem-Cell Nanoengineering (англ.). John Wiley & Sons, Ltd: 243—263. doi:10.1002/9781118540640.ch14. ISBN 9781118540640.
- ↑ Chen J, Li Y, Wang L та ін. (April 2001). Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4): 1005—1011. doi:10.1161/01.STR.32.4.1005. PMID 11283404.
- ↑ Assmus B, Schächinger V, Teupe C та ін. (December 2002). Transplantation of Progenitor Cells and Regeneration Enhancement in Acute Myocardial Infarction (TOPCARE-AMI). Circulation. 106 (24): 3009—3017. doi:10.1161/01.CIR.0000043246.74879.CD. PMID 12473544.
- ↑ Murphy JM, Fink DJ, Hunziker EB, Barry FP (December 2003). Stem cell therapy in a caprine model of osteoarthritis. Arthritis Rheum. 48 (12): 3464—3474. doi:10.1002/art.11365. PMID 14673997.
- ↑ Sampaolesi M, Blot S, D'Antona G та ін. (November 2006). Mesoangioblast stem cells ameliorate muscle function in dystrophic dogs. Nature. 444 (7119): 574—579. Bibcode:2006Natur.444..574S. doi:10.1038/nature05282. PMID 17108972.
- ↑ Taylor SE, Smith RK, Clegg PD (March 2007). Mesenchymal stem cell therapy in equine musculoskeletal disease: scientific fact or clinical fiction?. Equine Vet. J. 39 (2): 172—180. doi:10.2746/042516407X180868. PMID 17378447.
- ↑ Tecirlioglu RT, Trounson AO (2007). Embryonic stem cells in companion animals (horses, dogs and cats): present status and future prospects. Reprod. Fertil. Dev. 19 (6): 740—747. doi:10.1071/RD07039. PMID 17714628.
- ↑ Koch TG, Betts DH (November 2007). Stem cell therapy for joint problems using the horse as a clinically relevant animal model. Expert Opin Biol Ther. 7 (11): 1621—1626. doi:10.1517/14712598.7.11.1621. PMID 17961087.
- ↑ Enserink, M (14 липня 2006). Biomedicine. Selling the stem cell dream. Science. 313 (5784): 160—163. doi:10.1126/science.313.5784.160. PMID 16840673.

- ↑ а б Sipp, D (2017). The malignant niche: safe spaces for toxic stem cell marketing. npj Regenerative Medicine. 2: 33. doi:10.1038/s41536-017-0036-x. PMC 5736713. PMID 29302366.
- ↑ а б Slabbert, Melodie (21 серпня 2015). South Africa's struggle to control sham stem cell treatments. The Conversation (англ.).
- ↑ Turner, Leigh; Knoepfler, Paul (August 2016). Selling Stem Cells in the USA: Assessing the Direct-to-Consumer Industry. Cell Stem Cell. 19 (2): 154—157. doi:10.1016/j.stem.2016.06.007. ISSN 1934-5909. PMID 27374789.
- ↑ FDA presses its campaign against rogue regenerative med players, cites StemGenex for illegal sales. Endpoints News. 14 листопада 2018.
| Це незавершена стаття з медицини. Ви можете допомогти проєкту, виправивши або дописавши її. |