Інженерія нервової тканини
| Інженерія нервової тканини |


Інженерія нервової тканини (або нейротканинна інженерія) — це галузь тканинної інженерії та біомедичної інженерії, яка зосереджена на розробці функціональних замінників нервової тканини для заміни або відновлення пошкодженої або хворої тканини центральної нервової системи (ЦНС) або периферичної нервової системи (ПНС).[1] Метою інженерії нервової тканини є відновлення втраченої функції нервової системи за допомогою побудови нової нервової тканини із спеціальних матеріалів, клітин і факторів росту[2][3], для транплантування в місця дефекту.
Ця область дослідження включає в себе принципи матеріалознавства, біології та інженерії для проектування та розробки пристроїв, каркасів з біоматеріалів і 3D-культур, які сприяють росту, виживанню та функціональній інтеграції нейронів і гліальних клітин. Деякі із застосувань нейротканинної інженерії включають лікування травм спинного мозку, черепно-мозкових травм, інсульту, хвороби Паркінсона та інших станів, які призводять до пошкодження нервової системи чи її вікової дегенерації.
Розвиток інженерії нервової тканини потребує міждисциплінарного підходу, який передбачає співпрацю між біомедичними інженерами, нейронауковцями, біомедиками та лікарями для перетворення лабораторних результатів у клінічне застосування.
Огляд[ред. | ред. код]
Нервова система поділяється на два відділи: ЦНС і ПНС. ЦНС складається з головного та спинного мозку, тоді як ПНС складається з нервів, які походять від головного та спинного мозку та іннервують решту тіла.[4]
Потреба в інженерії нервової тканини, як окремої галузі, виникає через складність нервових клітин і нервової тканини відновлюватися самостійно після пошкодження нервової системи. ПНС має певну, але обмежену регенерацію нервових клітин. Було виявлено, що нейрогенез дорослих стовбурових клітин у ЦНС відбувається в гіпокампі, субвентрикулярній зоні (SVZ) і спинному мозку.[5] Дослідження 2020-го року показало також нейрогенез у дорослих у інших зонах мозку, зокрема вгіпоталамусі, смугастому тілі, чорній субстанції, корі головного мозку та мигдалині.[6]
Пошкодження ЦНС можуть бути викликані інсультом, нейродегенеративними розладами, травмою або енцефалопатією. Нині досліджуються кілька методів лікування пошкоджень ЦНС[7]:
- імплантація стовбурових клітин безпосередньо в місце пошкодження
- доставка морфогенів до місця пошкодження
- вирощування нервової тканини in vitro з нейронними стовбуровими або клітинами-попередниками в 3D каркасі.
Запропоноване використання електропрядених полімерних волокнистих каркасів для нейронних субстратів відновлення датується щонайменше 1986 роком у заявці NIH SBIR від Simon.[8]
Для ПНС відірваний нерв можна повторно з’єднати та повторно іннервувати за допомогою трансплантатів або спрямування існуючого нерва через канал.[4]
Нещодавні дослідження створення мініатюрної кори головного мозку, відомої як кортикопоез, і моделей мозку, відомих як церебральні органоїди[en], є методами, які можуть сприяти розвитку регенерації нервової тканини. Природні кортикальні попередники кортикопоезу — це нервові тканини, які можуть бути ефективно вбудовані в мозок.[9]
Церебральні органоїди — це тривимірні плюрипотентні стовбурові клітини людини, розвинені в секції кори головного мозку, що свідчить про наявність потенціалу для ізоляції та розвитку певних нервових тканин за допомогою нейронних попередників.[10]
Дослідження 2023 року показало, що органоїди людського мозку успішно інтегруються із зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори.[11]
Іншою ситуацією, що вимагає імплантації чужорідної тканини, є використання записуючих електродів. Хронічні електродні імплантати – це інструмент, який використовується в дослідницьких програмах для запису сигналів із областей кори головного мозку. Дослідження стимуляції нейронів ПНС у пацієнтів з паралічем і протезуванням може розширити знання про реіннервацію нервової тканини як у ПНС, так і в ЦНС. Це дослідження здатне зробити один складний аспект інженерії нервової тканини — функціональну іннервацію нервової тканини — більш керованою.[12]
Центральна нервова система (ЦНС)[ред. | ред. код]
Причини ураження ЦНС[ред. | ред. код]
Є чотири основні причини ураження ЦНС: інсульт, черепно-мозкова травма (ЧМТ), травма спинного мозку або ускладнення розвитку. Інсульти класифікуються як геморагічні (коли судина пошкоджена до ступеня крововиливу в мозок) або ішемічні (коли тромб блокує кровотік через судину в мозку). Коли відбувається крововилив, кров просочується в навколишні тканини, що призводить до відмирання тканин, тоді як ішемічні крововиливи призводять до відсутності кровотоку до певних тканин. Черепно-мозкова травма викликається зовнішніми силами, що впливають на череп або спинний мозок. Проблеми з розвитком ЦНС призводять до аномального росту тканин під час розвитку, таким чином знижуючи функцію ЦНС.[7]
Огляд 2023 року підсумував основні причини обмеженої регенерації в ЦНС: (1) неспроможність утворити клітинні або молекулярні субстрати для прикріплення аксонів і їх подовження через місце ураження; (2) фактори зовнішнього середовища, включаючи інгібітори росту аксонів, пов'язаних з мієліном і позаклітинним матриксом; (3) реакції астроцитів, які можуть як обмежувати, так і підтримувати ріст аксона; і (4) внутрішньонейронні механізми, що контролюють встановлення активної програми клітинного росту.[13]
Лікування та дослідження ЦНС[ред. | ред. код]
Імплантація стовбурових клітин на місце пошкодження[ред. | ред. код]

Один із потенційних методів лікування ураження ЦНС включає культивування стовбурових клітин in vitro та імплантацію їх у місце ураження мозку. Імплантація стовбурових клітин безпосередньо в місце пошкодження запобігає утворенню гліальних рубців і сприяє нейрогенезу, що походить від пацієнта, але також створює деякі ризики — ризик розвитку пухлини, запалення та міграції стовбурових клітин з місця пошкодження. Пухлиноутворення може виникнути через неконтрольований характер диференціації стовбурових клітин, запалення може виникнути через відторгнення імплантованих клітин клітинами-господарями, а висока міграційна природа стовбурових клітин призводить до того, що клітини віддаляються від місця пошкодження, тому не надає бажаний вплив на місце пошкодження.
Інші проблеми інженерії нервової тканини включають створення безпечних джерел стовбурових клітин і отримання відтворюваних результатів від лікування до лікування.[7]
Крім того, ці стовбурові клітини можуть діяти як носії для інших методів лікування, хоча позитивні ефекти використання стовбурових клітин як механізму доставки не підтверджені. Пряма доставка стовбурових клітин має підвищений корисний ефект, якщо вони запрограмовані як нейронні клітини in vitro.[7]
Дослідження 2020 року показали, що трансплантати нейронних клітин-попередників (NPC), отримані зі спинного мозку, інтегруються в ушкоджений спинний мозок хазяїна, забезпечують надійну регенерацію кортикоспинального аксона та відновлюють функцію передніх кінцівок після травми спинного мозку у гризунів.[15][16]
Електрично заряджені гідрогелів, що складаються з катіонних і аніонних мономерів у співвідношенні 1:1 (гідрогель C1A1), слугували ефективним каркасом для прикріплення нейронних стовбурових клітин (NSC). Пористий гідрогель сприяв утворенню судинної мережі разом з інфільтрацією макрофагів/мікроглії та астроцитів у гель. Крім того, поетапна трансплантація GFP-мічених NSCs підтримувала диференціацію до гліальних і нейрональних клітин. Таким чином, цей двоетапний метод нейронної регенерації може стати новим підходом до терапевтичної реконструкції тканин мозку після пошкодження мозку в майбутньому.[17]
Доставка молекул до місця пошкодження[ред. | ред. код]
Молекули, які сприяють регенерації нервової тканини, включаючи фармацевтичні препарати, фактори росту, відомі як морфогени, і мікроРНК також можуть бути безпосередньо введені в місце пошкодження пошкодженої тканини ЦНС.
Нейрогенез спостерігався також у тварин, яких лікували психотропними препаратами, через пригнічення зворотного захоплення серотоніну та індукцію нейрогенезу в мозку.
Коли стовбурові клітини диференціюються, клітини виділяють морфогени, такі як фактори росту, щоб сприяти здоровому розвитку. Ці морфогени допомагають підтримувати гомеостаз і нейронні сигнальні шляхи, і вони можуть бути доставлені в місце пошкодження для сприяння росту пошкоджених тканин. В даний час доставка морфогену має мінімальні переваги через взаємодію морфогенів з ушкодженою тканиною. Щоб лікування було ефективним, морфогени повинні бути присутніми в місці пошкодження в певній і постійній концентрації.
Було також показано, що мікроРНК впливає на нейрогенез, керуючи диференціюванням недиференційованих нейронних клітин.[7]
Цілеспрямована реіннервація[ред. | ред. код]
Цілеспрямована реіннервація (Targeted reinnervation) — це метод реіннервації нейронних зв’язків у ЦНС та ПНС, зокрема у паралізованих пацієнтів та осіб з ампутованими кінцівками, які використовують протези кінцівок. Зараз досліджуються пристрої, які сприймають і записують електричні сигнали, що поширюються через нейрони у відповідь на намір людини рухатися. Це дослідження може пролити світло на те, як реіннервувати нейронні зв’язки між розірваними нервами ПНС і зв’язки між пересадженими 3D каркасами в ЦНС.[12]
У ЦНС внутрішні фактори нейронів, такі як програми транскрипції та сигнальні шляхи росту, відіграють вирішальну роль у визначенні регенераційної здатності. Наприклад, модуляції шляхів, що включають mTOR і SOCS3, показали перспективу в сприянні подовженню аксона. Однак гальмівні фактори, такі як уламки мієліну та гліальний рубець, перешкоджають регенерації аксонів ЦНС, спонукаючи до потреби в стратегіях подолання цих бар’єрів. Гліальний рубець, який колись вважався виключно гальмівним для росту аксона, представляє складне середовище як з гальмівними, так і з стимулюючими сигналами. Останні дослідження ставлять під сумнів думку про те, що гліальний рубець повністю обмежує регенерацію аксона, припускаючи, що вибіркове маніпулювання певними компонентами рубця може сприяти повторному росту. Направляючі молекули аксона, відповідальні за спрямування росту аксона під час розвитку, також впливають на регенерацію після травми. Деякі молекули, такі як передача сигналів RGMa та Wnt, виявляють як гальмівний, так і стимулюючий вплив на ріст аксонів, пропонуючи потенційні терапевтичні цілі. Для відновлення нервової функції досліджуються стратегії, що сприяють проростанню колатеральних аксонів із звільнених аксонів або заохочують новий ріст із самого пошкодженого аксона. Однак досягнення контрольованого росту без аномальних результатів залишається проблемою, що підкреслює потребу в тонкому розумінні того, як використовувати молекулярні вказівки та фактори росту для сприяння функціональному нейронному відновленню.[18]
Дослідження показують, що маніпулювання певними генами або епігенетичними механізмами (див. також Епігенетичне перепрогармування), наприклад збільшення експресії Lin28[19][20] або Tet3[21], може сприяти регенерації аксонів у пошкоджених нейронах, пропонуючи потенційні терапевтичні підходи. Однак занепокоєння щодо можливих побічних ефектів або впливу цих втручань на нормальну клітинну функцію ще потребують повного вирішення.
Нейтралізація гальмівних ефектів RGMa може сприяти регенерації аксонів після травми спинного мозку, тоді як інгібування передачі сигналів Wnt-Ryk посилює проростання аксонів у пошкодженому спинному мозку.[18]
Карбіди та нітриди перехідних металів (MXene) є хорошими субстратами для регенерації нервових клітин і реконструкції нервів, які мають широкі перспективи застосування при відновленні пошкоджень нервової системи.[22]
Технологія електроспінінгу для розробки вирівняних децелюляризованих волокон спинного мозку (A-DSCF) без використання синтетичних полімерів або органічних розчинників зберігає кілька типів протеїнів позаклітинного матриксу спинного мозку та формує паралельно орієнтовану структуру. Порівняно з вирівняними колагеновими волокнами (A-CF), A-DSCF демонструє сильніші механічні властивості, покращену ферментативну стабільність і чудову функціональність у адгезії, проліферації, розширенні аксонів і мієлінізації диференційованих нейронних клітин-попередників (NPC). При трансплантації щурам із повним ТСМ A-DSCF, завантажений NPC, покращує виживаність, дозрівання, регенерацію аксонів і рухову функцію щурів із травмою спинного мозку.[23]
Імплантація нервової тканини, розробленої in vitro[ред. | ред. код]
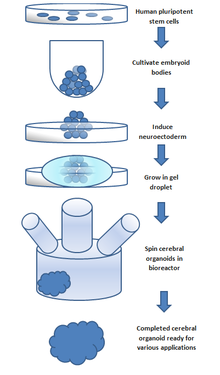
Ще один метод лікування пошкоджень ЦНС полягає у штучному створенні тканини поза тілом для імплантації в місце пошкодження. Цей метод може лікувати травми, які складаються з великих порожнин, де більша кількість нервової тканини потребує заміни та регенерації. Нервова тканина вирощується in vitro з нейронними стовбуровими клітинами або клітинами-попередниками в 3D каркасі, утворюючи ембріоїдні тіла. Ці ембріоїдні тіла складаються зі сфери стовбурових клітин, де внутрішні клітини є недиференційованими нервовими клітинами, а навколишні клітини стають все більш диференційованими. Тривимірні каркаси використовуються для трансплантації тканини до місця пошкодження та створення відповідного інтерфейсу між штучною та тканиною мозку.

Каркаси мають бути: біосумісними, біорозкладними, відповідати за розміром та формою місцю пошкодження, подібними до існуючої тканини за еластичністю та жорсткістю та підтримувати зростання клітин і тканин.
Поєднання використання спрямованих стовбурових клітин і каркасів для підтримки нервових клітин і тканин збільшує виживання стовбурових клітин у місці пошкодження, підвищуючи ефективність лікування.[7]

Існує 6 різних типів каркасів, які досліджуються для використання в цьому методі лікування ушкоджень нервової тканини:
- Рідкі гідрогелі — це зшиті гідрофобні полімерні ланцюги, в яких нейронні стовбурові клітини вирощуються на поверхні гелю або інтегруються в гель під час зшивання полімерних ланцюгів. Основним недоліком рідких гідрогелів є обмежений захист клітин, які трансплантуються.
- Підтримуючі каркаси (Supportive scaffolds) — виготовлені з твердих кулькоподібних або мікропористих структур і можуть діяти як носії для трансплантованих клітин або факторів росту, які стовбурові клітини виділяють під час диференціювання. Клітини прилипають до поверхні матриці двовимірними шарами. Підтримуючі каркаси легко трансплантуються в місце пошкодження головного мозку через розміри скаффолдів. Вони забезпечують матрицю, що сприяє клітинній адгезії та агрегації, таким чином збільшуючи культуру здорових клітин.
- Каркаси для вирівнювання (Aligning scaffolds) — можуть бути на основі шовку, полісахаридів або на основі інших матеріалів, таких як багатий колагеном гідрогель. Ці гелі тепер покращені мікровізерунками на поверхні для сприяння розвитку нейронних відростків. Ці каркаси в основному використовуються для регенерації, яка має відбуватися в певній орієнтації, наприклад, при травмах спинного мозку.
- Інтегративні каркаси — в основному використовуються для захисту трансплантованих клітин від механічних пошкоджень, яким вони піддаються в процесі імплантації в місце пошкодження. Ці каркаси також зменшують ймовірність того, що запальні клітини, розташовані в місці пошкодження, мігрують у каркас зі стовбуровими клітинами. Помічено, що кровоносні судини проростають через каркас, таким чином каркас і клітини інтегруються в тканину господаря.
- Комбінація сконструйованих каркасів представляє варіант 3D-каркасу, який може мати як необхідні візерунки для адгезії клітин, так і гнучкість для адаптації до постійно мінливого середовища в місці пошкодження.
- Децелюляризовані каркаси ECM є варіантом для каркасів, оскільки вони більш точно імітують нативну тканину, але наразі ці каркаси можна зібрати лише з ампутацій і трупів.[7]
Ці тривимірні каркаси можуть бути виготовлені за допомогою методів вилуговування частинок, газового спінювання, з’єднання волокон, лиття з розчинника або електроформування; кожна техніка створює каркас із властивостями, відмінними від інших технік.[25]
Полімери, зокрема, колаген широко використовується для інженерії нервової тканини. Останні досягнення в інтеграції колагену з виробничими стратегіями, такими як каркас, електроспінінг і 3D-біодрук, забезпечують локалізовану трофічну підтримку, направляють вирівнювання клітин і захищають нервові клітини від імунної активності.[26][27]
Також, п’єзоелектричні біоматеріали, завдяки властивостям власного живлення та чудовій біосумісності, мають потенціал в інженерії нервової тканини.[28]
Було показано, що успіх включення 3D каркасів у ЦНС залежить від стадії, на якій клітини диференціювалися. Пізніші стадії забезпечують більш ефективну імплантацію, тоді як клітини на більш ранніх стадіях повинні бути піддані впливу факторів, які змушують клітини диференціюватись і, таким чином, належним чином реагувати на сигнали, які клітини отримуватимуть у місці пошкодження ЦНС.[29] Нейротрофічний фактор, отриманий з мозку, є потенційним кофактором для сприяння функціональній активації нейронів, отриманих з клітин ES, у місцях пошкодження ЦНС.[30]
Полігідроксіалканоати є природними, біорозкладаними, термопластичними та стійкими біополімерами з величеким потенціалом у виготовленні біорозсмоктуваних каркасів для тканинної інженерії, зокерма для інженерії нервової тканини.[31]
Периферична нервова система (ПНС)[ред. | ред. код]

Причини ураження ПНС[ред. | ред. код]
Травма ПНС може спричинити таке серйозне пошкодження, як розрив нерва, розщеплення нерва на проксимальну та дистальну частини. Дистальний нерв з часом дегенерує через бездіяльність, тоді як проксимальний кінець з часом набрякає. Дистальний кінець не дегенерує відразу, а набряк проксимального кінця не робить його нефункціональним, тому досліджуються методи відновлення зв’язку між двома кінцями нерва.[4]
Доповнення екзогенними факторами росту є новою та універсальною терапевтичною стратегією для сприяння регенерації нервів та функціональному відновленню.[33]
Нанорозмірні каркаси на снові біоміметичних наноматеріалів можуть ініціювати секрецію та агрегацію факторів росту шляхом модифікації поверхні, регулювати синтез і гідроліз АТФ, перемикатися між станами окислення та відновлення, а також активувати іонні канали та стимулювати електричні сигнали за певними біофізичними сигналами. Отже, вони можуть визначати долю нейронних клітин шляхом модуляції їх життєздатності, розвитку та клітинних циклів під час процесу регенерації.[34]
Лікування та дослідження ПНС[ред. | ред. код]
Пошкодження периферичного нерва має серйозні та глибокі наслідки для життя пацієнта. Терапевтичний підхід залишається однією з найскладніших клінічних проблем. В останні роки запропоновано багато конструктивних схем регенерації нервів. Інженерія нервової тканини відіграє важливу роль і запропонувала багато нових підходів до виготовлення високорегульованих і функціональних каркасів, які мають великий потенціал для відновлення периферичних нервів. Однак досі велика кількість направляючих каналів (NGC), розроблених як в експериментах in vivo, так і in vitro, все ще має недоліки. Фізичні, хімічні і механічні властивості скаффолдів необхідно налаштувати для оптимізації взаємодії між клітинами в каркасі та імплантованою тканиною для реалізації широкомасштабного просування та застосування NGC. Швидкість біодеградації каркаса також необхідно контролювати, щоб підтримувати його цілісність до дозрівання регенерованої тканини. Крім того, технологія виробництва NGC також є гарячою точкою поточних досліджень. Тривимірні біодруковані NGC підтримують міграцію та проліферацію клітин. 3D-друк на основі технології Digital Light Processing[en] (DLP) може розробити точнішу внутрішню структуру каркаса та сприяти більш ефективній регенерації нервів.[35][36] Нервові направляючі канали (NGCs) на фіброїні шовку (SF), який є біосумісним і дуже універсальним, мають потенціал для використання в регенерації периферичних нервових волокон.[37]
Високочастотне, тривимірне, томографічне УЗД (HFtUS) може кількісно визначити ранню регенерацію периферичних нервів, пропонуючи вікно можливостей для хірургічного втручання, коли виявляється рання аномальна регенерація.[38]
Хірургічне з'єднання[ред. | ред. код]
Одним із методів лікування пошкодження ПНС є хірургічне відновлення відірваного нерва шляхом взяття двох кінців нерва та їх зшивання. Під час зшивання нервів кожен пучок нерва знову з’єднується, з’єднуючи нерв разом. Хоча цей метод працює для розривів, які створюють невеликий проміжок між проксимальним і дистальним закінченнями нервів, цей метод не працює на проміжках більшої відстані через напругу, яку необхідно застосувати до нервових закінчень. Ця напруга призводить до дегенерації нерва, і тому нерв не може відновитися та сформувати функціональний нейронний зв’язок.[4]
Пересадки тканин[ред. | ред. код]
Тканинні трансплантати використовують нерви або інші матеріали для з'єднання двох кінців відірваного нерва. Існує три категорії тканинних трансплантатів: трансплантати аутологічної тканини, трансплантати неавтологічної тканини та ацелюлярні трансплантати.
- Трансплантати аутологічної тканини пересаджують нерви з іншої частини тіла пацієнта, щоб заповнити проміжок між обома кінцями пошкодженого нерва. Ці нерви, як правило, є шкірними нервами, але й інші нерви були досліджені з обнадійливими результатами. Ці аутологічні нервові трансплантати є поточним золотим стандартом для трансплантації нервів ПНС через високу біосумісність аутологічних трансплантатів нервів, але існують проблеми щодо вилучення нерва у самих пацієнтів і можливості зберігати велику кількість аутологічних трансплантатів на майбутнє використовування.
- Неавтологічні та ацелюлярні трансплантати (включаючи матеріали на основі позаклітинного матриксу) — це тканини, які не походять від пацієнта, а можуть бути зібрані з трупів (відомі як алогенні тканини) або тварин (відомі як ксеногенні тканини). Хоча ці тканини мають перевагу перед аутологічними тканинними трансплантатами, оскільки тканину не потрібно брати у пацієнта, виникають труднощі з потенційною передачею захворювання та, отже, імуногенними проблемами. Наразі досліджуються методи усунення імуногенних клітин, залишаючи позаклітинно-матричні-компоненти тканини, щоб підвищити ефективність трансплантатів неаутологічної тканини.[4]
Наведення[ред. | ред. код]

Методи керування регенерацією ПНС використовують нервові направляючі канали, щоб допомогти аксонам відновити правильний шлях, і можуть спрямовувати фактори росту, що виділяються обома кінцями нерва, для сприяння росту та повторному з’єднанню. Методи наведення зменшують утворення рубців на нервах, збільшуючи функціональність нервів для передачі потенціалів дії після повторного підключення. У керівних методах регенерації ПНС використовуються два види матеріалів: натуральні та синтетичні.[40]
- Матеріали на натуральній основі – це модифіковані каркаси, що походять від компонентів позаклітинного матриксу і глікозаміногліканів. Ламінін, колаген і фібронектин, які є компонентами позаклітинного матриксу, направляють розвиток аксонів і сприяють нервовій стимуляції та активності. Інші молекули, які можуть сприяти відновленню нервів, це: гіалуронова кислота, фібриноген, фібринові гелі, самозбірні пептидні каркаси, альгінат, агароза та хітозан.
- Синтетичні матеріали забезпечують метод регенерації тканин, за допомогою якого можна контролювати хімічні та фізичні властивості трансплантата. Оскільки властивості матеріалу можуть бути визначені для ситуації, в якій він використовується, синтетичні матеріали є привабливим варіантом для регенерації ПНС. Використання синтетичних матеріалів пов’язане з певними проблемами, такими як: формування матеріалу трансплантата до необхідних розмірів, здатність до біологічного розкладання, стерилізація, стійкість до розривів, легкість у роботі, низький ризик інфікування та низька реакція на запалення завдяки матеріалу. Матеріал також повинен підтримувати канал під час регенерації нерва. В даний час найбільш часто досліджувані матеріали зосереджені на поліефірах, але також досліджуються біорозкладаний поліуретан, інші полімери та біорозкладне скло . Іншими можливостями для синтетичних матеріалів є електропровідні полімери та полімери, біологічно модифіковані для сприяння росту аксонів клітин і підтримки аксонного каналу.[4]
Направлена реіннервація[ред. | ред. код]
Направлена реіннервація (Targeted reinnervation) — це метод реіннервації нейронних зв’язків у ЦНС та ПНС, зокрема у паралізованих пацієнтів та осіб з ампутованими кінцівками, які використовують протези кінцівок. Зараз досліджуються пристрої, які сприймають і записують електричні сигнали, що поширюються через нейрони у відповідь на намір людини рухатися. Це дослідження може пролити світло на те, як реіннервувати нейронні зв’язки між розірваними нервами ПНС і зв’язки між пересадженими 3D каркасами в ЦНС.[12]
Периферична нервова система (ПНС) демонструє кращу здатність до регенерації, ніж ЦНС. Нейрони ПНС за допомогою Шванівских клітин дедиференціюються, щоб допомогти в очищенні від уламків і експресують фактори, які значно підвищують їх здатність до регенерації після травми. Ключові молекулярні властивості, такі як перепрограмування, викликане травмою, і локалізована трансляція білка, сприяють кращій регенераційній здатності ПНС.[18]
Такролімус, потужний імуносупресивний препарат, відомий своїми нейрорегенеративними властивостями, виявився в експериментальних дослідженнях як перспективний кандидат для прискорення регенерації нервових волокон.[41]
Нейротрофін-3 (NTF3) сприяє регенерації периферичних нервів шляхом підтримки стану відновлення шванівських клітин після хронічної денервації.[42]
Aдипоцити та клітини Шванна взаємодіють, щоб регулювати метаболічний гомеостаз після травми нерва, що може відкрити нові стратегії лікування травми нерва.[43]
Результати 52 досліджень показують, що нейромодуляція[en] посилює природні процеси регенерації периферичних нервів, але все ще вимагає інших втручань (наприклад, кондуїтів) для контролю напрямку реіннервації.[44]
Направлена реіннервація м’язів (TMR) є відносно нещодавнім хірургічним нововведенням, яке передбачає коаптацію основних периферичних нервів до моторної гілки реципієнта, яка іннервує м’язову ціль. Початковим показанням до TMR було посилення та оптимізація міоелектричних сигналів в ампутованій кінцівці для використання міоелектричних протезів (див. також Нейропротезування). Хірурги та пацієнти виявили, що ця техніка також може лікувати та запобігати фантомним і залишковим болям у кінцівках. TMR виконується під час ампутації або відкладається на будь-який час після ампутації, і TMR також можна виконувати на будь-якому рівні ампутації. Лікування периферичних нервів у людини з ампутованими кінцівками за допомогою TMR має бути розглянутим для всіх пацієнтів із великими ампутаціями верхніх кінцівок, особливо у великих установах, які можуть підтримувати міждисциплінарні групи порятунку кінцівок.[45][46][47]
Механічна електрична стимуляція (MES), опосередкована п’єзоелектричним нервовим каналом, викликала посилену регенерацію периферичного нерва, що призвело до повного повторного з’єднання аксона з регенерацією мієліну від проксимального до дистального кінців. Для порівняння, контрольна група, в якій імплантовані п’єзоелектричні канали не були активовані in vivo, не продемонструвала такої регенерації нерва. Крім того, як на проксимальному, так і на дистальному кінцях імплантованих каналів спостерігалося зменшення кількості пошкодженого мієліну, збільшення кількості мієлінізованих нервів і більший діаметр аксона в умовах MES порівняно з контрольними умовами. Крім того, на відміну від контрольної групи, стан MES продемонстрував чудове функціональне відновлення нерва, оцінене за допомогою аналізу пішохідної доріжки та поляризаційно-чутливої оптичної когерентної томографії, що демонструє значний потенціал підходу до фізичної стимуляції на основі п’єзоелектричного каналу для лікування пошкодження периферичного нерва.[48]
Пов'язані дослідження[ред. | ред. код]
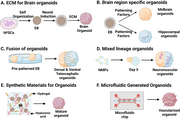
Моделювання розвитку тканин мозку in vitro[ред. | ред. код]
Двома моделями розвитку тканин мозку є церебральні органоїди та кортикопоез.
Ці моделі забезпечують in vitro модель нормального розвитку мозку[10], але ними можна маніпулювати, щоб дослідити нейронні дефекти. Таким чином, дослідники можуть вивчати механізми здорового та неправильного розвитку за допомогою цих моделей. [10] Ці тканини можна виготовити або з мишачих ембріональних стовбурових клітин (ЕСК), або з людських. Мишачі ЕСК культивують у білку, який називається 'інгібітор Sonic Hedgehog', щоб сприяти розвитку дорсального переднього мозку та вивчати долю кори.[9] Показано, що цей метод створює аксональні шари, які імітують широкий спектр кортикальних шарів.[10] Тканини, отримані з ЕСК людини, використовують плюрипотентні стовбурові клітини для формування тканин на каркасі, утворюючи людські ембріоїдні тіла. Ці тканини, отримані з ЕСК людини, утворюються шляхом культивування плюрипотентних ембріоїдних тіл людини в обертовому біореакторі.[10]
Сучасні методи мікроскопічної нейровізуалізації в поєднанні з машинним навчанням довзоляють отримати тривимірну реконструкцію тканини мозку на рівні синапсів, включаючи молекулярну інформацію, інформацію про активність та морфодинамічну інформацію.[49]
Церебральні органоїди[ред. | ред. код]

Церебральні органоїди[en], також відомі як органоїди мозку, є тривимірними (3D) структурами, створеними з плюрипотентних стовбурових клітин людини.[50] Такі органоїди нагадують людський мозок, що розвивається, з точки зору типів клітин, організації та функціональності. Церебральні органоїди здатні повторювати різні аспекти розвитку людського мозку, включаючи проліферацію нервових клітин-попередників, диференціацію нейронів, формування окремих ділянок мозку і навіть формування синапсів.
Ці органоїди зазвичай утворюються шляхом культивування плюрипотентних стовбурових клітин людини в 3D-матриці, яка сприяє утворенню нервових клітин-попередників, які диференціюються та самоорганізуються в різні типи клітин мозку. Церебральні органоїди широко використовуються в дослідженнях нейророзвитку[51] для вивчення клітинних і молекулярних механізмів розвитку людського мозку[52][53] та моделювання різних неврологічних розладів.[50][54]
Дослідження 2023 року, опубліковане в Nature Protocols, показало можливість створення фоточутливих органоїдів переднього мозку, що утворили примітивні епітеліальні та лінзоподібні клітини рогівки, пігментний епітелій сітківки, клітини-попередники сітківки, аксоноподібні проекції та електрично активні нейронні мережі.[55]
Використання церебральних органоїдів у дослідженнях має потенціал для значного вдосконалення нашого розуміння людського мозку та надання нових уявлень про розвиток і лікування неврологічних розладів.
Органоїдний інтелект[ред. | ред. код]
Органоїдний інтелект (ОІ) — це нова міждисциплінарна галузь, зосереджена на розробці біологічних обчислень із використанням органоїдів мозку і технологій нейрокомп'ютерного інтерфесу. Біобчислювальні системи на основі OI мають потенціал для швидшого прийняття рішень, безперервного навчання під час виконання завдань і більшої ефективності використання енергії та обчислення даних, ніж обчислення на основі кремнієвих транзисторів та штучного інтелекту. Розвиток OI може покращити наше розуміння розвитку мозку, навчання, пам’яті та, потенційно, може допомогти знайти лікування неврологічних розладів, таких як деменція чи аутизм.[56][57][58]
OI включає збільшення церебральних органоїдів у складні, міцні 3D-структури, збагачені клітинами та генами, пов’язаними з навчанням, підключення їх до пристроїв введення та виведення наступного покоління та систем ШІ/машинного навчання. Для цього потрібні нові моделі, алгоритми та технології інтерфейсу, щоб спілкуватися з органоїдами мозку, розуміти, як вони навчаються та обчислюють, а також обробляти та зберігати величезні обсяги даних, які вони генерують.[56][57][58]
Крім того, використання таких органоїдів, які можуть розвинути відчуття та, ймовірно, в подальшому, свідомість, є предметом дискусій в нейроетиці та біоетиці.[59][60][61][62]
Також досліджується апаратний підхід штучного інтелекту, який використовує адаптивне резервуарне обчислення біологічних нейронних мереж в органоїді мозку. У цьому підході, який називається Brainoware, обчислення виконуються шляхом надсилання та отримання інформації від органоїда мозку за допомогою матриці мікроелектродів[en] високої щільності. Застосовуючи просторово-часову електричну стимуляцію, досягається нелінійна динаміка та властивості запам’ятовування, а також неконтрольоване навчання на основі тренувальних даних шляхом зміни функціональних зв’язків в органоїдах. Був продемонстрований практичний потенціал цієї методики, використовуючи її для розпізнавання мовлення та прогнозування нелінійних рівнянь у системі резервуарних обчислень.[63]
Дослідження in vivo[ред. | ред. код]
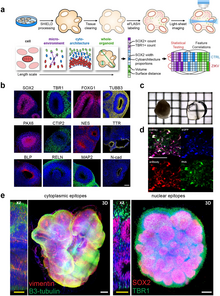
Трансплантація кортикальних стовбурових клітин показала багатообіцяючий потенціал для відновлення мозку.[65] Однак ефективність сучасних моделей трансплантації в кодуванні корисної функції для хазяїна через отримані від трансплантації нейрони все ще обмежена. Це пояснюється відсутністю деяких типів клітин у трансплантатах, аномальними пропорціями типів клітин, аномальною цитоархітектурою та неефективною васкуляризацією[66].[65]
Щоб усунути ці обмеження, була розроблена платформа трансплантації для тестування прототипів неокортикальної тканини.[67] Платформа включала трансплантацію дисоційованих мишачих ембріональних теленцефальних клітин у рідкому каркасі в уражену аспірацією кору кори дорослої миші. Попередники донорських нейронів диференціювалися на нейрони верхнього та глибокого шарів, які демонстрували синаптичні точки, проектувалися за межі трансплантата у відповідні ділянки мозку, ставали електрофізіологічно активними протягом одного місяця після трансплантації та реагували на візуальні стимули. Інтернейрони та олігодендроцити були присутні в трансплантатах з нормальною щільністю. Трансплантати повністю васкуляризувалися через тиждень після трансплантації. Клітини також були організовані в шари. Ця платформа in vivo пропонує підтвердження концепції розробки та тестування прототипів тканин, схожих на неокорку, які можуть мати наслідки для відновлення мозку та регенеративної медицини.
Техніка попередньої васкуляризації нервової тканини показує перспективні результати.[68]
Трансплантація органоїдів[ред. | ред. код]

Дослідження 2023 року показало, що органоїди людського мозку успішно інтегруються із зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори.[69] Транссинаптичне відстеження на основі вірусів виявило полісинаптичний шлях між трансплантованими людськими органоїдними нейронами та сітківкою щура-господаря, та взаємний зв’язок між трансплантатом та іншими регіонами зорової системи. Візуальна стимуляція тварин-господарів викликає відповіді в органоїдних нейронах, включаючи вибірковість орієнтації. Ці результати демонструють здатність органоїдів людського мозку приймати складні функції після введення у великі порожнини травми, пропонуючи трансляційну стратегію для відновлення функції після пошкодження кори.[69][70]
Ще одне дослідження на мишах, опубліковане в травні 2023 року в npj Regenerative Medicine, що досліджувало використання мозкових органоїдів для відновлення функціональної нервової тканини в місці ураження після ішемічного інсульту, показало[71]:
"...Через кілька місяців ми виявили, що трансплантовані органоїди добре вижили в ураженому інфарктом ядрі, диференціювалися в цільові нейрони, відновлювали інфарктну тканину, посилали аксони до віддалених мішеней мозку та інтегрувалися в нейронний ланцюг господаря, тим самим усуваючи сенсомоторні дефекти поведінки мишей, які перенесли інсульт, тоді як трансплантація дисоційованих окремих клітин з органоїдів не привела до відновлення ураженої інфарктом тканини."
Див.також[ред. | ред. код]
Література[ред. | ред. код]
Книги[ред. | ред. код]
- Biomaterials for Neural Tissue Engineering. / Oguzhan Gunduz, Cem Bulent Ustundag and Mustafa Sengor, 2023 — Elsevier. ISBN 978-0-323-90554-1.
- Advances in CNS Repair, Regeneration, and Neuroplasticity: From Basic Mechanisms to Therapeutic Strategies. / Li, Shuxin; Wu, Junfang; Tedeschi, Andrea, 2022 — Frontiers Media SA. ISBN 978-2-88974-633-0.
- Replacing Aging / Jean M Hébert Ph.D. / 2021 / ISBN 979-8577571191
- Principles of Tissue Engineering (5th Edition) / Роберт Ланца, Роберт Ленджер, Joseph P. Vacanti, Anthony Atala. / London, 2020. ISBN 978-0-12-821401-5.
Журнали[ред. | ред. код]
- Neural Regeneration Research
- Tissue Engineering and Regenerative Medicine
- Tissue Engineering: part A & part B: Reviews & part C: Methods
- Journal of Tissue Engineering
- TERM: Tissue Engineering & Regenerative Medicine
- Nature Biomedical Engineering
- Bioengineering
- Biofabrication
- International Journal of Bioprinting
Статті[ред. | ред. код]
- Le, Elliot L. H.; Iorio, Matthew L.; Greyson, Mark A. (2023-10). Targeted muscle reinnervation in upper extremity amputations. European Journal of Orthopaedic Surgery & Traumatology (англ.) doi:10.1007/s00590-023-03736-2.
- Varadarajan, Supraja G.; Wang, Fei; Dhande, Onkar S.; Le, Phung; Duan, Xin; Ендрю Губерман (2023-05). Postsynaptic neuronal activity promotes regeneration of retinal axons. Cell Reports. doi:10.1016/j.celrep.2023.112476.
- Rouleau, Nicolas; Murugan, Nirosha J.; Kaplan, David L. (2023-04). Functional bioengineered models of the central nervous system. Nature Reviews Bioengineering (англ.). doi:10.1038/s44222-023-00027-7.
- Quezada, Alexandra; Ward, Claire; Jean M. Hébert et al. (2023-02). An In Vivo Platform for Rebuilding Functional Neocortical Tissue. Bioengineering (англ.). doi:10.3390/bioengineering10020263.
- Jgamadze, Dennis; Lim, James T.; Zhang, Zhijian et al. (2023-02). Structural and functional integration of human forebrain organoids with the injured adult rat visual system. Cell Stem Cell. doi:10.1016/j.stem.2023.01.004.
- Clifford, Tanner; Finkel, Zachary; Rodriguez, Brianna; Joseph, Adelina; Cai, Li (2023-01). Current Advancements in Spinal Cord Injury Research—Glial Scar Formation and Neural Regeneration. Cells (англ.). doi:10.3390/cells12060853.
- Zhang, Xiaoge; Liu, Fuyao; Gu, Zhen (2023-01). Tissue Engineering in Neuroscience: Applications and Perspectives. BME Frontiers (англ.). doi:10.34133/bmef.0007.
- Tarricone, Giulia; Carmagnola, Irene; Chiono, Valeria (2022-09). Tissue-Engineered Models of the Human Brain: State-of-the-Art Analysis and Challenges. Journal of Functional Biomaterials (англ.). doi:10.3390/jfb13030146.
- Gong, Bowen; Zhang, Xindan; Zahrani, Ahmed Al; Gao, Wenwen; Ma, Guolin; Zhang, Liqun; Xue, Jiajia (2022-06). Neural tissue engineering: From bioactive scaffolds and in situ monitoring to regeneration. Exploration (англ.). doi:10.1002/EXP.20210035.
- Varadarajan, Supraja G.; Hunyara, John L.; Hamilton, Natalie R.; Kolodkin, Alex L.; Ендрю Губерман (2022-01). Central nervous system regeneration. Cell. doi:10.1016/j.cell.2021.10.029.
- Doblado, Laura Rodríguez; Martínez-Ramos, Cristina; Pradas, Manuel Monleón (2021). Biomaterials for Neural Tissue Engineering. Frontiers in Nanotechnology. doi:10.3389/fnano.2021.643507.
Посилання[ред. | ред. код]
- Institute of Neural Regeneration & Tissue Engineering
- The Hébert Lab — Albert Einstein College of Medicine
Відео[ред. | ред. код]
- Neural Tissue Engineering: How to Restore Structure and Function of 3D Neural Tissue? [відео] / 2021
- Nerve Guides as Nerve Tissue Engineering Biomaterials [відео] / 2021
- Present approaches for neural tissue regeneration: Neurostimspinal project [відео] / 2021
- Can the damaged brain repair itself? — Siddharthan Chandran. TED [відео] / 2013
Примітки[ред. | ред. код]
- ↑ Zhang, Xiaoge; Liu, Fuyao; Gu, Zhen (2023-01). Tissue Engineering in Neuroscience: Applications and Perspectives. BME Frontiers (англ.). Т. 4. doi:10.34133/bmef.0007. ISSN 2765-8031. Процитовано 9 червня 2023.
- ↑ Tarricone, Giulia; Carmagnola, Irene; Chiono, Valeria (2022-09). Tissue-Engineered Models of the Human Brain: State-of-the-Art Analysis and Challenges. Journal of Functional Biomaterials (англ.). Т. 13, № 3. с. 146. doi:10.3390/jfb13030146. ISSN 2079-4983. PMC 9501967. PMID 36135581. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Doblado, Laura Rodríguez; Martínez-Ramos, Cristina; Pradas, Manuel Monleón (2021). Biomaterials for Neural Tissue Engineering. Frontiers in Nanotechnology. Т. 3. doi:10.3389/fnano.2021.643507/full. ISSN 2673-3013. Процитовано 14 лютого 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г д е Schmidt, Christine E.; Leach, Jennie Baier (2003-08). Neural Tissue Engineering: Strategies for Repair and Regeneration. Annual Review of Biomedical Engineering (англ.). Т. 5, № 1. с. 293—347. doi:10.1146/annurev.bioeng.5.011303.120731. ISSN 1523-9829. Процитовано 11 лютого 2023.
- ↑ Temple, Sally (2001-11). The development of neural stem cells. Nature (англ.). Т. 414, № 6859. с. 112—117. doi:10.1038/35102174. ISSN 1476-4687. Процитовано 30 грудня 2023.
- ↑ а б Doerr, Jonas; Schwarz, Martin Karl; Wiedermann, Dirk; Leinhaas, Anke; Jakobs, Alina; Schloen, Florian; Schwarz, Inna; Diedenhofen, Michael; Braun, Nils Christian (19 січня 2017). Whole-brain 3D mapping of human neural transplant innervation. Nature Communications (англ.). Т. 8, № 1. с. 14162. doi:10.1038/ncomms14162. ISSN 2041-1723. Процитовано 11 лютого 2023.
- ↑ а б в г д е ж Forraz, N; Wright, Ke; Jurga, M; McGuckin, Cp (2013-07). Experimental therapies for repair of the central nervous system: stem cells and tissue engineering: Experimental therapies: brain tissue engineering. Journal of Tissue Engineering and Regenerative Medicine (англ.). Т. 7, № 7. с. 523—536. doi:10.1002/term.552. Процитовано 11 лютого 2023.
- ↑ Simon, Eric M. (1986). NIH SBIR PHASE I GRANT APPLICATION: FIBROUS SUBSTRATES FOR CELL CULTURE (PDF Download Available). ResearchGate (англ.). Процитовано 22 травня 2017.
- ↑ а б Gaspard, Nicolas; Gaillard, Afsaneh; Vanderhaeghen, Pierre (15 серпня 2009). Making cortex in a dish: In vitro corticopoiesis from embryonic stem cells. Cell Cycle. Т. 8, № 16. с. 2491—2496. doi:10.4161/cc.8.16.9276. ISSN 1538-4101. PMID 19597331. Процитовано 11 лютого 2023.
- ↑ а б в г д Lancaster, Madeline A.; Renner, Magdalena; Martin, Carol-Anne; Wenzel, Daniel; Bicknell, Louise S.; Hurles, Matthew E.; Homfray, Tessa; Penninger, Josef M.; Jackson, Andrew P. (2013-09). Cerebral organoids model human brain development and microcephaly. Nature (англ.). Т. 501, № 7467. с. 373—379. doi:10.1038/nature12517. ISSN 1476-4687. Процитовано 11 лютого 2023.
- ↑ Jgamadze, Dennis; Lim, James T.; Zhang, Zhijian; Harary, Paul M.; Germi, James; Mensah-Brown, Kobina; Adam, Christopher D.; Mirzakhalili, Ehsan; Singh, Shikha (2 лютого 2023). Structural and functional integration of human forebrain organoids with the injured adult rat visual system. Cell Stem Cell (English) . Т. 30, № 2. с. 137—152.e7. doi:10.1016/j.stem.2023.01.004. ISSN 1934-5909. PMC 9926224. PMID 36736289. Процитовано 15 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б в Tenore, Francesco; Vogelstein, Jacob (2011). Revolutionizing Prothetics: Devices for Neural Integration. Johns Hopkins APL Technical Digest. 30 (3): 230—39.
- ↑ Zheng, Binhai; Tuszynski, Mark H. (2023-06). Regulation of axonal regeneration after mammalian spinal cord injury. Nature Reviews Molecular Cell Biology (англ.). Т. 24, № 6. с. 396—413. doi:10.1038/s41580-022-00562-y. ISSN 1471-0080. Процитовано 10 червня 2023.
- ↑ Clifford, Tanner; Finkel, Zachary; Rodriguez, Brianna; Joseph, Adelina; Cai, Li (2023-01). Current Advancements in Spinal Cord Injury Research—Glial Scar Formation and Neural Regeneration. Cells (англ.). Т. 12, № 6. с. 853. doi:10.3390/cells12060853. ISSN 2073-4409. PMC 10046908. PMID 36980193. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Poplawski, Gunnar HD; Tuszynski, Mark H (2020-01). Regeneration of Corticospinal Axons into Neural Progenitor Cell Grafts After Spinal Cord Injury. Neuroscience Insights (англ.). Т. 15. с. 263310552097400. doi:10.1177/2633105520974000. ISSN 2633-1055. PMC 7691939. PMID 33283187. Процитовано 10 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Cao, Liying; Wang, Yongjie; Huang, Zhihui (1 лютого 2021). Reversion of Injured Adult Neurons to an Embryonic State by Grafts of Neural Progenitor Cells After Spinal Cord Injury. Neuroscience Bulletin (англ.). Т. 37, № 2. с. 271—274. doi:10.1007/s12264-020-00584-6. ISSN 1995-8218. PMC 7870728. PMID 32968955. Процитовано 10 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Tanikawa, Satoshi; Ebisu, Yuki; Sedlačík, Tomáš; Semba, Shingo; Nonoyama, Takayuki; Kurokawa, Takayuki; Hirota, Akira; Takahashi, Taiga; Yamaguchi, Kazushi (14 лютого 2023). Engineering of an electrically charged hydrogel implanted into a traumatic brain injury model for stepwise neuronal tissue reconstruction. Scientific Reports (англ.). Т. 13, № 1. с. 2233. doi:10.1038/s41598-023-28870-z. ISSN 2045-2322. Процитовано 30 грудня 2023.
- ↑ а б в Varadarajan, Supraja G.; Hunyara, John L.; Hamilton, Natalie R.; Kolodkin, Alex L.; Ендрю Губерман (2022-01). Central nervous system regeneration. Cell. Т. 185, № 1. с. 77—94. doi:10.1016/j.cell.2021.10.029. ISSN 0092-8674. Процитовано 30 грудня 2023.
- ↑ Wang, Xue-Wei; Li, Qiao; Liu, Chang-Mei; Hall, Philip A.; Jiang, Jing-Jing; Katchis, Christopher D.; Kang, Sehwa; Dong, Bryan C.; Li, Shuxin (2018-09). Lin28 Signaling Supports Mammalian PNS and CNS Axon Regeneration. Cell Reports. Т. 24, № 10. с. 2540—2552.e6. doi:10.1016/j.celrep.2018.07.105. ISSN 2211-1247. PMC 6173831. PMID 30184489. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Nathan, Fatima M.; Ohtake, Yosuke; Wang, Shuo; Jiang, Xinpei; Sami, Armin; Guo, Hua; Zhou, Feng-Quan; Li, Shuxin (2020-08). Upregulating Lin28a Promotes Axon Regeneration in Adult Mice with Optic Nerve and Spinal Cord Injury. Molecular Therapy. Т. 28, № 8. с. 1902—1917. doi:10.1016/j.ymthe.2020.04.010. ISSN 1525-0016. PMC 7403348. PMID 32353321. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Weng, Yi-Lan; An, Ran; Cassin, Jessica; Joseph, Jessica; Mi, Ruifa; Wang, Chen; Zhong, Chun; Jin, Seung-Gi; Pfeifer, Gerd P. (2017-04). An Intrinsic Epigenetic Barrier for Functional Axon Regeneration. Neuron. Т. 94, № 2. с. 337—346.e6. doi:10.1016/j.neuron.2017.03.034. ISSN 0896-6273. PMC 6007997. PMID 28426967. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Liao, Menghui; Cui, Qingyue; Hu, Yangnan; Xing, Jiayue; Wu, Danqi; Zheng, Shasha; Zhao, Yu; Yu, Yafeng; Sun, Jingwu (2024-02). Recent advances in the application of MXenes for neural tissue engineering and regeneration. Neural Regeneration Research (амер.). Т. 19, № 2. с. 258. doi:10.4103/1673-5374.379037. ISSN 1673-5374. PMC 10503607. PMID 37488875. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Chen, Zhenni; Sun, Zheng; Fan, Yongheng; Yin, Man; Jin, Chen; Guo, Bo; Yin, Yanyun; Quan, Rui; Zhao, Shuaijing (26 грудня 2023). Mimicked Spinal Cord Fibers Trigger Axonal Regeneration and Remyelination after Injury. ACS Nano (англ.). Т. 17, № 24. с. 25591—25613. doi:10.1021/acsnano.3c09892. ISSN 1936-0851. Процитовано 30 грудня 2023.
- ↑ Villanueva-Flores, Francisca; Garcia-Atutxa, Igor; Santos, Arturo; Armendariz-Borunda, Juan (2023-06). Toward a New Generation of Bio-Scaffolds for Neural Tissue Engineering: Challenges and Perspectives. Pharmaceutics (англ.). Т. 15, № 6. с. 1750. doi:10.3390/pharmaceutics15061750. ISSN 1999-4923. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Ko, J; Mohtaram NK; Ahmed F та ін. (September 2013). Fabrication of poly (ϵ-caprolactone) microfiber scaffolds with varying topography and mechanical properties for stem cell-based tissue engineering applications. Journal of Biomaterials Science, Polymer Edition. 25 (1): 1—17. doi:10.1080/09205063.2013.830913. PMID 23998440.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ Huang, Wen-Hui; Ding, Sheng-Long; Zhao, Xi-Yuan; Li, Kai; Guo, Hai-Tao; Zhang, Ming-Zhu; Gu, Qi (1 червня 2023). Collagen for neural tissue engineering: Materials, strategies, and challenges. Materials Today Bio. Т. 20. с. 100639. doi:10.1016/j.mtbio.2023.100639. ISSN 2590-0064. PMC 10183670. PMID 37197743. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Harley-Troxell, Meaghan E.; Steiner, Richard; Advincula, Rigoberto C.; Anderson, David E.; Dhar, Madhu (2023-01). Interactions of Cells and Biomaterials for Nerve Tissue Engineering: Polymers and Fabrication. Polymers (англ.). Т. 15, № 18. с. 3685. doi:10.3390/polym15183685. ISSN 2073-4360. PMC 10536046. PMID 37765540. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Xu, Dongyu; Zhang, Hui; Wang, Yu; Zhang, Yuan; Ye, Fanglei; Lu, Ling; Chai, Renjie (2023-05). Piezoelectric biomaterials for neural tissue engineering. Smart Medicine (англ.). Т. 2, № 2. doi:10.1002/SMMD.20230002. ISSN 2751-1871. Процитовано 30 грудня 2023.
- ↑ Sheen, V. L.; Arnold, M. W.; Wang, Y.; Macklis, J. D. (July 1999). Neural precursor differentiation following transplantation into neocortex is dependent on intrinsic developmental state and receptor competence. Experimental Neurology. 158 (1): 47—62. doi:10.1006/exnr.1999.7104. PMID 10448417.
- ↑ Copi, A; Jungling, K.; Gottmann, K. (November 2005). Activity- and BDNF-induced plasticity of miniature synaptic currents in ES cell-derived neurons integrated in a neocortical network. Journal of Neurophysiology. 94 (6): 4538—43. doi:10.1152/jn.00155.2005. PMID 16293594.
- ↑ Nigmatullin, Rinat; Taylor, Caroline S; Basnett, Pooja; Lukasiewicz, Barbara; Paxinou, Alexandra; Lizarraga-Valderrama, Lorena R; Haycock, John W; Roy, Ipsita (1 січня 2023). Medium chain length polyhydroxyalkanoates as potential matrix materials for peripheral nerve regeneration. Regenerative Biomaterials. Т. 10. doi:10.1093/rb/rbad063. ISSN 2056-3426. PMC 10369215. PMID 37501678. Процитовано 5 серпня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Rigoni, Michela; Negro, Samuele (2020-08). Signals Orchestrating Peripheral Nerve Repair. Cells (англ.). Т. 9, № 8. с. 1768. doi:10.3390/cells9081768. ISSN 2073-4409. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Li, Rui; Li, Duo-hui; Zhang, Hong-yu; Wang, Jian; Li, Xiao-kun; Xiao, Jian (2020-10). Growth factors-based therapeutic strategies and their underlying signaling mechanisms for peripheral nerve regeneration. Acta Pharmacologica Sinica (англ.). Т. 41, № 10. с. 1289—1300. doi:10.1038/s41401-019-0338-1. ISSN 1745-7254. Процитовано 30 грудня 2023.
- ↑ Qian, Yun; Lin, Han; Yan, Zhiwen; Shi, Jianlin; Fan, Cunyi (1 грудня 2021). Functional nanomaterials in peripheral nerve regeneration: Scaffold design, chemical principles and microenvironmental remodeling. Materials Today. Т. 51. с. 165—187. doi:10.1016/j.mattod.2021.09.014. ISSN 1369-7021. Процитовано 30 грудня 2023.
- ↑ Li, Yin; Ma, Zhenjiang; Ren, Ya; Lu, Dezhi; Li, Tao; Li, Wentao; Wang, Jinwu; Ma, Hui; Zhao, Jie (2021). Tissue Engineering Strategies for Peripheral Nerve Regeneration. Frontiers in Neurology. Т. 12. doi:10.3389/fneur.2021.768267/full. ISSN 1664-2295. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Khaled, Mona M; Ibrahium, Asmaa M; Abdelgalil, Ahmed I; El-Saied, Mohamed A.; El-Bably, Samah H (2023-10). Regenerative Strategies in Treatment of Peripheral Nerve Injuries in Different Animal Models. Tissue Engineering and Regenerative Medicine (англ.). Т. 20, № 6. с. 839—877. doi:10.1007/s13770-023-00559-4. ISSN 1738-2696. PMC 10519924. PMID 37572269. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Escobar, Ane; Carvalho, Mariana R.; Silva, Tiago H.; Reis, Rui L.; Oliveira, J. Miguel (18 квітня 2023). Longitudinally aligned inner-patterned silk fibroin conduits for peripheral nerve regeneration. In vitro models (англ.). Т. 2, № 5. с. 195—205. doi:10.1007/s44164-023-00050-3. ISSN 2731-3441. Процитовано 30 грудня 2023.
- ↑ Murphy, Ralph N. A.; Rogers, Steven K.; Bhatti, Waqar; Wong, Jason K.; Reid, Adam J. (13 вересня 2023). A pilot prospective cohort study using experimental quantification of early peripheral nerve regeneration with high-frequency three-dimensional tomographic ultrasound (HFtUS). Scientific Reports (англ.). Т. 13, № 1. с. 15175. doi:10.1038/s41598-023-42230-x. ISSN 2045-2322. Процитовано 30 грудня 2023.
- ↑ Carvalho, Cristiana R.; Oliveira, Joaquim M.; Reis, Rui L. (2019). Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. Т. 7. doi:10.3389/fbioe.2019.00337/full. ISSN 2296-4185. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Gong, Bowen; Zhang, Xindan; Zahrani, Ahmed Al; Gao, Wenwen; Ma, Guolin; Zhang, Liqun; Xue, Jiajia (2022-06). Neural tissue engineering: From bioactive scaffolds and in situ monitoring to regeneration. Exploration (англ.). Т. 2, № 3. с. 20210035. doi:10.1002/EXP.20210035. ISSN 2766-2098. Процитовано 14 лютого 2023.
- ↑ Daeschler, Simeon C.; Feinberg, Konstantin; Harhaus, Leila; Kneser, Ulrich; Gordon, Tessa; Borschel, Gregory H. (2023-01). Advancing Nerve Regeneration: Translational Perspectives of Tacrolimus (FK506). International Journal of Molecular Sciences (англ.). Т. 24, № 16. с. 12771. doi:10.3390/ijms241612771. ISSN 1422-0067. PMC 10454725. PMID 37628951. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Xu, Xiong; Song, Lili; Li, Yueying; Guo, Jin; Huang, Shuo; Du, Shuang; Li, Weizhen; Cao, Rangjuan; Cui, Shusen (17 жовтня 2023). Neurotrophin-3 promotes peripheral nerve regeneration by maintaining a repair state of Schwann cells after chronic denervation via the TrkC/ERK/c-Jun pathway. Journal of Translational Medicine (англ.). Т. 21, № 1. doi:10.1186/s12967-023-04609-2. ISSN 1479-5876. PMC 10583391. PMID 37848983. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Sundaram, Venkat Krishnan; Schütza, Vlad; Schröter, Nele H.; Backhaus, Aline; Bilsing, Annika; Joneck, Lisa; Seelbach, Anna; Mutschler, Clara; Gomez-Sanchez, Jose A. (2023-12). Adipo-glial signaling mediates metabolic adaptation in peripheral nerve regeneration. Cell Metabolism. Т. 35, № 12. с. 2136—2152.e9. doi:10.1016/j.cmet.2023.10.017. ISSN 1550-4131. PMC 10722468. PMID 37989315. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Jin, Max Y.; Weaver, Tristan E.; Farris, Adam; Gupta, Mayank; Abd-Elsayed, Alaa (2023-04). Neuromodulation for Peripheral Nerve Regeneration: Systematic Review of Mechanisms and In Vivo Highlights. Biomedicines (англ.). Т. 11, № 4. с. 1145. doi:10.3390/biomedicines11041145. ISSN 2227-9059. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Le, Elliot L. H.; Iorio, Matthew L.; Greyson, Mark A. (9 жовтня 2023). Targeted muscle reinnervation in upper extremity amputations. European Journal of Orthopaedic Surgery & Traumatology (англ.). doi:10.1007/s00590-023-03736-2. ISSN 1432-1068. Процитовано 30 грудня 2023.
- ↑ Shin, Ashley; Fracol, Megan; Roubaud, Margaret S. (2023-11). Targeted Muscle Reinnervation and Regenerative Peripheral Nerve Interfaces for Prophylactic Pain Control in Neurofibromatosis Type 1 Amputees. Plastic and Reconstructive Surgery - Global Open (англ.). Т. 11, № 11. с. e5405. doi:10.1097/GOX.0000000000005405. ISSN 2169-7574. PMC 10659716. PMID 38025622. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Mauch, Jaclyn T.; Kao, Dennis S.; Friedly, Janna L.; Liu, Yusha (2023-11). Targeted muscle reinnervation and regenerative peripheral nerve interfaces for pain prophylaxis and treatment: A systematic review. PM&R (англ.). Т. 15, № 11. с. 1457—1465. doi:10.1002/pmrj.12972. ISSN 1934-1482. Процитовано 30 грудня 2023.
- ↑ Tai, Youyi; Tonmoy, Thamidul Islam; Win, Shwe; Brinkley, Natasha T.; Park, B. Hyle; Nam, Jin (17 жовтня 2023). Enhanced peripheral nerve regeneration by mechano-electrical stimulation. npj Regenerative Medicine (англ.). Т. 8, № 1. с. 1—14. doi:10.1038/s41536-023-00334-y. ISSN 2057-3995. Процитовано 30 грудня 2023.
- ↑ Velicky, Philipp; Miguel, Eder; Michalska, Julia M.; Lyudchik, Julia; Wei, Donglai; Lin, Zudi; Watson, Jake F.; Troidl, Jakob; Beyer, Johanna (2023-08). Dense 4D nanoscale reconstruction of living brain tissue. Nature Methods (англ.). Т. 20, № 8. с. 1256—1265. doi:10.1038/s41592-023-01936-6. ISSN 1548-7105. Процитовано 30 грудня 2023.
- ↑ а б Eichmüller, Oliver L.; Knoblich, Juergen A. (2022-11). Human cerebral organoids — a new tool for clinical neurology research. Nature Reviews Neurology (англ.). Т. 18, № 11. с. 661—680. doi:10.1038/s41582-022-00723-9. ISSN 1759-4766. Процитовано 13 червня 2023.
- ↑ Setia, Harpreet; Muotri, Alysson R. (1 листопада 2019). Brain organoids as a model system for human neurodevelopment and disease. Seminars in Cell & Developmental Biology (англ.). Т. 95. с. 93—97. doi:10.1016/j.semcdb.2019.03.002. ISSN 1084-9521. PMC 6755075. PMID 30904636. Процитовано 13 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Trujillo, Cleber A.; Muotri, Alysson R. (2018-12). Brain Organoids and the Study of Neurodevelopment. Trends in Molecular Medicine. Т. 24, № 12. с. 982—990. doi:10.1016/j.molmed.2018.09.005. ISSN 1471-4914. PMC 6289846. PMID 30377071. Процитовано 13 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Xu, Jie; Wen, Zhexing (10 вересня 2021). Brain Organoids: Studying Human Brain Development and Diseases in a Dish. Stem Cells International (англ.). Т. 2021. с. e5902824. doi:10.1155/2021/5902824. ISSN 1687-966X. PMC 8448601. PMID 34539790. Процитовано 13 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Sun, Nan; Meng, Xiangqi; Liu, Yuxiang; Song, Dan; Jiang, Chuanlu; Cai, Jinquan (22 квітня 2021). Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science (англ.). Т. 28, № 1. doi:10.1186/s12929-021-00728-4. ISSN 1423-0127. PMC 8063318. PMID 33888112. Процитовано 13 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Gabriel, Elke; Albanna, Walid; Pasquini, Giovanni; Ramani, Anand; Josipovic, Natasa; Mariappan, Aruljothi; Riparbelli, Maria Giovanna; Callaini, Giuliano; Karch, Celeste M. (2023-06). Generation of iPSC-derived human forebrain organoids assembling bilateral eye primordia. Nature Protocols (англ.). Т. 18, № 6. с. 1893—1929. doi:10.1038/s41596-023-00814-x. ISSN 1750-2799. Процитовано 5 серпня 2023.
- ↑ а б Smirnova, Lena; Caffo, Brian S.; Gracias, David H.; Huang, Qi; Morales Pantoja, Itzy E.; Tang, Bohao; Zack, Donald J.; Berlinicke, Cynthia A.; Boyd, J. Lomax (28 лютого 2023). Organoid intelligence (OI): the new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science. Т. 1. с. 1017235. doi:10.3389/fsci.2023.1017235.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Organoid intelligence: a new biocomputing frontier. Frontiers (англ.). Процитовано 23 червня 2023.
- ↑ а б Thomas Hartung and colleagues | The future of organoid intelligence | Frontiers Forum Deep Dive 2023 (uk-UA) , процитовано 3 вересня 2023
- ↑ Niikawa, Takuya; Hayashi, Yoshiyuki; Shepherd, Joshua; Sawai, Tsutomu (2022-04). Human Brain Organoids and Consciousness. Neuroethics (англ.). Т. 15, № 1. doi:10.1007/s12152-022-09483-1.
- ↑ de Jongh, Dide; Massey, Emma K.; the VANGUARD consortium; Berishvili, Ekaterine; Fonseca, Laura Mar; Lebreton, Fanny; Bellofatto, Kevin; Bignard, Juliette; Seissler, Jochen (2022-12). Organoids: a systematic review of ethical issues. Stem Cell Research & Therapy (англ.). Т. 13, № 1. doi:10.1186/s13287-022-02950-9.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Lavazza, Andrea; Chinaia, Alice Andrea (1 квітня 2023). Human cerebral organoids: the ethical stance of scientists. Stem Cell Research & Therapy (англ.). Т. 14, № 1. doi:10.1186/s13287-023-03291-x.
{{cite news}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Jeziorski, Jacob; Brandt, Reuven; Evans, John H.; Campana, Wendy; Kalichman, Michael; Thompson, Evan; Goldstein, Lawrence; Koch, Christof; Muotri, Alysson R. (30 липня 2023). Brain organoids, consciousness, ethics and moral status. Seminars in Cell & Developmental Biology. Т. 144. с. 97—102. doi:10.1016/j.semcdb.2022.03.020.
- ↑ Cai, Hongwei; Ao, Zheng; Tian, Chunhui; Wu, Zhuhao; Liu, Hongcheng; Tchieu, Jason; Gu, Mingxia; Mackie, Ken; Guo, Feng (11 грудня 2023). Brain organoid reservoir computing for artificial intelligence. Nature Electronics (англ.). с. 1—8. doi:10.1038/s41928-023-01069-w. ISSN 2520-1131. Процитовано 12 грудня 2023.
- ↑ Albanese, Alexandre; Swaney, Justin M.; Yun, Dae Hee; Evans, Nicholas B.; Antonucci, Jenna M. та ін. (8 грудня 2020). Multiscale 3D phenotyping of human cerebral organoids. Scientific Reports (англ.). Т. 10, № 1. doi:10.1038/s41598-020-78130-7.
{{cite news}}: Явне використання «та ін.» у:|first5=(довідка) - ↑ а б в Revah, Omer; Gore, Felicity; Kelley, Kevin W.; Andersen, Jimena; Sakai, Noriaki; Chen, Xiaoyu; Li, Min-Yin; Birey, Fikri; Yang, Xiao (2022-10). Maturation and circuit integration of transplanted human cortical organoids. Nature (англ.). Т. 610, № 7931. с. 319—326. doi:10.1038/s41586-022-05277-w. ISSN 1476-4687. Процитовано 3 травня 2023.
- ↑ Crouch, Elizabeth E.; Joseph, Tara; Marsan, Elise; Huang, Eric J. (2023-05). Disentangling brain vasculature in neurogenesis and neurodegeneration using single-cell transcriptomics. Trends in Neurosciences. doi:10.1016/j.tins.2023.04.007. ISSN 0166-2236. Процитовано 13 червня 2023.
- ↑ Quezada, Alexandra; Ward, Claire; Bader, Edward R.; Zolotavin, Pavlo; Altun, Esra; Hong, Sarah; Killian, Nathaniel J.; Xie, Chong; Batista-Brito, Renata (2023-02). An In Vivo Platform for Rebuilding Functional Neocortical Tissue. Bioengineering (англ.). Т. 10, № 2. с. 263. doi:10.3390/bioengineering10020263. ISSN 2306-5354. PMC 9952056. PMID 36829757. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Wang, Hongkui; Zhang, Ping; Lu, Panjian; Cai, Xiaodong; Wang, Gang; Xu, Xi; Liu, Ying; Huang, Tianyi; Li, Meiyuan (1 серпня 2023). Neural tissue-engineered prevascularization in vivo enhances peripheral neuroregeneration via rapid vascular inosculation. Materials Today Bio. Т. 21. с. 100718. doi:10.1016/j.mtbio.2023.100718. ISSN 2590-0064. PMC 10339252. PMID 37455820. Процитовано 30 грудня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ а б Jgamadze, Dennis; Lim, James T.; Zhang, Zhijian; Harary, Paul M.; Germi, James; Mensah-Brown, Kobina; Adam, Christopher D.; Mirzakhalili, Ehsan; Singh, Shikha (2 лютого 2023). Structural and functional integration of human forebrain organoids with the injured adult rat visual system. Cell Stem Cell (English) . Т. 30, № 2. с. 137—152.e7. doi:10.1016/j.stem.2023.01.004. ISSN 1934-5909. PMC 9926224. PMID 36736289. Процитовано 15 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Wang, Meiyan; Gage, Fred H.; Schafer, Simon T. (2023-04). Transplantation Strategies to Enhance Maturity and Cellular Complexity in Brain Organoids. Biological Psychiatry. Т. 93, № 7. с. 616—621. doi:10.1016/j.biopsych.2023.01.004. ISSN 0006-3223. Процитовано 2 травня 2023.
- ↑ Cao, Shi-Ying; Yang, Di; Huang, Zhen-Quan; Lin, Yu-Hui; Wu, Hai-Yin; Chang, Lei; Luo, Chun-Xia; Xu, Yun; Liu, Yan (30 травня 2023). Cerebral organoids transplantation repairs infarcted cortex and restores impaired function after stroke. npj Regenerative Medicine (англ.). Т. 8, № 1. doi:10.1038/s41536-023-00301-7. ISSN 2057-3995. PMC 10229586. PMID 37253754. Процитовано 10 червня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання)