Рак печінки
| Ця стаття містить правописні, лексичні, граматичні, стилістичні або інші мовні помилки, які треба виправити. (січень 2020) |
| Рак печінки | |
|---|---|
 МРТ знімок печінки хворого на холангіокарциному | |
| Спеціальність | онкологія |
| Симптоми | жовтяниця, біль у животі, схуднення і гепатомегалія |
| Причини | цироз печінки і Афлатоксини |
| Метод діагностики | КТ, ультразвукове дослідження, МРТ, ендоскопічна ретроградна холангіопанкреатографія, percutaneous transhepatic cholangiographyd, magnetic resonance cholangiopancreatographyd, біопсія печінкиd і біохімічний аналіз крові |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 2C12.0 |
| OMIM | 114550 |
| | |
Рак печінки — злоякісна пухлина, яка формується в печінці.[1] Рак, який поширився з інших місць на печінку, відомий як метастази в печінці, є більш поширеним, ніж той, що починається в печінці.[2] Симптоми раку печінки можуть включати біль у правому боці під грудною кліткою, асцит, жовтяницю, втрату ваги, зниження апетиту та слабкість.
Частою причиною раку печінки є цироз внаслідок гепатиту В, гепатиту С або зловживання алкоголем.[3] Інші причини включають афлатоксин, неалкогольний стеатогепатит.[2] Найпоширенішим видом є гепатоцелюлярна карцинома, яка виникає найчастіше внаслідок гепатитів C і B. Становить до 80 % випадків раку печінки. Холангіокарцинома виникає з епітелію жовчних протоків, часто через опісторхоз і клонорхоз. Менш поширеними є муцинозно-кістозне новоутворення та інтрадуктальне папілярне біліарне новоутворення. Діагноз може бути підтверджений за допомогою аналізів крові та медичних зображень з підтвердженням біопсії тканини.[1]
Профілактичні заходи містять в собі імунізацію проти гепатиту В і лікуванні осіб, вже інфікованих вірусами гепатиту B або C.[2] Періодичне обстеження рекомендується хворим на хронічні захворювання печінки. Варіанти лікування можуть включати хірургічне втручання, хіміотерапію та променеву терапію.[1] У певних випадках може застосовуватися абляційна терапія, емболізаційна терапія або трансплантація печінки.
Первинний рак печінки у світі є шостим за частотою діагностування раком (6 %) і другою провідною причиною смерті від раку (9 %).[2][4] У 2018 році рак печінки був діагностований у 841 000 людей та призвів до загибелі 782 000 людей.[5] У 2015 році 263 000 смертей від раку печінки були наслідком гепатиту В, 245 000 — від зловживання алкоголем та 167 000 — від гепатиту С.[6] Найвищі показники раку печінки реєструються там, де поширені гепатити В та С, включаючи Азію та Субсахарську Африку. Чоловіки частіше уражаються гепатоцелюлярною карциномою, ніж жінки. Хвороба найчастіше зустрічається в людей, віком від 55 до 65 років. П'ятирічний рейтинг виживання становить 18 % у США.[7]
Оскільки рак печінки є парасольковим терміном для багатьох видів раку, ознаки та симптоми залежать від того, яким є тип раку. Холангіокарцинома пов'язана з пітливістю, жовтяницею, болем у животі, втратою ваги та збільшенням печінки.[8] Гепатоцелюлярна карцинома пов'язана зі зміною маси живота, болем у животі, блювотою, анемією, болями в спині, жовтяницею, сверблячкою, втратою ваги та гарячкою.[9]

Вірусна інфекція або вірус гепатиту С, або вірус гепатиту В є головною причиною раку печінки на сьогодні, що становить 80 % гепатоцелюлярної карциноми.[10][11][12] Віруси викликають гепатоцелюлярну карциному через те, що всередині печінки виникає масове запалення, фіброз та можливий цироз. Гепатоцелюлярна карцинома, як правило, виникає після цирозу, з річною захворюваністю у пацієнтів, інфікованих циротичним вірусом гепатиту С, що становить 1,7 %.[13] Близько 5-10 % людей, які заражаються вірусом гепатиту В, стають хронічними носіями, і близько 30 % з них набувають хронічних захворювань печінки, що може призвести до виникнення гепатоцелюлярної карциноми. Інфекція гепатиту В також пов'язана з холангіокарциномою.[14] Роль вірусів, відмінних від гепатиту С або гепатиту В, у раку печінки набагато менш зрозуміла, хоча є деякі докази того, що спільне зараження вірусом гепатиту С та вірусом гепатиту D може збільшити ризик виникнення гепатоцелюлярної карциноми.[15]
Багато генетичних та епігенетичних змін утворюються в клітинах печінки під час інфекцій гепатиту С та гепатиту В, що є головним фактором при утворенні пухлин печінки. Віруси індукують злоякісні зміни в клітинах, змінюючи метилювання генів, впливаючи на експресію генів, сприяючи або пригнічуючи шляхи передачі клітинного сигналу. Роблячи це, віруси можуть перешкоджати клітинам зазнавати запрограмованої форми загибелі клітин (апоптоз) та сприяти реплікації вірусу та їх персистенції.[10][13]
Гепатит В та гепатит С також індукують злоякісні зміни, викликаючи пошкодження ДНК та геномну нестабільність. Це створюється реактивними видами кисню, експресуються білками, які перешкоджають відновленню ферментів ДНК, а гепатит С викликає активацію мутаторного ферменту.[16][17]
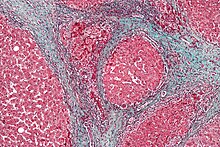
Окрім вірусного цирозу, описаного вище, інші причини цирозу можуть призвести до гепатоцелюлярної карциноми. Споживання алкоголю співвідноситься з ризиком виникнення гепатоцелюлярної карциноми, і ризик набагато більший в осіб з алкогольною індукцією цирозу печінки. Існує кілька розладів, які, як відомо, викликають цироз і призводять до раку, включаючи спадковий гемохроматоз та первинний біліарний цироз.[18]
Вплив афлатоксину може призвести до розвитку гепатоцелюлярної карциноми. Афлатоксини — це група хімічних речовин, що виробляються грибами Aspergillus flavus (назва походить від A. flavus токсину) та A. parasiticus. Забруднення їжею грибами призводить до потрапляння в організм дуже токсичних для печінки хімічних речовин. Поширеними харчовими продуктами, які є забрудненими токсинами — це крупи, арахіс та інші овочі. Забруднення їжі поширене в Африці, Південно-Східній Азії та Китаї. Одночасне зараження ВГВ та опроміненням афлатоксином збільшує ризик раку печінки більш ніж утричі, ніж спостерігається у людей, інфікованих ВГВ, без впливу афлатоксином. Механізм, за допомогою якого афлатоксини викликають рак, відбувається через мутації та епігенетичні зміни. Афлатоксини індукують спектр мутацій[19][20] включаючи дуже часту мутацію в генному супресорі пухлини p53. Мутація p53, імовірно, спільно з іншими мутаціями, спричиненими афлатоксином, та епігенетичними змінами[21], ймовірно, є частою причиною канцерогенезу, спричиненого афлатоксином.
- Диспластичні вузли високого ступеня є передраковими ураженнями печінки. Протягом двох років існує ризик виникнення раку, що виникає внаслідок цих вузликів, на 30-40 %.[22]
- Ожиріння стало важливим фактором ризику, оскільки може призвести до стеатогепатиту.[12][23]
- Діабет збільшує ризик виникнення гепатоцелюлярної карциноми.
- Куріння збільшує ризик виникнення гепатоцелюлярної карциноми, порівняно з не курцями та колишніми курцями.
- У людей з первинним склерозуючим холангітом існує близько 5-10 % ризику холангіокарциноми протягом життя.[24]
- Інфекція печінкового грипу збільшує ризик виникнення холангіокарциноми, Таїланд має особливо високі показники раку печінки.[25]
Підвищений ризик раку печінки у дітей може бути спричинений синдромом Беквіта-Відемана (пов'язаним з гепатобластомою),[26] сімейним аденоматозним поліпозом (асоційованим з гепатобластомою),[27] низькою вагою при народженні (пов'язаною з гепатобластомою),[28] Прогресуючий сімейний внутрішньопечінковий холестаз (асоційований з гепатоцелюлярною карциномою.)[29] та трисомія 18 (пов'язаний з гепатобластомою).
Багато способів візуалізації використовуються для діагностики первинного раку печінки. Для гепатоцелюлярної карциноми вони включають сонографію (УЗД), комп'ютерну томографію (КТ) та магнітно-резонансну томографію (МРТ). При візуалізації печінки за допомогою ультразвуку розмір більше 2 см має більше ніж 95 % шанс бути гепатоцелюлярною карциномою. Більшість холангіокарцими зустрічаються в області холодного відділу печінки і часто є непрохідністю жовчних проток. Якщо причина непрохідності є підозрою на злоякісну, застосовують ендоскопічну ретроградну холангіопанкреатографію, УЗД, КТ, МРТ та магнітно-резонансну холангіопанкреатографію.[30]
Пухлинні маркери, хімічні речовини, які іноді виявляються в крові людей, хворих на рак, можуть бути корисними для діагностики та моніторингу перебігу раку печінки. Високий рівень альфа-фетопротеїну (АФП) в крові можна виявити у багатьох випадках гепатоцелюлярної карциноми та внутрішньопечінкової холангіокарциноми. Холангіокарциному можна виявити за допомогою таких часто використовуваних пухлинних маркерів: вуглеводного антигену 19-9, карциноембріонального антигену та ракового антигену 125. Ці пухлинні маркери виявляються при первинних раках печінки, а також при інших ракових захворюваннях (іноді й при доброякісних пухлинах печінки) та деяких інших порушеннях.[31][32]
Найчастішим раком печінки, який становить приблизно 75 % усіх первинних ракових захворювань печінки, є гепатоцелюлярна карцинома (також названа гепатомою, що є неправильним явищем, оскільки аденоми зазвичай доброякісні). Гепатоцелюлярна карцинома — рак, утворений клітинами печінки, відомими як гепатоцити, які стають злоякісними. Ще одним типом раку, що утворюється клітинами печінки, є гепатобластома, яка спеціально утворюється незрілими клітинами печінки.[33] Це рідкісна злоякісна пухлина, яка розвивається в першу чергу у дітей, і на неї припадає приблизно 1 % усіх онкологічних захворювань у дітей та 79 % усіх первинних ракових захворювань печінки у віці до 15 років. Більшість гепатобластоми утворюють у правій частці.[28]
Рак печінки може також виходити з інших структур всередині печінки, таких як жовчні протоки, кровоносні судини та імунні клітини. Рак жовчних проток (холангіокарцинома та холангіоцелюлярна цистаденокарцинома) становить приблизно 6 % первинних ракових захворювань печінки.[33] Існує також варіант типу гепатоцелюлярна карцинома, який складається як з гепатоцелюлярна карцинома, так і з холангіокарциноми.[34] Пухлини судин (ангіосаркома і гемангіоендотеліома), ембріональна саркома і фібросаркома виробляються з типу сполучної тканини, відомої як мезенхіма. Рак, що утворюється з м'язів печінки, — лейоміосаркома і рабдоміосаркома. Інші менш поширені ракові захворювання печінки включають карциносаркоми, тератоми, пухлини жовткового мішка, карциноїдні пухлини та лімфоми. У лімфом зазвичай є дифузна інфільтрація до печінки, але вона також може утворювати печінкову масу в рідкісних випадках.
Багато ракових захворювань, виявлених у печінці, не є справжніми раками печінки, а є раками з інших ділянок в організмі, які поширилися на печінку (відомі як метастази). Найчастіше місцем виникнення є шлунково-кишковий тракт, оскільки печінка близька до багатьох цих метаболічно активних, багатих кров'ю органів поруч із судинами та лімфатичними вузлами (такі як рак підшлункової залози, рак шлунка, рак товстої кишки та карциноїдні пухлини переважно апендикс), а також від раку молочної залози, раку яєчників, раку легенів, раку нирок, раку передміхурової залози.
Профілактику раку можна розділити на первинну, вторинну та третинну профілактику. Первинна профілактика запобігає зменшенню впливу ризику раку печінки. Однією з найуспішніших первинних профілактик раку печінки є вакцинація проти гепатиту В. Вакцинація проти вірусу гепатиту С наразі недоступна. Інші форми первинної профілактики спрямовані на обмеження передачі цих вірусів шляхом сприяння безпечній практиці ін'єкцій, скринінгу продуктів здачі крові та скринінгу безсимптомних осіб високого ризику. Вплив афлатоксину можна уникнути після врожаю після збирання врожаю для відлякування цвілі, що було ефективно на заході Африки. Зменшення зловживання алкоголем, ожиріння та діабет також знизили б рівень раку печінки. Контроль дієти при гемохроматозі може зменшити ризик перевантаження залізом, знизивши ризик раку.[35]
Вторинна профілактика включає як вилікування збудника, що бере участь у формуванні раку (канцерогенез), так і запобігання канцерогенезу, якщо це неможливо. Вилікувати людей, заражених вірусом, неможливо, але лікування противірусними препаратами, такими як інтерферон, може знизити ризик раку печінки. Хлорофілін може потенційно зменшувати ефекти афлатоксину.[35]
Третинна профілактика включає лікування, щоб запобігти рецидиву раку печінки. Сюди входить використання хіміотерапевтичних препаратів та противірусних препаратів.[35]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
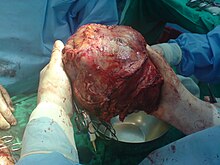
Часткова хірургічна резекція є оптимальним лікуванням гепатоцелюлярної карциноми (гепатоцелюлярна карцинома), коли пацієнти мають достатній запас функції печінки. Підвищений ризик виникнення ускладнень, таких як печінкова недостатність, може виникнути при резекції циротичних (тобто менш оптимальних функціональних) печінок. 5-річна виживаність після резекції значно покращилася за останні кілька десятиліть і зараз може перевищувати 50 %. Однак частота рецидивів після резекції може перевищувати 70 %, чи то через поширення початкової пухлини або утворення нових пухлин.[36] Трансплантація печінки також може бути розглянута у випадках ГХК, коли ця форма лікування може бути перенесена і пухлина відповідає конкретним критеріям (наприклад, міланським критеріям). Як правило, пацієнти, які розглядаються за трансплантацію печінки, мають множинні ураження печінки, важку основну дисфункцію печінки або те і інше. Менш ніж 30-40 % людей з ХСК мають право на операцію та трансплантацію, оскільки рак часто виявляється на пізній стадії. Крім того, гепатоцелюлярна карцинома може прогресувати під час очікування трансплантації печінки, що може запобігти пересадці через суворі критерії.
Черезшкірна абляція — єдине нехірургічне лікування, яке може запропонувати. Існує багато форм черезшкірної абляції, які складаються з введення хімічних речовин у печінку (етанол або оцтова кислота) або з утворенням крайніх температур за допомогою радіочастотної абляції, мікрохвильових печей, лазерів або кріотерапії. З них радіочастотна абляція має одну з найкращих репутацій у гепатоцелюлярна карцинома, але обмеження включають неможливість лікування пухлин, близьких до інших органів та кровоносних судин, через тепловіддачу та ефект тепловідведення відповідно.[37][38] Крім того, довгострокові результати процедур черезшкірної абляції для гепатоцелюлярної карциноми недостатньо вивчені. Взагалі, хірургічна операція є кращим способом лікування, коли це можливо.
Системні хіміотерапевтичні засоби не застосовуються звичайно в гепатоцелюлярна карцинома, хоча місцева хіміотерапія може застосовуватися в процедурі, відомій як трансартеріальна хіміоемболізація. У цій процедурі вводять цитотоксичні препарати, такі як доксорубіцин або цисплатин з ліпіодолом, а артерії, що постачають печінку, блокуються желатиновою губкою або іншими частинками. Оскільки більшість системних препаратів не мають ефективності в лікуванні гепатоцелюлярна карцинома, дослідження молекулярних шляхів, що беруть участь у виробництві раку печінки, виробляли сорафеніб — препарат цільової терапії, який запобігає проліферації клітин та росту клітин крові. Сорафеніб отримав схвалення FDA для лікування запущеної гепатоцелюлярної карциноми в листопаді 2007 року.[39] Цей препарат забезпечує перевагу виживання для передових гепатоцелюлярна карцинома.[38]
Променева терапія не часто застосовується при ГХК, оскільки печінка не толерантна до радіації. Хоча за допомогою сучасних технологій можна забезпечити добре націлене випромінювання пухлини, мінімізуючи дозу для решти печінки. Подвійне лікування променевою терапією плюс хіміоемболізація, місцева хіміотерапія, системна хіміотерапія або препарати цільової терапії можуть виявити користь лише від променевої терапії.[40]

Резекція є варіантом при холангіокарциномі, але менше 30 % випадків холангіокарциноми піддаються діагностиці. Після операції частота рецидивів становить до 60 %.[41][42] Трансплантацію печінки можна застосовувати там, де часткова резекція не є можливою, а хіміопромененість додаткової речовини може спричинити користь у деяких випадках.[24]
60 % холангіокарциноми утворюються в перигілярній області, і фотодинамічна терапія може бути використана для поліпшення якості життя та часу виживання в цих нерозбірливих випадках. Фотодинамічна терапія — це нове лікування, яке використовує молекули, що активуються світлом, для лікування пухлини. Сполуки активуються в області пухлини лазерним світлом, що викликає виділення токсичних речовин реактивного кисню, вбиваючи пухлинні клітини.[41][43]
Системні хіміотерапії, такі як гемцитабін та цисплатин, іноді застосовуються в неоперабельних випадках холангіокарциноми.[24]
Радіочастотна абляція, трансартеріальна хіміоемболізація та внутрішня променева терапія (брахітерапія) демонструють перспективність у лікуванні холангіокарциноми.[42]
Променева терапія може застосовуватися в допоміжних умовах або для паліативного лікування холангіокарциноми.[44]
Видалення пухлини шляхом хірургічної резекції або трансплантації печінки можна використовувати при лікуванні гепатобластоми. У деяких випадках операція може запропонувати ліки. Хіміотерапія може застосовуватися до і після операції та трансплантації.[45]
Для системного лікування гепатобластоми застосовують хіміотерапію, включаючи цисплатин, вінкристин, циклофосфамід та доксорубіцин. З цих препаратів цисплатин, здається, є найбільш ефективним.[46]

В усьому світі Станом на 2010 рак печінки призвів до смерті 754 000 людей, порівняно з 460 000 у 1990 році, що робить його третьою провідною причиною смерті від раку після раку легенів і шлунку. У 2012 році він представляв 7 % діагностованих онкологічних захворювань у чоловіків, 5-й за найбільш часто діагностованим раком цього року.[47] З цих смертей 340 000 були вторинними від гепатиту В, 196 000 були вторинними від гепатиту С, а 150 000 — вторинними від алкоголю.[48] Гепатоцелюлярна карцинома, найпоширеніша форма раку печінки, демонструє неймовірне географічне поширення. У Китаї 50 % випадків гепатоцелюлярної карциноми в усьому світі, і понад 80 % від загальної кількості випадків трапляється в Субсахарській Африці або в Східній Азії через вірус гепатиту В.[25][49] Холангіокарцинома також має значне географічне поширення, в Таїланді найвищі показники в усьому світі через наявність печінкового грипу.[50]
Кількість нових випадків гепатоцелюлярної карциноми на рік в Індії у чоловіків становить близько 4,1, а у жінок — 1,2 на 100 000. Зазвичай він зустрічається у віці від 40 до 70 років.[51]
Рак печінки — це вісімнадцятий найпоширеніший рак у Великій Британії (у 2011 р. У Великій Британії діагностували близько 4 300 людей), і це дванадцята найпоширеніша причина смерті від раку (від цієї хвороби у 2012 році померло близько 4500 осіб).[52]
Рівень смертності від раку печінки для дорослих у віці від 25 років збільшився на 43 відсотки з 7,2 на 100 000 стандартного населення США у 2000 році до 10,3 у 2016 році. Рівень смертності від раку печінки збільшився на 43 відсотки з 10,5 у 2000 році до 15,0 у 2016 році для чоловіків і на 40 відсотків з 4,5 до 6,3 для жінок. Коефіцієнт смертності серед чоловіків був упродовж цього періоду від 2,0 до 2,5 разів.[53]
Гепкортеспенлізимут-L — це пероральна імунотерапія, яка проходить фазу 3 клінічного випробування на гепатоцелюлярна карцинома.[54]
- ↑ а б в Adult Primary Liver Cancer Treatment (PDQ®)–Patient Version. NCI. 6 липня 2016. Архів оригіналу за 2 жовтня 2016. Процитовано 29 вересня 2016.
- ↑ а б в г World Cancer Report 2014. World Health Organization. 2014. с. Chapter 5.6. ISBN 978-9283204299.
- ↑ GBD 2013 Mortality and Causes of Death, Collaborators (17 грудня 2014). Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 385 (9963): 117—71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ↑ World Cancer Report 2014. World Health Organization. 2014. с. Chapter 1.1. ISBN 978-9283204299.
- ↑ Bray, F; Ferlay, J; Soerjomataram, I; Siegel, RL; Torre, LA; Jemal, A (November 2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians. 68 (6): 394—424. doi:10.3322/caac.21492. PMID 30207593.
- ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 жовтня 2016). Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 388 (10053): 1459—1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ↑ SEER Stat Fact Sheets: Liver and Intrahepatic Bile Duct Cancer. NCI. Архів оригіналу за 28 липня 2017. Процитовано 2016.
- ↑ Cholangiocarcinoma на eMedicine
- ↑ Liver tumors in Children. Boston Children's Hospital. Архів оригіналу за 4 червня 2011.
- ↑ а б Arzumanyan, A; Reis, HM; Feitelson, MA (February 2013). Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma. Nature Reviews. Cancer. 13 (2): 123—35. doi:10.1038/nrc3449. PMID 23344543.
- ↑ Rosen, HR (23 червня 2011). Clinical practice. Chronic hepatitis C infection. The New England Journal of Medicine. 364 (25): 2429—38. doi:10.1056/NEJMcp1006613. PMID 21696309.
- ↑ а б General Information About Adult Primary Liver Cancer. National Cancer Institute. 1 січня 1980. Архів оригіналу за 2 січня 2013. Процитовано 13 січня 2013.
- ↑ а б Jeong, SW; Jang, JY; Chung, RT (December 2012). Hepatitis C virus and hepatocarcinogenesis. Clinical and Molecular Hepatology. 18 (4): 347—56. doi:10.3350/cmh.2012.18.4.347. PMC 3540370. PMID 23323249.
- ↑ Ralphs, S; Khan, SA (May 2013). The role of the hepatitis viruses in cholangiocarcinoma. Journal of Viral Hepatitis. 20 (5): 297—305. doi:10.1111/jvh.12093. PMID 23565610.
- ↑ Kew, MC (March 2013). Hepatitis viruses (other than hepatitis B and C viruses) as causes of hepatocellular carcinoma: an update. Journal of Viral Hepatitis. 20 (3): 149—57. doi:10.1111/jvh.12043. PMID 23383653.
- ↑ Takeda H, Takai A, Inuzuka T, Marusawa H (2017). Genetic basis of hepatitis virus-associated hepatocellular carcinoma: linkage between infection, inflammation, and tumorigenesis. J. Gastroenterol. 52 (1): 26—38. doi:10.1007/s00535-016-1273-2. PMID 27714455.
- ↑ Yang, SF; Chang, CW; Wei, RJ; Shiue, YL; Wang, SN; Yeh, YT (2014). Involvement of DNA damage response pathways in hepatocellular carcinoma. BioMed Research International. 2014: 153867. doi:10.1155/2014/153867. PMC 4022277. PMID 24877058.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Fattovich, G; Stroffolini, T; Zagni, I; Donato, F (November 2004). Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 127 (5 Suppl 1): S35—50. doi:10.1053/j.gastro.2004.09.014. PMID 15508101.
- ↑ Smela ME, Currier SS, Bailey EA, Essigmann JM (April 2001). The chemistry and biology of aflatoxin B(1): from mutational spectrometry to carcinogenesis. Carcinogenesis. 22 (4): 535—45. doi:10.1093/carcin/22.4.535. PMID 11285186.
- ↑ Perduca V, Omichessan H, Baglietto L, Severi G (January 2018). Mutational and epigenetic signatures in cancer tissue linked to environmental exposures and lifestyle. Curr Opin Oncol. 30 (1): 61—67. doi:10.1097/CCO.0000000000000418. PMID 29076965.
- ↑ Dai Y, Huang K, Zhang B, Zhu L, Xu W (November 2017). Aflatoxin B1-induced epigenetic alterations: An overview. Food Chem. Toxicol. 109 (Pt 1): 683—689. doi:10.1016/j.fct.2017.06.034. PMID 28645871.
- ↑ Di Tommaso, L; Sangiovanni, A; Borzio, M; Park, YN; Farinati, F; Roncalli, M (April 2013). Advanced precancerous lesions in the liver. Best Practice & Research. Clinical Gastroenterology. 27 (2): 269—84. doi:10.1016/j.bpg.2013.03.015. PMID 23809245.
- ↑ Chuang SC, La Vecchia C, Boffetta P (1 грудня 2009). Liver cancer: descriptive epidemiology and risk factors other than HBV and HCV infection. Cancer Letters. 286 (1): 9—14. doi:10.1016/j.canlet.2008.10.040. PMID 19091458.
- ↑ а б в Razumilava, N; Gores, GJ (January 2013). Classification, diagnosis, and management of cholangiocarcinoma. Clinical Gastroenterology and Hepatology. 11 (1): 13—21.e1, quiz e3–4. doi:10.1016/j.cgh.2012.09.009. PMC 3596004. PMID 22982100.
- ↑ а б Jemal, A; Bray, F; Center, MM; Ferlay, J; Ward, E; Forman, D (Mar–Apr 2011). Global cancer statistics. CA: A Cancer Journal for Clinicians. 61 (2): 69—90. doi:10.3322/caac.20107. PMID 21296855.
- ↑ DeBaun, MR; Tucker, MA (March 1998). Risk of cancer during the first four years of life in children from The Beckwith-Wiedemann Syndrome Registry. The Journal of Pediatrics. 132 (3 Pt 1): 398—400. doi:10.1016/S0022-3476(98)70008-3. PMID 9544889.
- ↑ Spector, LG; Birch, J (November 2012). The epidemiology of hepatoblastoma. Pediatric Blood & Cancer. 59 (5): 776—9. doi:10.1002/pbc.24215. PMID 22692949.
- ↑ а б Emre, S; McKenna, GJ (December 2004). Liver tumors in children. Pediatric Transplantation. 8 (6): 632—8. doi:10.1111/j.1399-3046.2004.00268.x. PMID 15598339.
- ↑ Davit-Spraul, A; Gonzales, E; Baussan, C; Jacquemin, E (8 січня 2009). Progressive familial intrahepatic cholestasis. Orphanet Journal of Rare Diseases. 4: 1. doi:10.1186/1750-1172-4-1. PMC 2647530. PMID 19133130.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Ariff, B; Lloyd, CR; Khan, S; Shariff, M; Thillainayagam, AV; Bansi, DS; Khan, SA; Taylor-Robinson, SD; Lim, AK (21 березня 2009). Imaging of liver cancer. World Journal of Gastroenterology. 15 (11): 1289—300. doi:10.3748/wjg.15.1289. PMC 2658841. PMID 19294758.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Malaguarnera, G; Paladina, I; Giordano, M; Malaguarnera, M; Bertino, G; Berretta, M (2013). Serum markers of intrahepatic cholangiocarcinoma. Disease Markers. 34 (4): 219—28. doi:10.3233/DMA-130964. PMC 3809974. PMID 23396291.
- ↑ Zhao YJ, Ju Q, Li GC (2013). Tumor markers for hepatocellular carcinoma. Mol Clin Oncol. 1 (4): 593—598. doi:10.3892/mco.2013.119. PMC 3915636. PMID 24649215.
- ↑ а б Ahmed, Ahmed, I; Lobo D.N.; Lobo, Dileep N. (January 2009). Malignant tumours of the liver. Surgery (Oxford). 27 (1): 30—37. doi:10.1016/j.mpsur.2008.12.005.
- ↑ Khan SA, Davidson BR, Goldin RD, Heaton N, Karani J, Pereira SP, Rosenberg WM, Tait P, Taylor-Robinson SD, Thillainayagam AV, Thomas HC, Wasan H (2012). Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update. Gut. 61 (12): 1657—69. doi:10.1136/gutjnl-2011-301748. PMID 22895392.
- ↑ а б в Hoshida, Y; Fuchs, BC; Tanabe, KK (1 листопада 2012). Prevention of hepatocellular carcinoma: potential targets, experimental models, and clinical challenges. Current Cancer Drug Targets. 12 (9): 1129—59. doi:10.2174/156800912803987977. PMC 3776581. PMID 22873223.
- ↑ Bruix J, Sherman M, ((American Association for the Study of Liver, Diseases)) (March 2011). Management of hepatocellular carcinoma: an update. Hepatology. 53 (3): 1020—2. doi:10.1002/hep.24199. PMC 3084991. PMID 21374666.
- ↑ Wang, ZG; Zhang, GF; Wu, JC; Jia, MK (August 2013). Adjuvant therapy for hepatocellular carcinoma: Current situation and prospect. Drug Discoveries & Therapeutics. 7 (4): 137—143. doi:10.5582/ddt.2013.v7.4.137. PMID 24071575.
- ↑ а б de Lope, CR; Tremosini, S; Forner, A; Reig, M; Bruix, J (2012). Management of HCC. Journal of Hepatology. 56 Suppl 1: S75—87. doi:10.1016/S0168-8278(12)60009-9. PMID 22300468.
- ↑ Keating GM, Santoro A (2009). Sorafenib: a review of its use in advanced hepatocellular carcinoma. Drugs. 69 (2): 223—40. doi:10.2165/00003495-200969020-00006. PMID 19228077.
- ↑ Feng, M; Ben-Josef, E (October 2011). Radiation therapy for hepatocellular carcinoma. Seminars in Radiation Oncology. 21 (4): 271—7. doi:10.1016/j.semradonc.2011.05.002. PMID 21939856.
- ↑ а б Ulstrup, T; Pedersen, FM (25 лютого 2013). [Photodynamic therapy of cholangiocarcinomas]. Ugeskrift for Laeger. 175 (9): 579—82. PMID 23608009.
- ↑ а б Kuhlmann, JB; Blum, HE (May 2013). Locoregional therapy for cholangiocarcinoma. Current Opinion in Gastroenterology. 29 (3): 324—8. doi:10.1097/MOG.0b013e32835d9dea. PMID 23337933.
- ↑ Ortner, MA (September 2011). Photodynamic therapy for cholangiocarcinoma. Lasers in Surgery and Medicine. 43 (7): 776—80. doi:10.1002/lsm.21106. PMID 22057505.
- ↑ Valero V, 3rd; Cosgrove, D; Herman, JM; Pawlik, TM (August 2012). Management of perihilar cholangiocarcinoma in the era of multimodal therapy. Expert Review of Gastroenterology & Hepatology. 6 (4): 481—95. doi:10.1586/egh.12.20. PMC 3538366. PMID 22928900.
- ↑ Meyers, RL; Czauderna, P; Otte, JB (November 2012). Surgical treatment of hepatoblastoma. Pediatric Blood & Cancer. 59 (5): 800—8. doi:10.1002/pbc.24220. PMID 22887704.
- ↑ Perilongo, G; Malogolowkin, M; Feusner, J (November 2012). Hepatoblastoma clinical research: lessons learned and future challenges. Pediatric Blood & Cancer. 59 (5): 818—21. doi:10.1002/pbc.24217. PMID 22678761.
- ↑ World Cancer Report 2014. International Agency for Research on Cancer, World Health Organization. 2014. ISBN 978-92-832-0432-9.
- ↑ Lozano, R; Naghavi, M; Foreman, K; Lim, S; Shibuya, K; Aboyans, V; Abraham, J; Adair, T; Aggarwal, R (15 грудня 2012). Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859): 2095—128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
{{cite journal}}: Недійсний|displayauthors=29(довідка) - ↑ El-Serag, HB; Rudolph, KL (June 2007). Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 132 (7): 2557—76. doi:10.1053/j.gastro.2007.04.061. PMID 17570226.
- ↑ Khan, SA; Toledano, MB; Taylor-Robinson, SD (2008). Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma. HPB. 10 (2): 77—82. doi:10.1080/13651820801992641. PMC 2504381. PMID 18773060.
- ↑ Overview of Hepatocellular Carcinoma. Liver Cancer. Архів оригіналу за 18 березня 2017. Процитовано 18 березня 2017.
- ↑ Liver cancer statistics. Cancer Research UK. Архів оригіналу за 17 жовтня 2014. Процитовано 28 жовтня 2014.
- ↑ Xu, Jiaquan (July 2018). Trends in Liver Cancer Mortality Among Adults Aged 25 and Over in the United States, 2000-2016. Hyattsville, MD: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Health Statistics. Процитовано 17 вересня 2018.
- ↑ Immunitor Phase 3 trial of hepcortespenlisimut-L, Liver Cancer Immunotherapy Archived copy. Архів оригіналу за 30 травня 2015. Процитовано 29 травня 2015.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання)
- Керівництво EASL
- Інформація про рак печінки від Cancer Research UK
| Це незавершена стаття про хворобу, синдром або розлад. Ви можете допомогти проєкту, виправивши або дописавши її. |