Ендоканабіноїдна система
Ендоканабіноїдна система — це складна біологічна система, яка відіграє важливу роль у підтримці гомеостазу в організмі тварин.[1][2][3]
Ендоканабіноїдна система наявна в центральній і периферичній нервових системах хребетних. Вона складається з ендоканабіноїдів, які є природними нейромедіаторами на основі ліпідів, їх відповідних рецепторів (CB1 і CB2) і ферментів, відповідальних за синтез і деградацію (розщеплення) ендоканабіноїдів.[1][2][3]
На початку 21 століття дослідження ендоканабіноїдної системи набули популярності через потенційні терапевтичні наслідки для різних станів здоров'я, включаючи нейродегенеративні захворювання, розлади психічного здоров'я, запальні та аутоімунні захворювання, та залежність. Ендоканабіноїдна система бере участь у регулюванні фізіологічних процесів, включаючи метаболізм, різноманітну діяльність імунної системи[4], апетиту, відчуття болю, фертильність[5], вагітність[6], до- та постнатальний розвиток[7][8][9], а також у опосередкуванні фармакологічних ефектів канабісу; і різноманітних когнітивних процесів, наприклад, настрій та пам'ять, контроль і координація рухів, навчання, нейрогенез[10][11], емоції та мотивація, адиктивна поведінка та модуляція болю.[12][13][14]
Було ідентифіковано два основних канабіноїдних рецептора: CB1, вперше клонований (або виділений) у 1990 році; і CB2, клонований у 1993 році. Рецептори CB1 знаходяться переважно в головному мозку та нервовій системі, а також у периферичних органах і тканинах, і є основною молекулярною мішенню для ендогенного часткового агоніста, анандаміду (AEA), а також екзогенного ТГК, найбільш відомого активного компонента коноплі. Ендоканабіноїд 2-арахідоноїлгліцерин (2-AG), якого, як виявилося, на два-три порядки більше у мозку ссавців, ніж AEA, діє як повний агоніст обох CB-рецепторів.[15] Канабідіол (CBD) є фітоканабіноїдом, механізм дії якого, зазвичай, описують як негативний алостеричний модулятор рецепторів CB1[16] і CB2[17]. Канабідіол також діє як потужний агоніст TRPV1 і зворотний агоніст GPR3, GPR6 і GPR12.[17] Крім того, CBD діє як антагоніст GPR55, GPR18 і 5-HT3A[17], демонструючи найвищу ефективність як антагоніст TRPM8.[18] Завдяки своїй активності як негативного алостеричного модулятора, було виявлено, що CBD протидіє деяким побічним ефектам ТГК при спільному застосуванні.[17][19]
Загальний огляд[ред. | ред. код]
Ендоканабіноїдна система складається з трьох основних компонентів: ендоканабіноїдів, рецепторів і ферментів. Ці компоненти працюють разом, щоб модулювати різні фізіологічні процеси та підтримувати гомеостаз в організмі. Нейрони, нейронні шляхи та клітини, де ці молекули, ферменти та канабіноїдних рецепторів локалізовані, складають разом ендоканабіноїдну систему.
Ендоканабіноїди[ред. | ред. код]
Ендоканабіноїди — це природні нейротрансмітери на основі ліпідів, які зв'язуються з рецепторами канабіноїдів. Вони синтезуються за потреби у відповідь на активність клітин і беруть участь у широкому спектрі функцій в організмі. Два найбільш добре вивчені ендоканабіноїди це анандамід та 2-арахідоноїлгліцерин.
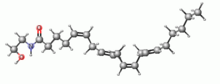
Анандамід[ред. | ред. код]
Анандамід (AEA) також відомий як N-арахідоноїлетаноламін, анандамід отримують з жирної кислоти арахідонової кислоти. Він був названий на честь санскритського слова «ananda», що означає блаженство, завдяки його ролі в модулюванні настрою та реакції на стрес. Анандамід в основному зв'язується з рецепторами CB1, але він також має певну спорідненість з рецепторами CB2.

2-арахідоноїлгліцерин[ред. | ред. код]
2-арахідоноїлгліцерин (2-AG) також походить від арахідонової кислоти та присутній у більш високих концентраціях в організмі порівняно з анандамідом. 2-AG має сильну спорідненість як з рецепторами CB1, так і з CB2 і відіграє певну роль у різних функціях, включаючи імунну відповідь і модуляцію болю.
Рецептори[ред. | ред. код]

Канабіноїдні рецептори — це G-білкові рецептори, які знаходяться на поверхні клітин по всьому тілу. Існує два основних типи канабіноїдних рецепторів: CB1 та CB2.
Рецептори CB1[ред. | ред. код]
Рецептори CB1 переважно знаходяться в мозку та центральній нервовій системі, хоча вони також присутні в периферичних тканинах. Рецептори CB1 беруть участь у різних функціях, включаючи регуляцію настрою, сприйняття болю, апетит і пам'ять.

Рецептори CB2[ред. | ред. код]

Рецептори CB2 розташовані в основному в імунних клітинах і периферичних тканинах, рецептори CB2 відіграють ключову роль у модулюванні імунної функції, запалення та болю. Вони також містяться в мозку, хоча й у менших концентраціях порівняно з рецепторами CB1.
Ферменти[ред. | ред. код]
Ферменти ендоканабіноїдної системи відповідають за синтез і розщеплення ендоканабіноїдів, забезпечуючи їх доступність, у разі потреби, та видалення, після того як вони виконають свою функцію. У цьому процесі беруть участь два основні ферменти: гідролаза амідів жирних кислот та моноацилгліцеролліпаза.
Амідна гідролаза жирних кислот[ред. | ред. код]
Амідна гідролаза жирних кислот (FAAH) відповідає за розщеплення анандаміду на його складові компоненти. Інгібування FAAH досліджували як потенційну терапевтичну мішень для таких станів, як тривога та депресія, оскільки підвищення рівня анандаміду може сприяти відчуттю благополуччя.
Моноацилгліцеролліпаза[ред. | ред. код]
Моноацилгліцеролліпаза (MAGL) відповідає за розщеплення 2-AG, допомагаючи регулювати рівень цього ендоканабіноїду в організмі. Інгібування MAGL також вивчалося на предмет його потенційних терапевтичних ефектів, зокрема в контексті лікування болю та нейрозапалення.
Таким чином, ендоканабіноїдна система включає ендоканабіноїди, рецептори та ферменти, які працюють разом, щоб регулювати різноманітні фізіологічні процеси. Краще розуміння цих компонентів та їх взаємодії має вирішальне значення для вивчення терапевтичного потенціалу впливу на ендоканабіноїдну систему при різних захворюваннях.
Функції ендоканабіноїдної системи[ред. | ред. код]
Ендоканабіноїдна система (ЕКС) — це складна й багатокомпонентна клітинна сигнальна система, яка відіграє вирішальну роль у підтримці гомеостазу – внутрішнього балансу в організмі. Система бере участь у регулюванні широкого спектру фізіологічних процесів, включаючи настрій, реакцію на стрес, модуляцію болю, апетит, метаболізм, імунітет, пам’ять, сон, розмноження тощо. У цьому розділі наведено огляд ключових функцій ЕКС, висвітлюючи визначні дослідження та важливі деталі.
Регуляція настрою та реакція на стрес[ред. | ред. код]
Показано, що ЕКС відіграє значну роль у регуляції настрою та реакції на стрес. Ендоканабіноїди, зокрема анандамід, модулюють вивільнення нейромедіаторів, таких як серотонін, дофамін і глутамат, які всі беруть участь у регуляції настрою.[20] Дослідження показали, що фармакологічне або генетичне інгібування ферменту амідної гідралази жирних кислот (FAAH), який розщеплює анандамід, призводить до анксіолітичних і антидепресивних ефектів на тваринних моделях.[21][22] Крім того, клінічні дослідження повідомляли про зміну рівня ендоканабіноїдів у пацієнтів з депресією та тривожними розладами.[22][23][24]
Модуляція болю[ред. | ред. код]
ЕКС бере участь у модуляції болю як на периферичному, так і на центральному рівнях. Рецептори CB1 присутні в областях мозку, спинного мозку та периферичних нервів, які викликають біль, тоді як рецептори CB2 експресуються на імунних клітинах, які беруть участь у запальній відповіді.[25] Активація цих рецепторів ендоканабіноїдами або екзогенними каннабіноїдами, такими як ТГК або КБД, може пригнічувати передачу болю та спричиняти знеболювальний ефект.[26][27] Клінічні дослідження показали, що канабіноїди можуть бути ефективними при лікуванні різних типів болю, включаючи невропатичний біль, біль при раку та хронічний біль.[28][29]
Апетит і обмін речовин[ред. | ред. код]
ЕКС відіграє важливу роль у регуляції апетиту та метаболізму. Рецептори CB1 сильно експресуються в областях мозку, які контролюють споживання їжі, таких як гіпоталамус, і їх активація ендоканабіноїдами може стимулювати апетит.[30] Крім того, ЕКС бере участь в енергетичному балансі та метаболізмі ліпідів, про що свідчить наявність рецепторів CB1 у жировій тканині та печінці.[31] Дослідження показали, що блокування рецепторів CB1 антагоністами, такими як римонабант, може зменшити споживання їжі та масу тіла як на моделях тварин.[32][33]
Регуляція імунної системи[ред. | ред. код]
ЕКС відіграє певну роль у модулюванні імунної функції та запалення через активацію рецепторів CB2 на імунних клітинах, таких як макрофаги, Т-клітини та В-клітини.[34] Активація цих рецепторів може пригнічувати вивільнення прозапальних цитокінів і сприяти зникненню запалення.[35] Дослідження продемонстрували потенційні терапевтичні ефекти канабіноїдів при різних запальних та аутоімунних захворюваннях, таких як розсіяний склероз[36], ревматоїдний артрит[37] і запальні захворювання кишечника[38][39].
Пам'ять і навчання[ред. | ред. код]
ЕКС бере участь у модуляції процесів пам’яті та навчання, зокрема в гіпокампі, який є ключовим регіоном мозку для цих функцій. Активація CB1 рецепторів ендоканабіноїдів можуть модулювати синаптичну пластичність, яка є важливою для формування пам’яті та навчання (Marsicano та ін., 2002). Проте роль ЕКС у пам’яті є складною і залежить від конкретного типу пам’яті, залученої області мозку та часу активації ЕКС. Наприклад, активація рецепторів CB1 може погіршити короткочасну пам’ять і когнітивні функції, водночас сприяючи довгостроковій синаптичній депресії та зникненню аверсивних спогадів (Riedel and Davies, 2005; Lutz, 2007). Ці ефекти були продемонстровані на тваринних моделях і людях, що має значення для потенційного використання канабіноїдів у лікуванні когнітивних розладів і посттравматичного стресового розладу (Bitencourt та ін., 2008; Curran та ін., 2002).
Сон і циркадні ритми[ред. | ред. код]
Показано, що ЕКС відіграє певну роль у регуляції сну та циркадних ритмів. Ендоканабіноїди, такі як анандамід і 2-AG, можуть модулювати цикл сон-неспання, впливаючи на рецептори CB1 в областях мозку, які беруть участь у регуляції сну, таких як гіпоталамус і стовбур мозку (Murillo-Rodriguez et al., 2003). Дослідження показали, що канабіноїди можуть покращувати якість сну та збільшувати повільний сон як на моделях тварин, так і на людях (Пава та ін., 2014; Карлі та ін., 2002). Крім того, нещодавні дослідження підкреслили роль ЕКС у регуляції циркадних ритмів, що може мати наслідки для розладів сну та інших станів, пов’язаних із порушенням циркадних функцій (Valencia-Olvera et al., 2017).
Розмноження та фертильність[ред. | ред. код]
ЕКС бере участь у різних аспектах відтворення та фертильності, включаючи виробництво гамет, імплантацію ембріона та розвиток плоду (Wang et al., 2006). Ендоканабіноїди, такі як анандамід, і канабіноїдні рецептори присутні в репродуктивній системі як чоловіків, так і жінок, відіграючи роль у регуляції функції статевих залоз, сексуальної поведінки та гормонального балансу (Battista et al., 2012). Порушення регуляції ЕКС причетно до різних репродуктивних розладів, таких як синдром полікістозних яєчників та ендометріоз (Cui та ін., 2018; Sanchez та ін., 2016). Крім того, було показано, що екзогенні канабіноїди, такі як ТГК, негативно впливають на фертильність, змінюючи рівень гормонів, погіршуючи функцію сперми та порушуючи ранній ембріональний розвиток (Rossato та ін., 2008; Льюїс та ін., 2012).
Підсумовуючи, ендоканабіноїдна система відіграє вирішальну роль у регулюванні широкого спектру фізіологічних процесів, включаючи настрій, реакцію на стрес, біль, апетит, метаболізм, імунну функцію, пам’ять, сон і репродукцію. Краще розуміння функцій ЕКС та його взаємодії з іншими системами в організмі має важливе значення для вивчення його терапевтичного потенціалу при різних станах здоров’я.
Дослідження ендоканабіноїдної системи[ред. | ред. код]
Ендоканабіноїдну систему вивчали генетичними та фармакологічними методами. Ці дослідження показали, що канабіноїди діють як нейромодулятори[40][41][42] для різноманітних процесів, включаючи рухове навчання[43], апетит[44] і відчуття болю[45], серед інших когнітивних і фізичних процесів. Локалізація рецептора CB1 в ендоканабіноїдній системі має дуже великий ступінь перекриття з орексинергічною проекційною системою (латеральний гіпоталамус), яка опосередковує багато тих самих функцій, як фізичних, так і когнітивних.[46] Крім того, CB1 локалізований на проекційних нейронах орексину в латеральному гіпоталамусі та багатьох вихідних структурах системи орексину[46][47], де CB1 і рецептор рецептора орексину 1 (OX1) фізично та функціонально об'єднуються, утворюючи рецептор CB1–OX1 гетеродимер.[46][48][49]
Експресія рецепторів[ред. | ред. код]
Місця зв'язування канабіноїдів існують у центральній і периферичній нервовій системі. Двома найбільш важливими рецепторами для канабіноїдів є рецептори CB1 і CB2, які експресуються переважно в мозку та імунній системі відповідно.[50] Щільність експресії змінюється залежно від виду та корелює з ефективністю, яку канабіноїди матимуть у модулюванні конкретних аспектів поведінки, пов'язаних із місцем експресії. Наприклад, у гризунів найвища концентрація сайтів зв'язування канабіноїдів знаходиться в базальних гангліях і мозочку, областях мозку, які беруть участь в ініціації та координації рухів.[51] У людей канабіноїдні рецептори існують у значно нижчій концентрації в цих регіонах, що допомагає пояснити, чому канабіноїди мають більшу ефективність у зміні моторних рухів гризунів, ніж у людей.
Нещодавній аналіз зв'язування канабіноїдів у нокаутних мишей рецепторів CB1 і CB2 виявив реакцію на канабіноїди навіть тоді, коли ці рецептори не експресувалися, що вказує на те, що в мозку може бути присутнім додатковий рецептор зв'язування.[51] Зв'язування було продемонстровано 2-арахідоноїлгліцерином (2-AG) на рецепторі TRPV1, що свідчить про те, що цей рецептор може бути кандидатом на встановлену відповідь.[52]
На додаток до CB1 і CB2 відомо, що певні рецептори-сироти також зв'язують ендоканабіноїди, включаючи GPR18, GPR55 (регулятор нейроімунної функції) і GPR119. Також було відмічено, що CB1 утворює гетеродимер функціонального людського рецептора в нейронах орексину з OX1, рецептором CB1–OX1, який опосередковує харчову поведінку та певні фізичні процеси, такі як індуковані канабіноїдами пресорні реакції, які, як відомо, відбуваються через сигналізацію в ростральному вентролатеральному відділі стовбура мозку.[53][54]
Синтез, вивільнення та деградація ендоканабіноїдів[ред. | ред. код]
Під час нейротрансмісії пресинаптичний нейрон вивільняє нейромедіатори в синаптичну щілину, які зв'язуються з рецепторами, експресованими на постсинаптичному нейроні. На основі взаємодії між трансмітером і рецептором нейромедіатори можуть викликати різноманітні ефекти в постсинаптичній клітині, такі як збудження, гальмування або ініціація каскадів вторинних посередників. В залежності від типу клітини, ці ефекти можуть призвести до синтезу ендогенних канабіноїдів анандаміду або 2-AG за допомогою процесу, який не зовсім зрозумілий, але є результатом підвищення внутрішньоклітинного кальцію.[55]
Докази свідчать про те, що індукція деполяризацією надходження кальцію в постсинаптичний нейрон викликає активацію ферменту під назвою трансацилаза. Вважається, що цей фермент каталізує першу стадію біосинтезу ендоканабіноїдів шляхом перетворення фосфатидилетаноламіну, мембранно-резидентного фосфоліпіду, на N-ацил-фосфатидилетаноламін (NAPE). Експерименти показали, що фосфоліпаза D розщеплює NAPE з утворенням анандаміду.[56][57] Цей процес опосередковується жовчними кислотами.[58][59] У мишей з нокаутом NAPE-фосфоліпази D (NAPEPLD) розщеплення NAPE знижується при низьких концентраціях кальцію, але не скасовується, що свідчить про те, що в синтезі анандаміду беруть участь численні різні шляхи.[60] Синтез 2-AG менш вивчений і вимагає подальших досліджень.
Після вивільнення в позаклітинний простір, ендоканабіноїди вразливі до інактивації гліальними клітинами. Ендоканабіноїди поглинаються транспортером на гліальних клітинах і розкладаються гідролазою амідів жирних кислот (FAAH), яка розщеплює анандамід на арахідонову кислоту та етаноламін або моноацилгліцеролліпазу (MAGL), а 2-AG — на арахідонову кислоту та гліцерин.[61] Хоча арахідонова кислота є субстратом для синтезу лейкотрієну та простагландину, незрозуміло, чи має цей побічний продукт розпаду унікальні функції в центральній нервовій системі.[62][63] Нові дані в цій галузі також вказують на те, що FAAH експресується в постсинаптичних нейронах, комплементарних пресинаптичним нейронам, які експресують канабіноїдні рецептори, підтверджуючи висновок, що вона є основним внеском у кліренс та інактивацію анандаміду та 2-AG після зворотного захоплення ендоканабіноїдів.[51] Нейрофармакологічне дослідження показало, що інгібітор FAAH (URB597) вибірково підвищує рівень анандаміду в мозку гризунів і приматів. Такі підходи можуть призвести до розробки нових препаратів із знеболювальною, анксіолітичною (протитривожною) та антидепресантною діями, які не супроводжуються явними ознаками зловживання.[64]
Зв'язування та внутрішньоклітинні ефекти[ред. | ред. код]
Канабіноїдні рецептори — це G-білкові рецептори, розташовані на пресинаптичній мембрані. Хоча є деякі статті, які пов'язують одночасну стимуляцію рецепторів дофаміну та CB1 із різким підвищенням виробництва циклічного аденозинмонофосфату (цАМФ), загальновизнано, що активація CB1 за допомогою канабіноїдів спричиняє зниження концентрації цАМФ[65], інгібування аденілілциклази та підвищення концентрації мітоген-активованої протеїнкінази (MAP-кінази).[51][66] Відносна потужність різних канабіноїдів щодо інгібування аденілілциклази корелює з їх різною ефективністю в поведінкових аналізах. Це інгібування цАМФ супроводжується фосфорилюванням і подальшою активацією не лише набору MAP-кіназ (p38/p42/p44), але й шляху PI3/PKB і MEK/ERK.[67][68] Результати даних генного чіпа гіпокампа щурів після гострого введення тетрагідроканабінолу (ТГК) показали збільшення експресії транскриптів, що кодують основний білок мієліну, ендоплазматичні білки, цитохромоксидазу та дві молекули клітинної адгезії: NCAM та SC1; зниження експресії спостерігалося як у кальмодуліну, так і в рибосомальних РНК.[69] Крім того, було продемонстровано, що активація CB1 підвищує активність факторів транскрипції, таких як c-Fos і Krox-24.[68]
Зв'язування та нейрональна збудливість[ред. | ред. код]
Також були детально вивчені молекулярні механізми CB1-опосередкованих змін мембранного потенціалу. Канабіноїди зменшують надходження кальцію, блокуючи активність залежних від напруги кальцієвих каналів N-, P/Q- і L-типів.[70][71] Окрім дії на кальцієві канали, було показано, що активація Gi/o та Gs, двох G-білків, які найчастіше сполучаються з канабіноїдними рецепторами, модулює активність калієвих каналів. Нещодавні дослідження виявили, що активація CB1 спеціально сприяє потоку іонів калію через GIRKs, сімейство калієвих каналів.[71] Імуногістохімічні експерименти продемонстрували, що CB1 локалізований спільно з калієвими каналами GIRK і Kv1.4, що свідчить про те, що ці два канали можуть взаємодіяти у фізіологічному контексті.[72]
У центральній нервовій системі рецептори CB1 впливають на збудливість нейронів, зменшуючи вхідний синаптичний сигнал.[73] Цей механізм, відомий як пресинаптичне гальмування, виникає, коли постсинаптичний нейрон вивільняє ендоканабіноїди при ретроградній передачі, які потім зв'язуються з канабіноїдними рецепторами на пресинаптичному терміналі. Потім рецептори CB1 зменшують кількість вивільненого нейромедіатора, так що подальше збудження в пресинаптичному нейроні призводить до зменшення впливу на постсинаптичний нейрон. Цілком ймовірно, що пресинаптичне інгібування використовує багато тих самих механізмів іонних каналів, які перераховані вище, хоча останні дані показали, що рецептори CB1 також можуть регулювати вивільнення нейромедіаторів за допомогою механізму неіонного каналу, тобто через Gi/o-опосередковане інгібування аденілілциклази і протеїнкіназа А.[74] Повідомлялося про безпосередній вплив рецепторів CB1 на збудливість мембрани та значний вплив на активацію кортикальних нейронів.[75] Серія поведінкових експериментів продемонструвала, що NMDAR, іонотропний глутаматний рецептор і метаботропні глутаматні рецептори (mGluRs) працюють разом з CB1, викликаючи знеболення у мишей, хоча механізм, що лежить в основі цього ефекту, поки що неясний.[76] Дослідження 2022 року додало розуміння в ці процеси і припускає, що специфічні для підтипу фармакологічні маніпуляції можуть запропонувати багатообіцяючі варіанти лікування болю та інших розладів.[77]
Потенційні функції[ред. | ред. код]
Пам'ять[ред. | ред. код]
У мишей, які отримували тетрагідроканабінол (ТГК), спостерігалося пригнічення довгострокової потенціації в гіпокампі, процесу, необхідного для формування та зберігання довгострокової пам'яті.[78] Відповідно до цього висновку миші без рецептора CB1 демонструють покращену пам'ять і довгострокову потенціацію, що вказує на те, що ендоканабіноїдна система може відігравати ключову роль у згасанні старих спогадів. Одне дослідження показало, що лікування щурів синтетичним канабіноїдом HU-210 у високих дозах протягом кількох тижнів призвело до стимуляції нейронного росту в області гіпокампу щурів, частини лімбічної системи, яка відіграє роль у формуванні декларативного та просторового спогадів, але не досліджував вплив на короткочасну чи довготривалу пам'ять.[10] У сукупності ці висновки свідчать про те, що вплив ендоканабіноїдів на різні мережі мозку, які беруть участь у навчанні та пам'яті, може відрізнятися.
Роль у гіпокампальному нейрогенезі[ред. | ред. код]
У дорослому мозку ендоканабіноїдна система сприяє нейрогенезу зернистих клітин гіпокампа.[10][11] У субгранулярній зоні зубчастої звивини мультипотентні нейронні попередники (НП) дають початок дочірнім клітинам, які протягом кількох тижнів дозрівають у зернисті клітини, аксони яких виступають і синапсують на дендритах в області CA3.[79] Показано, що нейронні попередники в гіпокампі володіють амідною гідролазою жирних кислот (FAAH), експресують CB1 і використовують 2-AG.[11] Цікаво, що активація CB1 ендогенними або екзогенними каннабіноїдами сприяє проліферації та диференціації НП; ця активація відсутня при нокауті CB1 і скасовується в присутності антагоніста.[10][11]
Індукція синаптичної депресії[ред. | ред. код]
Відомо, що ендоканабіноїди впливають на синаптичну пластичність і, зокрема, вважають, що вони є посередниками довготривалого пригнічення (LTD). Вперше зареєстровано в смугастому тілі[80], відомо, що ця система функціонує в кількох інших структурах мозку, таких як прилегле ядро, мигдалеподібне тіло, гіпокамп, кора головного мозку, мозочок, вентральна тегментальна область (VTA), стовбур мозку та верхній бугор.[81] Як правило, ці ретроградні трансмітери вивільняються постсинаптичним нейроном і індукують синаптичну депресію шляхом активації пресинаптичних рецепторів CB1.[81]
Крім того, було припущено, що різні ендоканабіноїди, наприклад 2-AG і анандамід, можуть опосередковувати різні форми синаптичного пригнічення через різні механізми.[52] Дослідження, проведене з ядром кінцевої смужки, показало, що стійкість до пригнічувальних ефектів опосередковується двома різними сигнальними шляхами залежно від типу активованого рецептора. Було виявлено, що 2-AG діє на пресинаптичні рецептори CB1, опосередковуючи ретроградне короткотривале пригнічення після активації кальцієвих каналів L-типу, тоді як анандамід синтезувався після активації mGluR5 і запускав аутокринну передачу сигналів на постсинапічні рецептори TRPV1, які індукували довготривале пригнічення.[52] Ці висновки показують, що мозок має прямі механізми для вибіркового пригнічення збудливості нейронів протягом варіабельних часових масштабів. Вибірково інтерналізуючи різні рецептори, мозок може обмежити виробництво специфічних ендоканабіноїдів, щоб сприяти своїм тимчасовим потребам.
Апетит[ред. | ред. код]
Докази ролі ендоканабіноїдної системи в поведінці пошуку їжі надходять з різноманітних досліджень канабіноїдів. Нові дані свідчать про те, що ТГК діє через рецептори CB1 у ядрах гіпоталамуса, безпосередньо підвищуючи апетит.[82] Вважається, що нейрони гіпоталамуса тонічно виробляють ендоканабіноїди, які працюють для жорсткого регулювання голоду. Кількість вироблених ендоканабіноїдів обернено пропорційна кількості лептину в крові.[83] Наприклад, миші без лептину не тільки страждають масовим ожирінням, але й виробляють аномально високі рівні гіпоталамічних ендоканабіноїдів як компенсаторний механізм.[44] Подібним чином, коли цих мишей лікували ендоканабіноїдними зворотними агоністами, такими як римонабант, споживання їжі було зменшено.[44] Коли рецептор CB1 нокаутується у мишей, ці тварини, як правило, худіші й менш голодні, ніж звичайні миші. Пов'язане дослідження вивчало вплив ТГК на гедонічну (задоволення) цінність їжі та виявило посилене вивільнення дофаміну в прилеглому ядрі та підвищення поведінки, пов'язаної із задоволенням, після прийому розчину сахарози.[84] Пов'язане дослідження показало, що ендоканабіноїди впливають на сприйняття смаку в смакових клітинах.[85] У смакових клітинах було показано, що ендоканабіноїди вибірково посилюють силу нейронних сигналів для солодкого смаку, тоді як лептин знижує силу цієї самої реакції. Хоча є потреба в додаткових дослідженнях, ці результати свідчать про те, що канабіноїдна активність у гіпоталамусі та прилеглому ядрі пов'язана з апетитом та поведінкою, спрямованою на пошук їжі.[82]
Енергетичний баланс і обмін речовин[ред. | ред. код]
Було показано, що ендоканабіноїдна система виконує гомеостатичну роль, контролюючи кілька метаболічних функцій, таких як накопичення енергії та транспорт поживних речовин. Він діє на периферичні тканини, такі як адипоцити, гепатоцити, шлунково-кишковий тракт, скелетні м'язи та ендокринну підшлункову залозу. Це також мається на увазі в модулюванні чутливості до інсуліну. Через усе це ендоканабіноїдна система може відігравати певну роль у клінічних станах, таких як ожиріння, діабет і атеросклероз, що також може впливати на стан серцево-судинної системи.[86]
Реакція на стрес[ред. | ред. код]
У той час як секреція глюкокортикоїдів у відповідь на стресові подразники є адаптивною реакцією, необхідною для того, щоб організм правильно реагував на стресор, постійна секреція може бути шкідливою і викликати хронічний стрес. Ендоканабіноїдна система була причетна до звикання гіпоталамо-гіпофізарно-надниркової осі до повторного впливу стримувального стресу. Дослідження продемонстрували диференціальний синтез анандаміду та 2-AG під час тонічного стресу. Зменшення анандаміду було виявлено вздовж осі, що сприяло базальній гіперсекреції кортикостерону; навпаки, збільшення 2-AG було виявлено в мигдалині після повторного стресу, що негативно корелювало з величиною відповіді кортикостерону. Усі ефекти були скасовані антагоністом CB1 AM251, підтверджуючи висновок про те, що ці ефекти були залежними від канабіноїдних рецепторів.[87]
Ці результати показують, що анандамід і 2-AG дивергентно регулюють відповідь гіпоталамо-гіпофізарної осі на стрес: у той час як звикання індукованої стресом гіпоталамо-гіпофізарної осі через 2-AG запобігає надмірній секреції глюкокортикоїдів на незагрозливі стимули, збільшення базальної секреції кортикостерону в результаті зниження анандаміду дозволяє сприяти полегшеній реакції гіпоталамо-гіпофізарної осі на нові подразники, тобто зменшення хронічного стресу.
Дослідження, соціальна поведінка та тривога[ред. | ред. код]
Ці контрастні ефекти розкривають важливість ендоканабіноїдної системи в регулюванні поведінки, залежної від тривоги. Результати свідчать про те, що глутаматергічні канабіноїдні рецептори відповідають не лише за посередництво агресії, але й виконують анксіолітичну (протитривожну) функцію, пригнічуючи надмірне збудження: надмірне збудження викликає занепокоєння, яке обмежує мишей досліджувати як живі, так і неживі об'єкти. Навпаки, ГАМКергічні нейрони, здається, контролюють анксіогенно-подібну функцію, обмежуючи вивільнення гальмівного передавача. Взяті разом, ці два набори нейронів, ймовірно, допомагають регулювати загальне відчуття збудження організму під час нових ситуацій.[88]
Імунна система[ред. | ред. код]
У лабораторних експериментах активація канабіноїдних рецепторів впливала на активацію ГТФаз у макрофагах, нейтрофілах і клітинах кісткового мозку. Ці рецептори також беруть участь у міграції В-клітин у крайову зону та регуляції рівнів IgM.[89]
Вагітність[ред. | ред. код]
Ембріон, що розвивається, експресує канабіноїдні рецептори на ранніх стадіях розвитку, які реагують на анандамід, що виділяється в матці. Цей сигнал важливий для регулювання часу імплантації ембріона та сприйнятливості матки. На мишах було показано, що анандамід модулює ймовірність імплантації до стінки матки. Наприклад, у людей ймовірність викидня зростає, якщо рівень анандаміду в матці занадто високий або низький.[90] Ці результати свідчать про те, що прийом екзогенних канабіноїдів (наприклад, каннабісу) може зменшити ймовірність вагітності для жінок з високим рівнем анандаміду, і, навпаки, це може збільшити ймовірність вагітності у жінок, у яких рівень анандаміду був надто низьким.[91][92]
Вегетативна нервова система[ред. | ред. код]
Периферична експресія канабіноїдних рецепторів спонукала дослідників до вивчення ролі канабіноїдів у вегетативній нервовій системі. Дослідження показали, що рецептор CB1 пресинаптично експресується моторними нейронами, які іннервують вісцеральні органи. Інгібування електричних потенціалів, опосередковане канабіноїдами, призводить до зниження вивільнення норадреналіну з нейронів симпатичної нервової системи. Інші дослідження виявили подібні ефекти в ендоканабіноїдній регуляції перистальтики кишківника, включаючи іннервацію гладких м'язів, пов'язаних з травною, сечовидільною та репродуктивною системами.[51]
Знеболювання[ред. | ред. код]
У спинному мозку канабіноїди пригнічують викликані шкідливими подразниками відповіді нейронів спинного рогу, можливо, шляхом модулювання низхідного надходження норадреналіну зі стовбура мозку.[51] Оскільки багато з цих волокон є в основному ГАМКергічними, канабіноїдна стимуляція в хребетному стовпі призводить до розгальмування, що збільшує вивільнення норадреналіну та ослаблює обробку шкідливих стимулів на периферії та в ганглії спинного корінця.
Ендоканабіноїд, який найбільше досліджується щодо болю, — це пальмітоілетаноламід. Пальмітоілетаноламід — це жирний амін, споріднений анандаміду, але насичений, і хоча спочатку вважалося, що пальмітоілетаноламід зв'язується з рецепторами CB1 і CB2, пізніше було виявлено, що найважливішими рецепторами є рецептор PPAR-альфа, рецептор TRPV і GPR55. Пальмітоілетаноламід був оцінений щодо його знеболюючої дії при різноманітних больових показаннях і визнаний безпечним та ефективним.[93][94][95][96]
Модуляція ендоканабіноїдної системи шляхом метаболізму до N-арахідиноїл-феноламіну (AM404), ендогенного канабіноїдного нейромедіатора, була виявлена як один із механізмів знеболення парацетамолом.[97]
Ендоканабіноїди також беруть участь у реакціях знеболення, викликаних плацебо.[98]
Терморегуляція[ред. | ред. код]
Було показано, що анандамід і N-арахідоноїл дофамін (NADA) діють на канали TRPV1, що сприймають температуру, які беруть участь у терморегуляції.[99] TRPV1 активується екзогенним лігандом капсаїцином, активним компонентом перцю чилі, який структурно подібний до ендоканабіноїдів. NADA активує канал TRPV1. Висока ефективність робить його ймовірним ендогенним агоністом TRPV1.[100] Також було виявлено, що анандамід активує TRPV1 на терміналах сенсорних нейронів і згодом викликає розширення судин.[51] TRPV1 також може бути активований метанандамідом і арахідоніл-2'-хлоретиламідом (ACEA).[66]
Сон[ред. | ред. код]
Посилена передача сигналів ендоканабіноїдів у центральній нервовій системі сприяє сну. Було показано, що міжцеребровентрикулярне введення анандаміду щурам зменшує неспання та збільшує повільний та швидкий сон.[101] Також було показано, що введення анандаміду в базальний відділ переднього мозку щурів підвищує рівень аденозину, який відіграє важливу роль у сприянні сну та пригніченні збудження.[102] Було продемонстровано, що депривація швидкого сну у щурів збільшує експресію рецептора CB1 у центральній нервовій системі.[103] Крім того, рівні анандаміду мають циркадний ритм у щурів, причому рівні вищі в світлу фазу дня, коли щури зазвичай сплять або менш активні, оскільки вони ведуть нічний спосіб життя.[104]
Фізичні вправи[ред. | ред. код]
Ендоканабіноїдна система також бере участь у опосередкуванні деяких фізіологічних і когнітивних ефектів добровільних фізичних вправ у людей та інших тварин, таких як сприяння ейфорії, спричиненій фізичними вправами, а також модулювання рухової активності та мотиваційної значимості для винагород.[105][106] У людей було виявлено, що плазмова концентрація анандаміду підвищується під час фізичної активності; оскільки ендоканабіноїди можуть ефективно проникати через гематоенцефалічний бар'єр, було припущено, що анандамід разом з іншими нейрохімічними речовинами сприяє розвитку ейфорії, спричиненої фізичними вправами.[105][106]
Канабіноїди в рослинах[ред. | ред. код]
Ендоканабіноїдна система є молекулярно-філогенетичним розподілом очевидно стародавніх ліпідів у царстві рослин, що свідчить про біосинтетичну пластичність і потенційну фізіологічну роль ендоканабіноїдоподібних ліпідів у рослинах[107], а виявлення арахідонової кислоти (АК) вказує на хемотаксономічні зв'язки між монофілетичними групами зі спільним предком, який датується приблизно 500 мільйонами років тому (кембрій). Філогенетичний розподіл цих ліпідів може бути наслідком взаємодії/адаптації до навколишніх умов, таких як хімічна взаємодія рослин-запилювачів, комунікація та захисні механізми. Дві нові про ендоканабіноїдно-подібні молекули, отримані з ейкозатетраєнової кислоти ялівцевої кислоти, омега-3 структурного ізомеру АК, а саме юніпероїл етаноламіду та 2-юніпероїл гліцерину (1/2-AG) у голонасінних, лікофітів і кількох монілофітів, показують, що АК є еволюційно збережена сигнальна молекула, яка діє в рослинах у відповідь на стрес, подібно до того, що відбувається в системах тварин.[108]
Див. також[ред. | ред. код]
Література[ред. | ред. код]
Книги[ред. | ред. код]
- Agrawal Dinesh Chandra; Kumar Rajiv; Dhanasekaran, Muralikrishnan (2022). Cannabis/marijuana for healthcare. Springer, Singapore. ISBN 978-981-16-8822-5.
- Finn Kenneth (2020). Cannabis in medicine: an evidence-based approach. Springer, Cham, Switzerland. ISBN 978-3-030-45968-0.
- Johnson, Scott A. (2019). The endocannabinoid system and cannabis: a perfect partnership for self-regulation and healing. Orem, Utah. ISBN 978-0-9975487-5-4.
- Parker, Linda (2018). Cannabinoids and the brain (вид. 1st). MIT Press, Cambridge, Massachusetts. ISBN 0-262-53660-9.
- Murillo-Rodriguez Eric (2017). The endocannabinoid system: genetics, biochemistry, brain disorders, and therapy. London: Academic Press, Elsevier. ISBN 978-0-12-809667-3.
- Maccarrone Mauro (2016). Endocannabinoid signaling: methods and protocols. Springer, New York, NY. ISBN 978-1-4939-3539-0.
- Parsons, Loren; Hill, Matthew (2015). Endocannabinoids (вид. 1st edition). Waltham, MA. ISBN 978-0-12-801376-2.
- Fattore Liana (2015). Cannabinoids in neurologic and mental disease. Elsevier, Amsterdam. ISBN 978-0-12-417124-4.
- Wang Jenny (2015). Endocannabinoidome: the world of endocannabinoids and related mediators. Elsevier, London. ISBN 978-0-12-800429-6.
- Kendall David A.; Alexander S. P. H. (2009). Behavioral neurobiology of the endocannabinoid system. Berlin: Springer-Verlag. ISBN 978-3-540-88955-7.
Журнали[ред. | ред. код]
Статті[ред. | ред. код]
- Bilbao Ainhoa; Spanagel Rainer (19 серпня 2022). Medical cannabinoids: a pharmacology-based systematic review and meta-analysis for all relevant medical indications. BMC Medicine 20 (1). с. 259. doi:10.1186/s12916-022-02459-1.
- Kilaru Aruna; Chapman Kent D. (2020). The endocannabinoid system. Essays in Biochemistry 64 (3). с. 485–499. doi:10.1042/ebc20190086.
- Zou Shenglong; Kumar Ujendra (2018). Cannabinoid Receptors and the Endocannabinoid System: Signaling and Function in the Central Nervous System. International Journal of Molecular Sciences (англ.) 19 (3). с. 833. doi:10.3390/ijms19030833.
- Whiting Penny F.; Wolff Robert F.; Deshpande Sohan та ін. (2015). Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA 313 (24). с. 2456–2473. doi: 10.1001/jama.2015.6358.
- Gruden G; Barutta F; Kunos G; Pacher P (2016). Role of the endocannabinoid system in diabetes and diabetic complications. British Journal of Pharmacology (англ.) 173 (7). с. 1116–1127. doi:10.1111/bph.13226.
Примітки[ред. | ред. код]
- ↑ а б Wang, Jenny (2015). Endocannabinoidome: the world of endocannabinoids and related mediators (англ.). London: Academic Press, Elsevier. ISBN 978-0-12-800429-6. OCLC 891370821.
- ↑ а б Maccarrone, Mauro (2016). Endocannabinoid signaling: methods and protocols. Methods in Molecular Biology (англ.). New York, NY: Springer. ISBN 978-1-4939-3539-0. OCLC 951535640.
- ↑ а б Murillo-Rodriguez, Eric (2017). The endocannabinoid system: genetics, biochemistry, brain disorders, and therapy (англ.). London: Academic Press, Elsevier. ISBN 978-0-12-809667-3. OCLC 987753061.
- ↑ Pandey R, Mousawy K, Nagarkatti M, Nagarkatti P (August 2009). Endocannabinoids and immune regulation. Pharmacological Research. 60 (2): 85—92. doi:10.1016/j.phrs.2009.03.019. PMC 3044336. PMID 19428268.
- ↑ Klein C, Hill MN, Chang SC, Hillard CJ, Gorzalka BB (June 2012). Circulating endocannabinoid concentrations and sexual arousal in women. The Journal of Sexual Medicine. 9 (6): 1588—601. doi:10.1111/j.1743-6109.2012.02708.x. PMC 3856894. PMID 22462722.
- ↑ Wang H, Xie H, Dey SK (June 2006). Endocannabinoid signaling directs periimplantation events. The AAPS Journal. 8 (2): E425-32. doi:10.1007/BF02854916. PMC 3231559. PMID 16808046.
- ↑ Freitas HR, Isaac AR, Silva TM, Diniz GO, Dos Santos Dabdab Y, Bockmann EC, Guimarães MZ, da Costa Calaza K, de Mello FG, Ventura AL, de Melo Reis RA, França GR (September 2019). Cannabinoids Induce Cell Death and Promote P2X7 Receptor Signaling in Retinal Glial Progenitors in Culture. Molecular Neurobiology. 56 (9): 6472—6486. doi:10.1007/s12035-019-1537-y. PMID 30838518.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Freitas HR, Reis RA, Ventura AL, França GR (December 2019). Interaction between cannabinoid and nucleotide systems as a new mechanism of signaling in retinal cell death. Neural Regeneration Research. 14 (12): 2093—2094. doi:10.4103/1673-5374.262585. PMC 6788250. PMID 31397346.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Fride E (October 2004). The endocannabinoid-CB(1) receptor system in pre- and postnatal life. European Journal of Pharmacology. SPECIAL CELEBRATORY VOLUME 500 Dedicated to Professor David de Wied Honorary and Founding Editor. 500 (1–3): 289—97. doi:10.1016/j.ejphar.2004.07.033. PMID 15464041.
- ↑ а б в г Jiang W, Zhang Y, Xiao L, Van Cleemput J, Ji SP, Bai G, Zhang X (2005). Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects. Journal of Clinical Investigation. 115 (11): 3104—16. doi:10.1172/JCI25509. PMC 1253627. PMID 16224541. Помилка цитування: Некоректний тег
<ref>; назва «Jiang2005» визначена кілька разів з різним вмістом - ↑ а б в г Aguado T, Monory K, Palazuelos J, Stella N, Cravatt B, Lutz B, Marsicano G, Kokaia Z, Guzmán M, Galve-Roperh I (2005). The endocannabinoid system drives neural progenitor proliferation. The FASEB Journal. 19 (12): 1704—6. doi:10.1096/fj.05-3995fje. PMID 16037095.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Aizpurua-Olaizola O, Elezgarai I, Rico-Barrio I, Zarandona I, Etxebarria N, Usobiaga A (January 2017). Targeting the endocannabinoid system: future therapeutic strategies. Drug Discovery Today. 22 (1): 105—110. doi:10.1016/j.drudis.2016.08.005. PMID 27554802.
- ↑ Donvito G, Nass SR, Wilkerson JL, Curry ZA, Schurman LD, Kinsey SG, Lichtman AH (January 2018). The Endogenous Cannabinoid System: A Budding Source of Targets for Treating Inflammatory and Neuropathic Pain. Neuropsychopharmacology. 43 (1): 52—79. doi:10.1038/npp.2017.204. PMC 5719110. PMID 28857069.
- ↑ de Melo Reis RA, Isaac AR, Freitas HR, de Almeida MM, Schuck PF, Ferreira GC, Andrade-da-Costa BL, Trevenzoli IH (2021). Quality of Life and a Surveillant Endocannabinoid System. Frontiers in Neuroscience. 15: 747229. doi:10.3389/fnins.2021.747229. PMC 8581450. PMID 34776851.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Baggelaar MP, Maccarrone M, van der Stelt M (July 2018). 2-Arachidonoylglycerol: A signaling lipid with manifold actions in the brain. Progress in Lipid Research. 71: 1—17. doi:10.1016/j.plipres.2018.05.002. PMID 29751000.
- ↑ Laprairie RB, Bagher AM, Kelly ME, Denovan-Wright EM (October 2015). Cannabidiol is a negative allosteric modulator of the cannabinoid CB1 receptor. British Journal of Pharmacology. 172 (20): 4790—805. doi:10.1111/bph.13250. PMC 4621983. PMID 26218440.
- ↑ а б в г Cherkasova, Viktoriia; Wang, Bo; Gerasymchuk, Marta; Fiselier, Anna; Kovalchuk, Olga; Kovalchuk, Igor (20 жовтня 2022). Use of Cannabis and Cannabinoids for Treatment of Cancer. Cancers (англ.). 14 (20): 5142. doi:10.3390/cancers14205142. ISSN 2072-6694. PMC 9600568. PMID 36291926.
- ↑ De Petrocellis L, Ligresti A, Moriello AS, Allarà M, Bisogno T, Petrosino S, Stott CG, Di Marzo V (August 2011). Effects of cannabinoids and cannabinoid-enriched Cannabis extracts on TRP channels and endocannabinoid metabolic enzymes. British Journal of Pharmacology. 163 (7): 1479—94. doi:10.1111/j.1476-5381.2010.01166.x. PMC 3165957. PMID 21175579.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Hudson R, Renard J, Norris C, Rushlow WJ, Laviolette SR (October 2019). Cannabidiol Counteracts the Psychotropic Side-Effects of Δ-9-Tetrahydrocannabinol in the Ventral Hippocampus through Bidirectional Control of ERK1-2 Phosphorylation. The Journal of Neuroscience. 39 (44): 8762—8777. doi:10.1523/JNEUROSCI.0708-19.2019. PMC 6820200. PMID 31570536.
- ↑ Bambico, Francis Rodriguez; Katz, Noam; Debonnel, Guy; Gobbi, Gabriella (24 жовтня 2007). Cannabinoids Elicit Antidepressant-Like Behavior and Activate Serotonergic Neurons through the Medial Prefrontal Cortex. Journal of Neuroscience (англ.). Т. 27, № 43. с. 11700—11711. doi:10.1523/JNEUROSCI.1636-07.2007. ISSN 0270-6474. PMC 6673235. PMID 17959812. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Kathuria, Satish; Gaetani, Silvana; Fegley, Darren; Valiño, Fernando; Duranti, Andrea; Tontini, Andrea; Mor, Marco; Tarzia, Giorgio; Rana, Giovanna La (2003-01). Modulation of anxiety through blockade of anandamide hydrolysis. Nature Medicine (англ.). Т. 9, № 1. с. 76—81. doi:10.1038/nm803. ISSN 1546-170X. Процитовано 24 квітня 2023.
- ↑ а б Gobbi, G.; Bambico, F. R.; Mangieri, R.; Bortolato, M.; Campolongo, P.; Solinas, M.; Cassano, T.; Morgese, M. G.; Debonnel, G. (20 грудня 2005). Antidepressant-like activity and modulation of brain monoaminergic transmission by blockade of anandamide hydrolysis. Proceedings of the National Academy of Sciences (англ.). Т. 102, № 51. с. 18620—18625. doi:10.1073/pnas.0509591102. ISSN 0027-8424. PMC 1317988. PMID 16352709. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Hill, M. N.; Gorzalka, B. B. (2005-09). Is there a role for the endocannabinoid system in the etiology and treatment of melancholic depression?. Behavioural Pharmacology (амер.). Т. 16, № 5-6. с. 333. doi:10.1097/00008877-200509000-00006. ISSN 0955-8810. Процитовано 24 квітня 2023.
- ↑ Hill, Matthew N.; Gorzalka, Boris B. (1 грудня 2005). Pharmacological enhancement of cannabinoid CB1 receptor activity elicits an antidepressant-like response in the rat forced swim test. European Neuropsychopharmacology (англ.). Т. 15, № 6. с. 593—599. doi:10.1016/j.euroneuro.2005.03.003. ISSN 0924-977X. Процитовано 24 квітня 2023.
- ↑ Finn, David P.; Haroutounian, Simon; Hohmann, Andrea G.; Krane, Elliot; Soliman, Nadia; Rice, Andrew S. C. (2021-07). Cannabinoids, the endocannabinoid system, and pain: a review of preclinical studies. PAIN (амер.). Т. 162. с. S5. doi:10.1097/j.pain.0000000000002268. ISSN 0304-3959. PMC 8819673. PMID 33729211. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Walker, J. M.; Hohmann, A. G. (2005). Pertwee, Roger G. (ред.). Cannabinoid Mechanisms of Pain Suppression. Cannabinoids (англ.). Berlin, Heidelberg: Springer. с. 509—554. doi:10.1007/3-540-26573-2_17. ISBN 978-3-540-26573-3.
- ↑ Hohmann, Andrea G.; Suplita, Richard L.; Bolton, Nathan M.; Neely, Mark H.; Fegley, Darren; Mangieri, Regina; Krey, Jocelyn F.; Michael Walker, J.; Holmes, Philip V. (2005-06). An endocannabinoid mechanism for stress-induced analgesia. Nature (англ.). Т. 435, № 7045. с. 1108—1112. doi:10.1038/nature03658. ISSN 1476-4687. Процитовано 24 квітня 2023.
- ↑ Whiting, Penny F.; Wolff, Robert F.; Deshpande, Sohan; Di Nisio, Marcello; Duffy, Steven; Hernandez, Adrian V.; Keurentjes, J. Christiaan; Lang, Shona; Misso, Kate (23 червня 2015). Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA (англ.). Т. 313, № 24. с. 2456. doi:10.1001/jama.2015.6358. ISSN 0098-7484. Процитовано 24 квітня 2023.
- ↑ Russo, Ethan B. (8 лютого 2008). Cannabinoids in the management of difficult to treat pain. Therapeutics and Clinical Risk Management (English) . Т. 4, № 1. с. 245—259. doi:10.2147/TCRM.S1928. PMC 2503660. PMID 18728714. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Di Marzo, Vincenzo; Goparaju, Sravan K.; Wang, Lei; Liu, Jie; Bátkai, Sándor; Járai, Zoltán; Fezza, Filomena; Miura, Grant I.; Palmiter, Richard D. (2001-04). Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature (англ.). Т. 410, № 6830. с. 822—825. doi:10.1038/35071088. ISSN 1476-4687. Процитовано 24 квітня 2023.
- ↑ Osei-Hyiaman, Douglas; DePetrillo, Michael; Pacher, Pál; Liu, Jie; Radaeva, Svetlana; Bátkai, Sándor; Harvey-White, Judith; Mackie, Ken; Offertáler, László (2 травня 2005). Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity. The Journal of Clinical Investigation (англ.). Т. 115, № 5. с. 1298—1305. doi:10.1172/JCI23057. ISSN 0021-9738. PMC 1087161. PMID 15864349. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ van Gaal, Luc (1 січня 2007). Reducing cardiometabolic risk through selective antagonism of CB1 receptors. Clinical Cornerstone (англ.). Т. 8. с. S24—S29. doi:10.1016/S1098-3597(07)80012-3. ISSN 1098-3597. Процитовано 24 квітня 2023.
- ↑ Nogueiras, Ruben; Veyrat-Durebex, Christelle; Suchanek, Paula M.; Klein, Marcella; Tschöp, Johannes; Caldwell, Charles; Woods, Stephen C.; Wittmann, Gabor; Watanabe, Masahiko (1 листопада 2008). Peripheral, but Not Central, CB1 Antagonism Provides Food Intake–Independent Metabolic Benefits in Diet-Induced Obese Rats. Diabetes. Т. 57, № 11. с. 2977—2991. doi:10.2337/db08-0161. ISSN 0012-1797. PMC 2570394. PMID 18716045. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Cabral, Guy A.; Griffin-Thomas, LaToya (2009-01). Emerging role of the cannabinoid receptor CB2 in immune regulation: therapeutic prospects for neuroinflammation. Expert Reviews in Molecular Medicine (англ.). Т. 11. с. e3. doi:10.1017/S1462399409000957. ISSN 1462-3994. PMC 2768535. PMID 19152719. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Klein, Thomas W. (2005-05). Cannabinoid-based drugs as anti-inflammatory therapeutics. Nature Reviews Immunology (англ.). Т. 5, № 5. с. 400—411. doi:10.1038/nri1602. ISSN 1474-1733. Процитовано 24 квітня 2023.
- ↑ Croxford, J. Ludovic; Miller, Stephen D. (15 квітня 2003). Immunoregulation of a viral model of multiple sclerosis using the synthetic cannabinoid R(+)WIN55,212. The Journal of Clinical Investigation (англ.). Т. 111, № 8. с. 1231—1240. doi:10.1172/JCI17652. ISSN 0021-9738. PMC 152941. PMID 12697742. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Jain, Nibha; Moorthy, Arumugam (2022-06). Cannabinoids in rheumatology: Friend, foe or a bystander?. Musculoskeletal Care (англ.). Т. 20, № 2. с. 416—428. doi:10.1002/msc.1636. ISSN 1478-2189. PMC 9322323. PMID 35476898. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Massa, Federico; Storr, Martin; Lutz, Beat (1 грудня 2005). The endocannabinoid system in the physiology and pathophysiology of the gastrointestinal tract. Journal of Molecular Medicine (англ.). Т. 83, № 12. с. 944—954. doi:10.1007/s00109-005-0698-5. ISSN 1432-1440. Процитовано 24 квітня 2023.
- ↑ Izzo, Angelo A.; Sharkey, Keith A. (1 квітня 2010). Cannabinoids and the gut: New developments and emerging concepts. Pharmacology & Therapeutics (англ.). Т. 126, № 1. с. 21—38. doi:10.1016/j.pharmthera.2009.12.005. ISSN 0163-7258. Процитовано 24 квітня 2023.
- ↑ Fortin DA, Levine ES (2007). Differential effects of endocannabinoids on glutamatergic and GABAergic inputs to layer 5 pyramidal neurons. Cerebral Cortex. 17 (1): 163—74. doi:10.1093/cercor/bhj133. PMID 16467564.
- ↑ Good CH (2007). Endocannabinoid-dependent regulation of feedforward inhibition in cerebellar Purkinje cells. Journal of Neuroscience. 27 (1): 1—3. doi:10.1523/JNEUROSCI.4842-06.2007. PMC 6672293. PMID 17205618.
- ↑ Hashimotodani Y, Ohno-Shosaku T, Kano M (2007). Presynaptic monoacylglycerol lipase activity determines basal endocannabinoid tone and terminates retrograde endocannabinoid signaling in the hippocampus. Journal of Neuroscience. 27 (5): 1211—9. doi:10.1523/JNEUROSCI.4159-06.2007. PMC 6673197. PMID 17267577.
- ↑ Kishimoto Y, Kano M (2006). Endogenous cannabinoid signaling through the CB1 receptor is essential for cerebellum-dependent discrete motor learning. Journal of Neuroscience. 26 (34): 8829—37. doi:10.1523/JNEUROSCI.1236-06.2006. PMC 6674369. PMID 16928872.
- ↑ а б в Di Marzo V, Goparaju SK, Wang L, Liu J, Bátkai S, Járai Z, Fezza F, Miura GI, Palmiter RD, Sugiura T, Kunos G (April 2001). Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature. 410 (6830): 822—5. Bibcode:2001Natur.410..822D. doi:10.1038/35071088. PMID 11298451.
- ↑ Cravatt BF, Demarest K, Patricelli MP, Bracey MH, Giang DK, Martin BR, Lichtman AH (July 2001). Supersensitivity to anandamide and enhanced endogenous cannabinoid signaling in mice lacking fatty acid amide hydrolase. Proceedings of the National Academy of Sciences. 98 (16): 9371—6. Bibcode:2001PNAS...98.9371C. doi:10.1073/pnas.161191698. JSTOR 3056353. PMC 55427. PMID 11470906.
{{cite journal}}: Недійсний|displayauthors=1(довідка) - ↑ а б в Flores A, Maldonado R, Berrendero F (2013). Cannabinoid-hypocretin cross-talk in the central nervous system: what we know so far. Frontiers in Neuroscience. 7: 256. doi:10.3389/fnins.2013.00256. PMC 3868890. PMID 24391536.
Direct CB1-HcrtR1 interaction was first proposed in 2003 (Hilairet et al., 2003). Indeed, a 100-fold increase in the potency of hypocretin-1 to activate the ERK signaling was observed when CB1 and HcrtR1 were co-expressed ... In this study, a higher potency of hypocretin-1 to regulate CB1-HcrtR1 heteromer compared with the HcrtR1-HcrtR1 homomer was reported (Ward et al., 2011b). These data provide unambiguous identification of CB1-HcrtR1 heteromerization, which has a substantial functional impact. ... The existence of a cross-talk between the hypocretinergic and endocannabinoid systems is strongly supported by their partially overlapping anatomical distribution and common role in several physiological and pathological processes. However, little is known about the mechanisms underlying this interaction.
• Figure 1: Schematic of brain CB1 expression and orexinergic neurons expressing OX1 or OX2
• Figure 2: Synaptic signaling mechanisms in cannabinoid and orexin systems
• Figure 3: Schematic of brain pathways involved in food intake - ↑ Watkins BA, Kim J (2014). The endocannabinoid system: helps to direct eating behavior and macronutrient metabolism. Frontiers in Psychology. 5: 1506. doi:10.3389/fpsyg.2014.01506. PMC 4285050. PMID 25610411.
CB1 is present in neurons of the enteric nervous system and in sensory terminals of vagal and spinal neurons in the gastrointestinal tract (Massa et al., 2005). Activation of CB1 is shown to modulate nutrient processing, such as gastric secretion, gastric emptying, and intestinal motility. ... CB1 is shown to co-localize with the food intake inhibiting neuropeptide, corticotrophin-releasing hormone, in the paraventricular nucleus of the hypothalamus, and with the two orexigenic peptides, melanin-concentrating hormone in the lateral hypothalamus and with pre-pro-orexin in the ventromedial hypothalamus (Inui, 1999; Horvath, 2003). CB1 knockout mice showed higher levels of CRH mRNA, suggesting that hypothalamic EC receptors are involved in energy balance and may be able to mediate food intake (Cota et al., 2003). ... The ECS works through many anorexigenic and orexigenic pathways where ghrelin, leptin, adiponectin, endogenous opioids, and corticotropin-releasing hormones are involved (Viveros et al., 2008).
- ↑ Thompson MD, Xhaard H, Sakurai T, Rainero I, Kukkonen JP (2014). OX1 and OX2 orexin/hypocretin receptor pharmacogenetics. Frontiers in Neuroscience. 8: 57. doi:10.3389/fnins.2014.00057. PMC 4018553. PMID 24834023.
OX1–CB1 dimerization was suggested to strongly potentiate orexin receptor signaling, but a likely explanation for the signal potentiation is, instead, offered by the ability of OX1 receptor signaling to produce 2-arachidonoyl glycerol, a CB1 receptor ligand, and a subsequent co-signaling of the receptors (Haj-Dahmane and Shen, 2005; Turunen et al., 2012; Jäntti et al., 2013). However, this does not preclude dimerization.
- ↑ Jäntti MH, Mandrika I, Kukkonen JP (2014). Human orexin/hypocretin receptors form constitutive homo- and heteromeric complexes with each other and with human CB1 cannabinoid receptors. Biochemical and Biophysical Research Communications. 445 (2): 486—90. doi:10.1016/j.bbrc.2014.02.026. PMID 24530395.
Orexin receptor subtypes readily formed homo- and hetero(di)mers, as suggested by significant BRET signals. CB1 receptors formed homodimers, and they also heterodimerized with both orexin receptors. ... In conclusion, orexin receptors have a significant propensity to make homo- and heterodi-/oligomeric complexes. However, it is unclear whether this affects their signaling. As orexin receptors efficiently signal via endocannabinoid production to CB1 receptors, dimerization could be an effective way of forming signal complexes with optimal cannabinoid concentrations available for cannabinoid receptors.
- ↑ Pertwee RG (January 2008). The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin. British Journal of Pharmacology. 153 (2): 199—215. doi:10.1038/sj.bjp.0707442. PMC 2219532. PMID 17828291.
- ↑ а б в г д е ж Elphick MR, Egertová M (March 2001). The neurobiology and evolution of cannabinoid signalling. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 356 (1407): 381—408. doi:10.1098/rstb.2000.0787. PMC 1088434. PMID 11316486.
- ↑ а б в Puente N, Cui Y, Lassalle O, Lafourcade M, Georges F, Venance L, Grandes P, Manzoni OJ (December 2011). Polymodal activation of the endocannabinoid system in the extended amygdala. Nature Neuroscience. 14 (12): 1542—7. doi:10.1038/nn.2974. PMID 22057189.
- ↑ Ibrahim BM, Abdel-Rahman AA (2014). Cannabinoid receptor 1 signaling in cardiovascular regulating nuclei in the brainstem: A review. Journal of Advanced Research. 5 (2): 137—45. doi:10.1016/j.jare.2013.03.008. PMC 4294710. PMID 25685481.
- ↑ Ibrahim BM, Abdel-Rahman AA (2015). A pivotal role for enhanced brainstem Orexin receptor 1 signaling in the central cannabinoid receptor 1-mediated pressor response in conscious rats. Brain Research. 1622: 51—63. doi:10.1016/j.brainres.2015.06.011. PMC 4562882. PMID 26096126.
Orexin receptor 1 (OX1R) signaling is implicated in cannabinoid receptor 1 (CB1R) modulation of feeding. Further, our studies established the dependence of the central CB1R-mediated pressor response on neuronal nitric oxide synthase (nNOS) and extracellular signal-regulated kinase1/2 (ERK1/2) phosphorylation in the RVLM. We tested the novel hypothesis that brainstem orexin-A/OX1R signaling plays a pivotal role in the central CB1R-mediated pressor response. Our multiple labeling immunofluorescence findings revealed co-localization of CB1R, OX1R and the peptide orexin-A within the C1 area of the rostral ventrolateral medulla (RVLM). Activation of central CB1R ... in conscious rats caused significant increases in BP and orexin-A level in RVLM neuronal tissue. Additional studies established a causal role for orexin-A in the central CB1R-mediated pressor response
- ↑ Pertwee RG (January 2008). The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin. British Journal of Pharmacology. 153 (2): 199—215. doi:10.1038/sj.bjp.0707442. PMC 2219532. PMID 17828291.
- ↑ Okamoto Y, Morishita J, Tsuboi K, Tonai T, Ueda N (February 2004). Molecular characterization of a phospholipase D generating anandamide and its congeners. Journal of Biological Chemistry. 279 (7): 5298—305. doi:10.1074/jbc.M306642200. PMID 14634025.
- ↑ Liu J, Wang L, Harvey-White J, Osei-Hyiaman D, Razdan R, Gong Q, Chan AC, Zhou Z, Huang BX, Kim HY, Kunos G (September 2006). A biosynthetic pathway for anandamide. Proceedings of the National Academy of Sciences. 103 (36): 13345—50. Bibcode:2006PNAS..10313345L. doi:10.1073/pnas.0601832103. PMC 1557387. PMID 16938887.
- ↑ Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (2014). Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids. Structure. 23 (3): 598—604. doi:10.1016/j.str.2014.12.018. PMC 4351732. PMID 25684574.
- ↑ Margheritis E, Castellani B, Magotti P, Peruzzi S, Romeo E, Natali F, Mostarda S, Gioiello A, Piomelli D, Garau G (2016). Bile Acid Recognition by NAPE-PLD. ACS Chemical Biology. 11 (10): 2908—2914. doi:10.1021/acschembio.6b00624. PMC 5074845. PMID 27571266.
- ↑ Leung D, Saghatelian A, Simon GM, Cravatt BF (April 2006). Inactivation of N-acyl phosphatidylethanolamine phospholipase D reveals multiple mechanisms for the biosynthesis of endocannabinoids. Biochemistry. 45 (15): 4720—6. doi:10.1021/bi060163l. PMC 1538545. PMID 16605240.
- ↑ Pazos MR, Núñez E, Benito C, Tolón RM, Romero J (June 2005). Functional neuroanatomy of the endocannabinoid system. Pharmacology Biochemistry and Behavior. 81 (2): 239—47. doi:10.1016/j.pbb.2005.01.030. PMID 15936805.
- ↑ Yamaguchi T, Shoyama Y, Watanabe S, Yamamoto T (January 2001). Behavioral suppression induced by cannabinoids is due to activation of the arachidonic acid cascade in rats. Brain Research. 889 (1–2): 149—54. doi:10.1016/S0006-8993(00)03127-9. PMID 11166698.
- ↑ Brock TG (December 2005). Regulating leukotriene synthesis: the role of nuclear 5-lipoxygenase (PDF). Journal of Cellular Biochemistry. 96 (6): 1203—11. doi:10.1002/jcb.20662. PMID 16215982.
- ↑ Clapper JR, Mangieri RA, Piomelli D (2009). The endocannabinoid system as a target for the treatment of cannabis dependence. Neuropharmacology. 56 (Suppl 1): 235—43. doi:10.1016/j.neuropharm.2008.07.018. PMC 2647947. PMID 18691603.
- ↑ Kubrusly RC, Günter A, Sampaio L, Martins RS, Schitine CS, Trindade P та ін. (January 2018). Neuro-glial cannabinoid receptors modulate signaling in the embryonic avian retina. Neurochemistry International. 112: 27—37. doi:10.1016/j.neuint.2017.10.016. PMID 29108864.
- ↑ а б Pertwee RG (April 2006). The pharmacology of cannabinoid receptors and their ligands: an overview. International Journal of Obesity. 30 (Suppl 1): S13—8. doi:10.1038/sj.ijo.0803272. PMID 16570099.
- ↑ Galve-Roperh I, Rueda D, Gómez del Pulgar T, Velasco G, Guzmán M (December 2002). Mechanism of extracellular signal-regulated kinase activation by the CB(1) cannabinoid receptor (PDF). Molecular Pharmacology. 62 (6): 1385—92. doi:10.1124/mol.62.6.1385. PMID 12435806. Архів оригіналу (PDF) за 28 лютого 2019.
- ↑ а б Graham ES, Ball N, Scotter EL, Narayan P, Dragunow M, Glass M (September 2006). Induction of Krox-24 by endogenous cannabinoid type 1 receptors in Neuro2A cells is mediated by the MEK-ERK MAPK pathway and is suppressed by the phosphatidylinositol 3-kinase pathway. The Journal of Biological Chemistry. 281 (39): 29085—95. doi:10.1074/jbc.M602516200. PMID 16864584.
- ↑ Kittler JT, Grigorenko EV, Clayton C, Zhuang SY, Bundey SC, Trower MM, Wallace D, Hampson R, Deadwyler S (September 2000). Large-scale analysis of gene expression changes during acute and chronic exposure to [Delta]9-THC in rats (PDF). Physiological Genomics. 3 (3): 175—85. doi:10.1152/physiolgenomics.2000.3.3.175. PMID 11015613. Архів оригіналу (PDF) за 4 березня 2019.
- ↑ Twitchell W, Brown S, Mackie K (1997). Cannabinoids inhibit N- and P/Q-type calcium channels in cultured rat hippocampal neurons. Journal of Neurophysiology. 78 (1): 43—50. doi:10.1152/jn.1997.78.1.43. PMID 9242259.
- ↑ а б Guo J, Ikeda SR (2004). Endocannabinoids modulate N-type calcium channels and G-protein-coupled inwardly rectifying potassium channels via CB1 cannabinoid receptors heterologously expressed in mammalian neurons. Molecular Pharmacology. 65 (3): 665—74. doi:10.1124/mol.65.3.665. PMID 14978245.
- ↑ Binzen U, Greffrath W, Hennessy S, Bausen M, Saaler-Reinhardt S, Treede RD (2006). Co-expression of the voltage-gated potassium channel Kv1.4 with transient receptor potential channels (TRPV1 and TRPV2) and the cannabinoid receptor CB1 in rat dorsal root ganglion neurons. Neuroscience. 142 (2): 527—39. doi:10.1016/j.neuroscience.2006.06.020. PMID 16889902.
- ↑ Freund TF, Katona I, Piomelli D (2003). Role of endogenous cannabinoids in synaptic signaling. Physiological Reviews. 83 (3): 1017—66. doi:10.1152/physrev.00004.2003. PMID 12843414.
- ↑ Chevaleyre V, Heifets BD, Kaeser PS, Südhof TC, Purpura DP, Castillo PE (2007). Endocannabinoid-Mediated Long-Term Plasticity Requires cAMP/PKA Signaling and RIM1α. Neuron. 54 (5): 801—12. doi:10.1016/j.neuron.2007.05.020. PMC 2001295. PMID 17553427.
- ↑ Bacci A, Huguenard JR, Prince DA (2004). Long-lasting self-inhibition of neocortical interneurons mediated by endocannabinoids. Nature. 431 (7006): 312—6. Bibcode:2004Natur.431..312B. doi:10.1038/nature02913. PMID 15372034.
- ↑ Gladding, Clare M.; Fitzjohn, Stephen M.; Molnár, Elek (1 грудня 2009). Metabotropic Glutamate Receptor-Mediated Long-Term Depression: Molecular Mechanisms. Pharmacological Reviews (англ.). Т. 61, № 4. с. 395—412. doi:10.1124/pr.109.001735. ISSN 0031-6997. PMC 2802426. PMID 19926678. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Mazzitelli, Mariacristina; Presto, Peyton; Antenucci, Nico; Meltan, Shakira; Neugebauer, Volker (2022-01). Recent Advances in the Modulation of Pain by the Metabotropic Glutamate Receptors. Cells (англ.). Т. 11, № 16. с. 2608. doi:10.3390/cells11162608. ISSN 2073-4409. PMC 9406805. PMID 36010684. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Hampson RE, Deadwyler SA (1999). Cannabinoids, hippocampal function and memory. Life Sciences. 65 (6–7): 715—23. doi:10.1016/S0024-3205(99)00294-5. PMID 10462072.
- ↑ Christie BR, Cameron HA (2006). Neurogenesis in the adult hippocampus. Hippocampus. 16 (3): 199—207. doi:10.1002/hipo.20151. PMID 16411231.
- ↑ Gerdeman GL, Ronesi J, Lovinger DM (May 2002). Postsynaptic endocannabinoid release is critical to long-term depression in the striatum. Nature Neuroscience. 5 (5): 446—51. doi:10.1038/nn832. PMID 11976704.
- ↑ а б Heifets BD, Castillo PE (12 лютого 2009). Endocannabinoid signaling and long-term synaptic plasticity. Annual Review of Physiology. 71 (1): 283—306. doi:10.1146/annurev.physiol.010908.163149. PMC 4454279. PMID 19575681.
- ↑ а б Kirkham TC, Tucci SA (2006). Endocannabinoids in appetite control and the treatment of obesity. CNS Neurol Disord Drug Targets. 5 (3): 272—92. doi:10.2174/187152706777452272. PMID 16787229.
- ↑ Di Marzo V, Sepe N, De Petrocellis L, Berger A, Crozier G, Fride E, Mechoulam R (December 1998). Trick or treat from food endocannabinoids?. Nature. 396 (6712): 636—7. Bibcode:1998Natur.396..636D. doi:10.1038/25267. PMID 9872309.
- ↑ De Luca MA, Solinas M, Bimpisidis Z, Goldberg SR, Di Chiara G (July 2012). Cannabinoid facilitation of behavioral and biochemical hedonic taste responses. Neuropharmacology. 63 (1): 161—8. doi:10.1016/j.neuropharm.2011.10.018. PMC 3705914. PMID 22063718.
- ↑ Yoshida R та ін. (January 2010). Endocannabinoids selectively enhance sweet taste. Proceedings of the National Academy of Sciences. 107 (2): 935—9. Bibcode:2010PNAS..107..935Y. doi:10.1073/pnas.0912048107. JSTOR 40535875. PMC 2818929. PMID 20080779.
- ↑ Bellocchio L, Cervino C, Pasquali R, Pagotto U (June 2008). The endocannabinoid system and energy metabolism. Journal of Neuroendocrinology. 20 (6): 850—7. doi:10.1111/j.1365-2826.2008.01728.x. PMID 18601709.
- ↑ Hill MN, McLaughlin RJ, Bingham B, Shrestha L, Lee TT, Gray JM, Hillard CJ, Gorzalka BB, Viau V (May 2010). Endogenous cannabinoid signaling is essential for stress adaptation. Proceedings of the National Academy of Sciences. 107 (20): 9406—11. Bibcode:2010PNAS..107.9406H. doi:10.1073/pnas.0914661107. PMC 2889099. PMID 20439721.
- ↑ Häring M, Kaiser N, Monory K, Lutz B (2011). Circuit specific functions of cannabinoid CB1 receptor in the balance of investigatory drive and exploration. PLOS ONE (англ.). 6 (11): e26617. Bibcode:2011PLoSO...626617H. doi:10.1371/journal.pone.0026617. PMC 3206034. PMID 22069458.
- ↑ Basu S, Ray A, Dittel BN (December 2011). Cannabinoid receptor 2 is critical for the homing and retention of marginal zone B lineage cells and for efficient T-independent immune responses. The Journal of Immunology (англ.). 187 (11): 5720—32. doi:10.4049/jimmunol.1102195. PMC 3226756. PMID 22048769.
- ↑ Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agrò A (2000). Relation between decreased anandamide hydrolase concentrations in human lymphocytes and miscarriage. Lancet (англ.). 355 (9212): 1326—9. doi:10.1016/S0140-6736(00)02115-2. PMID 10776746.
- ↑ Das SK, Paria BC, Chakraborty I, Dey SK (1995). Cannabinoid ligand-receptor signaling in the mouse uterus. Proceedings of the National Academy of Sciences (англ.). 92 (10): 4332—6. Bibcode:1995PNAS...92.4332D. doi:10.1073/pnas.92.10.4332. PMC 41938. PMID 7753807.
- ↑ Paria BC, Das SK, Dey SK (1995). The preimplantation mouse embryo is a target for cannabinoid ligand-receptor signaling. Proceedings of the National Academy of Sciences (англ.). 92 (21): 9460—4. Bibcode:1995PNAS...92.9460P. doi:10.1073/pnas.92.21.9460. PMC 40821. PMID 7568154.
- ↑ Hesselink JM (2012). New Targets in Pain, Non-Neuronal Cells, and the Role of Palmitoylethanolamide. The Open Pain Journal. 5 (1): 12—23. doi:10.2174/1876386301205010012.
- ↑ Gabrielsson, Linda; Mattsson, Sofia; Fowler, Christopher J. (2016-10). Palmitoylethanolamide for the treatment of pain: pharmacokinetics, safety and efficacy. British Journal of Clinical Pharmacology (англ.). Т. 82, № 4. с. 932—942. doi:10.1111/bcp.13020. ISSN 0306-5251. PMC 5094513. PMID 27220803. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Clayton, Paul; Hill, Mariko; Bogoda, Nathasha; Subah, Silma; Venkatesh, Ruchitha (2021-01). Palmitoylethanolamide: A Natural Compound for Health Management. International Journal of Molecular Sciences (англ.). Т. 22, № 10. с. 5305. doi:10.3390/ijms22105305. ISSN 1422-0067. PMC 8157570. PMID 34069940. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Lang-Illievich, Kordula; Klivinyi, Christoph; Lasser, Christian; Brenna, Connor T. A.; Szilagyi, Istvan S.; Bornemann-Cimenti, Helmar (2023-01). Palmitoylethanolamide in the Treatment of Chronic Pain: A Systematic Review and Meta-Analysis of Double-Blind Randomized Controlled Trials. Nutrients (англ.). Т. 15, № 6. с. 1350. doi:10.3390/nu15061350. ISSN 2072-6643. PMC 10053226. PMID 36986081. Процитовано 24 квітня 2023.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Ghanem CI, Pérez MJ, Manautou JE, Mottino AD (July 2016). Acetaminophen from liver to brain: New insights into drug pharmacological action and toxicity. Pharmacological Research. 109: 119—31. doi:10.1016/j.phrs.2016.02.020. PMC 4912877. PMID 26921661.
- ↑ Colloca, Luana (28 серпня 2013). Placebo and Pain: From Bench to Bedside (вид. 1st). Elsevier Science. с. 11—12. ISBN 978-0-12-397931-5.
- ↑ Ross RA (November 2003). Anandamide and vanilloid TRPV1 receptors. British Journal of Pharmacology. 140 (5): 790—801. doi:10.1038/sj.bjp.0705467. PMC 1574087. PMID 14517174.
- ↑ Huang SM, Bisogno T, Trevisani M, Al-Hayani A, De Petrocellis L, Fezza F, Tognetto M, Petros TJ, Krey JF, Chu CJ, Miller JD, Davies SN, Geppetti P, Walker JM, Di Marzo V (June 2002). An endogenous capsaicin-like substance with high potency at recombinant and native vanilloid VR1 receptors. Proceedings of the National Academy of Sciences. 99 (12): 8400—5. Bibcode:2002PNAS...99.8400H. doi:10.1073/pnas.122196999. PMC 123079. PMID 12060783.
- ↑ Murillo-Rodríguez E, Sánchez-Alavez M, Navarro L, Martínez-González D, Drucker-Colín R, Prospéro-García O (November 1998). Anandamide modulates sleep and memory in rats. Brain Research. 812 (1–2): 270—4. doi:10.1016/S0006-8993(98)00969-X. PMID 9813364.
- ↑ Santucci V, Storme JJ, Soubrié P, Le Fur G (1996). Arousal-enhancing properties of the CB1 cannabinoid receptor antagonist SR 141716A in rats as assessed by electroencephalographic spectral and sleep-waking cycle analysis. Life Sciences. 58 (6): PL103—10. doi:10.1016/0024-3205(95)02319-4. PMID 8569415.
- ↑ Wang L, Yang T, Qian W, Hou X (January 2011). The role of endocannabinoids in visceral hyposensitivity induced by rapid eye movement sleep deprivation in rats: regional differences. International Journal of Molecular Medicine. 27 (1): 119—26. doi:10.3892/ijmm.2010.547. PMID 21057766.
- ↑ Murillo-Rodriguez E, Désarnaud F, Prospéro-García O (May 2006). Diurnal variation of arachidonoylethanolamine, palmitoylethanolamide and oleoylethanolamide in the brain of the rat. Life Sciences. 79 (1): 30—7. doi:10.1016/j.lfs.2005.12.028. PMID 16434061.
- ↑ а б Tantimonaco M, Ceci R, Sabatini S, Catani MV, Rossi A, Gasperi V, Maccarrone M (2014). Physical activity and the endocannabinoid system: an overview. Cellular and Molecular Life Sciences. 71 (14): 2681—2698. doi:10.1007/s00018-014-1575-6. PMID 24526057.
- ↑ а б Raichlen DA, Foster AD, Gerdeman GL, Seillier A, Giuffrida A (2012). Wired to run: exercise-induced endocannabinoid signaling in humans and cursorial mammals with implications for the 'runner's high'. Journal of Experimental Biology. 215 (Pt 8): 1331—1336. doi:10.1242/jeb.063677. PMID 22442371.
- ↑ Gachet MS, Schubert A, Calarco S, Boccard J, Gertsch J (January 2017). Targeted metabolomics shows plasticity in the evolution of signaling lipids and uncovers old and new endocannabinoids in the plant kingdom. Scientific Reports. 7: 41177. Bibcode:2017NatSR...741177G. doi:10.1038/srep41177. PMC 5264637. PMID 28120902.
- ↑ Wasternack C, Hause B (June 2013). Jasmonates: biosynthesis, perception, signal transduction and action in plant stress response, growth and development. An update to the 2007 review in Annals of Botany. Annals of Botany. 111 (6): 1021—58. doi:10.1093/aob/mct067. PMC 3662512. PMID 23558912.
Посилання[ред. | ред. код]
- Домашня сторінка ICRS — Міжнародного товариства дослідження канабіноїдів
- Ендоканабіноїдна система: її роль, функції та значення - портал CBDInfo