Користувач:Aspilemetala/Чернетка/Холестерол
| Холестерол | |
|---|---|

| |

| |
| Систематична назва | (3β)-холест-5-ен-3-ол |
| Інші назви | Холестерин |
| Ідентифікатори | |
| Номер CAS | 57-88-5 |
| PubChem | 5997 |
| Назва MeSH | Cholesterol |
| SMILES | C[C@H](CCCC(C)C)[C@H]1CC[C@@H]2[C@@]1(CC[C@H]3[C@H]2CC=C4[C@@]3(CC[C@@H](C4)O)C)C |
| InChI | |
| Властивості | |
| Молекулярна формула | C27H46O |
| Молярна маса | 386,65 г/моль |
| Зовнішній вигляд | білий кристалічний порошок |
| Густина | 1,052 г/см3 |
| Тпл | 148–150° C |
| Ткип | 360° C |
| Розчинність (вода) | 0,095 мг/л (30° C) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
| Типи жирів у їжі |
|---|
| Дивіться також |
Холестеро́л (іноді холестерин; англ. cholesterol) — речовина з групи стеролів. У значних кількостях міститься в нервовій та жировій тканинах, печінці тощо. У хребетних тварин і людини — біохімічний попередник стероїдних гормонів, жовчних кислот, ліпопротеїнів (сполук, у формі яких ліпіди транспортуються по організму) та вітаміну D[1]. Надлишок холестеролу в організмі людини призводить до утворення жовчних каменів, відкладення холестеролу на стінках судин, порушення обміну речовин.
Історія[ред. | ред. код]
1769 року Франсуа Пулетьє де ла Саль отримав з жовчних каменів густу білу речовину («жировіск»), що мала властивості жирів. У чистому вигляді холестерол уперше виділив хімік Антуан-Франсуа де Фуркруа в 1789 році. Хімік Мішель-Ежен Шеврель, що теж отримав цю сполуку 1815 року, назвав її холестерином. У 1859 році Марселен Бертло встановив, що холестерин належить до класу спиртів, тому відповідно до номенклатури його назва має утворюватися з суфіксом -ол. У французькій хімічній термінології відразу ж було прийняте нове найменування холестерол, але стара некоректна з наукової точки зору назва збереглась у деяких мовах.
Фізіологія[ред. | ред. код]
Холестерол необідний усім тваринам і кожна клітина може синтезувати його через складний процес із 37 кроків. Цей процес починається зі шляху мевалонату або HMGCR (3-гідрокси-3-метилглютарил-кофермент А редуктази), мішені статинів. Цей шлях охоплює перші 18 кроків. Далі слідують 19 кроків із перетворення отриманого ланостерину на холестерол.
Чоловік вагою 68 кг (150 lb) зазвичай синтезує приблизно 1 грам холестеролу на день, а в його тілі знаходиться всього 35 грам, які здебільшого є частиною клітинної мембрани. Щоденно типовий чоловік-американець отримує 307 мг холестеролу з їжі[2].
Більшість спожитого холестеролу естерифікована, через що він погано всмоктується кишківником. Організм також компенсує недостатнє поглинання спожитого холестерину шляхом зниження синтезу власного[3]. Через це холестерол із їжі після 7-10 годин після споживання має незначний, якщо взагалі має, ефект на концентрацію холестеролу в крові[4]. Однак, протягом перших 7 годин після споживання холестеролу, оскільки абсорбовані жири розносяться по тілу по міжклітинній рідині різними ліпопротеїнами (вони транспортують усі жири по рідині поза клітинами), концентрація зростає[5].
Рослини виробляють дуже мало холестеролу[6]. У більших кількостях вони виробляють фітостерини, хімічно подібні речовини, які можуть конкурувати з холестерином за реабсорбцію в кишковому тракті, таким чином потенційно знижуючи його реабсорбцію[7]. Коли клітини слизової оболонки кишечника поглинають фітостерини замість холестеролу, вони зазвичай виділяють молекули фітостерину назад у шлунково-кишківниковий тракт, що є важливим захисним механізмом. Споживання фітостеринів природного походження, які складаються з рослинних стеролів і станолів, варіюється між ≈200–300 мг/доба, задежно від харчових звичок[8]. Деякі спеціально розроблені вегетаріанські експериментальні дієти дають більше 700 мг/день[9].
Функція в клітинах[ред. | ред. код]
Мембрани[ред. | ред. код]
Холестерол становить 30% усіх тваринних клітинних мембран. Це необхідно для утворення та підтримки мембран і це регулює текучість мембрани у діапазоні низьких температур. Гідроксильна група кожної молекули холестеролу взаємодіє з молекулами води, що оточує мембрану, як і полярні головки мембранних фосфоліпідів і сфінголіпідів, коли великий стероїдний і вуглеводневий ланцюг вбудовується в мембрану разом із неполярним ланцюгом жирних кислот із інших ліпідів. Через взаємодію з фосфоліпідними ланцюгами жирних кислот холестерол збільшує щільність мембрани, що змінює текучість мембрани[10] і підтримує її цілісність, через що тваринним клітинам не потрібно утворювати клітинну оболонку (як більшості рослин і бактерій). Мембрана залишається міцною та крепкою, але не жорсткою, що дозволяє клітинам тварин змінювати форму, а тваринам рухатися.
Структура тетрациклічного кільця холестеролу сприяє текучості клітинної мембрани, оскільки молекула знаходиться у транс-конформації, роблячи усю молекулу холестеролу окрім бічних ланцюгів жорстким і пласким[11]. Виконуючи цю структурну роль, холестерин також знижує проникність плазматичної мембрани для нейтральних розчинених речовин[12], йонів вондю та йонів натрію[13].
Презентація субстрата[ред. | ред. код]
Холестерол регулює біологічний процес презентації субстрата і ферменти, які використовують механізм презентації субстрата для своєї активації. (PLD2) - чітко визначений приклад такого ферменту[14]. Фермент пальмітується, що спричиняє його рух до холестерол-залежних ліпідних доменів, які іноді називають "ліпідними рафтами". Субстратом фосполіпази D є фосфатидилхолін (PC; ФХ), який є неначименим і містяться в ліпідних рафтах у низькій кількості. ФХ локалізується у хворій частині клітини разом із поліненасиченим жирамом - фосфатидилінозитол-4,5-бісфосфатом (PIP2). PLD2 містить зв'язуючий домен до PIP2. Коли концентрація PIP2 у мембрані зростає, PLD2 залишає холестерол-залежний домен і прив'язується до PIP2, завдяки чому отримує доступ до його субстрата ФХ і розпочинає каталіз на основі презентації субстрата.

Сигналювання[ред. | ред. код]
Холестерол також залучений до сигнальних процесів клітин, допомагаючи формувати ліпідні рафти у плазматичній мембрані, що ставить білки-рецептори в безпосередню близькість до високих концентрацій інших клітин-месенджерів[15]. У багатьох шарах холестерин і фосфоліпіди, які обидва є електроізоляторами, можуть сприяти швидкості передачі електричних імпульсів по нервових тканинах. Для багатьох нейронних волокон мієлінова оболонка, багата холестерином, оскільки вона походить від ущільнених шарів мембран шваннівських клітин, забезпечує ізоляцію для більш ефективного проведення імпульсів[16]. Демієлінізація (втрата деяких таких шваннівських клітин) вважається частиною основи розсіяного склерозу.
Холестерол зв'язується з великою кількістю іонних каналів, таких як нікотиновий ацетилхоліновий рецептор, ГАМКA-рецептор і калієві канали внутрішнього випрямлення, та впливає на їх воротний механізм[17]. Холестерол також активує eSRRA (ERRα) і може бути ендогенним лігандом для цього рецептора[18][19]. Конститутивно активна природа рецептора може бути пояснена тим фактом, що холестерин є всюди в організмі[19]. Інгібування передачі сигналів ERRα шляхом зменшення вироблення холестерину було визначено як ключовий медіатор впливу статинів і бісфосфонатів на кістки, м'язи і макрофагиs[18][19]. Опираючись на ці дослідження, було запропоновано деорфанувати рецептор ERRα і класифікувати його як рецептор холестеролу[18][19].
Прекурсор[ред. | ред. код]
Холестерол є також прекурсором для декількох біохімічних шляхів. Наприклад, він є прекурсором для синтезу вітаміну D в метаболізмі кальцію та всіх стероїдних гормонів, включаючи гормони надниркової залози: кортизол і альдостерон, а також гормони прогестерон, естрогени, тестостерон і похідні від них[20][21].
Метаболізм[ред. | ред. код]
Організм використовує холестерол повторно. Печінка виділяє холестерол у жовч, яка потім зберігається в жовчному міхурі, який потім виділяє їх у неестерифікованій формі (через жовч) у травний. тракт. Як правило, близько 50% виділеного холестеролу реабсорбується тонкою кишною назад у кров'яний потік[22].
Біосинтез та регуляція[ред. | ред. код]
Біосинтез[ред. | ред. код]
Усі тваринні клітини (винятки існують лише у безхребетних) виробляти холестерол для підтримки структури мембран та інших цілей. Відносна величина його вироблення варіюється залежно від типу клітини та функції органу. Близько 80% від усього виробленого за день холестеролу продукується у печінці та кишках[23]; значні частини решти біосинтезу відбуваються в головному мозку, надниркових залозах та репродуктивних орагнах.
Синтез у тілі починається з мелавонатного шляху, в якому дві молекули ацетилу-КоА конденсується задля формування ацетоацетилу-КоА. За цим слідує друга конденсація між ацетилом-КоА та ацетоацетилом-КоА для формування 3-гідрокси-3-метилглютарилу КоА[24].

Ця молекула потім відновлюється до мевалонату 3-гідрокси-3-метилглютарил-КоА редуктазою. Вироблення мевалонату є обмежуючим та незворотнім кроком у синтезі холестеролу, а також місцем дії статинів (клас холестерол-знижуючих препаратів).
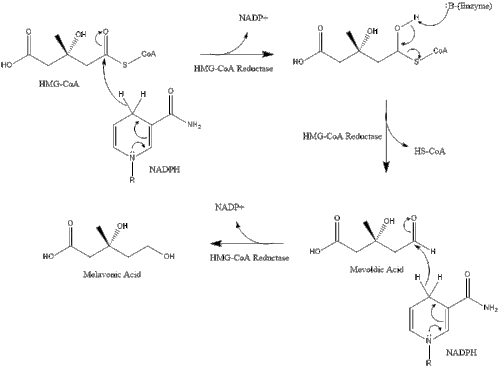
Потім мелавонат перетворюється на ізопентенилпірофосфат через два кроки фосфорилювання та один крок декарбоксилювання, який потребує АТФ.
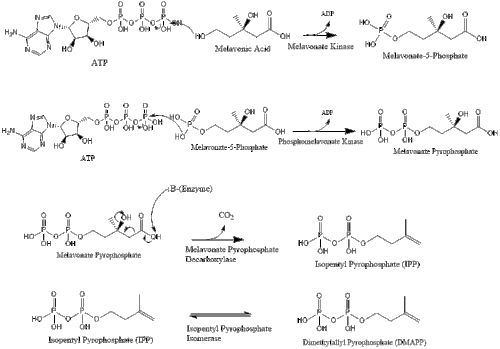
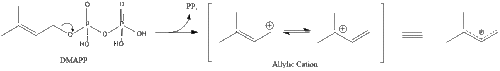
Три молекули ізопентенилпірофосфату конденсуються для формування фарнезилпірофосфату за допомогою дії of геранилтрансферази.

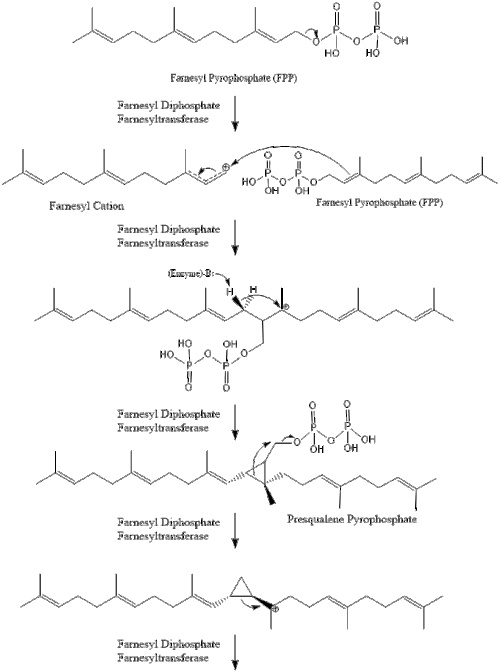
Дві молекули фарнезилпірофосфат потім конденсуються для формування сквалену за допомогою дії скваленсинтази в ендоплазматичному ретикулумі[24].
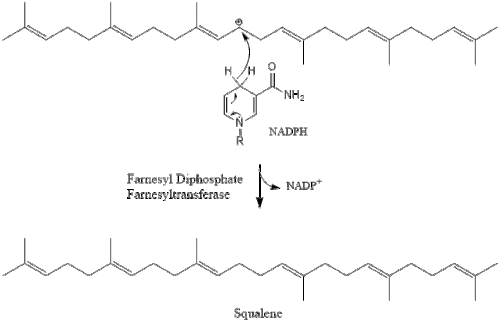
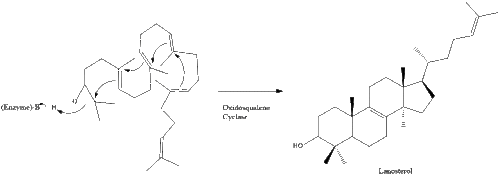
Оксидоскваленциклаза потім циклізує сквален для формування ланостеролу.
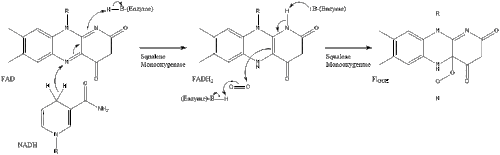
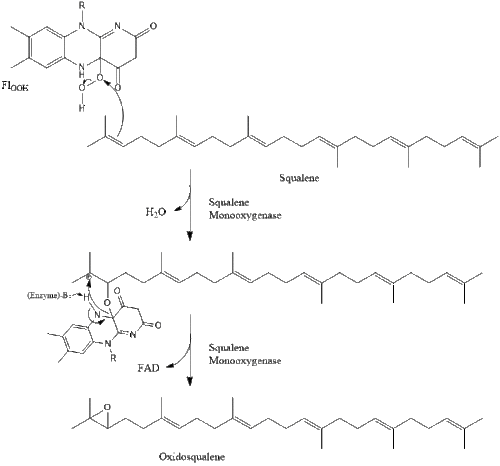
Під кінець, ланостерол перетворюється на холестерол через один із двох шляхів: шлях Блоха або шлях Кандуч-Рассел[25][26][27][28][29]. Фінальні 19 кроків для формування холестеролу задіюють NADPH та кисень для окиснення метильних груп задля вилучення вуглецю, мутази для переміщення алкенових груп, та NADH задля відновлення кетонів.
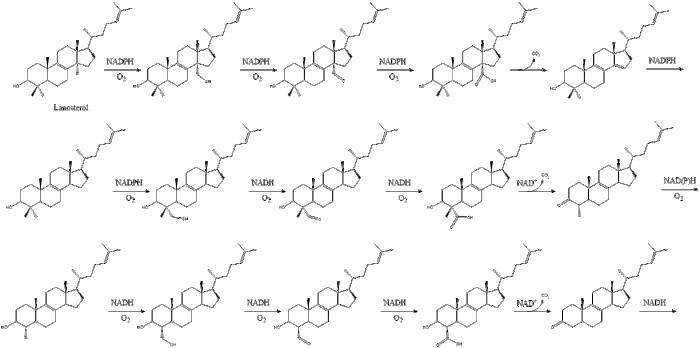

Конрад Блох і Феодор Лінен розділили Нобелівську премію з фізіології або медицини 1964 року за їхні відкриття щодо деяких механізмів та методів регуляції холестеролу та метаболізму жирних кислот[30].
Regulation of cholesterol synthesis[ред. | ред. код]
Biosynthesis of cholesterol is directly regulated by the cholesterol levels present, though the homeostatic mechanisms involved are only partly understood. A higher intake of food leads to a net decrease in endogenous production, whereas a lower intake of food has the opposite effect. The main regulatory mechanism is the sensing of intracellular cholesterol in the ендоплазматичний ретикулум by the білки SREBP (sterol regulatory element-binding protein 1 and 2).[31] In the presence of cholesterol, SREBP is bound to two other proteins: SCAP (SREBP cleavage-activating protein) and INSIG1. When cholesterol levels fall, INSIG-1 dissociates from the SREBP-SCAP complex, which allows the complex to migrate to the Комплекс Ґольджі. Here SREBP is cleaved by S1P and S2P (site-1 protease and site-2 protease), two enzymes that are activated by SCAP when cholesterol levels are low.
The cleaved SREBP then migrates to the nucleus and acts as a фактори транскрипції to bind to the sterol regulatory element (SRE), which stimulates the transcription of many genes. Among these are the low-density lipoprotein (LDL) receptor and HMGCR. The LDL receptor scavenges circulating LDL from the bloodstream, whereas HMG-CoA reductase leads to an increase in endogenous production of cholesterol.[32] A large part of this signaling pathway was clarified by Dr. Майкл Стюарт Браун and Dr. Джозеф Леонард Голдштейн in the 1970s. In 1985, they received the Нобелівська премія з фізіології або медицини for their work. Their subsequent work shows how the SREBP pathway regulates the expression of many genes that control lipid formation and metabolism and body fuel allocation.
Cholesterol synthesis can also be turned off when cholesterol levels are high. HMG-CoA reductase contains both a cytosolic domain (responsible for its catalytic function) and a membrane domain. The membrane domain senses signals for its degradation. Increasing concentrations of cholesterol (and other sterols) cause a change in this domain's oligomerization state, which makes it more susceptible to destruction by the протеасома. This enzyme's activity can also be reduced by phosphorylation by an AMP-activated protein кінази. Because this kinase is activated by AMP, which is produced when ATP is hydrolyzed, it follows that cholesterol synthesis is halted when ATP levels are low.[33]
Plasma transport and regulation of absorption[ред. | ред. код]

As an isolated molecule, cholesterol is only minimally soluble in вода, or hydrophilic. Because of this, it dissolves in blood at exceedingly small concentrations. To be transported effectively, cholesterol is instead packaged within ліпопротеїниs, complex discoidal particles with exterior amphiphilic proteins and lipids, whose outward-facing surfaces are water-soluble and inward-facing surfaces are lipid-soluble. This allows it to travel through the blood via emulsification. Unbound cholesterol, being amphipathic, is transported in the monolayer surface of the lipoprotein particle along with phospholipids and proteins. Cholesterol esters bound to fatty acid, on the other hand, are transported within the fatty hydrophobic core of the lipoprotein, along with triglyceride.[34]
There are several types of lipoproteins in the blood. In order of increasing density, they are chylomicrons, very-low-density lipoprotein (VLDL), intermediate-density lipoprotein (IDL), ліпопротеїни низької густини (LDL), and ліпопротеїни високої густини (HDL). Lower protein/lipid ratios make for less dense lipoproteins. Cholesterol within different lipoproteins is identical, although some is carried as its native "free" alcohol form (the cholesterol-OH group facing the water surrounding the particles), while others as fatty acyl esters, known also as cholesterol esters, within the particles.[34]
Lipoprotein particles are organized by complex apolipoproteins, typically 80–100 different proteins per particle, which can be recognized and bound by specific receptors on cell membranes, directing their lipid payload into specific cells and tissues currently ingesting these fat transport particles. These surface receptors serve as unique molecular signatures, which then help determine fat distribution delivery throughout the body.[34]
Chylomicrons, the least dense cholesterol transport molecules, contain apolipoprotein B-48, apolipoprotein C, and аполіпопротеїн E (the principal cholesterol carrier in the brain[35]) in their shells. Chylomicrons carry fats from the intestine to muscle and other tissues in need of fatty acids for energy or fat production. Unused cholesterol remains in more cholesterol-rich chylomicron remnants, and taken up from here to the bloodstream by the liver.[34]
VLDL molecules are produced by the liver from triacylglycerol and cholesterol which was not used in the synthesis of bile acids. These molecules contain apolipoprotein B100 and аполіпопротеїн E in their shells, and can be degraded by ліпопротеїнліпаза on the artery wall to IDL. This arterial wall cleavage allows absorption of triacylglycerol and increases the concentration of circulating cholesterol. IDL molecules are then consumed in two processes: half is metabolized by LIPC and taken up by the LDL receptor on the liver cell surfaces, while the other half continues to lose triacylglycerols in the bloodstream until they become cholesterol-laden LDL particles.[34]
LDL particles are the major blood cholesterol carriers. Each one contains approximately 1,500 molecules of cholesterol ester. LDL molecule shells contain just one molecule of apolipoprotein B100, recognized by Рецептор ліпопротеїнів низької густиниs in peripheral tissues. Upon binding of apolipoprotein B100, many LDL receptors concentrate in клатрин-coated pits. Both LDL and its receptor form vesicles within a cell via ендоцитоз. These vesicles then fuse with a лізосома, where the lysosomal acid lipase enzyme hydrolyzes the cholesterol esters. The cholesterol can then be used for membrane biosynthesis or esterified and stored within the cell, so as to not interfere with the cell membranes.[34]
LDL receptors are used up during cholesterol absorption, and its synthesis is regulated by SREBP, the same protein that controls the synthesis of cholesterol de novo, according to its presence inside the cell. A cell with abundant cholesterol will have its LDL receptor synthesis blocked, to prevent new cholesterol in LDL molecules from being taken up. Conversely, LDL receptor synthesis proceeds when a cell is deficient in cholesterol.[34]
When this process becomes unregulated, LDL molecules without receptors begin to appear in the blood. These LDL molecules are oxidized and taken up by macrophages, which become engorged and form foam cells. These foam cells often become trapped in the walls of blood vessels and contribute to atherosclerotic plaque formation. Differences in cholesterol homeostasis affect the development of early atherosclerosis (carotid intima-media thickness).[36] These plaques are the main causes of heart attacks, strokes, and other serious medical problems, leading to the association of so-called LDL cholesterol (actually a ліпопротеїни) with "bad" cholesterol.[33]
HDL particles are thought to transport cholesterol back to the liver, either for excretion or for other tissues that synthesize hormones, in a process known as reverse cholesterol transport (RCT).[37] Large numbers of HDL particles correlates with better health outcomes,[38] whereas low numbers of HDL particles is associated with atheromatous disease progression in the arteries.[39]
Metabolism, recycling and excretion[ред. | ред. код]
Cholesterol is susceptible to oxidation and easily forms oxygenated derivatives called oxysterols. Three different mechanisms can form these: autoxidation, secondary oxidation to lipid peroxidation, and cholesterol-metabolizing enzyme oxidation. A great interest in oxysterols arose when they were shown to exert inhibitory actions on cholesterol biosynthesis.[40] This finding became known as the "oxysterol hypothesis". Additional roles for oxysterols in human physiology include their participation in bile acid biosynthesis, function as transport forms of cholesterol, and regulation of gene transcription.[41]
In biochemical experiments radiolabelled forms of cholesterol, such as tritiated-cholesterol are used. These derivatives undergo degradation upon storage and it is essential to purify cholesterol prior to use. Cholesterol can be purified using small Sephadex LH-20 columns.[42]
Cholesterol is oxidized by the liver into a variety of bile acids.[43] These, in turn, are conjugated with гліцин, таурин, глюкуронова кислота, or сульфати. A mixture of conjugated and nonconjugated bile acids, along with cholesterol itself, is excreted from the печінка into the жовч. Approximately 95% of the bile acids are reabsorbed from the intestines, and the remainder are lost in the feces.[44] The excretion and reabsorption of bile acids forms the basis of the кишково-печінкова циркуляція жовчних кислот, which is essential for the digestion and absorption of dietary fats. Under certain circumstances, when more concentrated, as in the жовчний міхур, cholesterol crystallises and is the major constituent of most жовчні каменіs (лецитин and білірубін gallstones also occur, but less frequently).[45] Every day, up to 1 g of cholesterol enters the colon. This cholesterol originates from the diet, bile, and desquamated intestinal cells, and can be metabolized by the colonic bacteria. Cholesterol is converted mainly into coprostanol, a nonabsorbable sterol that is excreted in the feces.[джерело?]
Although cholesterol is a steroid generally associated with mammals, the human pathogen Mycobacterium tuberculosis is able to completely degrade this molecule and contains a large number of genes that are regulated by its presence.[46] Many of these cholesterol-regulated genes are homologues of жирні кислоти β-oxidation genes, but have evolved in such a way as to bind large steroid substrates like cholesterol.[47][48]
Біотрансформація холестеролу[ред. | ред. код]
| Цей розділ потребує доповнення. (січень 2016) |
В організмі холестерол зазнає біотрансформації, численних метаболічних перетворень. Цей процес забезпечує синтез стероїдних сполук та забезпечує умови для екскреції надлишків стеролу. Першим етапом біотрансформації холестеролу є утворення його етерів з вищими карбоновими кислотами[49].
Примітки[ред. | ред. код]
- ↑ Biosynthesis and Regulation of Cholesterol (with Animation) | Animations | PharmaXChange.info. PharmaXChange.info. Процитовано 27 січня 2016.
- ↑ National Health and Nutrition Examination Survey (PDF). United States Center for Disease Control. Процитовано 28 січня 2012.
- ↑ Lecerf JM, de Lorgeril M (July 2011). Dietary cholesterol: from physiology to cardiovascular risk. The British Journal of Nutrition. 106 (1): 6—14. doi:10.1017/S0007114511000237. PMID 21385506.
- ↑ Soliman GA (June 2018). Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease. Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ↑ Dubois C, Armand M, Mekki N, Portugal H, Pauli AM, Bernard PM, Lafont H, Lairon D (November 1994). Effects of increasing amounts of dietary cholesterol on postprandial lipemia and lipoproteins in human subjects. Journal of Lipid Research. 35 (11): 1993—2007. doi:10.1016/S0022-2275(20)39946-6. PMID 7868978.
{{cite journal}}: Недійсний|display-authors=6(довідка) - ↑ Behrman EJ, Gopalan V (2005). Scovell WM (ред.). Cholesterol and Plants. Journal of Chemical Education. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791.
- ↑ John S, Sorokin AV, Thompson PD (February 2007). Phytosterols and vascular disease. Current Opinion in Lipidology. 18 (1): 35—40. doi:10.1097/MOL.0b013e328011e9e3. PMID 17218830. S2CID 29213889.
- ↑ Jesch ED, Carr TP (June 2017). Food Ingredients That Inhibit Cholesterol Absorption. Preventive Nutrition and Food Science. 22 (2): 67—80. doi:10.3746/pnf.2017.22.2.67. PMC 5503415. PMID 28702423.
- ↑ Agren JJ, Tvrzicka E, Nenonen MT, Helve T, Hänninen O (February 2001). Divergent changes in serum sterols during a strict uncooked vegan diet in patients with rheumatoid arthritis. The British Journal of Nutrition. 85 (2): 137—9. doi:10.1079/BJN2000234. PMID 11242480.
- ↑ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology 9th Edition. San Francisco: Freeman. с. 105—114. ISBN 978-1-4292-4646-0.
- ↑ Ohvo-Rekilä H, Ramstedt B, Leppimäki P, Slotte JP (January 2002). Cholesterol interactions with phospholipids in membranes. Progress in Lipid Research. 41 (1): 66—97. doi:10.1016/S0163-7827(01)00020-0. PMID 11694269.
- ↑ Yeagle PL (October 1991). Modulation of membrane function by cholesterol. Biochimie. 73 (10): 1303—10. doi:10.1016/0300-9084(91)90093-G. PMID 1664240.
- ↑ Haines TH (July 2001). Do sterols reduce proton and sodium leaks through lipid bilayers?. Progress in Lipid Research. 40 (4): 299—324. doi:10.1016/S0163-7827(01)00009-1. PMID 11412894.
- ↑ Petersen EN, Chung HW, Nayebosadri A, Hansen SB (December 2016). Kinetic disruption of lipid rafts is a mechanosensor for phospholipase D. Nature Communications. 7: 13873. Bibcode:2016NatCo...713873P. doi:10.1038/ncomms13873. PMC 5171650. PMID 27976674.
- ↑ Incardona JP, Eaton S (April 2000). Cholesterol in signal transduction. Current Opinion in Cell Biology. 12 (2): 193—203. doi:10.1016/S0955-0674(99)00076-9. PMID 10712926.
- ↑ Pawlina W, Ross MW (2006). Histology: a text and atlas: with correlated cell and molecular biology. Philadelphia: Lippincott Wiliams & Wilkins. с. 230. ISBN 978-0-7817-5056-1.
- ↑ Levitan I, Singh DK, Rosenhouse-Dantsker A (2014). Cholesterol binding to ion channels. Frontiers in Physiology. 5: 65. doi:10.3389/fphys.2014.00065. PMC 3935357. PMID 24616704.
- ↑ а б в Wei W, Schwaid AG, Wang X, Wang X, Chen S, Chu Q, Saghatelian A, Wan Y (March 2016). Ligand Activation of ERRα by Cholesterol Mediates Statin and Bisphosphonate Effects. Cell Metabolism. 23 (3): 479—91. doi:10.1016/j.cmet.2015.12.010. PMC 4785078. PMID 26777690.
{{cite journal}}: Недійсний|display-authors=6(довідка) - ↑ а б в г Nuclear Receptors in Development and Disease. Elsevier Science. 17 May 2017. с. 88–. ISBN 978-0-12-802196-5.
- ↑ Hanukoglu I (December 1992). Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis. The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779—804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ↑ Payne AH, Hales DB (December 2004). Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones. Endocrine Reviews. 25 (6): 947—70. doi:10.1210/er.2003-0030. PMID 15583024.
- ↑ Cohn JS, Kamili A, Wat E, Chung RW, Tandy S (February 2010). Dietary phospholipids and intestinal cholesterol absorption. Nutrients. 2 (2): 116—27. doi:10.3390/nu2020116. PMC 3257636. PMID 22254012.
- ↑ How it's made: Cholesterol production in your body (амер.). Harvard Health Publishing. Процитовано 18 жовтня 2018.
- ↑ а б Biosynthesis and Regulation of Cholesterol (with Animation). PharmaXChange.info. 17 September 2013.
- ↑ Cholesterol metabolism (includes both Bloch and Kandutsch-Russell pathways) (Mus musculus) – WikiPathways. www.wikipathways.org. Процитовано 2 February 2021.
- ↑ Singh P, Saxena R, Srinivas G, Pande G, Chattopadhyay A (2013). Cholesterol biosynthesis and homeostasis in regulation of the cell cycle. PLOS ONE. 8 (3): e58833. Bibcode:2013PLoSO...858833S. doi:10.1371/journal.pone.0058833. PMC 3598952. PMID 23554937.
- ↑ Kandutsch-Russell pathway. pubchem.ncbi.nlm.nih.gov (англ.). Процитовано 2 February 2021.
- ↑ Berg J (2002). Biochemistry. New York: WH Freeman. ISBN 978-0-7167-3051-4.
- ↑ Rhodes CM, Stryer L, Tasker R (1995). Biochemistry (вид. 4th). San Francisco: W.H. Freeman. с. 280, 703. ISBN 978-0-7167-2009-6.
- ↑ The Nobel Prize in Physiology or Medicine, 1964. Nobel Prize, Nobel Media.
- ↑ Espenshade PJ, Hughes AL (2007). Regulation of sterol synthesis in eukaryotes. Annual Review of Genetics. 41: 401—27. doi:10.1146/annurev.genet.41.110306.130315. PMID 17666007.
- ↑ Brown MS, Goldstein JL (May 1997). The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3): 331—40. doi:10.1016/S0092-8674(00)80213-5. PMID 9150132. S2CID 17882616.
- ↑ а б Tymoczko JL, Berg T, Stryer L, Berg JM (2002). Biochemistry. San Francisco: W.H. Freeman. с. 726–727. ISBN 978-0-7167-4955-4.
- ↑ а б в г д е ж Patton KT, Thibodeau GA (2010). Anatomy and Physiology (вид. 7). Mosby/Elsevier. ISBN 978-9996057762.
- ↑ Mahley RW (July 2016). Apolipoprotein E: from cardiovascular disease to neurodegenerative disorders. Journal of Molecular Medicine. 94 (7): 739—46. doi:10.1007/s00109-016-1427-y. PMC 4921111. PMID 27277824.
- ↑ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S, Ulrich C, Girndt M, Böhm M, Fliser D, Laufs U, Lütjohann D, Heine GH (October 2010). Federici M (ред.). The relationships of markers of cholesterol homeostasis with carotid intima-media thickness. PLOS ONE. 5 (10): e13467. Bibcode:2010PLoSO...513467W. doi:10.1371/journal.pone.0013467. PMC 2956704. PMID 20976107.
{{cite journal}}: Недійсний|display-authors=6(довідка) - ↑ Lewis GF, Rader DJ (June 2005). New insights into the regulation of HDL metabolism and reverse cholesterol transport. Circulation Research. 96 (12): 1221—1232. doi:10.1161/01.RES.0000170946.56981.5c. PMID 15976321.
- ↑ Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, Jacobs DR, Bangdiwala S, Tyroler HA (January 1989). High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation. 79 (1): 8—15. doi:10.1161/01.CIR.79.1.8. PMID 2642759.
{{cite journal}}: Недійсний|display-authors=6(довідка) - ↑ Miller NE, Thelle DS, Forde OH, Mjos OD (May 1977). The Tromsø heart-study. High-density lipoprotein and coronary heart-disease: a prospective case-control study. Lancet. 1 (8019): 965—968. doi:10.1016/s0140-6736(77)92274-7. PMID 67464. S2CID 140204202.
- ↑ Kandutsch AA, Chen HW, Heiniger HJ (August 1978). Biological activity of some oxygenated sterols. Science. 201 (4355): 498—501. Bibcode:1978Sci...201..498K. doi:10.1126/science.663671. PMID 663671.
- ↑ Russell DW (December 2000). Oxysterol biosynthetic enzymes. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1529 (1–3): 126—35. doi:10.1016/S1388-1981(00)00142-6. PMID 11111082.
- ↑ Hanukoglu I, Jefcoate CR (1980). Pregnenolone separation from cholesterol using Sephadex LH-20 mini-columns. Journal of Chromatography A. 190 (1): 256—262. doi:10.1016/S0021-9673(00)85545-4.
- ↑ Javitt NB (December 1994). Bile acid synthesis from cholesterol: regulatory and auxiliary pathways. FASEB Journal. 8 (15): 1308—11. doi:10.1096/fasebj.8.15.8001744. PMID 8001744. S2CID 20302590.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Wolkoff AW, Cohen DE (February 2003). Bile acid regulation of hepatic physiology: I. Hepatocyte transport of bile acids. American Journal of Physiology. Gastrointestinal and Liver Physiology. 284 (2): G175-9. doi:10.1152/ajpgi.00409.2002. PMID 12529265.
- ↑ Marschall HU, Einarsson C (June 2007). Gallstone disease. Journal of Internal Medicine. 261 (6): 529—42. doi:10.1111/j.1365-2796.2007.01783.x. PMID 17547709. S2CID 8609639.
- ↑ Wipperman MF, Sampson NS, Thomas ST (2014). Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis. Critical Reviews in Biochemistry and Molecular Biology. 49 (4): 269—93. doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808.
- ↑ Thomas ST, Sampson NS (April 2013). Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain. Biochemistry. 52 (17): 2895—904. doi:10.1021/bi4002979. PMC 3726044. PMID 23560677.
- ↑ Wipperman MF, Yang M, Thomas ST, Sampson NS (October 2013). Shrinking the FadE proteome of Mycobacterium tuberculosis: insights into cholesterol metabolism through identification of an α2β2 heterotetrameric acyl coenzyme A dehydrogenase family. Journal of Bacteriology. 195 (19): 4331—41. doi:10.1128/JB.00502-13. PMC 3807453. PMID 23836861.
- ↑ Губський, 2000, с. 220.
Література[ред. | ред. код]
- Губський Ю. Біологічна хімія. — Київ-Тернопіль : Укрмедкнига, 2000. — 508 с. — ISBN 966-7364-41-0.
- Гонський Я., Максимчук Т., Калинський М. Біохімія людини. — Тернопіль : Укрмедкнига, 2002. — 744 с. — ISBN 966-7364-17-8.
Посилання[ред. | ред. код]
| Це незавершена стаття з біохімії. Ви можете допомогти проєкту, виправивши або дописавши її. |