Оксиди амінів
Оксиди амінів (N-оксиди) — похідні третинних (зокрема і гетероароматичних) амінів загальної формули . До N-оксидів також відносять аналогічні похідні первинних та вторинних амінів[1]. N-оксиди імінів називають нітронами[2].
Оксиди третинних амінів — стабільні речовини, нижчі N-оксиди розчиняються у воді та обмежено розчинні в неполярних розчинниках. Оксиди первинних і вторинних амінів нестабільні і перегруповуються in situ в гідроксиламіни.
Загальні відомості[ред. | ред. код]
Хіміки вивчали оксиди амінів ще до 1900 року, але тільки після того, як компанія IGFarbenindustrie 1939 року отримала патент на речовину диметилдодецил амін оксид, оксиди амінів стали загальновизнаними поверхнево-активними речовинами (ПАР). За 22 роки виявлено корисність включення оксидів аміну в рецептури рідких засобів побутової хімії, що сприяло широкому інтересу виробників до цього класу сполук. Заміна алканоламідів жирних кислот, традиційно використовуваних, як піноутворювачі в рецептурах засобів для миття посуду оксидом аміну — це приклад застосування цієї речовини, що призвів до її популяризації. Співвідношення між кількістю оксиду аміну, що вводиться в рецептуру, і одержуваним ефектом компенсувало його вищу вартість.
Реакція між перекисом водню і вторинними або первинними амінами не приводить до синтезу речовин, цікавих з комерційної точки зору, зате реакція з третинними амінами дає можливість отримувати речовини, які можна використовувати не тільки в різних мийних засобах, але й у рідких відбілювачах на основі гіпохлориту натрію, і як антистатик у текстильній промисловості, як стабілізатор піни при виробництві гуми, як каталізатори полімеризації при виготовленні пластиків, як антикорозійні склади, як диспергатор кальцієвого мила та антибактеріальний агент у твердих дезодорантах, що обумовлено доброю сумісністю з іншими компонентами складу та синергізмом. Оксиди аміну одержують в результаті екзотермічної реакції другого порядку між перекисом водню та третинними амінами, природа яких може бути аліфатичною, ароматичною, гетероциклічною, аліциклічною або їх комбінацією. У поширених оксидах аміну попередня ПАР зазвичай C12-C18 алкілдиметил амін.
Оксиди амінів відносять до особливого класу ПАР, класифікованих як амфотерні ПАР. Це пов'язано з тим, що оксид аміну є цвітер-іонною молекулою, яка при зміні pH від низької до високої величини змінює свою природу з катіонної на неіоногенну.
Оксиди аміну мають низький коефіцієнт біологічного накопичення, легко видаляються стандартними способами очищення стічних вод, біорозкладні під дією аеробних та анаеробних бактерій. Усі оксиди аміну мають токсичність від низької до помірної[3].
Реакційна здатність[ред. | ред. код]
Зв'язок в N-оксидах диполярний зі суттєво підвищеною електронною густиною на атомі кисню, що є нуклеофільним центром.
Так, N-оксиди протонуються, утворюючи кристалічні солі з сильними кислотами, однак є слабшими основами, ніж початкові аміни. N-оксиди алкілюються з утворенням солей тетразаміщеного гідроксиамонію, що розкладаються у водному лугу з утворенням альдегідів та третинних амінів:
Ацилювання аліфатичних N-оксидів приводить до нестабільних O-ацилпохідних, котрі, як і O-алкілпохідні, розкладаються з утворенням альдегіду та заміщеного ацетаміду:
Ця реакція з подальшим гідролізом ацетаміду використовується як метод деметилювання метиламінів (реакція Полоновського):
N-оксиди третинних амінів, в алкільних замісниках яких є атом водню в β-положенні до N-оксидного азоту, при нагріванні розкладаються з утворенням алкенів та гідроксиламінів. Реакцію використовують для синтезу алкенів із третинних амінів, N-оксиди яких найчастіше синтезують in situ і, не очищаючи, піддають термічному розкладання (елімінування за Коупом)[4]:
При нагріванні в розчині лугу або при фотолізі N-оксиди третинних амінів перегруповуються в O-заміщені гідроксиламіни (реакція Майзенхаймера), реакція зазвичай протікає як 1,2-зсув:
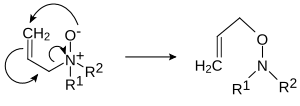
У разі N-оксидів аліламінів можливе 2,3-перегрупування в O-алілгідроксиламіни:
За каталітичного гідрування над нікелем або паладієм, а також під дією фосфінів N-оксиди відновлюються до початкових амінів.
Синтез[ред. | ред. код]
Загальний метод синтезу N-оксидів — окислення третинних амінів перекисом водню, реакцію в разі аліфатичних амінів проводять у нейтральному середовищі, в разі ароматичних — у кислому:
У природі[ред. | ред. код]

Триметиламіноксид[en] утворюється в організмі людини з триметиламіну[en], який, у свою чергу, є результатом переробки карнітину, холіну, бетаїну та лецитину кишковим мікробіомом[5].
N-оксиди пергідроазафеналенів — кокцинелін[6] і конвергін[7] входять до складу гемолімфи сонечок, при захисній реакції гемолімфа виділяється з отворів біля рота і в суглобах ніжок, надзвичайно гіркий смак цих сполук відіграє захисну роль.
Див. також[ред. | ред. код]
Примітки[ред. | ред. код]
- ↑ amine oxides // IUPAC Gold Book. Архів оригіналу за 2 листопада 2013. Процитовано 8 жовтня 2013.
- ↑ nitrones // IUPAC Gold Book. Архів оригіналу за 21 жовтня 2012. Процитовано 8 жовтня 2013.
- ↑ Об оксидах аминов. https://nobel-group.by (русский) . 11 грудня 2017. Архів оригіналу за 29 червня 2021. Процитовано 29 червня 2021.
- ↑ Arthur C. Cope, Engelbert Ciganek. Methylenecyclohexane and n, n-dimethylhydroxylamine hydrochloride. Organic Syntheses, Coll. Vol. 4, p.612 (1963); Vol. 39, p.40 (1959). Архів оригіналу за 22 серпня 2010. Процитовано 8 жовтня 2013.
- ↑ Chhibber-Goel J, Singhal V, Parakh N, Bhargava B, Sharma A. The Metabolite Trimethylamine-N-Oxide is an Emergent Biomarker of Human Health. PubMed.
- ↑ Holloway, Graham J.; de Jong, Peter W.; Brakefield, Paul M.; de Vos, Helene (1 грудня 1991). Chemical defence in ladybird beetles (Coccinellidae). I. Distribution of coccinelline and individual variation in defence in 7-spot ladybirds (Coccinella septempunctata). CHEMOECOLOGY. 2 (1): 7—14. doi:10.1007/BF01240660. ISSN 1423-0445. Процитовано 10 вересня 2020.
- ↑ Tursch, B.; Daloze, D.; Braekman, J. C.; Hootele, C.; Cravador, A.; Losman, D.; Karlsson, R. (1974). Chemical ecology of arthropods. 9. Structure and absolute configuration of hippodamine and convergine, two novel alkaloids from american ladybug hippodamia convergens (coleoptera- coccinellidae). Tetrahedron Letters: 409—412. ISSN 0040-4039. Архів оригіналу за 31 липня 2016. Процитовано 10 вересня 2020.
|
| ||||||||||||||||||||||||||