Рак голови та шиї
| Рак голови та шиї | |
|---|---|
 Поширений рак язика з супутнім ураженням плоский лишай | |
| Спеціальність | онкологія, щелепно-лицьова хірургія |
| Симптоми | Lump or sore that does not heal, sore throat that does not go away, trouble swallowing, change in the voice[1] |
| Фактори ризику | алкоголь, тютюн, бетель, папіломавірус людини, радіація, певні професійні чинники, вірус Епстайн-Бар[1][2] |
| Метод діагностики | біопсія[1] |
| Профілактика | Відмова від куріння і алкоголю[2] |
| Лікування | хірургія, променева терапія, хімієтерапія, прицільна терапія[1] |
| Препарати | вінбластин[3], метотрексат[3], карбоплатин[3], доцетаксел[3], пілокарпін[3], цисплатин[3], гідроксикарбамід[3], 5-фторурацил[3] і doxorubicin hydrochlorided[3] |
| Частота | 5.5 млн (протягом 2015)[4] |
| Смерті | 379,000 (2015)[5] |
| Класифікація та зовнішні ресурси | |
| МКХ-10 | C07, C14, C32 і C33 |
| | |
Рак голови та шиї - це група злоякісних пухлин, яка починається у роті, носі, горлі, гортані, пазухах або слинних залозах.[1] Симптоми раку голови та шиї можуть включати опуклість або рану, яка не загоюється, біль у горлі, яка не зникає, проблеми з ковтанням або зміна голосу. Також можуть бути незвичні кровотечі, набряки обличчя або проблеми з диханням.[6]
Близько 75 % випадків раку голови та шиї спричинене вживанням алкоголю або тютюну, включаючи бездимний тютюн.[6] Інші фактори ризику включають жування бетелю, певні типи вірусу папіломи людини, радіаційне опромінення, дія певних чинників виробництва та вірус Епштейна-Барр. Близько 90 % випадків раку голови та шиї - це плоскоклітинний рак.[2][7] Діагноз підтверджується біопсією тканини. Ступінь поширення може бути визначена за допомогою медичної візуалізації та аналізів крові.
Відмова від тютюну та алкоголю може зменшити ризик раку голови та шиї.[2] Хоча скринінг серед загальної популяції не представляється корисним, скринінг груп високого ризику шляхом обстеження горла може мати зиск. Рак голови та шиї часто є виліковний, якщо його діагностувати рано; однак результати, як правило, погані, якщо діагноз встановлений пізно. Лікування може включати комбінацію хірургічного втручання, променевої терапії, хіміотерапії та націленої терапії.[6] Після лікування одного раку голови та шиї люди мають більший ризик захворіти на другий рак.
У 2015 році на рак голови та шиї в усьому світі хворіло понад 5,5 мільйона людей (2,4 млн — ротової порожнини, 1,7 млн — горла та 1,4 млн — раку гортані).[5][4] Разом вони є сьомим за частотою раком та дев'ятою за частотою причиною смерті від раку.[2] У Сполучених Штатах приблизно 1% людей хворіє на нього в певний момент свого життя, а чоловіки хворіють удвічі частіше, ніж жінки.[6] Звичайний вік при встановленні діагнозу — від 55 до 65 років. Середнє 5-річне виживання після встановлення діагнозу в розвинених країнах становить 42-64 %.[8][9]
Рак голови та шиї зазвичай починається із симптомів, які здаються досить нешкідливими, таких як збільшення лімфатичного вузла на зовнішній стороні шиї, біль у шиї, біль у горлі або хриплий голос. Однак у випадку раку голови та шиї ці стани можуть зберігатися та переходити в хронічну форму. У горлі або шиї може бути опуклість або рана, яка не загоюється і не зникає. Може бути важке або болюче ковтання. Може ускладнитися мовлення. Також може бути постійний біль у вусі.[10]
До інших симптомів можуть належати: ущільнення в губі, роті або яснах, виразки або рани, які не загоюються, кровотеча з рота або оніміння, неприємний запах з рота, знебарвлені плями, які постійно присутні в роті, біль при говорінні та нечіткість мови якщо рак вражає язик. Також можуть бути закладені пазухи, втрата ваги та деяке оніміння або параліч м’язів обличчя.
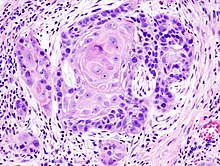
Плоскоклітинний рак поширений в ділянці рота, включаючи внутрішню поверхню губ, язик, дно рота, ясна та тверде небо. Рак рота тісно пов'язаний із вживанням тютюну, особливо вживанням тютюну для жування, а також із вживанням міцного алкоголю. Рак в цій ділянці, особливо язика, частіше лікується хірургічним медом, ніж інші види раку голови та шиї.
Операції з приводу раку рота включають:
- Максилектомія (видалення верхньої щелепи, може бути зроблена з орбітальною екзентерацією або без неї)
- Мандібулектомія (видалення нижньої щелепи або її частини)
- Глоссектомія (видалення язика, може бути тотальною, половинчастою або частковою)
- Радикальний розтин шиї
- Комбіновані, наприклад, глоссектомія та ларінгектомія, зроблені разом.
Зазвичай дефект покривається за допомогою іншої частини тіла та / або шкірних трансплантатів та / або носінням протеза.
Рак навколоносних пазух і структур носової порожнини. Більшість із цих видів раку є плоскоклітинним раком.[11]
Рак носоглотки виникає в ділянці, в якій носові порожнини і євстахієві труби з'єднуються з верхньою частиною горла. Хоча деякі злоякісні пухлини носоглотки біологічно подібні до звичайних плоскоклітинних карцином голови та шиї (HNSCC), "малодиференційованою" карциномою носоглотки є лімфоепітеліома, яка відрізняється своєю епідеміологією, біологією, клінічною поведінкою та лікуванням і розглядається багатьма фахівцями як окрема хвороба.
Більшість випадків раку ротоглотки - це плоскоклітинний рак, який починається в ротоглотці (горлі), середній частині горла, що включає м’яке піднебіння, основу язика та мигдалики.[1] Плоскоклітинний рак мигдаликів сильніше пов'язаний з вірусом папіломи людини, ніж рак інших ділянок голови та шиї. ВПЛ-позитивний рак ротоглотки, як правило, має кращі результати, ніж ВПЛ-негативна хвороба (на 54 % краще виживання[12]) але ця перевага для ВПЛ-асоційованого раку стосується лише раку ротоглотки.[13]
Люди з ротоглотковою карциномою мають високий ризик розвитку другого первинного раку голови та шиї.[14]
Гіпофаринкс включає грушоподібні пазухи, задню стінку глотки та посткрікоїдну ділянку. Пухлини гіпофаринкса часто бувають запущеними під час діагнозу і мають найбільш несприятливі прогнози серед пухлин глотки. Вони, як правило, рано метастазують через розгалужену лімфатичну мережу навколо гортані.
Рак гортані або «голосової скриньки». Рак може виникати на самих голосових складках ("глоттичний" рак) або на тканинах над і під справжніми голосовими зв'язками ("супраглотичний" і "субглотичний" рак). Рак гортані тісно пов’язаний з курінням тютюну.
Хірургічне втручання може включати лазерне висічення дрібних уражень голосових зв’язок, часткову ларінгектомію (видалення частини гортані) або тотальну ларингектомію (видалення всієї гортані). Якщо видалена вся гортань, у людини залишається постійна трахеостомія. Реабілітація голосу у таких пацієнтів можлива трьома способами - стравохідним голосом, трахео-стравохідною пункцією або електрогортанню. Швидше за все, потрібна буде допомога інтенсивного навчання та логопедії та / або електронний пристрій.
Рак трахеї - рідкісний рак, який зазвичай класифікується як рак легенів.[15]
Більшість пухлин слинних залоз відрізняються від звичайних плоскоклітинних карцином голови та шиї причиною, гістопатологією, клінічними проявами та терапією. Інші рідкісні пухлини, що виникають в ділянці голови та шиї, включають тератоми, аденокарциноми, аденоїдні кістозні карциноми та мукоепідермоїдні карциноми Рідше зустрічаються меланоми та лімфоми верхніх дихально-травних шляхів.

Близько 75 % випадків раку голови і шиї спричинені вживанням алкоголю та тютюну.[1]
Куріння тютюну є одним з основних факторів ризику раку голови та шиї. Основною канцерогенною сполукою тютюнового диму є акрилонітрил.[16] Очевидно, що акрилонітрил опосередковано пошкоджує ДНК, посилюючи окислювальний стрес, що призводить до підвищення рівня 8-оксо-2'-дезоксигуанозину (8-оксо-дГ) та формамідопіримідину в ДНК.[17] (див. рис.). І 8-оксо-dG, і формамідопіримідин є мутагенними сполуками.[18][19] ДНК-глікозилаза NEIL1 запобігає мутагенезу за допомогою 8-оксо-dG [20] і видаляє формамідопіримідини з ДНК.[21]
Однак у курців сигарет протягом життя підвищується ризик раку голови та шиї, що в 5-25 разів більше серед загальної популяції.[22] Ризик екс-курця щодо розвитку раку голови та шиї починає наближатися до ризику загальної популяції через 15 років після відмови від куріння.[23] Висока поширеність вживання тютюну та алкоголю у всьому світі та їх висока асоціація з раком голови і шиї робить ці шкідливі звички ідеальними мішенями для профілактики цього захворювання.
Бездимний тютюн є причиною раку ротової порожнини та раку ротоглотки.[24] Куріння сигар також є важливим фактором ризику раку органів порожнини рота.[25]
Інші зовнішні канцерогени, які підозрюються як потенційні причини раку голови та шиї, включають такі професійні чинники, як переробка нікелевої руди, вплив текстильних волокон та деревообробка. Вживання марихуани, особливо у молодшому віці, було пов'язано зі збільшенням випадків плоскоклітинної карциноми щонайменше в одному дослідженні [26] тоді як інші дослідження свідчать про те, що вживання не пов'язано з плоскоклітинним раком структур ротової порожнини або пов'язане зі зменшенням частоти плоскоклітинного раку.[27][28]
В одному дослідженні надмірне споживання яєць, м’ясопродуктів та червоного м’яса було пов’язане із збільшенням частоти раку голови та шиї, тоді як споживання сирих та варених овочів видавалося захисним чинником.[29]
Не доведено, що вітамін Е запобігає розвитку лейкоплакії - білих нальотів, які є попередником карцином слизової поверхні у дорослих курців.[30] В іншому дослідженні вивчалася комбінація вітаміну Е та бета-каротину у курців з ранньою стадією раку ротоглотки, і виявлено гірший прогноз у споживачів цього вітаміну.[31]
Жування бетелю пов’язане з підвищеним ризиком плоскоклітинного раку голови та шиї.[1][32]
Деякі типи раку голови та шиї спричинені вірусом папіломи людини (ВПЛ, Human Papilloma Virus).[1] Зокрема, HPV16 є причинним фактором для деяких плоскоклітинних карцином голови та шиї (HNSCC).[33][34] Приблизно 15 - 25% випадків HNSCC містять геномну ДНК ВПЛ[35] і асоціація з ним варіюється залежно від місця пухлини [36] особливо ВПЛ-позитивного раку ротоглотки, з найвищим розподілом в мигдаликах, де виявлена ДНК ВПЛ у 45 - 67 % випадків,[37] рідше в гіпофаринксі (13 – 25 %), і найменше в ротовій порожнині (12 – 18%) та гортані (3 – 7 %).[38][39]
Деякі дослідники підрахували, що хоча до 50 % раків мигдалика можуть бути інфіковані ВПЛ, лише 50 % з них, ймовірно, будуть спричинені ВПЛ (на відміну від звичайних причин тютюну та алкоголю). Роль ВПЛ в решті 25 - 30 % ще не зрозуміла.[40] Оральний секс не є вільним від ризику і призводить до значної частки ВПЛ, пов'язаного з раком голови та шиї.[41]
Позитивний статус ВПЛ16 пов'язаний із покращенням прогнозу щодо ВПЛ-негативної ротової плоскоклітинної карциноми.[42]
ВПЛ може індукувати пухлину за кількома механізмами:[43]
- Онкогенні білки Е6 та Е7.
- Порушення генів-супресорів пухлини.
- Високорівневі ампліфікації ДНК, наприклад, онкогенів.
- Створення альтернативних нефункціональних транскриптів.
- Міжхромосомні перебудови.
- Виражені патерни метилювання та експресії генома хазяїна, що проявляються навіть тоді, коли вірус не інтегрований у геном хазяїна.
Індукція раку може бути пов’язана з експресією вірусних онкопротеїнів, найважливішими з яких є Е6 та Е7, або інших механізмів, багато з яких здійснюються завдяки інтеграції, такій як генерація змінених транскриптів, порушення супресорів пухлини, високий рівень ампліфікації ДНК, міжхромосомні перебудови або зміни в структурі метилювання ДНК. Метилювання може бути виявлене навіть тоді, коли вірус ідентифікований в епісомах.[36][44] E6 секвеструє p53 і сприяє його деградації, тоді як pRb інгібує E7. p53 запобігає росту клітин, при пошкодженні ДНК шляхом активації апоптозу. p21, кіназа, яка блокує утворення цикліну D/Cdk4, запобігаючи фосфорилюванню pRb і тим самим перешкоджаючи вивільненню E2F - фактора транскрипції, необхідного для активації генів, що беруть участь у проліферації клітин. pRb залишається зв’язаним з E2F, тоді як при фосфорилюванні, він запобігає активації проліферації. Отже, Е6 та Е7 діють синергетично, ініціюючи запуск клітинного циклу, а отже, і неконтрольовану проліферацію, інактивуючи супресори пухлини p53 та Rb.
Вірусна інтеграція, як правило, відбувається в онкогенах або генах-супресорах пухлини або поблизу них, і саме з цієї причини інтеграція вірусу може значно сприяти розвитку характеристик пухлини.[44]
Інфекція вірусом Епштейна – Барр (EBV) пов’язана з раком носоглотки. Рак носоглотки ендемічно зустрічається в деяких країнах Середземномор’я та Азії, де титри антитіл до EBV можуть бути виміряні для скринінгу популяцій високого ризику. Рак носоглотки також був пов’язаний із вживанням солоної риби, яка може містити високий вміст нітритів.[45]
Наявність рефлюксної хвороби (гастроезофагеальна рефлюксна хвороба [ГЕРХ]) або рефлюксної хвороби гортані також може бути основним фактором. Шлункові кислоти, що потрапляють до глотки через стравохід, можуть пошкодити її слизову оболонку та підвищити ризик виникнення раку горла.
У пацієнтів після трансплантації гемопоетичних стовбурових клітин (HSCT) спостерігається підвищений ризик розвитку плоскоклітинного раку органів ротової порожнини. Рак органів ротової порожнини після HSCT може мати більш агресивну поведінку з гіршим прогнозом у порівнянні з раком органів порожнини рота у пацієнтів, що не мають HSCT.[46] Цей ефект пов'язують з пожиттєвим пригніченням імунітету та хронічною хворобою трансплантата проти хазяїна.
Існує кілька факторів ризику розвитку раку горла. До них належать куріння або жування тютюну чи інших речовин, такі як гутка або паан, зловживання алкоголем, неповноцінне харчування, що призводять до вітамінної недостатності (гірше, якщо вона викликана зловживанням алкоголю), ослаблений імунітет, дія азбесту, тривала дія пилу деревини або випаровувань фарби, вплив хімічних речовин нафтової промисловості та вік старше 55 років. Інші фактори ризику включають появу білих плям або точок у роті, відомих як лейкоплакія які приблизно в ⅓ випадків переростають у рак, та вдихання кремнезему при різанні бетону, каменю або шлакоблоків, особливо у закритих приміщеннях, такі як склад, гараж або підвал.
Людина, як правило, скаржиться лікареві на один або кілька із перерахованих вище симптомів. Зазвичай, проводять голкову біопсію даного утворення, що надає гістопатологічну інформацію. Міждисциплінарне обговорення оптимальної стратегії лікування проводиться променевим терапевтом, онкохірургом та онкологом. Більшість (90 %) видів раку голови та шиї є похідними епітеліальних клітин і позначаються як "плоскоклітинні карциноми голови та шиї".[7]
Рак горла класифікується відповідно до їх гістології або будови клітин, і зазвичай його називають за місцем розташування в ротовій порожнині та шиї. Це впливає на прогноз - деякі види раку горла є більш агресивними, ніж інші, залежно від їх розташування. Стадія, на якій діагностується рак, також є критичним фактором прогнозу перебігу хвороби. Рекомендоване рутинне тестування на наявність ВПЛ для всіх орофарингеальних плоскоклітинних пухлин.[47]
Плоскоклітинний рак - це рак клітин зроговілого епітелію - роду епітеліальних клітин, що містяться як у шкірі, так і в слизових оболонках. На нього припадає понад 90 % усіх видів раку голови та шиї [48] включаючи понад 90 % раку горла. Плоскоклітинний рак найчастіше з’являється у чоловіків старше 40 років із зловживанням міцних алкогольних напоїв разом із курінням в анамнезі.
Маркер пухлини Cyfra 21-1 може бути корисним для діагностики плоскоклітинного раку голови/шиї (SCCHN).[49]
Аденокарцинома - рак епітеліальної тканини, що має залозисті характеристики. Кілька видів раку голови та шиї є аденокарциномами (кишкового або некишкового клітинного типу).[48]
Уникнення відомих факторів ризику (які описані вище) є єдиною найбільш ефективною формою профілактики. Регулярні стоматологічні огляди можуть виявити передракові ураження в порожнині рота.[1]
При ранньому виявленні рак органів порожнини рота, голови та шиї можна лікувати простіше, і шанси на виживання надзвичайно зростають.[1] Станом на 2017 рік не було відомо, чи існуючі вакцини проти ВПЛ, що можуть допомогти запобігти раку голови та шиї.
Поліпшення діагностики та місцевого лікування, а також таргетована терапія призвели до поліпшення якості життя та виживання людей з раком голови та шиї.[50]
Після встановлення гістологічного діагнозу та визначення ступеня пухлини вибір відповідного лікування конкретного раку залежить від комплексу змінних, включаючих розташування пухлини, супутні проблеми зі здоров’ям, соціальні та логістичні фактори, попередні первинні пухлини та побажання пацієнта. Планування лікування, як правило, вимагає мультидисциплінарного підходу із залученням онкохірургів, онкологів, спеціалістів з променевої медицини. [ <span title="no source (May 2014)">цитування потрібно</span> ] Хірургічна резекція та променева терапія є основними методами лікування більшості випадків раку голови та шиї та в більшості випадків вони залишаються стандартом лікування. При невеликих первинних ракових захворюваннях без регіонарних метастазів (I або II стадія) застосовується широке хірургічне висічення або лише променева терапія. Більш обширні первинні пухлини або наявність регіональних метастазів (стадія III або IV) вимагають запланованих комбінацій до- або післяопераційного опромінення та повного хірургічного висічення. Нещодавно, через те, що історичні показники виживання та контролю визнані малозадовільними, було зроблено акцент на використанні різних індукційних або супутніх схем хіміотерапії.
Хірургія як метод лікування застосовується при більшості видів раку голови та шиї. Зазвичай мета операції полягає в тому, щоб повністю видалити ракові клітини. Це може бути особливо складно, якщо рак міститься поблизу гортані і може призвести до того, що людина втрачає можливість говорити. Хірургічне втручання також зазвичай використовується для резекції (видалення) деяких або всіх шийних лімфатичних вузлів, щоб запобігти подальшому поширенню захворювання.
Лазерна хірургія на основі CO2 - альтернативний метод лікування. Трансоральна лазерна мікрохірургія дозволяє хірургам видаляти пухлини з голосової скриньки без зовнішніх розрізів. Вона також дозволяє отримати доступ до пухлин, недоступних за для роботизованої хірургії. Під час операції хірург та патологоанатом працюють разом, щоб оцінити адекватність висічення (“маржинальний статус”), мінімізуючи кількість видаленої або пошкодженої нормальної тканини.[51] Цей метод допомагає залишити людині якомога більше функції мовлення та ковтання після операції.

Променева терапія є найпоширенішою формою лікування. Існують різні форми променевої терапії, включаючи тривимірну променеву терапію, променеву терапію з модуляцією інтенсивності, променеву терапію частинками та брахітерапію, які зазвичай використовуються для лікування раку голови та шиї. Більшість людей з раком голови та шиї, які отримують лікування в США та Європі, отримують променеву терапію з модуляцією інтенсивності з використанням фотонів високої енергії. Високі дози опромінення голови та шиї пов'язані з порушенням роботи щитоподібної залози та гіпофізарної осі.[52] Променева терапія раку голови та шиї може також спричинити гострі шкірні реакції різного рівня тяжкості, які можна лікувати та контролювати за допомогою кремів або спеціальних плівок для місцевого застосування.[53]
Хіміотерапія при раку горла зазвичай не використовується для лікування раку як такого. Натомість її використовують для забезпечення несприятливого середовища для появи метастазів, щоб вони не закріпилися в інших ділянках тіла. Типовими хіміотерапевтичними засобами є комбінація паклітакселу та карбоплатину. Цетуксимаб також використовується при лікуванні раку горла.
Хіміотерапія на основі доцетакселу показала дуже добрий результат при місцевопоширеному раку голови та шиї. Доцетаксел - єдиний таксан, затверджений FDA США при раку голови та шиї, у поєднанні з цисплатином та фторурацилом для індукційного лікування неоперабельного, локально поширеного плоскоклітинного раку голови та шиї.[54]
Хоча його і не вважають хіміотерапією, аміфостин часто призначаєтьсявнутрішньовенно разом із сеансами променевої терапії IMRT. Аміфостин захищає ясна і слинні залози від впливу радіації. [джерело?] Немає доказів того, що еритропоетин слід рутинно призначати разом з променевою терапією.[55]
Фотодинамічна терапія може сприяти лікуванню дисплазії слизової та дрібних пухлин голови та шиї. Амфінекс мав хороші результати в ранніх клінічних випробуваннях для лікування запущеного раку голови та шиї.[56]
Цільова терапія, за даними Національного інституту раку, є "видом лікування, який використовує ліки або інші речовини, такі як моноклональні антитіла, для виявлення та знищення специфічних ракових клітин без шкоди нормальним клітинам". Деякі таргетовані лікування, що застосовуються при плоскоклітинному раку голови та шиї, включають цетуксимаб, бевацизумаб та ерлотиніб.
Дані найвищої якості доступні для цетуксимабу з моменту публікації у 2006 році результатів рандомізованого клінічного випробування, в якому порівнювали результати променевого лікування та цетуксимаб у порівнянні з результатами променевого лікування окремо.[57] Це дослідження показало, що одночасне призначення цетуксимабу та променевої терапії покращує виживаність та контроль локорегіонарного ураження порівняно з тільки променевою терапією, без істотного збільшення побічних ефектів, які були очікувані при доданні хіміотерапії. Станом на 2020 рік це комбіноване лікування є золотим стандартом лікування запущеного раку голови та шиї. Хоча це дослідження має вирішальне значення, його інтерпретація ускладнена, оскільки цетуксимаб-радіотерапія не була безпосередньо порівняна з іншою хіміорадіотерапією.
В іншому дослідженні оцінювали вплив додавання цетуксимабу до звичайної хіміотерапії (цисплатин) порівняно з цисплатином окремо. Це дослідження не виявило покращення виживаності чи виживаності без рецидиву при додаванні цетуксимабу до звичайної хіміотерапії.[58]
Однак інше дослідження, яке завершилось у березні 2007 року, показало, що виживаність покращилася. [джерело?] Автори огляду 2010 року дійшли висновку, що комбінація цетуксимабу та препаратів платини / 5-фторурацилу повинна розглядатися як поточне стандартне лікування першої лінії.[59]
Гендицин - це генна терапія, яка використовує аденовірус для доставки гена супресора пухлини p53 до клітин. Він був затверджений у Китаї в 2003 році для лікування плоскоклітинного раку голови та шиї.[60]
Повідомлялося про мутаційний профіль ВПЛ-позитивного та ВПЛ-негативного раку голови та шиї, що ще раз демонструє, що вони є принципово різними захворюваннями.[61] [ потрібне не первинне джерело ]
Імунотерапія - це вид лікування, який активізує імунну систему для боротьби з раком. Один із видів імунотерапії, блокада імунної контрольної точки, пов'язує та блокує гальмівні сигнали на імунних клітинах, щоб звільнити їх протиракову діяльність.
У 2016 році FDA надала прискорене схвалення пембролізумабу для лікування людей з рецидивним або метастатичним HNSCC з прогресуванням захворювання під час або після хіміотерапії, що містять препарати платини.[62] Пізніше того ж року FDA затвердила ніволумаб для лікування за такими ж показаннями.[63] У 2019 році FDA затвердила пембролізумаб як лікування першої лінії метастатичного або нерезектабельного рецидиву HNSCC.[64]
Залежно від застосовуваного лікування, пацієнти з раком голови та шиї можуть відчувати такі симптоми та побічні ефекти лікування:[53]
- Проблеми з їдою
- Біль через ушкодження тканин
- Мукозити
- Нефротоксичність та ототоксичність
- Ксеростомія
- Гастроезофагальний рефлюкс
- Радіаційний остеонекроз щелепи
- Гострі радіаційні реакції шкіри
Можуть бути запропоновані програми підтримки емоційного та соціального благополуччя людей, у яких діагностовано рак голови та шиї.[65] Немає чітких доказів ефективності цих втручань чи будь-якого конкретного типу психосоціальної програми чи тривалості програми, які є найбільш корисними для тих, хто хворіє на рак голови та шиї.
Хоча на ранніх стадіях раку голови та шиї (особливо гортані та органів ротової порожнини) спостерігаються високі показники одужання, до 50 % людей із раком голови та шиї надходять із запущеним захворюванням.[66] Рівень одужання зменшується при локально запущених випадках, ймовірність вилікувати які має обернену залежність від розміру пухлини і тим більшу, чим більше ураження регіональних лімфатичних вузлів.
Групи консенсусу в Америці (AJCC) та Європі (UICC) створили системи стадіювання для плоскоклітинних раків голови та шиї. Ці системи покликані стандартизувати критерії клінічних досліджень та намагаються визначити прогностичні категорії захворювання. Плоскоклітинний рак голови та шиї ділиться на стадії відповідно до класифікаційної системи TNM, де Т - розмір та конфігурація пухлини, N - наявність або відсутність метастазів у лімфатичних вузлах, а М - наявність або відсутність віддалених метастазів. Характеристики T, N і M поєднуються для отримання "стадії" раку, від I до IVB.[67]
Показник виживаності, значно покращений новими методами лікування, виявився "зіпсованим" значним відсотком людей, вилікуваних від плоскоклітинного раку голови та шиї (HNSCC), у яких згодом розвиваються інші первинні пухлини. Частота розвитку "вторинних первинних" пухлин коливається в дослідженнях від 9 % [68] до 23 % [69] протягом 20 років. Вторинні первинні пухлини є основною загрозою довготривалій виживаності після успішної терапії HNSCC на ранній стадії.[70] Їх висока частота обумовлена тим самим канцерогенним впливом, що відповідає за початковий первинний процес, що називається польовою канцеризацією.
Багато людей з раком голови та шиї не здатні нормально харчуватися. Пухлина може погіршити здатність людини жувати та ковтати, а рак горла може уражати травну систему. Труднощі з ковтанням можуть призвести до того, що людина задихається їжею, і це заважає нормальному проходженню їжі вниз у стравохід і далі.
Лікування раку горла може також нашкодити травній системі, а також іншим системам організму. Променева терапія може призвести до нудоти та блювання, що може позбавити організм життєво важливих рідин (хоча їх можна отримати за допомогою інфузій, якщо це необхідно). Часте блювання може призвести до порушення електролітного балансу, що має серйозні наслідки для нормальної роботи серця. Воно також може порушити баланс шлункових кислот, що негативно впливає на травну систему, особливо слизову оболонку шлунка та стравоходу.
Деяким людям може знадобитися ентеральне годування - метод, при якому поживні речовини подаються безпосередньо в шлунок людини за допомогою назогастральної або гастростомічної трубки.[71] Потрібні подальші дослідження, щоб визначити найефективніший метод ентерального годування, щоб гарантувати, що люди, які проходять променеву або хіміопроменеву терапію, отримують достатнє живлення під час лікування.
У випадках деяких видів раку горла проходження повітря ротом та носом можуть перекриватися пухлинними масами або набряками навколо відкритих ран. Якщо рак розташований біля дна глотки, він має велику ймовірність розповсюдження в легені і заважає здатності людини дихати; це особливо ймовірно, якщо людина курить, оскільки при цьому вона дуже вразлива до раку легенів.
Рак голови або шиї може вплинути на психічне благополуччя людини, а іноді може призвести до соціальної ізоляції.[65] Може виникнути психологічний дистрес і такі почуття, як невпевненість і страх. Деякі люди можуть мати змінений зовнішній вигляд, відмінність в ковтанні або диханні та залишковий біль.
Доглядачі за пацієнтами з раком голови та шиї беруть на себе серйозну та часто технічно ускладнену відповідальність. Через локалізацію цих пухлин їх лікування пов’язане із значною симптоматикою, функційними порушеннями та психосоціальними супутніми захворюваннями. Функційні порушення включають біль, дефіцит зору та мовлення, а також порушення жування та ковтання; тоді як психосоціальні наслідки можуть включати підвищену тривожність та депресію, зниження якості життя та соціальну ізоляцію. Такі порушення, що виникають у пацієнтів з раком голови та шиї, вимагають складних схем допомоги протягом усього періоду лікування та після нього. Як результат, неформальні доглядачі, такі як родичі та друзі, зараз є незамінною та невід’ємною частиною команди лікування раку голови та шиї. [джерело?]
Як і при будь-якому раку, метастазування уражає багато ділянок тіла, оскільки рак поширюється від клітини до клітини та від органу до органу. Наприклад, якщо він поширюється на кістковий мозок, це заважатиме організму виробляти достатню кількість еритроцитів і впливатиме на належне функціонування білих кров’яних тілець та імунну систему організму; поширення в кровоносну систему заважає транспортуванню кисню до всіх клітин тіла; а рак горла може призвести до хаосу у нервовій системі, через що вона не може належним чином регулювати і контролювати організм.

Кількість нових випадків раку голови та шиї в США у 2006 р. становила 40 490, що становить близько 3 % злоякісних пухлин у дорослих. Загалом у 2006 році від цієї хвороби померли 11 170 людей [73] Світова захворюваність щорічно перевищує півмільйона випадків. У Північній Америці та Європі пухлини зазвичай виникають із ротової порожнини, ротоглотки або гортані, тоді як рак носоглотки частіше зустрічається в країнах Середземномор’я та на Далекому Сході. У Південно-Східному Китаї та на Тайвані рак голови та шиї, зокрема рак носоглотки, є найчастішою причиною смерті молодих чоловіків.[74]
- У 2008 році в США було зареєстровано 22 900 випадків раку порожнини рота, 12 250 випадків раку гортані та 12 410 випадків раку глотки.
- У 2002 році, за оцінками, 7 400 американців померли від цих видів раку.
- Понад 70 % випадків раку горла виявляються на запущеній стадії.[75]
- У чоловіків хвороба діагностується на 89 % частіше, ніж у жінок, і чоловіки майже вдвічі частіше помирають від цих видів раку.
- Афро-американці непропорційно частіше хворіють на рак голови та шиї, при молодшому віці захворюваності, збільшеній смертності та більшій частоті запущених захворювань.[66] Частота раку гортані вища у афроамериканців порівняно з білим, азійським та латиноамериканським населенням. У афроамериканців з раком голови та шиї нижчий рівень виживаності для подібних пухлинних станів.
- Куріння та вживання тютюну безпосередньо пов'язані зі смертю від раку ротоглотки (горла).[76]
- Ризик розвитку раку голови та шиї зростає з віком, особливо після 50 років. Більшість людей, у яких він діагностується перебувають у віці від 50 до 70 років.
Імунотерапія інгібіторами імунної контрольної точки активно вивчається при раку голови та шиї.[77]
- ↑ а б в г д е ж и к л м Oropharyngeal Cancer Treatment (Adult) (PDQ®)–Patient Version. National Cancer Institute (англ.). 22 листопада 2019. Процитовано 28 листопада 2019.
- ↑ а б в г д World Cancer Report 2014. World Health Organization. 2014. с. Chapter 5.8. ISBN 978-9283204299.
- ↑ а б в г д е ж и к NDF-RT
- ↑ а б GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 388 (10053): 1545—1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ а б GBD 2015 Mortality and Causes of Death Collaborators (October 2016). Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 388 (10053): 1459—1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ↑ а б в г Head and Neck Cancers. NCI. 29 березня 2017. Процитовано 17 вересня 2017.
- ↑ а б Vigneswaran N, Williams MD (May 2014). Epidemiologic trends in head and neck cancer and aids in diagnosis. Oral and Maxillofacial Surgery Clinics of North America. 26 (2): 123—41. doi:10.1016/j.coms.2014.01.001. PMC 4040236. PMID 24794262.
- ↑ SEER Stat Fact Sheets: Oral Cavity and Pharynx Cancer. SEER. April 2016. Архів оригіналу за 15 November 2016. Процитовано 29 вересня 2016.
- ↑ Beyzadeoglu, Murat; Ozyigit, Gokhan; Selek, Ugur (2014). Radiation Therapy for Head and Neck Cancers: A Case-Based Review (англ.). Springer. с. 18. ISBN 9783319104133. Архів оригіналу за 10 вересня 2017.
- ↑ Head and neck cancer : emerging perspectives. Amsterdam: Academic Press. 2003. ISBN 978-0-08-053384-1. OCLC 180905431.
- ↑ Paranasal Sinus and Nasal Cavity Cancer Treatment (Adult) (PDQ®)–Patient Version. National Cancer Institute (англ.). 8 листопада 2019. Процитовано 4 грудня 2019.
- ↑ O'Rorke MA, Ellison MV, Murray LJ, Moran M, James J, Anderson LA (December 2012). Human papillomavirus related head and neck cancer survival: a systematic review and meta-analysis (PDF). Oral Oncology. 48 (12): 1191—201. doi:10.1016/j.oraloncology.2012.06.019. PMID 22841677. Архів оригіналу за 10 вересня 2017.
- ↑ Ragin CC, Taioli E (October 2007). Survival of squamous cell carcinoma of the head and neck in relation to human papillomavirus infection: review and meta-analysis. International Journal of Cancer. 121 (8): 1813—20. doi:10.1002/ijc.22851. PMID 17546592.
- ↑ Krishnatreya M, Rahman T, Kataki AC, Das A, Das AK, Lahkar K (2013). Synchronous primary cancers of the head and neck region and upper aero digestive tract: defining high-risk patients. Indian Journal of Cancer. 50 (4): 322—6. doi:10.4103/0019-509x.123610. PMID 24369209.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Throat cancer | Head and neck cancers | Cancer Research UK. www.cancerresearchuk.org. Процитовано 28 листопада 2019.
- ↑ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (November 2011). A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants. Food and Chemical Toxicology. 49 (11): 2921—33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
- ↑ Pu X, Kamendulis LM, Klaunig JE (September 2009). Acrylonitrile-induced oxidative stress and oxidative DNA damage in male Sprague-Dawley rats. Toxicological Sciences. 111 (1): 64—71. doi:10.1093/toxsci/kfp133. PMC 2726299. PMID 19546159.
- ↑ Kalam MA, Haraguchi K, Chandani S, Loechler EL, Moriya M, Greenberg MM, Basu AK (2006). Genetic effects of oxidative DNA damages: comparative mutagenesis of the imidazole ring-opened formamidopyrimidines (Fapy lesions) and 8-oxo-purines in simian kidney cells. Nucleic Acids Research. 34 (8): 2305—15. doi:10.1093/nar/gkl099. PMC 1458282. PMID 16679449.
- ↑ Jena NR, Mishra PC (October 2013). Is FapyG mutagenic?: Evidence from the DFT study (PDF). ChemPhysChem. 14 (14): 3263—70. doi:10.1002/cphc.201300535. PMID 23934915.
- ↑ Suzuki T, Harashima H, Kamiya H (May 2010). Effects of base excision repair proteins on mutagenesis by 8-oxo-7,8-dihydroguanine (8-hydroxyguanine) paired with cytosine and adenine. DNA Repair. 9 (5): 542—50. doi:10.1016/j.dnarep.2010.02.004. PMID 20197241.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ Nemec AA, Wallace SS, Sweasy JB (October 2010). Variant base excision repair proteins: contributors to genomic instability. Seminars in Cancer Biology. 20 (5): 320—8. doi:10.1016/j.semcancer.2010.10.010. PMC 3254599. PMID 20955798.
- ↑ Andre K, Schraub S, Mercier M, Bontemps P (September 1995). Role of alcohol and tobacco in the aetiology of head and neck cancer: a case-control study in the Doubs region of France. European Journal of Cancer. Part B, Oral Oncology. 31B (5): 301—9. doi:10.1016/0964-1955(95)00041-0. PMID 8704646.
- ↑ La Vecchia C, Franceschi S, Bosetti C, Levi F, Talamini R, Negri E (April 1999). Time since stopping smoking and the risk of oral and pharyngeal cancers. Journal of the National Cancer Institute. 91 (8): 726—8. doi:10.1093/jnci/91.8.726a. PMID 10218516.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ Winn D (1992). Smokeless tobacco and aerodigestive tract cancers: recent research directions. The Biology and Prevention of Aerodigestive Tract Cancers. Advances in Experimental Medicine and Biology. Т. 320. с. 39—46. doi:10.1007/978-1-4615-3468-6_6. ISBN 978-0-306-44244-5. PMID 1442283.
{{cite book}}: Проігноровано|journal=(довідка) - ↑ Iribarren C, Tekawa IS, Sidney S, Friedman GD (June 1999). Effect of cigar smoking on the risk of cardiovascular disease, chronic obstructive pulmonary disease, and cancer in men. The New England Journal of Medicine. 340 (23): 1773—80. CiteSeerX 10.1.1.460.1056. doi:10.1056/NEJM199906103402301. PMID 10362820.
- ↑ Zhang ZF, Morgenstern H, Spitz MR, Tashkin DP, Yu GP, Marshall JR, Hsu TC, Schantz SP (December 1999). Marijuana use and increased risk of squamous cell carcinoma of the head and neck. Cancer Epidemiology, Biomarkers & Prevention. 8 (12): 1071—8. PMID 10613339.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Rosenblatt KA, Daling JR, Chen C, Sherman KJ, Schwartz SM (June 2004). Marijuana use and risk of oral squamous cell carcinoma. Cancer Research. 64 (11): 4049—54. doi:10.1158/0008-5472.CAN-03-3425. PMID 15173020.
- ↑ Liang C, McClean MD, Marsit C, Christensen B, Peters E, Nelson HH, Kelsey KT (August 2009). A population-based case-control study of marijuana use and head and neck squamous cell carcinoma. Cancer Prevention Research. 2 (8): 759—68. doi:10.1158/1940-6207.CAPR-09-0048. PMC 2812803. PMID 19638490.
- ↑ Levi F, Pasche C, La Vecchia C, Lucchini F, Franceschi S, Monnier P (August 1998). Food groups and risk of oral and pharyngeal cancer. International Journal of Cancer. 77 (5): 705—9. doi:10.1002/(SICI)1097-0215(19980831)77:5<705::AID-IJC8>3.0.CO;2-Z. PMID 9688303.
- ↑ Liede K, Hietanen J, Saxen L, Haukka J, Timonen T, Häyrinen-Immonen R, Heinonen OP (June 1998). Long-term supplementation with alpha-tocopherol and beta-carotene and prevalence of oral mucosal lesions in smokers. Oral Diseases. 4 (2): 78—83. doi:10.1111/j.1601-0825.1998.tb00261.x. PMID 9680894.
- ↑ Bairati I, Meyer F, Gélinas M, Fortin A, Nabid A, Brochet F, Mercier JP, Têtu B, Harel F, Mâsse B, Vigneault E, Vass S, del Vecchio P, Roy J (April 2005). A randomized trial of antioxidant vitamins to prevent second primary cancers in head and neck cancer patients. Journal of the National Cancer Institute. 97 (7): 481—8. doi:10.1093/jnci/dji095. PMID 15812073.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Jeng JH, Chang MC, Hahn LJ (September 2001). Role of areca nut in betel quid-associated chemical carcinogenesis: current awareness and future perspectives. Oral Oncology. 37 (6): 477—92. doi:10.1016/S1368-8375(01)00003-3. PMID 11435174.
- ↑ Biomarkers for Cancers of the Head and Neck. Процитовано 7 серпня 2014.
- ↑ D'Souza G, Kreimer AR, Viscidi R, Pawlita M, Fakhry C, Koch WM, Westra WH, Gillison ML (May 2007). Case-control study of human papillomavirus and oropharyngeal cancer. The New England Journal of Medicine. 356 (19): 1944—56. doi:10.1056/NEJMoa065497. PMID 17494927.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Kreimer AR, Clifford GM, Boyle P, Franceschi S (February 2005). Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiology, Biomarkers & Prevention. 14 (2): 467—75. doi:10.1158/1055-9965.EPI-04-0551. PMID 15734974.
- ↑ а б Joseph AW, D'Souza G (August 2012). Epidemiology of human papillomavirus-related head and neck cancer. Otolaryngologic Clinics of North America. 45 (4): 739—64. doi:10.1016/j.otc.2012.04.003. PMID 22793850.
- ↑ Perez-Ordoñez B, Beauchemin M, Jordan RC (May 2006). Molecular biology of squamous cell carcinoma of the head and neck. Journal of Clinical Pathology. 59 (5): 445—53. doi:10.1136/jcp.2003.007641. PMC 1860277. PMID 16644882.
- ↑ Paz IB, Cook N, Odom-Maryon T, Xie Y, Wilczynski SP (February 1997). Human papillomavirus (HPV) in head and neck cancer. An association of HPV 16 with squamous cell carcinoma of Waldeyer's tonsillar ring. Cancer. 79 (3): 595—604. doi:10.1002/(SICI)1097-0142(19970201)79:3<595::AID-CNCR24>3.0.CO;2-Y. PMID 9028373.
- ↑ Hobbs CG, Sterne JA, Bailey M, Heyderman RS, Birchall MA, Thomas SJ (August 2006). Human papillomavirus and head and neck cancer: a systematic review and meta-analysis (PDF). Clinical Otolaryngology. 31 (4): 259—66. doi:10.1111/j.1749-4486.2006.01246.x. PMID 16911640. Архів оригіналу (PDF) за 11 серпня 2017.
- ↑ Weinberger PM, Yu Z, Haffty BG, Kowalski D, Harigopal M, Brandsma J, Sasaki C, Joe J, Camp RL, Rimm DL, Psyrri A (February 2006). Molecular classification identifies a subset of human papillomavirus--associated oropharyngeal cancers with favorable prognosis. Journal of Clinical Oncology. 24 (5): 736—47. doi:10.1200/JCO.2004.00.3335. PMID 16401683. Архів оригіналу за 20 січня 2009.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Haddad, Robert I., MD (2007). Human Papillomavirus Infection and Oropharyngeal Cancer (PDF). Архів оригіналу (PDF) за 13 травня 2012. Процитовано 26 вересня 2012.
- ↑ Tahtali A, Hey C, Geissler C, Filman N, Diensthuber M, Leinung M, Stöver T, Wagenblast J (August 2013). HPV status and overall survival of patients with oropharyngeal squamous cell carcinoma--a retrospective study of a German head and neck cancer center. Anticancer Research. 33 (8): 3481—5. PMID 23898123. Архів оригіналу за 7 січня 2016.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Schmitz M, Driesch C, Beer-Grondke K, Jansen L, Runnebaum IB, Dürst M (September 2012). Loss of gene function as a consequence of human papillomavirus DNA integration. International Journal of Cancer. 131 (5): E593-602. doi:10.1002/ijc.27433. PMID 22262398.
- ↑ а б Parfenov M, Pedamallu CS, Gehlenborg N, Freeman SS, Danilova L, Bristow CA, Lee S, Hadjipanayis AG, Ivanova EV, Wilkerson MD, Protopopov A, Yang L, Seth S, Song X, Tang J, Ren X, Zhang J, Pantazi A, Santoso N, Xu AW, Mahadeshwar H, Wheeler DA, Haddad RI, Jung J, Ojesina AI, Issaeva N, Yarbrough WG, Hayes DN, Grandis JR, El-Naggar AK, Meyerson M, Park PJ, Chin L, Seidman JG, Hammerman PS, Kucherlapati R (October 2014). Characterization of HPV and host genome interactions in primary head and neck cancers. Proceedings of the National Academy of Sciences of the United States of America. 111 (43): 15544—9. Bibcode:2014PNAS..11115544P. doi:10.1073/pnas.1416074111. PMC 4217452. PMID 25313082.
{{cite journal}}: Недійсний|displayauthors=6(довідка) - ↑ Risks and causes | Nasopharyngeal cancer | Cancer Research UK. www.cancerresearchuk.org. Процитовано 4 грудня 2019.
- ↑ Elad S, Zadik Y, Zeevi I, Miyazaki A, de Figueiredo MA, Or R (December 2010). Oral cancer in patients after hematopoietic stem-cell transplantation: long-term follow-up suggests an increased risk for recurrence. Transplantation. 90 (11): 1243—4. doi:10.1097/TP.0b013e3181f9caaa. PMID 21119507.
- ↑ Routine HPV Testing in Head and Neck Squamous Cell Carcinoma. EBS 5-9. May 2013. Архів оригіналу за 30 September 2016. Процитовано 22 травня 2017.
- ↑ а б Haines, GK 3rd (24 травня 2013). Pathology of Head and Neck Cancers I: Epithelial and Related Tumors. У Radosevich, JA (ред.). Head & Neck Cancer: Current Perspectives, Advances, and Challenges. Springer Science & Business Media. с. 257—87. ISBN 978-94-007-5827-8.
{{cite book}}:|archive-url=вимагає|url=(довідка) - ↑ Wang YX, Hu D, Yan X (September 2013). Diagnostic accuracy of Cyfra 21-1 for head and neck squamous cell carcinoma: a meta-analysis. European Review for Medical and Pharmacological Sciences. 17 (17): 2383—9. PMID 24065233.
- ↑ Al-Sarraf M (2002). Treatment of locally advanced head and neck cancer: historical and critical review. Cancer Control. 9 (5): 387—99. doi:10.1177/107327480200900504. PMID 12410178.
- ↑ Maxwell JH, Thompson LD, Brandwein-Gensler MS, Weiss BG, Canis M, Purgina B та ін. (December 2015). Early Oral Tongue Squamous Cell Carcinoma: Sampling of Margins From Tumor Bed and Worse Local Control. JAMA Otolaryngology-- Head & Neck Surgery. 141 (12): 1104—10. doi:10.1001/jamaoto.2015.1351. PMC 5242089. PMID 26225798.
- ↑ Mahmood SS, Nohria A (July 2016). Cardiovascular Complications of Cranial and Neck Radiation. Current Treatment Options in Cardiovascular Medicine. 18 (7): 45. doi:10.1007/s11936-016-0468-4. PMID 27181400.
- ↑ а б Yan, Jing; Yuan, Ling; Wang, Juan; Li, Shuangshuang; Yao, Mengdi; Wang, Kongcheng; Herst, Patries M. (2020). Mepitel Film is superior to Biafine cream in managing acute radiation-induced skin reactions in head and neck cancer patients: a randomised intra-patient controlled clinical trial. Journal of Medical Radiation Sciences (англ.). n/a (n/a). doi:10.1002/jmrs.397. ISSN 2051-3909. PMID 32475079.
- ↑ FDA Approval for Docetaxel - National Cancer Institute. Cancer.gov. Архів оригіналу за 1 вересня 2014. Процитовано 7 серпня 2014.
- ↑ Lambin P, Ramaekers BL, van Mastrigt GA, Van den Ende P, de Jong J, De Ruysscher DK, Pijls-Johannesma M (July 2009). Erythropoietin as an adjuvant treatment with (chemo) radiation therapy for head and neck cancer. The Cochrane Database of Systematic Reviews (3): CD006158. doi:10.1002/14651858.CD006158.pub2. PMID 19588382.
- ↑ "Inoperable cancers killed by new laser surgery" The Times. UK. 3-April-2010 p15
- ↑ Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB та ін. (February 2006). Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. The New England Journal of Medicine. 354 (6): 567—78. doi:10.1056/NEJMoa053422. PMID 16467544.
- ↑ Burtness B, Goldwasser MA, Flood W, Mattar B, Forastiere AA (December 2005). Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/recurrent head and neck cancer: an Eastern Cooperative Oncology Group study. Journal of Clinical Oncology. 23 (34): 8646—54. doi:10.1200/JCO.2005.02.4646. PMID 16314626.
- ↑ Specenier P, Vermorken JB (May 2010). Advances in the systemic treatment of head and neck cancers. Current Opinion in Oncology. 22 (3): 200—5. doi:10.1097/CCO.0b013e3283376e15. PMID 20154619.
- ↑ Pearson S, Jia H, Kandachi K (January 2004). China approves first gene therapy. Nature Biotechnology. 22 (1): 3—4. doi:10.1038/nbt0104-3. PMC 7097065. PMID 14704685.
- ↑ Lechner M, Frampton GM, Fenton T, Feber A, Palmer G, Jay A та ін. (2013). Targeted next-generation sequencing of head and neck squamous cell carcinoma identifies novel genetic alterations in HPV+ and HPV- tumors. Genome Medicine. 5 (5): 49. doi:10.1186/gm453. PMC 4064312. PMID 23718828.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Research, Center for Drug Evaluation and (9 лютого 2019). pembrolizumab (KEYTRUDA). FDA (англ.).
- ↑ Research, Center for Drug Evaluation and (3 листопада 2018). Nivolumab for SCCHN. FDA (англ.).
- ↑ Research, Center for Drug Evaluation and (11 червня 2019). FDA approves pembrolizumab for first-line treatment of head and neck squamous cell carcinoma. FDA (англ.).
- ↑ а б Semple C, Parahoo K, Norman A, McCaughan E, Humphris G, Mills M (July 2013). Psychosocial interventions for patients with head and neck cancer. The Cochrane Database of Systematic Reviews (7): CD009441. doi:10.1002/14651858.CD009441.pub2. PMID 23857592.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ а б Gourin CG, Podolsky RH (July 2006). Racial disparities in patients with head and neck squamous cell carcinoma. The Laryngoscope. 116 (7): 1093—106. doi:10.1097/01.mlg.0000224939.61503.83. PMID 16826042.
- ↑ Iro H, Waldfahrer F (November 1998). Evaluation of the newly updated TNM classification of head and neck carcinoma with data from 3247 patients. Cancer. 83 (10): 2201—7. doi:10.1002/(SICI)1097-0142(19981115)83:10<2201::AID-CNCR20>3.0.CO;2-7. PMID 9827726.
- ↑ Jones AS, Morar P, Phillips DE, Field JK, Husband D, Helliwell TR (March 1995). Second primary tumors in patients with head and neck squamous cell carcinoma. Cancer. 75 (6): 1343—53. doi:10.1002/1097-0142(19950315)75:6<1343::AID-CNCR2820750617>3.0.CO;2-T. PMID 7882285.
- ↑ Cooper JS, Pajak TF, Rubin P, Tupchong L, Brady LW, Leibel SA та ін. (September 1989). Second malignancies in patients who have head and neck cancer: incidence, effect on survival and implications based on the RTOG experience. International Journal of Radiation Oncology, Biology, Physics. 17 (3): 449—56. doi:10.1016/0360-3016(89)90094-1. PMID 2674073.
- ↑ Priante AV, Castilho EC, Kowalski LP (April 2011). Second primary tumors in patients with head and neck cancer. Current Oncology Reports. 13 (2): 132—7. doi:10.1007/s11912-010-0147-7. PMID 21234721.
- ↑ Nugent B, Lewis S, O'Sullivan JM (January 2013). Enteral feeding methods for nutritional management in patients with head and neck cancers being treated with radiotherapy and/or chemotherapy. The Cochrane Database of Systematic Reviews (1): CD007904. doi:10.1002/14651858.CD007904.pub3. PMC 6769131. PMID 23440820.
- ↑ WHO Disease and injury country estimates. World Health Organization. 2009. Архів оригіналу за 11 листопада 2009. Процитовано 11 листопада 2009.
- ↑ Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, Thun MJ (2006). Cancer statistics, 2006. Ca. 56 (2): 106—30. doi:10.3322/canjclin.56.2.106. PMID 16514137.
- ↑ Titcomb CP (2001). High incidence of nasopharyngeal carcinoma in Asia. Journal of Insurance Medicine. 33 (3): 235—8. PMID 11558403.
- ↑ Throat Cancer patient information web page, Archived copy. Архів оригіналу за 1 липня 2007. Процитовано 17 червня 2007.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання), NCH Healthcare Systems, 1999 - ↑ Reducing the Health Consequences of Smoking: 25 Years of Progress. A Report of the Surgeon General, U. S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, 1989.
- ↑ Syn NL, Teng MW, Mok TS, Soo RA (December 2017). De-novo and acquired resistance to immune checkpoint targeting. The Lancet. Oncology. 18 (12): e731—e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
| Класифікація | |
|---|---|
| Зовнішні ресурси |