Рак легені
| Рак легені | |
|---|---|
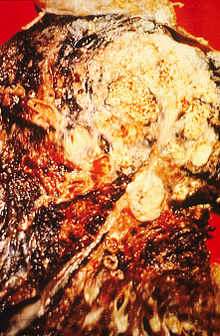
 Рентгенограма органів грудної порожнини: рак легені - затемнення з нерівним та нечітким контуром (позначено стрілкою). | |
| Спеціальність | онкологія і пульмонологія |
| Симптоми | біль за грудиною[1], кашель[1], кровохаркання[1], перевтома[1], схуднення[1], анорексія[1], задишка[1] і хрип[d][1] |
| Причини | куріння, азбестоз[2], Пасивне куріння, радон, забруднення повітря і паління |
| Метод діагностики | радіографія, КТ, Бронхоскопія і біопсія |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 2C25 |
| МКХ-10 | C33-C34 |
| OMIM | 211980, 608935, 612593, 614210 і 612571 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336
emerg/335 radio/807 radio/405radio/406 |
| MeSH | D002283 |
| | |
Ра́к леге́ні — це злоякісне новоутворення легені, що посідає чільне місце серед всіх злоякісних пухлин. Рак легені може поширюватися локальними метастазами у прилеглих тканинах або інших органах (віддалені метастази). Якщо первинні вогнища раку є в обох легенях одразу, говорять про рак легень, якщо в одній — рак правої (чи лівої, з уточненням локалізації) легені.
Більшість типів раку легені (так звані первинні ракові захворювання легень) — це карциноми, тобто утворюються з епітеліальних клітин. Основними видами раку є дрібноклітинний рак легені (ДРЛ), також знаний як вівсяноклітинний рак, та недрібноклітинний рак легені (НДРЛ). Найбільш поширені симптоми захворювання — кашель (в тому числі з кровохарканням), втрата ваги та задишка.[3]
На 2005 рік абсолютна кількість людей з пухлинними захворюваннями легень перевищувала кількість усіх решта хворих на пухлинні захворювання іншої локалізації[4].
Найбільш поширеною причиною раку легень є тривалий вплив тютюнового диму,[5] внаслідок дії якого діагностується 80—90 % карцином.[3] Серед хворих, які не палять, припадає 10—15 % випадків раку легень.[6] Причинами захворювання в цьому разі часто називають поєднання генетичних факторів,[7] впливу газу радону,[7] дія азбесту,[8] забруднення повітря іншими канцерогенами,[7] а також пасивне паління.[9][10] Рак легень можна визначити на рентгенограмі грудної клітини та комп'ютерній томографії (КТ). Діагноз підтверджують за допомогою біопсії,[11] яку зазвичай роблять при бронхоскопії. Лікування та його довгострокові результати залежать від типу раку, його стадії (ступеня поширення) та загального стану здоров'я людини, що оцінюється за допомогою показника загального стану пацієнта.
Загальні методи лікування включають хірургічний, хімієтерапію і променеву терапію. Недрібноклітинний рак легень іноді лікують за допомогою хірургічного втручання, а дрібноклітинний краще піддається лікуванню хімієтерапією та променевою терапією.[12] Загалом, 15 % пацієнтів з раком легень у Сполучених Штатах Америки виживають через п'ять років після постановки діагнозу.[13] Рак легень є найпоширенішою причиною смертності від онкологічних захворювань у чоловіків та жінок у всьому світі. 2012 року рак легень було діагностовано у 1,8 млн осіб у всьому світі, серед яких 1,6 млн — летальні випадки.[14]
На рак легень можуть вказувати наступні ознаки та симптоми:[3]
- респіраторні симптоми: кашель, кровохаркання, хрипи чи задишка
- системні симптоми: втрата ваги, гарячка, симптом барабанних паличок — потовщення фалангів пальців, а також перевтома
- симптоми, які спричинює місцеве здавлювання: біль у грудях, у кістках, синдром верхньої порожнистої вени, труднощі при ковтанні
Якщо ракова пухлина розвивається в дихальних шляхах, вона може перешкоджати проходженню повітря, спричинюючи задишку. Перешкода диханню може призвести до накопичення секрету, що може спричинити парапластичну пнемонію.[3]
Залежно від типу пухлини до хвороби можуть привернути увагу так звані паранеопластичні явища.[15] У випадку раку легень ці явища можуть включати міастенічний синдром Ламберта-Ітона (слабкість м'язів через автоімунні антитіла), гіперкальціємію чи синдром неадекватної секреції антидіуретичного гормону. Пухлина у верхній частини легені, також знана як пухлина Панкоста, може вразити місцеву частину симпатичної нервової системи та призвести до виникнення синдрому Горнера (опущення повіка та звуження зіниці), а також до ураження плечового нервового сплетіння.[3]
Багато симптомів раку легень (поганий апетит, втрата ваги, гарячка, перевтома) не є специфічними.[11] У багатьох випадках рак вже встигає поширитися за межі місця свого виникнення до того часу, коли у людини з'являться симптоми, що потребують медичного втручання. Рак зазвичай може розповсюдитися на мозок, кістки, надниркову залозу, протилежну легеню, печінку, перикард та нирки.[16] Близько 10 % людей з раком легень не мають симптомів на момент постановки діагнозу; захворювання знаходять під час планової рентгенографії грудної клітини.[13]
Рак виникає після генетичного пошкодження ДНК. Це генетичне пошкодження впливає на нормальні функції клітини, в тому числі на проліферацію клітин, запрограмовану загибель клітин (апоптоз) та репарацію ДНК. Чим більше пошкоджень, тим вищий ризик виникнення раку.[17]

Паління, особливо сигарет, на сьогодні є основною причиною виникнення раку легень.[18] Сигаретний дим містить понад 60 відомих канцерогенів,[19] в тому числі радіоактивні ізотопи, що виникають при розпаді радону, нітрозамін та бензопірен. Крім того, нікотин пригнічує реакцію імунітету на ракові новоутворення в ушкодженій тканині.[20] У 2000 році причиною 90 % смертей від раку легень у чоловіків у розвинених країнах було паління (для жінок ця цифра складає 70 %).[21] Паління є причиною раку в 80-90 % випадків захворювання.[3]
Пасивне паління, тобто вдихання диму від курців поряд, є причиною раку легень у некурців. Пасивний курець — це людина, яка живе чи працює з курцем. Дослідження, проведені в США,[22][23] Європі,[24] Великій Британії[25] та Австралії[26] показали, що пасивні курці піддаються більш високому ризику виникнення раку.[27] Якщо ви живете з кимось, хто палить, ризик того, що ви захворієте, підвищується на 20—30 %, а якщо ви працюєте з курцями — на 16—19 %.[28] Дослідження побічного диму припускають, що він є більш небезпечним, ніж прямий дим.[29] У США щороку пасивне паління забирає життя 3 400 людей.[23]
Радон — це газ без кольору та запаху, що утворюється при розпаді радіоактивного радію, який своєю чергою є продуктом розпаду урану, що знаходиться у земній корі. Продукти радіаційного розпаду іонізують генетичний матеріал, внаслідок чого виникають мутації, які іноді перетворюються на злоякісні пухлини. Радон є другою найбільш поширеною причиною раку легень в США після куріння.[23] Ризик зростає на 8-16 % на кожні 100 Бк/м³ концентрації радону.[30] Рівень концентрації радону змінюється залежно від місцевості і складу базового ґрунту та породи. Наприклад, в таких місцях, як Корнуолл, Велика Британія (де як основна порода виступає граніт), радон є серйозною проблемою, тому всі будинки повинні бути обладнані примусовою вентиляцією для зниження концентрації радону. Управління з охорони навколишнього середовища США встановило, що в одному з 15 будинків в США концентрація радону перевищує рекомендований рівень — 4 пікокюрі на літр (пКі/л) (148 Бк/м³).[31]
Азбест може викликати різні захворювання легень, в тому числі й рак. Паління тютюну разом із впливом азбесту створюють синергічний вплив на формування раку легень.[8] Азбест також може викликати рак плеври — мезотеліому (що відрізняється від раку легень).[32]
Забруднення атмосферного повітря має невеликий вплив на підвищення ризику раку легень.[7] Дрібні тверді часточки (PM2,5) та сульфатні аерозолі, що викидаються у повітря разом із вихлопними газами автомобілів, трохи підвищують ризик захворювання.[7][33] Що стосується оксиду азоту, збільшення його концентрації на 10 частин на мільярд збільшує ризик розвитку раку легень на 14 %.[34] Забруднення атмосферного повітря є причиною виникнення раку в 1-2 % випадків.[7]
Орієнтовні дані підтверджують, що ризик раку легень підвищується від забруднення повітря всередині приміщень, що пов'язане зі спалюванням деревини, деревного вугілля, гною або рослинних залишків для приготування їжі та опалення.[35] Ризик захворювання жінок, які вдихають вугільний дим в приміщенні, зростає удвічі. Крім того, ряд побічних продуктів згорання біомаси є канцерогенами.[36] Цьому негативному впливу піддаються близько 2,4 мільярда людей у всьому світі,[35] та він є причиною захворювання у 1,5 % випадків.[36]
За деякими оцінками, від 8 до 14 % випадків захворювання на рак легень пов'язані зі спадковими факторами.[37] У людей, чиї родичі хворіли на рак легень, ризик захворювання збільшується в 2,4 рази. Це, імовірно, зумовлено певним поєднанням генів.[38]
Виникнення раку легень пов'язують з багатьма іншими речовинами, професіями та факторами навколишнього середовища. За даними Міжнародного агентства з вивчення раку (МАВР), є «достатні підстави» вважати наступні фактори такими, що підвищують ризик виникнення захворювання:[39]
- Деякі метали (виробництво алюмінію, кадмій та його сполуки, сполуки хрому(VI), берилій та його сполуки, литво сталі, сполуки нікелю, миш'як та його неорганічні сполуки, підземний видобуток гематиту)
- Деякі продукти згоряння (неповне згоряння, спалювання вугілля (викиди від побутового спалювання вугілля у приміщенні), газифікація вугілля, кам'яновугільна смола, виробництво коксу, сажа, вихлопні гази дизельних двигунів)
- Іонізуюче випромінювання (рентгенівське випромінювання, радон-222 та продукти його розпаду, гамма-випромінювання, плутоній)
- Деякі токсичні гази (метиловий ефір (технічного сорту), біс-(хлорметил) ефір, іприт, МОПП (суміш вінкристину, преднізолону, азотистого іприту та прокарбазину), пари від фарби)
- Виробництво гуми та кристалічного кварцового пилу
Як і багато інших видів ракових захворювань, рак легень починається з активації онкогенів чи інактивації генів-супресорів пухлин, тобто генів, що подавляють пухлини.[40] Вважається, що онкогени роблять людей більш схильними до захворювання. Протоонкогени, як вважають, перетворюються на онкогени під впливом певних канцерогенів.[41] Мутації протоонкогена K-ras є причиною 10-30 % випадків аденокарциноми легень.[42][43] Рецептор епідермального фактора росту (РЕФР) регулює проліферацію клітин, апоптоз, ангіогенез та інвазію пухлин.[42] Мутації і посилення РЕФР є частими явищами при недрібноклітинному раку легень і служать основою для лікування за допомогою РЕФР-інгібіторів. Білок HER2/neu рідше підпадає під негативний вплив.[42] Пошкодження хромосом може призвести до втрати гетерозиготності. Це, у свою чергу, може призвести до інактивації генів-супресорів пухлин. Пошкодження хромосом 3p, 5q, 13q та 17p особливо часто виникає при дрібноклітинному раку легень. Ген-супресор пухлин p53, розташований на хромосомі 17p, підпадає під негативний вплив у 60-75 % випадків.[44] Інші гени також піддаються мутації та ампліфікації. Серед них c-MET, NKX2-1,LKB1, PIK3CA та BRAF.[42]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |

Рентгенограма грудної клітини — це один з перших кроків, які необхідно зробити, якщо пацієнт повідомляє про симптоми, які можуть вказувати на рак легень. Рентгенограма може виявити видиму пухлину, розширення середостіння (що може вказувати на поширення у лімфатичні вузли), ателектаз (колапс), консолідацію (пневмонію) або плеврит.[5] Для отримання більш докладної інформації про тип та ступінь захворювання зазвичай використовується комп'ютерна томографія. Пробу пухлини для гістопатології зазвичай беруть за допомогою бронхоскопії або біопсії під контролем КТ.[13]
На рентгенограмі грудної клітини рак легень часто проявляється як солітарний легеневий вузол. Однак диференційна діагностика цього захворювання може зайняти багато часу. Багато інших захворювань може мати такі ж ознаки, в тому числі туберкульоз, грибкові інфекції, метастатичний рак або пневмосклероз. Менш поширеними причинами утворення солітарного легеневого вузла є гамартома, бронхогенна кіста, аденома, артеріовенозна мальформація, легенева секвестрація, ревматоїдні вузли, гранулематоз Вегенера або лімфома.[45] Рак легень можна також виявити випадково, знайшовши солітарний легеневий вузол на рентгенограмі грудної клітини або комп'ютерній томограмі, які були зроблені з інших причин.[46] Остаточний діагноз ставлять на основі гістологічного дослідження підозрілих тканин з огляду на клінічні та рентгенологічні ознаки.[3]
| Гістологічний тип | Захворюваність на 100 000 на рік |
|---|---|
| Всі типи | 66,9 |
| Аденокарцинома | 22,1 |
| Плоскоклітинна карцинома | 14.4 |
| Дрібноклітинна карцинома | 9,8 |
Ракові захворювання легень класифікують за гістологічним типом.[11] Ця класифікація має важливе значення для визначення лікування та прогнозування результатів захворювання. Переважна більшість ракових захворювань — це карциноми. Карцинома — це злоякісне новоутворення, що виникає з епітеліальних клітин. Карциноми легень класифікують за розміром і зовнішнім виглядом злоякісних клітин, виявлених лікарем-гістопатологом під мікроскопом. Загалом, карциноми легень бувають двох видів: недрібноклітинні та дрібноклітинні.[47]

Трьома основними типами недрібноклітинних карцином є аденокарцинома, плоскоклітинна карцинома та великоклітинна карцинома.[3]
Майже 40 % випадків раку легень — це аденокарциноми, що зазвичай виникають в периферичній легеневій тканині.[11] У більшості випадків виникнення аденокарцином пов'язане з палінням, однак серед людей, які викурили менше 100 сигарет у своєму житті (тобто ніколи або майже ніколи не палили),[3] аденокарцинома також є найбільш поширеною формою раку легень.[48] Серед жінок, які не палять, частіше зустрічається підтип аденокарциноми — бронхіолоальвеолярна карцинома, при якій показники виживання у довгостроковому періоді дуже високі.[49]
Плоскоклітинна карцинома виникає у 30 % випадків захворювання на рак легень. Як правило, вона утворюється поблизу великих дихальних шляхів. У центрі пухлини зазвичай утворюється порожнина, та виникає омертвіння клітин.[11] Близько 9 % випадків раку легень — це великоклітинна карцинома. Вона так називається, тому що ракові клітини великі за розміром, з надлишком цитоплазми, великими ядрами та помітними ядерцями.[11]

У випадку дрібноклітинної карциноми клітини містять щільні нейросекреторні гранули (везикули, що містять нейроендокринні гормони), які пов'язують пухлину з ендокринним/паранеопластичним синдромом.[50] У більшості випадків пухлини виникають у великих дихальних шляхах (первинних і вторинних бронхах).[13] Ці пухлини ростуть швидко і поширюються на ранніх стадіях захворювання. У 60-70 % випадків утворюються метастази. Цей тип раку легень великою мірою пов'язаний з палінням.[3]
Розрізняють чотири головні гістологічні підтипи раку, хоча деякі види захворювання можуть містити комбінацію ранніх підтипів.[47] Серед рідкісних підтипів раку розрізняють пухлини слинних залоз, карциноїдні пухлини та недиференційовані карциноми.[3]
| Гістологічний тип | Імунозабарвлення |
|---|---|
| Плоскоклітинна карцинома | CK5/6-позитивне CK7 негативне |
| Аденокарцинома | CK7-позитивне TTF1 позитивне |
| Великолітинна карцинома | TTF1-негативне |
| Дрібноклітинна карцинома | TTF1-позитивне CD56-позитивне Хромогранін-позитивне Синаптофізин-позитивне |
Легені — це місце, куди часто поширюються пухлини з інших частин тіла. Вторинні ракові захворювання класифікуються за місцем походження: наприклад, рак молочної залози, який поширився на легені, називається метастатичним раком молочної залози. Метастази часто мають характерну круглу форму на рентгенограмі грудної клітини.[51]
Первинний рак легень, у свою чергу, найбільш часто метастазує в мозок, кістки, печінку і наднирники.[11] Імунозабарвлення біопсії часто буває корисним для визначення джерела виникнення раку.[52]
Т — первинна пухлина.
ТО — первинна пухлина не виявляється;
Т і S — преінвазивна карцинома (carcinoma in situ);
Т1 — пухлина не більше 3 см, оточена легеневою тканиною або вісцеральною плеврою, без видимої інвазії проксимально — долькового бронху при бронхоскопії;
Т2 — пухлина більша 3 см або пухлина будь-якого розміру, яка супроводжується ателектазом частки або обструктивною пневмонією, яка розповсюджується на корінь легені. Проксимальний край пухлини розташовується не менше ніж за 2 см від каріни;
Т3- пухлина будь-якого розміру безпосередньо переходить на сусідні анатомічні структури, або пухлина знаходиться менше ніж за 2 см від каріни; пухлина з супутнім ателектазом або обструктивною пневмонією всієї легені або з геморагічним випотом;
Тх — будь-яка пухлина, яка може бути виявлена, або пухлина, доказана цитологічно, але невидима рентгенологічно і бронхоскопічно.
N — регіонарні лімфатичні вузли (внутрішньогрудні лімфовузли)
N0 — немає даних про ураження регіонарних лімфатичних вузлів.
N1 — є ураження не бронхіальних і (або) лімфатичних вузлів кореня легені на стороні ураження, включаючи безпосереднє розповсюдження пухлини на лімфатичні вузли.
N2 — уражені лімфатичні вузли середостіння.
N3 — недостатньо даних для оцінки стану лімфатичних вузлів.
М — віддалені метастази.
М0 — немає ознак віддалених метастазів.
М1 — є віддалені метастази.
Мх — недостатньо даних для визначення віддалених метастазів.
Профілактика — це найбільш економічно вигідний засіб зниження темпів розвитку раку легень. У той час як промислові та побутові канцерогени були виявлені і заборонені у більшості країн світу, паління тютюну все ще залишається поширеним явищем. Усунення паління тютюну є одною з головних цілей профілактики раку, тому відмова від паління наразі є важливим профілактичним засобом.[53]
В багатьох західних країнах посилилось політичне втручання для зменшення пасивного паління в громадських місцях, таких як ресторани і робочі місця.[54] В Бутані з 2005 року діє повна заборона паління,[55] а в Індії заборона паління в громадських місцях діє з жовтня 2008 року.[56] Всесвітня організація охорони здоров'я закликає уряди багатьох країн ввести повну заборону на рекламу тютюнових виробів, щоб вберегти молодих людей від паління. За оцінками організації, у країнах, де була введена заборона, споживання тютюну скоротилось на 16 %.[57]
Додаткове тривале вживання вітамінів A,[58][59] C,[58] D[60] або E[58] не зменшує ризик раку легень. За даними деяких досліджень особи, що вживають більше овочів та фруктів, мають менший ризик захворювання,[23][61] але це, найімовірніше, завадний фактор. Більш точні дослідження не виявили чіткого зв'язку.[61]
Скринінг означає використання медичних тестів для виявлення захворювання у безсимптомних осіб. Можливі скринінг-тести для виявлення раку легень включають цитологію мокротиння, рентгенографію грудної клітки (РГК) та комп'ютерну томографію (КТ). Скринінг-програми з використанням РГК та цитології не продемонстрували жодних переваг.[62] Щорічний скринінг груп ризику (тобто осіб у віці від 55 до 79 років, які курили понад 30 пачко-років, або осіб, які раніше хворіли на рак легень) за допомогою сканерів КТ з низьким рівнем опромінення може зменшити імовірність смерті через рак легень на 0,3 % абсолютної величини (20 % відносної величини).[63][64] Однак існує високий ризик хибно позитивних сканувань, що може призвести до непотрібних інвазійних процедур, а також значних фінансових витрат.[65] На кожне дійсно позитивне сканування приходиться понад 19 хибно позитивних.[66] Радіаційне опромінення — це ще одна потенційна загроза скринінгу.[67]
Спосіб лікування раку легень залежить від конкретного типу ракових клітин, ступеня розповсюдження та загального стану хворого. Найчастішими методами лікування є паліативна допомога,[68] хірургія, хімієтерапія та променева терапія.[3]

Якщо аналізи підтверджують недрібноклітинну карциному легень (НДККЛ), то для оцінювання рівня розповсюдження (випадок локального раку, який можна оперувати, або випадок значного поширення хвороби, коли хірургічне втручання не допоможе) визначають стадію. Для цього використовуються КТ-сканування та позитрон-емісійна томографія.[3] У разі підозри на ураження медіастінального лімфатичного вузла для відбору відповідних зразків та встановлення стадії може використовуватися медіастіноскопія.[69] Для визначення ступеня готовності особи до операції проводять біохімічний аналіз крові та дослідження легеневих функцій.[13] Якщо дослідження легеневих функцій покажуть низький резервний об'єм видиху, то хірургічне втручання може стати неможливим.[3]
У більшості випадків НДККЛ на ранній стадії використовується такий вид хірургічного лікування, як видалення долі легені (лобектомія). Особам, які мають протипоказання до повної лобектомії, призначають меншу за ступенем втручання сублобарну резекцію (клиноподібну резекцію). Однак клиноподібна резекція має більш високий ризик рецидиву, аніж лобектомія.[70] Брахітерапія з радіоактивним ізотопом йоду по краях ділянки клиноподібної резекції може зменшити ризик рецидиву.[71] Інколи видаляють усю легеню (пневмонектомія).[70] Відеоторакоскопічна хірургія (ВТХ) та лобектомія методом ВТХ є мінімально інвазійними підходами оперування раку легень.[72] Лобектомія методом ВТХ має таку ж ефективність, як і звичайна відкрита лобектомія, але, на відміну від останньої, перша характеризується більш комфортним післяопераційним періодом.[73]
У випадку дрібноклітинної карциноми легень (ДККЛ) зазвичай використовуються хімієтерапія та/або променева терапія.[74] Однак значення оперативного втручання при ДККЛ наразі переглядається. На ранніх стадіях ДККЛ операція може покращити шанси на одужання, якщо її доповнює хіміє- та променева терапія.[75]
Радіотерапію дуже часто пропонують разом із хімієтерапією; її також використовують для лікування осіб з НДККЛ, які мають протипоказання до оперативного втручання. Ця форма високоінтенсивної радіотерапії також називається радикальної радіотерапією.[76] Її різновидом є неперервна гіперфракціонована прискорена радіотерапія (або CHART-терапія), при якій за короткий проміжок часу пацієнт проходить декілька сеансів (гіперфракціонування) радіотерапії.[77] Як правило, післяопераційна торакальна радіотерапія після операції з видалення НДККЛ використовуватися не повинна.[78] Деяким пацієнтам з ураженим медіастінальним лімфовузлом N2 може допомогти післяопераційна радіотерапія.[79]
У потенційно виліковних випадках ДККЛ, окрім хімієтерапії, також часто рекомендована радіотерапія грудної клітки.[11]
Якщо збільшення раку призводить до звуження (блокування) бронхіального просвіту, то для його звільнення безпосередньо у дихальному шляху може проводитись брахітерапія (радіотерапія локальної дії).[80] У порівнянні з зовнішньою радіотерапією брахітерапія дозволяє зменшити час лікування та рівень променевого навантаження на медперсонал.[81]
Профілактичне краніальне опромінення (ПКО) — це різновид радіотерапії головного мозку для зменшення ризику метастазів. ПКО є найбільш дієвим при ДККЛ. На ранніх стадіях захворювання ПКО збільшує трирічну виживаність з 15 % до 20 %; при розповсюдженому патологічному захворюванні однорічна виживаність збільшується з 13 % до 27 %.[82]
Подальші удосконалення способів виявлення та візуалізації ступенів ураження тканин призвели до розробки методики стереотаксичного опромінення для лікування раку легень на ранніх стадіях. Ця форма радіотерапії за допомогою технік стереотаксичного наведення забезпечує опромінення високими дозами за невелику кількість сеансів. Вона, насамперед, використовується у пацієнтів, оперування яких через медичну коморбидність є неможливим.[83]
Для пацієнтів з НДККЛ та ДККЛ невеликі дози опромінення грудної клітини можуть використовуватися для контролювання симптомів (паліативна радіотерапія).[84]
Спосіб проведення хімієтерапії залежить від типу пухлини.[11] Першочерговим лікуванням дрібноклітинної карциноми легень (ДККЛ), навіть на ранніх стадіях, є хімієтерапія та опромінення.[85] При ДККЛ найчастіше використовують цисплатин та етопозид.[86] Також використовуються поєднання з карбоплатином, гемцитабіном,паклітакселом, вінорельбіном, топотеканом та іринотеканом.[87][88] На пізніх стадіях недрібноклітинної карциноми легень (НДККЛ) хімієтерапія збільшує виживаність та використовується як першочергове лікування для осіб, які почуваються досить добре, щоб витримати лікування.[89] Зазвичай використовуються два препарати, один з яких (дуже часто) — на основі платини (цисплатин або карбоплатин). Іншими поширеними препаратами є гемцитабін, паклітаксел, доцетаксел,[90][91] пеметрексед,[92] етопозид або вінорельбін.[91]
Ад'ювантна хімієтерапія означає хімієтерапію, яку призначають після лікувальної хірургічної операції з метою збільшення шансів на одужання. При НДККЛ під час операції збираються зразки тканин найближчого лімфатичного вузла для визначення стадії. При підтвердженні стадії II або III захворювання ад'ювантна хімієтерапія збільшує 5-річну виживаність на 5 %.[93][94] Поєднання вінорельбіну з цисплатином є більш ефективним, ніж попередні способи лікування.[94] Ад'ювантна хімієтерапія для осіб зі стадією раку IB вважається спірним методом, оскільки клінічні випробування не виявили її чіткого впливу на рівень виживаності.[95][96] Дослідження передопераційної хімієтерапії (неоад'ювантної хімієтерапії) в операбельних випадках НДККЛ ще не завершено.[97]
Людям на завершальних стадіях захворювання надається паліативна допомога та допомога із полегшення страждань невиліковно хворих.[13] Такі методи передбачають додаткове обговорення варіантів лікування для пошуку зважених рішень[98][99] та допомагають уникнути недієвого, але дорогого догляду наприкінці життя.[99]
При лікування НДККЛ хімієтерапію можна суміщати з паліативною допомогою. У випадках поширення хвороби відповідна хімієтерапія збільшує середньостатистичну виживаність у порівнянні з виживаністю на підтримуючих препаратах без додаткового лікування, а також покращує якість життя.[100] У разі відповідного рівня фізичної форми підтримуюча хімієтерапія впродовж паліативного курсу забезпечує подовження строку виживаності від 1.5 до 3 місяців, а також полегшення симптомів, покращення якості життя та кращі результати лікування завдяки сучасним препаратам.[101][102] Група сумісних досліджень НДККЛ у разі здатності пацієнта перенести лікування рекомендує розглядати хімієтерапію як спосіб лікування навіть на пізніх стадіях НДККЛ.[89][103]
| Клінічна стадія | Виживання впродовж п'яти років (%) | |
|---|---|---|
| Недрібноклітинна карцинома легень | Дрібноклітинна карцинома легень | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Загалом, прогнози невтішні. Після встановлення діагнозу приблизно 15 % осіб з раком легень мають 5-річну виживаність.[5] Хвороба дуже часто має пізню стадію на момент її діагностування. Сьогодні 30-40 % випадків НДККЛ мають стадію IV, як і 60 % випадків ДККЛ.[11]
До факторів прогнозування розвитку НДККЛ відносять наявність або відсутність пульмональних симптомів, розмір пухлини, тип клітин (гістологію), ступінь поширення (стадія) та метастази у різних лімфатичних вузлах, а також проростання судин. В осіб з неоперабельними випадками захворювання виживаність нижча при поганому загальному стані хворого та при втраті ваги понад 10 %.[105] До факторів прогнозування розвитку дрібноклітинного раку легень відносять загальний стан хворого, стать, стадію захворювання та рівень ураження центральної нервової системи або печінки на момент діагностування.[106]
При НДККЛ найкращий прогноз досягається при повній хірургічній резекції пухлини на стадії IA: це 5-річна виживаність у 70 %.[107] Для ДККЛ загальна 5-річна виживаність становить близько 5 %.[3] В осіб з ДККЛ на пізній стадії 5-річна виживаність складає менше 1 %. Середній строк виживаності на перших стадіях складає 20 місяців, а 5-річна виживаність — 20 %.[5]
За даними Національного інституту раку середній вік діагностування раку легень у США становить 70 років,[108] а середній вік смерті через це захворювання — 72 роки.[109] У США особи з полісом медичного страхування найімовірніше мають кращі наслідки хвороби.[110]


В усьому світі рак легень є найпоширенішим видом раку як за розповсюдженістю, так і за кількістю смертельних випадків. 2008 року було зафіксовано 1,61 мільйона нових випадків та 1,38 мільйона смертей через рак легень. Найвищі показники спостерігаються в Європі та Північній Америці.[112] Сегмент населення з високою імовірністю розвитку раку легень — це особи старше 50 років, які довгий час курили. На відміну від рівня смертності серед чоловіків, який почав знижуватися понад 20 років тому, рівень смертності через рак легень серед жінок впродовж останніх десятиліть збільшувався і почав стабілізуватися лише останнім часом.[113] У США довічний ризик розвитку раку легень становить 8 % для чоловіків та 6 % для жінок.[3]
На кожні 3-4 мільйони викурених сигарет припадає один випадок раку легень.[3][114] Вплив «Big Tobacco» (гігантів тютюнової промисловості) відіграє значну роль у формуванні культури куріння.[115] Молоді люди без звички до куріння через перегляд реклами тютюнових виробів найімовірніше почнуть курити.[116] Роль пасивного куріння дуже серйозно розглядається як один з факторів ризику розвитку раку легень,[27] саме тому для зменшення небажаного впливу тютюнового диму на осіб, що не курять, застосовуються різноманітні законодавчі важелі.[117] Шкідливі викиди автомобілів, заводів та енергетичних станцій також представляють потенційний ризик.[7]
Найбільший рівень смертності через рак легень серед чоловіків спостерігається у Східній Європі, у той час як серед жінок — у Північній Європі та США. У Сполучених Штатах більша розповсюдженість захворювання зафіксована серед афроамериканців (чоловіків та жінок).[118] На цей час рівень захворюваності на рак легень нижчий у країнах, що розвиваються.[119] Але через високі показники тютюнопаління у наступні декілька років очікується зріст захворюваності на цей вид раку, особливо в Китаї[120] та Індії.[121]
З 1960-х рр. рівень захворюваності на аденокарциному легень у порівнянні з іншими типами раку почав збільшуватися. Це частково пояснюється початком виробництва сигарет з фільтром. Використання фільтру дозволяє зменшити потрапляння у бронхи крупних часток з тютюнового диму. Однак для отримання такої ж кількості нікотину необхідно затягуватись глибше, що збільшує рівень накопичення шкідливих часток у бронхіолах — основному місці утворення аденокарциноми.[122] Захворюваність на аденокарциному продовжує зростати.[123]
Рак легень був дуже рідким захворюванням до розповсюдження тютюнопаління; до 1761 року його навіть не виділяли як окрему хворобу.[124] Різні види раку легень були описані пізніше, у 1810 році.[125] Злоякісні пухлини легень становили усього до 1 % усіх видів раку, зафіксованих під час процедур автопсії у 1878 році, але цей показник зріс до 10-15 % на початку 20-го сторіччя.[126] У 1912 році в усьому світі було письмово зафіксовано лише 374 випадки цієї хвороби,[127] однак перегляд звітів автопсії показав, що захворюваність на рак легень збільшилася з 0,3 % у 1852 році до 5,66 % у 1952 році.[128] У 1929 році терапевт Фріц Лікінт (Німеччина) відкрив зв'язок між курінням та раком легень,[126] що призвело до агресивної кампанії з боротьби проти куріння.[129] British Doctors Study (дослідження британських докторів), опубліковане у 1950-х рр., стало першим авторитетним епідеміологічним доказом зв'язку між курінням та раком легень.[130] В результаті у 1964 році Головний хірург США порекомендував особам, що курять, припинити курити.[131]
Зв'язок хвороби з газом радоном було вперше виявлено серед шахтарів, які працювали у Рудних горах біля Шнеберга, Саксонія. У цих горах з 1470 року видобували срібло; ці гори також багаті на уран і на супутній радій та радоновий газ.[132] Серед шахтарів спостерігалася непропорційно велика кількість випадків захворювання, яке у 1870-х рр. врешті-решт було визнано раком легень.[133] Попри таке відкриття у 1950-х рр., через попит СРСР на уран, добування продовжувалося.[132] У 1960-х рр. було підтверджено, що радон є причиною раку легень.[134]
Першу успішну пневмонектомію для лікування раку легень було проведено у 1933 році.[135] Паліативна радіотерапія використовувалася з 1940-х рр.[136] Радикальна радіотерапія, яку спочатку використовували у 1950-х рр., була спробою лікування значними дозами опромінення пацієнтів на ранніх стадіях раку легень з протипоказаннями до хірургічного втручання.[137] У 1997 році як більш прогресивний метод у порівнянні зі звичайною радикальною радіотерапією було запропоновано неперервну гіперфракціоновану прискорену радіотерапію.[138] Перші спроби лікування дрібноклітинної карциноми методами хірургічної резекції[139] та радикальної радіотерапії[140], проведені у 1960-х рр., виявилися марними. У 1970-х рр. було створено дієві препарати для хімієтерапії[141].
- ↑ а б в г д е ж и PubMed — 1997.
- ↑ http://www.asbestos.com/asbestosis/
- ↑ а б в г д е ж и к л м н п р с т у ф Horn, L; Pao W, Johnson DH (2012). Chapter 89. У Longo, DL; Kasper, DL; Jameson, JL; Fauci, AS; Hauser, SL; Loscalzo, J (ред.). Harrison's Principles of Internal Medicine (вид. 18th). McGraw-Hill. ISBN 0-07-174889-X.
- ↑ Сучасні аспекти скринінгу раку легені. А. В. Ганул, В. Д. Захаричев/Здоров'я України, 2013
- ↑ а б в г Lung Carcinoma: Tumors of the Lungs. Merck Manual Professional Edition, Online edition. Процитовано 15 серпня 2007.
- ↑ Thun, MJ; Hannan LM, Adams-Campbell LL et al. (September 2008). Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies. PLoS Medicine. 5 (9): e185. doi:10.1371/journal.pmed.0050185. PMC 2531137. PMID 18788891.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б в г д е ж и Alberg AJ, Samet JM (2010). Chapter 46. Murray & Nadel's Textbook of Respiratory Medicine (вид. 5th). Saunders Elsevier. ISBN 978-1-4160-4710-0.
- ↑ а б O'Reilly, KM; Mclaughlin AM, Beckett WS, Sime PJ (March 2007). Asbestos-related lung disease. American Family Physician. 75 (5): 683—688. PMID 17375514. Архів оригіналу за 29 вересня 2007. Процитовано 30 грудня 2014.
- ↑ Carmona, RH (27 червня 2006). The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General. U.S. Department of Health and Human Services. Архів оригіналу за 3 липня 2006. Процитовано 30 грудня 2014.
Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.
- ↑ Tobacco Smoke and Involuntary Smoking (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer. 83. 2002.
There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).
- ↑ а б в г д е ж и к л Lu, C; Onn A, Vaporciyan AA et al. (2010). 78: Cancer of the Lung. Holland-Frei Cancer Medicine (вид. 8th). People's Medical Publishing House. ISBN 9781607950141.
- ↑ Chapman, S; Robinson G, Stradling J, West S (2009). Chapter 31. Oxford Handbook of Respiratory Medicine (вид. 2nd). Oxford University Press. ISBN 9-780199-545162.
- ↑ а б в г д е Collins, LG; Haines C, Perkel R, Enck RE (January 2007). Lung cancer: diagnosis and management. American Family Physician. American Academy of Family Physicians. 75 (1): 56—63. PMID 17225705. Архів оригіналу за 29 вересня 2007. Процитовано 30 грудня 2014.
- ↑ World Cancer Report 2014. World Health Organization. 2014. с. Chapter 5.1. ISBN 92-832-0429-8.
- ↑ Honnorat, J; Antoine JC (May 2007). Paraneoplastic neurological syndromes. Orphanet Journal of Rare Diseases. BioMed Central. 2 (1): 22. doi:10.1186/1750-1172-2-22. PMC 1868710. PMID 17480225.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Greene, Frederick L. (2002). AJCC cancer staging manual. Berlin: Springer-Verlag. ISBN 0-387-95271-3.
- ↑ Brown, KM; Keats JJ, Sekulic A et al. (2010). 8. Holland-Frei Cancer Medicine (вид. 8th). People's Medical Publishing House USA. ISBN 978-1607950141.
- ↑ Biesalski, HK; Bueno de Mesquita B, Chesson A et al. (1998). European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel. CA Cancer J Clin. Smoking is the major risk factor, accounting for about 90% of lung cancer incidence. 48 (3): 167—176, discussion 164–166. doi:10.3322/canjclin.48.3.167. PMID 9594919.
- ↑ Hecht, S (October 2003). Tobacco carcinogens, their biomarkers and tobacco-induced cancer. Nature Reviews Cancer. Nature Publishing Group. 3 (10): 733—744. doi:10.1038/nrc1190. PMID 14570033.
- ↑ Sopori, M (May 2002). Effects of cigarette smoke on the immune system. Nature Reviews Immunology. 2 (5): 372—7. doi:10.1038/nri803. PMID 12033743.
- ↑ Peto, R; Lopez AD, Boreham J et al. (2006). Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. ISBN 0-19-262535-7.
- ↑ California Environmental Protection Agency (1997). Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency. Tobacco Control. 6 (4): 346—353. doi:10.1136/tc.6.4.346. PMC 1759599. PMID 9583639.
* CDC (December 2001). State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000. Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC. 50 (49): 1101—1106. PMID 11794619.{{cite journal}}: Вказано більш, ніж один|author1=та|last=(довідка) - ↑ а б в г Alberg, AJ; Samet JM (September 2007). Epidemiology of lung cancer. Chest. American College of Chest Physicians. 132 (S3): 29S—55S. doi:10.1378/chest.07-1347. PMID 17873159. Архів оригіналу за 29 березня 2020. Процитовано 30 грудня 2014.
- ↑ Jaakkola, MS; Jaakkola JJ (August 2006). Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention. European Respiratory Journal. 28 (2): 397—408. doi:10.1183/09031936.06.00001306. PMID 16880370.
- ↑ Parkin, DM (December 2011). Tobacco—attributable cancer burden in the UK in 2010. British Journal of Cancer. 105 (Suppl. 2): S6—S13. doi:10.1038/bjc.2011.475. PMC 3252064. PMID 22158323.
- ↑ National Health and Medical Research Council (April 1994). The health effects and regulation of passive smoking. Australian Government Publishing Service. Архів оригіналу за 29 вересня 2007. Процитовано 10 серпня 2007.
- ↑ а б Taylor, R; Najafi F, Dobson A (October 2007). Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. International Journal of Epidemiology. 36 (5): 1048—1059. doi:10.1093/ije/dym158. PMID 17690135.
- ↑ Frequently asked questions about second hand smoke. World Health Organization. Процитовано 25 липня 2012.
- ↑ Schick, S; Glantz S (December 2005). Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke. Tobacco Control. 14 (6): 396—404. doi:10.1136/tc.2005.011288. PMC 1748121. PMID 16319363.
- ↑ Schmid K, Kuwert T, Drexler H (March 2010). Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine. Dtsch Arztebl Int. 107 (11): 181—6. doi:10.3238/arztebl.2010.0181. PMC 2853156. PMID 20386676.
- ↑ EPA (October 2006). Radiation information: radon. EPA. Процитовано 11 серпня 2007.
- ↑ Davies, RJO; Lee YCG (2010). 18.19.3. Oxford Textbook Medicine (вид. 5th). OUP Oxford. ISBN 978-0199204854.
- ↑ Chen, H; Goldberg MS, Villeneuve PJ (Oct-Dec 2008). A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases. Reviews on Environmental Health. 23 (4): 243—297. PMID 19235364.
- ↑ Clapp, RW; Jacobs MM, Loechler EL (Jan-Mar 2008). Environmental and Occupational Causes of Cancer New Evidence, 2005–2007. Reviews on Environmental Health. 23 (1): 1—37. PMC 2791455. PMID 18557596.
- ↑ а б Lim, WY; Seow, A (2012 Jan). Biomass fuels and lung cancer. Respirology (Carlton, Vic.). 17 (1): 20—31. PMID 22008241.
- ↑ а б Sood, A (2012 Dec). Indoor fuel exposure and the lung in both developing and developed countries: an update. Clinics in chest medicine. 33 (4): 649—65. PMID 23153607.
- ↑ Dudley, Joel (2013). Exploring Personal Genomics. Oxford University Press. с. 25. ISBN 9780199644483.
- ↑ Kern JA, McLennan G (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 1802. ISBN 0-07-145739-9.
- ↑ Cogliano, VJ; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, CP (2011 Dec 21). Preventable exposures associated with human cancers (PDF). Journal of the National Cancer Institute. 103 (24): 1827—39. PMID 22158127. Архів оригіналу (PDF) за 20 вересня 2012. Процитовано 30 грудня 2014.
- ↑ Fong, KM; Sekido Y, Gazdar AF, Minna JD (October 2003). Lung cancer • 9: Molecular biology of lung cancer: clinical implications. Thorax. BMJ Publishing Group Ltd. 58 (10): 892—900. doi:10.1136/thorax.58.10.892. PMC 1746489. PMID 14514947.
- ↑ Salgia, R; Skarin AT (March 1998). Molecular abnormalities in lung cancer. Journal of Clinical Oncology. 16 (3): 1207—1217. PMID 9508209.
- ↑ а б в г Herbst, RS; Heymach JV, Lippman SM (September 2008). Lung cancer. New England Journal of Medicine. 359 (13): 1367—1380. doi:10.1056/NEJMra0802714. PMID 18815398. Архів оригіналу за 28 вересня 2008. Процитовано 30 грудня 2014.
- ↑ Aviel-Ronen, S; Blackhall FH, Shepherd FA, Tsao MS (July 2006). K-ras mutations in non-small-cell lung carcinoma: a review. Clinical Lung Cancer. Cancer Information Group. 8 (1): 30—38. doi:10.3816/CLC.2006.n.030. PMID 16870043.
- ↑ Devereux, TR; Taylor JA, Barrett JC (March 1996). Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors. Chest. American College of Chest Physicians. 109 (Suppl 3): 14S—19S. doi:10.1378/chest.109.3_Supplement.14S. PMID 8598134.
- ↑ Miller, WT (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 486. ISBN 0-07-145739-9.
- ↑ Kaiser, LR (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 1815—1816. ISBN 0-07-145739-9.
- ↑ а б Maitra, A; Kumar V (2007). Robbins Basic Pathology (вид. 8th). Saunders Elsevier. с. 528—529. ISBN 978-1-4160-2973-1.
- ↑ Subramanian, J; Govindan R (February 2007). Lung cancer in never smokers: a review. Journal of Clinical Oncology. American Society of Clinical Oncology. 25 (5): 561—570. doi:10.1200/JCO.2006.06.8015. PMID 17290066.
- ↑ Raz, DJ; He B, Rosell R, Jablons DM (March 2006). Bronchioloalveolar carcinoma: a review. Clinical Lung Cancer. 7 (5): 313—322. doi:10.3816/CLC.2006.n.012. PMID 16640802.
- ↑ Rosti, G; Bevilacqua G, Bidoli P et al. (March 2006). Small cell lung cancer. Annals of Oncology. 17 (Suppl. 2): 5—10. doi:10.1093/annonc/mdj910. PMID 16608983.
- ↑ Seo, JB; Im JG, Goo JM et al. (1 March 2001). Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics. 21 (2): 403—417. PMID 11259704.
- ↑ Tan D, Zander DS (2008). Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update. Int J Clin Exp Pathol. 1 (1): 19—31. PMC 2480532. PMID 18784820.
- ↑ Goodman, GE (November 2002). Lung cancer. 1: prevention of lung cancer (PDF). Thorax. 57 (11): 994—999. PMC 1746232. PMID 12403886.
- ↑ McNabola, A; Gill LW (February 2009). The control of environmental tobacco smoke: a policy review. International Journal of Environmental Research and Public Health. 6 (2): 741—758. doi:10.3390/ijerph6020741. PMC 2672352. PMID 19440413.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Pandey, G (February 2005). Bhutan's smokers face public ban. BBC. Процитовано 7 вересня 2007.
- ↑ Pandey, G (2 October 2008). Indian ban on smoking in public. BBC. Процитовано 25 квітня 2012.
- ↑ UN health agency calls for total ban on tobacco advertising to protect young (Пресреліз). United Nations News service. 30 травня 2008.
- ↑ а б в Fabricius, P; Lange P (July–September 2003). Diet and lung cancer. Monaldi Archives for Chest Disease. 59 (3): 207—211. PMID 15065316.
- ↑ Fritz, H; Kennedy D, Fergusson D et al. (2011). Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis. PLoS ONE. 6 (6): e21107. doi:10.1371/journal.pone.0021107. PMC 3124481. PMID 21738614.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Herr, C; Greulich T, Koczulla RA et al. (March 2011). The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer. Respiratory Research. 12 (1): 31. doi:10.1186/1465-9921-12-31. PMC 3071319. PMID 21418564.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Key, TJ (January 2011). Fruit and vegetables and cancer risk. British Journal of Cancer. 104 (1): 6—11. doi:10.1038/sj.bjc.6606032. PMC 3039795. PMID 21119663.
- ↑ Manser, RL; Irving LB, Stone C et al. (2004). Screening for lung cancer. Cochrane Database of Systematic Reviews (1): CD001991. doi:10.1002/14651858.CD001991.pub2. PMID 14973979.
- ↑ Jaklitsch, MT; Jacobson FL, Austin JH et al. (July 2012). The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. Journal of Thoracic and Cardiovascular Surgery. 144 (1): 33—38. doi:10.1016/j.jtcvs.2012.05.060. PMID 22710039.
- ↑ Bach, PB; Mirkin JN, Oliver TK et al. (June 2012). Benefits and harms of CT screening for lung cancer: a systematic review. JAMA: the Journal of the American Medical Association. 307 (22): 2418—2429. doi:10.1001/jama.2012.5521. PMID 22610500.
- ↑ Boiselle, PM (2013 Mar 20). Computed tomography screening for lung cancer. JAMA : the journal of the American Medical Association. 309 (11): 1163—70. PMID 23512063.
- ↑ Bach PB, Mirkin JN, Oliver TK та ін. (June 2012). Benefits and harms of CT screening for lung cancer: a systematic review. JAMA. 307 (22): 2418—29. doi:10.1001/jama.2012.5521. PMID 22610500.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Aberle, DR; Abtin, F; Brown, K (2013 Mar 10). Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 31 (8): 1002—8. PMID 23401434.
- ↑ Ferrell, B; Koczywas M, Grannis F, Harrington A (April 2011). Palliative care in lung cancer. Surgical Clinics of North America. 91 (2): 403—417. doi:10.1016/j.suc.2010.12.003. PMID 21419260.
- ↑ Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 1853—1854. ISBN 0-07-145739-9.
- ↑ а б Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 1855—1856. ISBN 0-07-145739-9.
- ↑ Odell, DD; Kent MS, Fernando HC (Spring 2010). Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer. Seminars in Thoracic and Cardiovascular Surgery. 22 (1): 32—37. doi:10.1053/j.semtcvs.2010.04.003. PMID 20813314.
- ↑ Alam, N; Flores RM (July–September 2007). Video-assisted thoracic surgery (VATS) lobectomy: the evidence base. Journal of the Society of Laparoendoscopic Surgeons. 11 (3): 368—374. PMC 3015831. PMID 17931521.
- ↑ Rueth, NM; Andrade RS (June 2010). Is VATS lobectomy better: perioperatively, biologically and oncologically?. Annals of Thoracic Surgery. 89 (6): S2107—S2111. doi:10.1016/j.athoracsur.2010.03.020. PMID 20493991.
- ↑ Simon GR, Turrisi A (September 2007). Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 132 (3 Suppl): 324S—339S. doi:10.1378/chest.07-1385. PMID 17873178.
- ↑ Goldstein, SD; Yang SC (October 2011). Role of surgery in small cell lung cancer. Surgical Oncology Clinics of North America. 20 (4): 769—777. doi:10.1016/j.soc.2011.08.001. PMID 21986271.
- ↑ Arriagada, R; Goldstraw P, Le Chevalier T (2002). Oxford Textbook of Oncology (вид. 2nd). Oxford University Press. с. 2094. ISBN 0-19-262926-3.
- ↑ Hatton, MQ; Martin JE (June 2010). Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions. Clinical Oncology (Royal College of Radiologists). 22 (5): 356—364. doi:10.1016/j.clon.2010.03.010. PMID 20399629.
- ↑ PORT Meta-analysis Trialists Group (2005). Rydzewska, Larysa (ред.). Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews (2): CD002142. doi:10.1002/14651858.CD002142.pub2. PMID 15846628.
- ↑ Le Péchoux, C (2011). Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data. Oncologist. 16 (5): 672—681. doi:10.1634/theoncologist.2010-0150. PMC 3228187. PMID 21378080.
- ↑ Cardona, AF; Reveiz L, Ospina EG et al. (April 2008). Palliative endobronchial brachytherapy for non-small cell lung cancer. Cochrane Database of Systematic Reviews (2): CD004284. doi:10.1002/14651858.CD004284.pub2. PMID 18425900.
- ↑ Ikushima, H (February 2010). Radiation therapy: state of the art and the future. Journal of Medical Investigation. 57 (1–2): 1—11. PMID 20299738.[недоступне посилання з квітня 2019]
- ↑ Paumier, A; Cuenca X, Le Péchoux C (June 2011). Prophylactic cranial irradiation in lung cancer. Cancer Treatment Reviews. 37 (4): 261—265. doi:10.1016/j.ctrv.2010.08.009. PMID 20934256.
- ↑ Girard, N; Mornex F (October 2011). Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update. Cancer Radiothérapie. 15 (6–7): 522—526. doi:10.1016/j.canrad.2011.07.241. PMID 21889901.
- ↑ Fairchild, A; Harris K, Barnes E et al. (August 2008). Palliative thoracic radiotherapy for lung cancer: a systematic review. Journal of Clinical Oncology. 26 (24): 4001—4011. doi:10.1200/JCO.2007.15.3312. PMID 18711191.
- ↑ Hann CL, Rudin CM (30 листопада 2008). Management of small-cell lung cancer: incremental changes but hope for the future. Oncology (Williston Park). 22 (13): 1486—92. PMID 19133604.
- ↑ Murray, N; Turrisi AT (March 2006). A review of first-line treatment for small-cell lung cancer. Journal of Thoracic Oncology. 1 (3): 270—278. PMID 17409868.
- ↑ Azim, HA; Ganti AK (March 2007). Treatment options for relapsed small-cell lung cancer. Anticancer drugs. 18 (3): 255—261. doi:10.1097/CAD.0b013e328011a547. PMID 17264756.
- ↑ MacCallum, C; Gillenwater HH (July 2006). Second-line treatment of small-cell lung cancer. Current Oncology Reports. 8 (4): 258—264. doi:10.1007/s11912-006-0030-8. PMID 17254525.
- ↑ а б NSCLC Meta-Analyses Collaborative Group (October 2008). Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials. J. Clin. Oncol. 26 (28): 4617—25. doi:10.1200/JCO.2008.17.7162. PMC 2653127. PMID 18678835.
- ↑ Mehra R, Treat J (2008). Fishman's Pulmonary Diseases and Disorders (вид. 4th). McGraw-Hill. с. 1876. ISBN 0-07-145739-9.
- ↑ а б Clegg, A; Scott DA, Hewitson P et al. (January 2002). Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax. BMJ Publishing Group. 57 (1): 20—28. doi:10.1136/thorax.57.1.20. PMC 1746188. PMID 11809985.
- ↑ Fuld AD, Dragnev KH, Rigas JR (June 2010). Pemetrexed in advanced non-small-cell lung cancer. Expert Opin Pharmacother. 11 (8): 1387—402. doi:10.1517/14656566.2010.482560. PMID 20446853.
- ↑ Carbone, DP; Felip E (September 2011). Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms. Clinical Lung Cancer. 12 (5): 261—271. doi:10.1016/j.cllc.2011.06.002. PMID 21831720.
- ↑ а б Le Chevalier, T (October 2010). Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Annals of Oncology. 21 (Suppl. 7): vii196—198. doi:10.1093/annonc/mdq376. PMID 20943614.
- ↑ Horn, L; Sandler AB, Putnam JB Jr, Johnson DH (May 2007). The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer. Journal of Thoracic Oncology. 2 (5): 377—383. doi:10.1097/01.JTO.0000268669.64625.bb. PMID 17473651.
- ↑ Wakelee, HA; Schiller JH, Gandara DR (July 2006). Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial. Clinical Lung Cancer. Cancer Information Group. 8 (1): 18—21. doi:10.3816/CLC.2006.n.028. PMID 16870041.
- ↑ BMJ (December 2005). Clinical evidence concise : the international resource of the best available evidence for effective health care. № 14. London: BMJ Publishing Group. с. 486–488. ISBN 1-905545-00-2. ISSN 1475-9225.
- ↑ Kelley AS, Meier DE (August 2010). Palliative care—a shifting paradigm. New England Journal of Medicine. 363 (8): 781—2. doi:10.1056/NEJMe1004139. PMID 20818881.
- ↑ а б Prince-Paul M (April 2009). When hospice is the best option: an opportunity to redefine goals. Oncology (Williston Park, N.Y.). 23 (4 Suppl Nurse Ed): 13—7. PMID 19856592.
- ↑ Souquet PJ, Chauvin F, Boissel JP, Bernard JP (April 1995). Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer. Lung Cancer. 12 Suppl 1: S147—54. doi:10.1016/0169-5002(95)00430-9. PMID 7551923.
- ↑ Sörenson S, Glimelius B, Nygren P (2001). A systematic overview of chemotherapy effects in non-small cell lung cancer. Acta Oncol. 40 (2–3): 327—39. PMID 11441939.
- ↑ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (2001). A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer. Health Technol Assess. 5 (32): 1—195. PMID 12065068.
- ↑ Non-Small Cell Lung Cancer Collaborative Group (2010). Burdett, Sarah (ред.). Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. 2 (5). PMID 20464750.
- ↑ Rami-Porta R, Crowley JJ, Goldstraw P (February 2009). The revised TNM staging system for lung cancer (PDF). Annals of Thoracic and Cardiovascular Surgery. 15 (1): 4—9. PMID 19262443. Архів (PDF) оригіналу за 9 May 2012.(англ.) Наведено за англійською вікіпедією.
- ↑ Non-Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. Процитовано 22 листопада 2008.
- ↑ Small Cell Lung Cancer Treatment. PDQ for Health Professionals. National Cancer Institute. 2012. Процитовано 16 травня 2012.
- ↑ Spiro, SG (2010). 18.19.1. Oxford Textbook Medicine (вид. 5th). OUP Oxford. ISBN 978-0199204854.
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002—2003
- ↑ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002—2006
- ↑ Slatore, CG; Au DH, Gould MK (November 2010). An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes. American Journal of Respiratory and Critical Care Medicine. 182 (9): 1195—1205. doi:10.1164/rccm.2009-038ST. PMID 21041563.
- ↑ WHO Disease and injury country estimates. World Health Organization. 2009. Процитовано 11 листопада 2009.
- ↑ Ferlay, J; Shin HR, Bray F et al. (December 2010). Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal of Cancer. 127 (12): 2893—2917. doi:10.1002/ijc.25516. PMID 21351269.
- ↑ Jemal A, Tiwari RC, Murray T та ін. (2004). Cancer statistics, 2004. CA: a Cancer Journal for Clinicians. 54 (1): 8—29. doi:10.3322/canjclin.54.1.8. PMID 14974761.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Proctor, RN (March 2012). The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll. Tobacco Control. 21 (2): 87—91. doi:10.1136/tobaccocontrol-2011-050338. PMID 22345227.
- ↑ Lum, KL; Polansky JR, Jackler RK, Glantz SA (October 2008). Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951. Tobacco Control. 17 (5): 313—323. doi:10.1136/tc.2008.025445. PMC 2602591. PMID 18818225.
- ↑ Lovato, C; Watts A, Stead LF (October 2011). Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours. Cochrane Database of Systematic Reviews (10): CD003439. doi:10.1002/14651858.CD003439.pub2. PMID 21975739.
- ↑ Kemp, FB (Jul–Sep 2009). Smoke free policies in Europe. An overview. Pneumologia. 58 (3): 155—158. PMID 19817310.
- ↑ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010 [1]
- ↑ Gender in lung cancer and smoking research (PDF). World Health Organization. 2004. Процитовано 26 травня 2007.
- ↑ Zhang, J; Ou JX, Bai CX (November 2011). Tobacco smoking in China: prevalence, disease burden, challenges and future strategies. Respirology. 16 (8): 1165—1172. doi:10.1111/j.1440-1843.2011.02062.x. PMID 21910781.
- ↑ Behera, D; Balamugesh T (2004). Lung cancer in India (PDF). Indian Journal of Chest Diseases and Allied Sciences. 46 (4): 269—281. PMID 15515828. Архів оригіналу (PDF) за 17 грудня 2008. Процитовано 30 грудня 2014.
- ↑ Charloux, A; Quoix E, Wolkove N et al. (February 1997). The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma. International Journal of Epidemiology. 26 (1): 14—23. doi:10.1093/ije/26.1.14. PMID 9126499.
- ↑ Kadara, H; Kabbout M, Wistuba II (January 2012). Pulmonary adenocarcinoma: a renewed entity in 2011. Respirology. 17 (1): 50—65. doi:10.1111/j.1440-1843.2011.02095.x. PMID 22040022.
- ↑ Morgagni, Giovanni Battista (1761). De sedibus et causis morborum per anatomen indagatis. OL 24830495M.
- ↑ Bayle, Gaspard-Laurent (1810). Recherches sur la phthisie pulmonaire (French) . Paris. OL 15355651W.
- ↑ а б Witschi, H (November 2001). A short history of lung cancer. Toxicological Sciences. 64 (1): 4—6. doi:10.1093/toxsci/64.1.4. PMID 11606795.
- ↑ Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA (2005). One hundred years of lung cancer. American Journal of Respiratory and Critical Care Medicine. 172 (5): 523—529. doi:10.1164/rccm.200504-531OE. PMID 15961694.
- ↑ Grannis, FW. History of cigarette smoking and lung cancer. smokinglungs.com. Архів оригіналу за 18 липня 2007. Процитовано 6 серпня 2007.
- ↑ Proctor, R (2000). The Nazi War on Cancer. Princeton University Press. с. 173–246. ISBN 0-691-00196-0.
- ↑ Doll, R; Hill AB (November 1956). Lung Cancer and Other Causes of Death in Relation to Smoking. British Medical Journal. 2 (5001): 1071—1081. doi:10.1136/bmj.2.5001.1071. PMC 2035864. PMID 13364389.
- ↑ US Department of Health Education and Welfare (1964). Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF). Washington, DC: US Government Printing Office.
- ↑ а б Greaves, M (2000). Cancer: the Evolutionary Legacy. Oxford University Press. с. 196–197. ISBN 0-19-262835-6.
- ↑ Greenberg, M; Selikoff IJ (February 1993). Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879. Annals of Occupational Hygiene. 37 (1): 5—14. PMID 8460878.
- ↑ Samet, JM (April 2011). Radiation and cancer risk: a continuing challenge for epidemiologists. Environmental Health. 10 (Suppl. 1): S4. doi:10.1186/1476-069X-10-S1-S4. PMC 3073196. PMID 21489214.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Horn, L; Johnson DH (July 2008). Evarts A. Graham and the first pneumonectomy for lung cancer. Journal of Clinical Oncology. 26 (19): 3268—3275. doi:10.1200/JCO.2008.16.8260. PMID 18591561. Архів оригіналу за 17 березня 2020. Процитовано 30 грудня 2014.
- ↑ Edwards, AT (1946). Carcinoma of the Bronchus. Thorax. 1 (1): 1—25. doi:10.1136/thx.1.1.1. PMC 1018207. PMID 20986395.
- ↑ Kabela, M (1956). Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses [Experience with radical irradiation of bronchial cancer]. Ceskoslovenská Onkológia (German) . 3 (2): 109—115. PMID 13383622.
- ↑ Saunders, M; Dische S, Barrett A et al. (July 1997). Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. Lancet. Elsevier. 350 (9072): 161—165. doi:10.1016/S0140-6736(97)06305-8. PMID 9250182.
- ↑ Lennox, SC; Flavell G, Pollock DJ et al. (November 1968). Results of resection for oat-cell carcinoma of the lung. Lancet. Elsevier. 2 (7575): 925—927. doi:10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ↑ Miller, AB; Fox W, Tall R (September 1969). Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet. Elsevier. 2 (7619): 501—505. doi:10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ↑ Cohen, M; Creaven PJ, Fossieck BE Jr et al. (1977). Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treatment Reports. 61 (3): 349—354. PMID 194691.
|