Аргінін
| Аргінін | |
|---|---|

| |

| |
| Інші назви | δ-гуанідин-α-аміновалеріанова кислота |
| Ідентифікатори | |
| Абревіатури | Арг, Arg, R |
| Номер CAS | 7200-25-1 |
| PubChem | 232 |
| Номер EINECS | 200-811-1 |
| DrugBank | DB00125 |
| KEGG | C02385 |
| Назва MeSH | Arginine |
| ChEBI | 29016 |
| SMILES | NC(CCCNC(N)=N)C(O)=O |
| InChI | InChI=1S/C6H14N4O2/c7-4(5(11)12)2-1-3-10-6(8)9/h4H,1-3,7H2,(H,11,12)(H4,8,9,10)/t4-/m0/s1 |
| Номер Бельштейна | 1725413 |
| Номер Гмеліна | 83283 |
| Властивості | |
| Молекулярна формула | C6H14N4O2 |
| Молярна маса | 174,2 г/моль |
| Зовнішній вигляд | Білі кристали |
| Розчинність (вода) | 87,1 г/л |
| Кислотність (pKa) | 2,488 |
| Ізоелектрична точка | 10,75 |
| Небезпеки | |
| Класифікація ЄС | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Аргіні́н (δ-гуанідин-α-аміновалеріанова кислота, скорочення Арг, Arg, R) — основна α-амінокислота, l-форма якої входить до 20 амінокислот, що кодуються генетичним кодом (кодони ЦГА, ЦГУ, ЦГГ, ЦГЦ, АГА та АГГ в мРНК[1]) і становлять основу білків. Для людини аргінін є напівнезамінною амінокислотою, тобто біохімічні шляхи для її біосинтезу існують, проте в певні періоди життя, зокрема інтенсивного росту та розвитку, а також під час деяких захворювань вони не можуть забезпечувати достатньої кількості цієї сполуки, через що вона повинна потрапляти в організм із їжею[2]. Для деяких видів тварин, як-от птахів, хижих та морських ссавців, аргінін є незамінною амінокислотою[3].
Завдяки гуанідиновому угрупуванню є найосновнішою з амінокислот. Часто входить до частин білків, що взаємодіють з ДНК. У організмі тварин деградується до сечовини.
Окрім того, що аргінін входить до складу білків, ця амінокислота також важлива для багатьох інших метаболічних шляхів клітини, зокрема синтезу Нітроген (II) оксиду, поліамінів, проліну, глутамату, креатину та агматину[4].
Аргінін був вперше виділений із проростків люпину 1886 року, а через 9 років з'ясувалося, що він входить до складу тваринних білків. 1897 року вдалося встановити хімічну будову цієї амінокислоти шляхом її лужного гідролізу до орнітину та сечовини, а пізніше (у 1910 р.) структура аргініну була підтверджена шляхом його синтезу із бензилорнітину. 1924 було відкрито, що аргінін є головною амінокислотою в основних білках сперми риб. А 1930 році Вільям Каммінг Роуз показав у своєму класичному експерименті, що аргінін належить до замінних амінокислот, тобто може синтезуватися в організмі ссавців. 1932 року Ганс Кребс та Курт Гензеляйт відкрили цикл сечовини, у якому аргінін є проміжним метаболітом, що поклало початок детальному вивченню метаболізму цієї амінокислоти[5].
У пізні 1930-ті та 1940-ві роки Фостер встановив, що аргінін є попередником у синтезі креатину. Тоді ж було виявлено, що надходження цієї амінокислоти із дієтою необхідне для росту курчат і молодих пацюків, але не обов'язкове для нормальної життєдіяльності дорослих здорових пацюків. Подальші дослідження, що тривали до 1970-х років, показали, що аргінін — замінна амінокислота для дорослих здорових людей та багатьох інших ссавців, але незамінна для їхніх малят та для хижаків[5].
Віндмюллер (англ. Windmueller) та Спаєт (англ. Spaeth) у 1980-х роках показали, що головним джерелом цитруліну в крові, який використовується тканинами для синтезу аргініну, є тонка кишка. Згодом це призвело до відкриття метаболічного шляху біосинтезу цитруліну із глутаміну/глутамату через Δ1-піролін-5-карбоксилат. Також наприкінці 1980-х років була з'ясована роль аргініну як попередника у синтезі NO в едотелії та макрофагах, а пізніше і в багатьох інших типах клітин[5].

Аргінін як α-амінокислота містить аміно- та карбоксильну групу розташовані біля одного (α) атома Карбону. Цей атом є хіральним, і в залежності від розташування замісників біля нього розрізняють l- та d-форми, до складу білків входить перша із них.
R-група аргініну складається із карбонового ланцюга довжиною три атоми, на кінці якого розташоване гуанідинове угрупування, завдяки якому ця амінокислота має сильні основні властивості. Коли аргінін перебуває в іонізованій формі, позитивний заряд у гуанідиновій групі рівномірно розподіляється між трьома атомами Нітрогену й атомом Карбону завдяки делокалізації електронів[6].
Логарифмічна константа дисоціації карбоксильної групи аргініну pK1 = 2,17; константа дисоціації α-аміногрупи pK2 = 9,04, а гуанідинвого угрупування pKR(R група) = 12,48. Аргінін найосновніша із 20 стандартних амінокислот, ізоелектрична точка для неї становить pI = 10,76[7].
Індекс гідропатичності (заміна вільної енергії при перенесенні R групи із гідрофобного розчинника у воду) для аргініну становить -4,5 кДж/моль, вона найбільш гідрофільна із 20 стандартних амінокислот[7].
У розчині або у складі білків аргінін можна якісно та кількісно визначити завдяки реакції Сакагучі. Вона полягає у взаємодії гіпохлориту натрію і 2-нафтолу з гуанідином у лужному середовищі з утворенням сполук червоного забарвлення[8][9].
Одержання орнітину
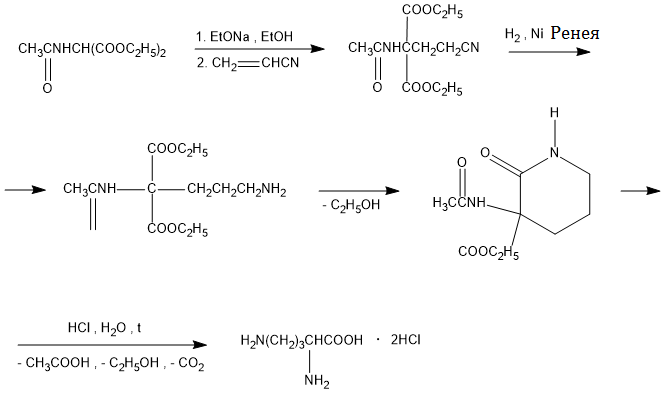
Основа: В пов'язує протон карбоксильної групи, після чого слідує нуклеофільна атака δ-NH2-групи (більш сильний нуклеофільний центр, ніж α-аміногрупа) по -зв'язку ціанаміду


Основними джерелами аргініну в організмі людини є їжа, обмін білків та ендогенний синтез. При чому у дорослих осіб тільки 5—15 % загальної кількості цієї амінокислоти в крові припадає на утворену de novo. Більшість синтезу аргініну в організмі відбувається за участі тонкого кишечника та нирок[5].
Біосинтез аргініну de novo розпочинається із глутамату, який фосфорилюється до γ-глутамілфосфату із використанням однієї молекули АТФ, після чого утворений продукт відновлюється до глутамат-γ-семіадьдегіду. Ці реакції каталізують глутаматкіназа та γ-глутамілфосфатредуктаза відповідно. Глутамат-γ-семіальдегід спонтанно циклізується у Δ1-піролін-5-карбоксилат (П5К), який далі може бути перетворений у пролін, проте під час біосинтезу аргініну глутамат-γ-семіальдегід повинен вступати в реакцію переамінування із глутаматом, внаслідок якої він перетворюється до l-орнітину. Рівновага реакції циклізації семіальдегу у П5К сприяє утворенню останнього, проте вона може протікати і в напрямку необхідному для синтезу орнітину, за умов нестачі аргініну в організмі. Орнітин також може бути синтезований із проліну, що окиснюється до П5К проліноксидазою[5][10].
Орнітин є проміжним продуктом циклу сечовини, в реакціях якого він перетворюється до аргініну. Спершу ця амінокислота вступає в реакцію конденсації із карбамоїлфосфатом, продуктом якої є l-цитрулін. Каталізує це перетворення орнітинкарбамоїлтрансфераза (інша назва орнітинтранскарбамоїлаза). Карбамоїлфосфат синтезується у мітохондріях із гідрокарбонату та аміаку ферментом карбамоїлфосфатсинтазою I, яка потребує наявності N-ацетилглутамату як алостеричного активатора. У цитоплазмі клітини аргініносукцинатсинтаза (АСС) каталізує взаємодію цитруліну із аспартатом, продуктом якої є аргініносукцинат, що відразу ж розщеплюється аргініносукциназою (аргініносукцинатліазою, АСЛ) до аргініну та фумарату[5][11].
| Орнітинамінотрансфераза | Більшість органів |
| Аргініносукцинатсинтаза (АСС) | |
| Аргініносукцинатліаза (АСЛ) | |
| Карбамоїлфосфатсинтаза I | Печінка, тонка кишка |
| Орнітинтранскарбамоїлаза | |
| N-ацетилглутаматсинтаза | |
| Проліноксидаза | Печінка, тонка кишка, нирки |
| Глутаматкіназа | Тонка кишка |
| γ-глутамілфосфатредуктаза |
Експресія ферментів шляху біосинтезу аргініну із глутамату відрізняється в різних органах. Деякі із них, такі як орнітин-δ-амінотрансфераза, аргінінсукцинатсинтаза та аргінінсукциназа, наявні у більшості тканин, інші, наприклад карбамоїлфосфатсинтаза I, орнітинтранскарбамоїлаза та N-ацетилглутаматсинтаза (фермент, необхідний для синтезу N-ацетилглутамату), експресуються тільки печінкою та тонкою кишкою, проліноксидаза — крім цих органів також і нирками, а глутаматкіназа і γ-глутамілфосфатредуктаза наявні тільки в ентероцитах. Таким чином деякі реакції цього біохімічного шляху можуть відбуватись тільки в окремих органах. Більшість біосинтезу аргініну в організмі відбувається завдяки метаболічній колаборації між тонкою кишкою та нирками, відомій також як кишково-ниркова вісь (англ. intestinal-renal axis)[5].
Клітини тонкої кишки поглинають глутамін і глутамат, а також пролін, із крові та порожнини кишки, у їхніх мітохондріях значна частина цих амінокислот перетворюється у цитрулін, в ентероцитах також може синтезуватись деяка кількість аргініну. Цитрулін вивільняється у кров, звідки може поглинатись іншими органами. Найактивніше його використовують нирки, на які припадає приблизно 60 % сумарного синтезу аргініну в дорослих ссавців. Перетворення цитруліну в аргінін відбувається завдяки активності АСС та АСЛ. Найбільша концентрація цих ферментів спостерігається у проксимальних звивистих канальцях[5].
Профіль синтезу аргініну різними органами змінюється із віком: відразу після народження весь біохімічний шлях утворення цієї амінокислоти відбувається у тонкій кишці, пізніше в ентероцитах збільшується експресія аргінази і основним їхнім продуктом стає цитрулін. Одночасно в нирках зростає активність ферментів, необхідних для перетворення цитруліну в аргінін[5].
Основним чинником, що визначає активність біосинтезу аргініну нирками, є концентрація цитруліну в крові, оскільки та частина біохімічного шляху, яка відбувається у тонкій кишці, протікає значно повільніше. Проте експериментальні дані свідчать, що утворення цитруліну не є строго регульованим процесом. Зокрема, його інтенсивність у щурів та свиней не збільшується за умов вживання дієти бідної на аргінін, навіть коли попередники (глутамін, глутамат) наявні у великій кількості. Припускається, що для регуляції загального вмісту аргініну в організмі більше значення має контроль над його катаболізмом, ніж над біосинтезом[5].
У гепатоцитах велика кількість аргініну постійно утворюється в циклі сечовини, проте, він одразу ж розщеплюється аргіназою. Таким чином для того, щоб у печінці відбувався сумарний синтез цієї амінокислоти, цикл сечовини повинен поповнюватись за рахунок інших метаболітів, таких як орнітин. Крім того, всі ферменти циклу сечовини організовані у метаболон, в якому проміжні метаболіти не вивільняються у цитоплазму (чи матрикс мітохондрій), а передаються від одного активного центру до іншого. Про те, що печінка робить дуже малий вклад у сумарний синтез аргініну (або взагалі не робить), свідчать випадки трансплантації цього органа людям із вродженими дефектами ферментів циклу сечовини. Навіть після отримання здорової печінки вони повинні отримувати весь аргінін із дієти[5].
Аргінін є основним джерелом для синтезу NO у багатьох типах клітин, фермент NO-синтаза (iNOS) перетворює його на оксид Нітрогену (II) та цитрулін. Останній може знову перетворюватись в аргінін, у шляху відомому як цитрулін/NO цикл (або цитрулін/аргінін-цикл), основними ферментами якого є АСС та АСЛ. Проте інтенсивність цього шляху значно нижча, ніж циклу сечовини у печінці, внаслідок чого в клітинах може накопичуватись цитрулін. Причиною цього може бути знижена активність АСС у порівнянні із iNOS або/і браком каналювання субстратів між ферментами[5].

У бактерій шлях біосинтезу аргініну із глутамату de novo схожий до такого у ссавців, проте він може протікати більш ефективно, через те, що аміногрупа в α-положенні глутамату захищається ацетильною групою, через що циклізація семіальдегіду стає неможливою. Першою реакцією цього шляху є утворення N-ацетилглутамату, внаслідок перенесення ацетильної групи із ацетил-КоА ферментом N-ацетилглутаматсинтазою. Далі N-ацетилглутамат активується приєднанням фосфатної групи і відновлюється до N-ацетилглутамат-γ-семіальдегіду. Останній вступає в реакцію переамінування із глутаматом, одним із продуктів якої є N-ацетилорнітин, який перетворюється в орнітин шляхом відщеплення ацетильної групи (фермент N-ацетилорнітиназа). Подальші перетворення орінтину аналогічні до тих, що відбуваються у ссавців[11][12].
Аргінін поглинається клітинами із плазми, його час півжиття у крові дорослої свині становить 1,06 год, вагітної — 0,75 год, а неонатальної — 0,65 год[3]. Транспорт цієї амінокислоти через мембрану забезпечується однією із систем y+, bo,+, Bo,+, y+L. З яких найважливішою є перша — y+ — високоафінний Na-незалежний транспортер аргініну, лізину та орнітину. Перелічені системи транспорту експресуються тканиноспецифічно, наприклад y+ наявна майже у всіх клітинах організму, крім гепатоцитів. Кількість транспортерів аргініну підлягає регулюванню, зокрема вона може бути збільшена у відповідь на дію бактерійних ендотоксинів або цитокінів запалення[5].
Аргінін кодується шістьма кодонами мРНК: ЦГА, ЦГУ, ЦГГ, ЦГЦ, АГА та АГГ[1]. Які всі інші амінокислоти, перед включенням у білок він бути активованим і приєднаним до відповідної тРНК. Ці реакції забезпечує фермент аргініл-тРНК-синтаза. Спершу відбувається аденілювання аргініну по карбоксильній групі, пізніше аденіл заміщується на відповідну тРНК. Утворена сполука аргініл-тРНК може бути використана у процесі трансляції, що відбувається на рибосомах[13].
Аналіз більше 1150 білків показав, що аргінін становить близько 5,1 % усіх амінокислот в їх складі[7]. Підвищений його вміст спостерігається у тих білках, що взаємодіють із негативно зарядженими молекулами, такими як ДНК, зокрема в протамін сперми лосося (сальмін) містить 85,2 % цієї амінокислоти[14]. Основні властивості аргініну також сприяють формуванню просторової структури поліпептидів, завдяки утворенню іонних зв'язків із вільними карбоксильними групами інших амінокислот[15].
Після включення до складу поліпептиду залишок аргініну може зазнавати модифікації, зокрема пептидиларгініндеамінази (PAD) здатні перетворювати його у залишок цитруліну[16]. Також аргінін може зворотно метилюватись з утворенням ω-N-метиларгініну[17] з метою регулювання активності білків[18].
Окрім того, що аргінін є однією із двадцяти стандартних амінокислот, що кодуються генетичним кодом і входять до складу білків, ця амінокислота має ряд інших функцій в організмі. Зокрема, вона необхідна для синтезу сечовини в уреателічних організмів, продукування оксиду Нітрогену (II), поліамінів, агматину, креатину, також аргінін може виступати попередником для утворення інших амінокислот, зокрема проліну та глутамату і глутаміну[5]. Перелічні шляхи утилізації аргініну в організмі функціонують з різною інтенсивністю, наприклад швидкість утворення NO у 180 разів нижча за швидкість продукції сечовини, й у 8 — за швидкість продукції креатину[4]. На продукцію поліамінів використовується навіть менше аргініну, ніж на конститутивний синтез NO[3].
Найбільша кількість аргініну в організмі ссавців катаболізується за участі ферменту аргінази (КФ 3.5.3.1) до орнітину та сечовини. Ця реакція є одним із етапів циклу сечовини, що забезпечує детоксифікацію аміаку в уреателічних тварин. Цикл сечовини протікає головним чином у печінці, де у великій кількості експресується аргіназа I (один із двох ізоферментів у ссавців). Також аргіназа I наявна у клітинах ендотелію, епітеліальних клітинах молочних залоз, макрофагах, а в приматів ще і в еритроцитах. Аргіназа II натомість експресується майже у всіх клітинах, що містять мітохондрії, за винятком гепатоцитів. Її роль, ймовірно, полягає у регуляції доступу аргініну для інших шляхів його катаболізму, зокрема вона може обмежувати доступність субстрату для синтезу NO, зібльшувати кількість орінтину, необхідного для утворення поліамінів (путресцину, спермідину та сперміну) та проліну. Деяка активність аргінази також спостерігається у позаклітинних рідинах, вона значно зростає в умовах запалення або травм[3]. В ушкоджених місцях аргіназа може мати протизапальний ефект, одночасно негативно впливаючи на швидкість синтезу NO, і позитивно — на утворення проліну, необхідного для продукції колагену[5].
Зовсім немає аргіназоної активності в клітинах плаценти свиней й ентероцитах поросят, що вигодовуються молоком. Завдяки цьому максимальна кількість аргініну може постачатись від матері до дитини. Проте така закономірність спостерігається не у всіх видів, наприклад ті ж тканини овець мають досить високі рівні аргінази[3]. Також цей фермнет дуже активний у молочних залозах під час лактації, оскільки він необхідний для утворення проліну із аргініну[5].
У людини, що важить 70 кг приблизно 2,3 г аргініну в день витрачається на синтез креатину (10 % всього аргініу в кровообігу). Ця сполука у фосфорильваному стані (фосфокреатин) слугує резервуаром вільної енергії для швидкої регенерації АТФ у тих типах клітин, які його дуже інтенсивно використовують (м'язи, нейрони). Кількості фосфокреатину в склетених м'язах людини достатньо для забезпечення їх енергії впродовж кількох хвилин[19]. Також є відомості про те, що креатин має антиоксидативні і протизапальні властивості, а також покращує глюкозотолерантність у людей[3].
Фосфокреатин синтезується в організмі завдяки метаболічній кооперації між нирками, підшлунковою залозою, печінкою та скелетними м'язами. Першу реакцію на шляху перетворення аргініну в креатин каталізує аргінін:гліцин амідинотрансфераза (КФ 2.1.4.1) — мітохондріальний фермент, що експресується головним чином у ниркових трубочках та підшлунковій залозі, і в значно меншій кількості в печінці та інших органах. Продуктом цієї реакції, що полягає у перенесенні гуанідинової групи із аргініну на гліцин, є гуанідиноацетат та орнітин. Гуанідиноацетат підлягає метилюванню цитоплазматичним ферментом гуанідиноацетат-N-метилтрансферазою із утворенням креатину. Цей етап найбільш інтенсивно протікає у печінці та підшлунковій залозі, і значно повільніше у нирках. Креатин вивільняється у кров, звідки може поглинатись м'язами і нейронами та фосфорилюватись до фосфокреатину[5].
У деяких безхребетних, таких як омар, функцію фосфокреатину виконує фосфоаргінін[19].
Аргінін є попередником для синтезу монооксиду азоту (NO) — сигнальної молекули, що бере участь у регуляції ряду фізіологічних процесів, таких як розширення кровоносних судин, передача нервових імпульсів та імунна відповідь. Утворення NO забезпечує фермент NO-синтаза, що у ссавців має три ізоформи (нейрональна nNOS, ендотеліальна eNOS, індуцибельна iNOS), які відрізняються функціями, поширенням у тканинах та особливостями регуляції[20].
Реакція перетворення аргініну до цитруліну та NO відбувається у два етапи із проміжним продуктом Nω-гідроксил-l-аргінін (NOHA) та потребує кисню, НАДФН, 5,6,7,8-тетрагідробіоптерину, ФМН та ФАД[21].
Фермент аргініндекарбоксилаза, який каталізує декарбоксилювання аргініну до агматину, був спершу виявлений у рослинних та бактерійних клітинах, проте пізніше його знайшли і в мозку, печінці, нирках, надниркових залозах, макрофагах та тонкій кишці ссавців. Фізіологічна роль агматину точно не встановлена, проте тривають його дослідження як можливого нейромедіатора та регулятора багатьох функцій організму[5][22].
У деяких лініях злоякісних клітин, зокрема меланоми, гепатоцелюлярної карциноми, нирковоклітинного раку та деяких мезотеліом, спостерігається брак експресії аргініносукцинатсинтази, внаслідок чого вони стають ауксотрофними за аргініном. Через це ферменти, що розщеплюють аргінін, такі як аргіназа та бактерійна аргініндеіміназа, можуть використовуватись як протипухлинні препарати при цих типах раку[23].
Вміст аргініну відносно високий у морській їжі, соку кавуна, горіхах, насінні, водоростях, м'ясі, концентраті рисового білка та у соєвому білку, але низький у молоці більшості ссавців (включно із людиною, коровами і свиньми). Проте велика частина від загальної кількості цієї амінокислоти, що поступає в організм дорослої людини із їжею, не потрапляє в кров, оскільки близько 40 % аргініну відразу ж розщеплюється у тонкій кишці[3].
- ↑ а б Nelson et al, 2008, с. 1069.
- ↑ Nelson et al, 2008, с. 686.
- ↑ а б в г д е ж Wu G, Bazer FW, Davis TA, Kim SW, Li P, Marc Rhoads J, Carey Satterfield M, Smith SB, Spencer TE, Yin Y (2008). Arginine metabolism and nutrition in growth, health and disease. Amino Acids. 37: 153—68. doi:10.1007/s00726-008-0210-y. PMID 19030957.
- ↑ а б Morris SM Jr (2006). Arginine: beyond protein. Am J Clin Nutr. 83: 508S—512S. PMID 16470022. Архів оригіналу за 19 грудня 2011. Процитовано 14 серпня 2012.
- ↑ а б в г д е ж и к л м н п р с т у ф Wu G, Morris SM Jr (1998). Arginine metabolism: nitric oxide and beyond. Biochem J. 15: 1—17. PMID 9806879. Архів оригіналу за 15 серпня 2002. Процитовано 14 серпня 2012.
- ↑ Ластухін et al, 2006, с. 475.
- ↑ а б в Nelson et al, 2008, с. 73.
- ↑ Ластухін, 2005, с. 114.
- ↑ Jorpes E, Thorén S (1932). The use of the Sakaguchi reaction for the quantitative determination of arginine (PDF). Biochem J. 26: 1504—6. PMID 16744969.
- ↑ Nelson et al, 2008, с. 863.
- ↑ а б Nelson et al, 2008, с. 862.
- ↑ Voet et al, 2011, с. 1071.
- ↑ Nelson et al, 2008.
- ↑ Ластухін, 2005, с. 98.
- ↑ Ластухін, 2005, с. 119.
- ↑ Vossenaar ER, Zendman AJ, van Venrooij WJ, Pruijn GJ (2003). PAD, a growing family of citrullinating enzymes: genes, features and involvement in disease. Bioessays. 25: 1106—18. doi:10.1002/bies.10357. PMID 14579251.
- ↑ Voet et al, 2011.
- ↑ Nelson et al, 2008, с. 78.
- ↑ а б Voet, 2011, с. 583.
- ↑ Nelson et al, 2008, с. 882.
- ↑ Voet et al, 2011, с. 687.
- ↑ Galgano F, Caruso M, Condelli N, Favati F (2012). Focused review: agmatine in fermented foods. Front Microbiol. 3. doi:10.3389/fmicb.2012.00199. PMID 22701114.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Feun L, You M, Wu CJ, Kuo MT, Wangpaichitr M, Spector S, Savaraj N (2008). Arginine deprivation as a targeted therapy for cancer. Curr Pharm Des. 14: 1049—57. PMID 18473854.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 487—496. ISBN 978-0470-57095-1.
- Ластухін О.Ю. (2005). Хімія природних органічних сполук. Львів: Національний університет «Львівська політехніка», «Інтелект-Захід». с. 560. ISBN 966-7597-47-4.
- Ластухін Ю.О., Воронов С.А. (2006). Органічна хімія. Львів: Центр Європи. с. 864. ISBN 966-7022-19-6.
- АРГІНІН [Архівовано 10 березня 2016 у Wayback Machine.] Фармацевтична енциклопедія
