Фоторецептор: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
Доповнив про структуру фоторецептора. Написав розділ "Дискретизація фоторецептором зображення." Додав зображення. |
Дописав розділ про зорові пігменти, класи фоторецепторів та ядро. Змінив структуру розділів. Переніс розділ про ЕСКІ в окрему сторінку |
||
| Рядок 11: | Рядок 11: | ||
Фоторецептори відповідають [[гіперполяризація|гіперполяризацією]] (а не [[деполяризація|деполяризацією]] як інші [[нейрон]]и) у відповідь на адекватний цим рецепторам сигнал — [[світло]]<ref name="Aidley1998">{{cite book|author=Aidley, David J. |title=The Physiology of Excitable Cells|url=https://books.google.com/books?id=3JgC_rE8ZVwC|date=1998-09-03|publisher=Cambridge University Press|isbn=978-0-521-57421-1|pages=477 }}</ref>. |
Фоторецептори відповідають [[гіперполяризація|гіперполяризацією]] (а не [[деполяризація|деполяризацією]] як інші [[нейрон]]и) у відповідь на адекватний цим рецепторам сигнал — [[світло]]<ref name="Aidley1998">{{cite book|author=Aidley, David J. |title=The Physiology of Excitable Cells|url=https://books.google.com/books?id=3JgC_rE8ZVwC|date=1998-09-03|publisher=Cambridge University Press|isbn=978-0-521-57421-1|pages=477 }}</ref>. |
||
Сітківка [[хребетні|хребетних]] містить два класи фоторецепторів — [[паличка|'''палички''']] та [[колбочка|'''колбочки''']], що мають чотири характерні структурно-функціональні складові: зовнішній сегмент, внутрішній сегмент, |
Сітківка [[хребетні|хребетних]] містить два класи фоторецепторів — [[паличка|'''палички''']] та [[колбочка|'''колбочки''']], що мають чотири характерні лише для фоторецепторів структурно-функціональні складові: зовнішній сегмент, внутрішній сегмент, з'єднувальна війка та унікальні в усій нервовій системі [[синапс|синаптичні]] закінчення, які неперервно вивільняють нейромедіатор за відсутності стимулу. Колбочки і палички різняться між собою морфологією, чутливістю та реакцією на світло, структурою фоточутливих [[біологічний пігмент|пігментів]] і діапазоном покриття інтенсивностей світла. |
||
Палички, яких в сітківці лише один тип, відповідають за зір при тьмяному і нічному освітлені ('''скотопічний зір''') і дозволяють зоровій системі досягнути меж, накладених поглинанням одиничних фотонів. Коли палички повністю адаптовані до темряви, то можуть реагувати на одиничні фотони<ref name=" Baylor1979">{{cite journal| author=Baylor DA, Lamb TD, Yau KW| title=Responses of retinal rods to single photons. | journal= The Journal of physiology | year= 1979 | volume= 288 | issue= | pages= 613-634 | pmid=112243 | doi= 10.1113/jphysiol.1979.sp012716 }} </ref><ref name="Hecht1942">{{cite journal| author=Hecht S., Shlaer S., and Pirenne M.H.| title=Energy, quanta, and vision |journal=The Journal of General Physiology|volume=25|issue=6|year=1942|pages=819–840|issn=0022-1295|doi=10.1085/jgp.25.6.819}}</ref>. |
Палички, яких в сітківці людини лише один тип, відповідають за зір при тьмяному і нічному освітлені ('''скотопічний зір''') і дозволяють зоровій системі досягнути меж, накладених поглинанням одиничних фотонів. Коли палички повністю адаптовані до темряви, то можуть реагувати на одиничні фотони<ref name=" Baylor1979">{{cite journal| author=Baylor DA, Lamb TD, Yau KW| title=Responses of retinal rods to single photons. | journal= The Journal of physiology | year= 1979 | volume= 288 | issue= | pages= 613-634 | pmid=112243 | doi= 10.1113/jphysiol.1979.sp012716 }} </ref><ref name="Hecht1942">{{cite journal| author=Hecht S., Shlaer S., and Pirenne M.H.| title=Energy, quanta, and vision |journal=The Journal of General Physiology|volume=25|issue=6|year=1942|pages=819–840|issn=0022-1295|doi=10.1085/jgp.25.6.819}}</ref>. |
||
Колбочки менш чутливі до світла, але забезпечують гостроту зору. Сітківка ссавців має два типи колбочок, а людини і деяких [[мавпові|мавпових]] три типи, які забезпечують двоколірний та триколірний зір, відповідно. Відтак, колбочки відповідальні за денний ('''фототопічний''') зір. |
|||
Колбочки менш чутливі до світла, але забезпечують гостроту зору. Сітківка більшості ссавців має два типи колбочок, а людини і деяких [[мавпові|мавпових]] три типи, які є максимально чутливими до трьох кольорів (червоного, зеленого та синього). Поєднання відносних [[інтенсивність світла|інтенсивностей]] цих трьох [[основні кольори|основних кольорів]] дозволяє людському зору визначити колір будь-якого об’єкту. Відтак, колбочки відповідальні за денний ('''фототопічний''') зір. |
|||
Колбочки у центральній ямці сітківці примат формують регулярну трикутну мозаїку<ref name="BorweinBorwein1980">{{cite journal|author=Borwein B., Borwein D., Medeiros J., and William M. J.|title=The ultrastructure of monkey foveal photoreceptors, with special reference to the structure, shape, size, and spacing of the foveal cones|journal=American Journal of Anatomy|volume=159|issue=2|year=1980|pages=125–146|issn=0002-9106|doi=10.1002/aja.1001590202}}</ref> <ref name="HirschHylton1984">{{cite journal|author=Hirsch J. and Hylton R.|title=Quality of the primate photoreceptor lattice and limits of spatial vision|journal=Vision Research|volume=24|issue=4|year=1984|pages=347–355|issn=00426989|doi=10.1016/0042-6989(84)90060-9}}</ref><ref name="ChuiSong2008">{{cite journal|author=Chui T.Y., Song HX., and Burns S.A.|title=Adaptive-optics imaging of human cone photoreceptor distribution|journal=Journal of the Optical Society of America A|volume=25|issue=12|year=2008|pages=3021|issn=1084-7529|doi=10.1364/JOSAA.25.003021}}</ref>, тоді як поза центральною ямкою мозаїка колбочок втрачає регулярність, яка швидко спадає із [[ексцентриситет]]ом<ref name="WassleRiemann1978">{{cite journal|author=Wassle H. and Riemann H. J.|title=The Mosaic of Nerve Cells in the Mammalian Retina|journal=Proceedings of the Royal Society B: Biological Sciences|volume=200|issue=1141|year=1978|pages=441–461|issn=0962-8452|doi=10.1098/rspb.1978.0026}}</ref><ref name="HirschMiller1987">{{cite journal|author=Hirsch J. and Miller W. H.|title=Does cone positional disorder limit resolution?|journal=Journal of the Optical Society of America A|volume=4|issue=8|year=1987|pages=1481|issn=1084-7529|doi=10.1364/JOSAA.4.001481}}</ref>. |
Колбочки у центральній ямці сітківці примат формують регулярну трикутну мозаїку<ref name="BorweinBorwein1980">{{cite journal|author=Borwein B., Borwein D., Medeiros J., and William M. J.|title=The ultrastructure of monkey foveal photoreceptors, with special reference to the structure, shape, size, and spacing of the foveal cones|journal=American Journal of Anatomy|volume=159|issue=2|year=1980|pages=125–146|issn=0002-9106|doi=10.1002/aja.1001590202}}</ref> <ref name="HirschHylton1984">{{cite journal|author=Hirsch J. and Hylton R.|title=Quality of the primate photoreceptor lattice and limits of spatial vision|journal=Vision Research|volume=24|issue=4|year=1984|pages=347–355|issn=00426989|doi=10.1016/0042-6989(84)90060-9}}</ref><ref name="ChuiSong2008">{{cite journal|author=Chui T.Y., Song HX., and Burns S.A.|title=Adaptive-optics imaging of human cone photoreceptor distribution|journal=Journal of the Optical Society of America A|volume=25|issue=12|year=2008|pages=3021|issn=1084-7529|doi=10.1364/JOSAA.25.003021}}</ref>, тоді як поза центральною ямкою мозаїка колбочок втрачає регулярність, яка швидко спадає із [[ексцентриситет]]ом<ref name="WassleRiemann1978">{{cite journal|author=Wassle H. and Riemann H. J.|title=The Mosaic of Nerve Cells in the Mammalian Retina|journal=Proceedings of the Royal Society B: Biological Sciences|volume=200|issue=1141|year=1978|pages=441–461|issn=0962-8452|doi=10.1098/rspb.1978.0026}}</ref><ref name="HirschMiller1987">{{cite journal|author=Hirsch J. and Miller W. H.|title=Does cone positional disorder limit resolution?|journal=Journal of the Optical Society of America A|volume=4|issue=8|year=1987|pages=1481|issn=1084-7529|doi=10.1364/JOSAA.4.001481}}</ref>. |
||
| Рядок 44: | Рядок 45: | ||
==== Фоторецептори в центральній ямці ==== |
==== Фоторецептори в центральній ямці ==== |
||
Протягом еволюції ока відбулась характерна спеціалізація сітківки — істотне зміщення щільності фоторецепторів та нейронів. Тоді як в ссавців нижчого порядку, напр., щурів та мишей, щільність клітин в сітківці є рівномірною, то в центрі сітківки ссавців вищого порядку, як котів та примат, з'явилось невелике поглиблення — т. зв. |
Протягом еволюції ока відбулась характерна спеціалізація сітківки — істотне зміщення щільності фоторецепторів та нейронів. Тоді як в ссавців нижчого порядку, напр., щурів та мишей, щільність клітин в сітківці є рівномірною, то в центрі сітківки ссавців вищого порядку, як котів та примат, з'явилось невелике поглиблення — т. зв. '''[[центральна ямка]]''' (''fovea centralis'', ~1 мм в діаметрі, покриває близько 3 градусів зорового поля) — де нейрони зміщені в бік, дозволяючи фоторецепторам в цій ділянці отримувати найменш викривлене зорове зображення<ref name="Dowling1987">{{cite book|author=Dowling, John E. |title=The Retina: An Approachable Part of the Brain|url=https://books.google.com/books?id=DDNnUZYOi0QC+|year=1987|publisher=Harvard University Press|isbn=978-0-674-76680-8|pages=282 }}</ref>. Таке зміщення є найбільш явним в середині центральної ямки, {{не перекладено|фовеола|'''фовеолі'''|en|Foveola}} (~300 [[Мікрометр|мкм]] в діаметрі). В фовеолі відсутні палички і є найбільша концентрація колбочок, які уможливлюють найкращу гостроту та високу роздільну здатність зору<ref name="WiklerWilliams1990">{{cite journal|author=Wikler K.C., Williams R.W., and Rakic P.|title=Photoreceptor mosaic: Number and distribution of rods and cones in the rhesus monkey retina|journal=The Journal of Comparative Neurology|volume=297|issue=4|year=1990|pages=499–508|issn=0021-9967|doi=10.1002/cne.902970404}}</ref>. Замість збільшення фоторецепторів та інших нейронів в усій сітківці для забезпечення вищої гостроти зору, що б також потребувало істотного збільшення розмірів ока, подібна спеціалізація обмежена невеликою ділянкою ока. Щоб фіксувати погляд на речах і могти розгледіти їх більш детально, очі повинні постійно рухатись, уможливлюючи проекцію зорового зображення на центральну ямку. Тому протягом споглядання, людина робить чисельні рухи очей, близько 3 рухів/сек<ref name="Schiller2015">{{cite book|author=Schiller P.H. and Tehovnik E.J.|title=Vision and the Visual System|url=https://books.google.com/books?id=esffrQEACAAJ|year=2015|publisher=Oxford University Press|isbn=978-0-19-993653-3|page=416}}</ref>. |
||
[[File:Human photoreceptor distribution.svg|thumb|Розподіл паличок і колбочок в сітківці]] |
[[File:Human photoreceptor distribution.svg|thumb|Розподіл паличок і колбочок в сітківці]] |
||
Центральна ямка в очах людини є неглибокою і має ~570 мкм в діаметрі, містячи до 200 тис. довгохвильових та середньохвильових колбочок / мм<sup>2</sup>, середня відстань (від центру до центру) між якими становить від 2 до 2,5 мкм<ref name="Curcio1990">{{cite journal| author=Curcio C.A., Sloan K.R., Kalina R.E. and Hendrickson A.E.|title=Human photoreceptor topography| journal=The Journal of Comparative Neurology|volume=292|issue=4|year=1990|pages=497–523|issn=0021-9967|doi=10.1002/cne.902920402}}</ref>, тобто, ~120 колбочок / градус {{не перекладено|зоровий кут|зорового кута|||Visual angle}} , що достатньо для формування нейронного зображення найдетальніших ґраток, з 60 [[оберт|циклами]]/градус зорового кута — межа роздільної здатності зору людини<ref name="Smallman1996">{{cite journal| author=Smallman HS, MacLeod DI, He S, and Kentridge RW| title=Fine grain of the neural representation of human spatial vision. | journal=Journal of Neuroscience | year= 1996 | volume= 16 | issue= 5 | pages= 1852-9 | pmid=8774453 | url=http://www.jneurosci.org/content/16/5/1852.short }} </ref><ref name="Williams1992">{{cite book|author=Williams D.R. |editor= Moore, D.T.|title=Tutorials in Optics|url=https://books.google.com/books?id=3x8bAQAAIAAJ|date=1992-01-01|publisher=Washington : Optical Society of America|isbn=978-1-55752-038-8|pages=15–27|chapter=Photoreceptor sampling and aliasing in human vision}}</ref>). (Для порівняння, щільність колбочок в центральній ямці сітківки [[Орел клинохвостий| орла клинохвостого]] становить ~1 млн колбочок/ мм<sup>2</sup>, що відповідає вдвічі більшій гостроті зору (143 цикли/градус), ніж у людини, досягаючи біофізичної межі можливої щільності колбочок, оскільки ще більша щільність колбочок потребуватиме тонших внутрішніх сегментів, чий [[хвилевід]]ний механізм не зможе запобігти розсіянню фотонів на сусідні колбочки<ref> {{aut|Shlaer R. }} {{cite journal|title=An Eagle's Eye: Quality of the Retinal Image|journal=Science|volume=176|issue=4037|year=1972|pages=920–922|issn=0036-8075|doi=10.1126/science.176.4037.920}}</ref><ref > {{aut|Reymond L.}} {{cite journal|title=Spatial visual acuity of the eagle Aquila audax: a behavioural, optical and anatomical investigation|journal=Vision Research|volume=25|issue=10|year=1985|pages=1477–1491|issn=00426989|doi=10.1016/0042-6989(85)90226-3}}</ref>.) |
|||
З [[ексцентриситет]]ом в 5 градусів від центральної ямки сітківки людини, щільність колбочок спадає в 10 разів (до 20 тис. колбочок/мм<sup>2</sup>), а з ексцентриситетом в 10 градусів спадає на половину (10 тис. колбочок/ мм<sup>2</sup>)<ref name=" Carroll 2009">{{cite book|author=Carroll J., Yoon G. , and Williams D. R. |editor=Gazzaniga, Michael S. |title=The Cognitive Neurosciences|url=https://books.google.com/books?id=IykTDgAAQBAJ|date=2009-09-18|publisher=MIT Press|isbn=978-0-262-01341-3|pages=383–394 |chapter= The cone photoreceptor mosaic in normal and defective color vision}}</ref><ref name="WiklerRakic1990">{{cite journal| author=Wikler K.C. and Rakic P.| title=Distribution of photoreceptor subtypes in the retina of diurnal and nocturnal primates. | journal=The Journal of neuroscience | year= 1990 | volume= 10 | issue= 10 | pages= 3390-401 | pmid=2145402 | url= http://www.jneurosci.org/content/jneuro/10/10/3390.full.pdf }} </ref>. Із збільшенням ексцентриситета від центру сітківки також збільшується і діаметр колбочок: від 1 до 2 мкм в діаметрі у центральній ямці і від 4 до 10 мкм в діаметрі із ексцентриситетом в 10 градусів, після чого їх діаметр залишається відносно сталим<ref name="SamyHirsch1989">{{cite journal|author=Samy C.N. and Hirsch J.|title=Comparison of human and monkey retinal photoreceptor sampling mosaics|journal=Visual Neuroscience|volume=3|issue=03|year=1989|pages=281–285|issn=0952-5238|doi=10.1017/S0952523800010038}}</ref><ref name="PackerHendrickson1989" /> . Тварини, які мають менш гострий денний зір, ніж людина, але кращий зір вночі, мають зменшену щільність колбочок в центральній ямці задля збільшення кількості паличок в сітківці. Так, щільність колбочок в центральній ямці кішки майже в десятеро менша (30 тис. / мм<sup>2</sup>) ніж в людини, завдяки чому у них збільшується щільність паличок до 200 тис. / мм<sup>2</sup><ref name="WilliamsSekiguchi1993">{{cite journal| author=Williams D, Sekiguchi N, and Brainard D| title=Color, contrast sensitivity, and the cone mosaic. | journal=Proceedings of the National Academy of Sciences of the United States of America | year= 1993 | volume= 90 | issue= 21 | pages= 9770-7 | pmid=8234313 | pmc=47655 | url=http://www.pnas.org/content/90/21/9770.short }} </ref>. |
|||
[[File:Macula.svg|thumb|Фотографія сітківки людського ока з діаграмами, що показують положення та розмір макули, центральної ямки та оптичного диска]] |
[[File:Macula.svg|thumb|Фотографія сітківки людського ока з діаграмами, що показують положення та розмір макули, центральної ямки та оптичного диска]] |
||
| Рядок 55: | Рядок 58: | ||
Фоторецептори сітківки організовані мозаїчно в один шар, що формує [[синапс|синаптичні]] зв'язки з нижчестоячими нейронами — горизонтальними та біполярними нейронами в [[Зовнішній сітчастий шар |зовнішньому сітчастому шарі]]<ref name="Masland1986" />. |
Фоторецептори сітківки організовані мозаїчно в один шар, що формує [[синапс|синаптичні]] зв'язки з нижчестоячими нейронами — горизонтальними та біполярними нейронами в [[Зовнішній сітчастий шар |зовнішньому сітчастому шарі]]<ref name="Masland1986" />. |
||
==== Класи фоторецепторів ==== |
|||
[[File:Rhodopsin.jpg|thumb|3D структура родопсину сітківки бика]] |
|||
Зорові пігменти фоторецепторів класифікуються відповідно до спектру поглинання фотону, який описує відносну ймовірність поглинання фотона з певною енергією. Існує багато класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком в найбільш переважній довжині хвилі світла. В паличках та колбочках виявлені п'ять різних типів зорових пігментів: тип [[Родопсин]] 1 (позначається: '''Rh1''') найчастіше знаходиться в паличках, тоді як в колбочках знаходяться інші чотири типи пігментів: '''Rh2''' , '''LWS''' ({{lang-en|long wavelength sensitive}}, чутливі до довгих довжин хвиль світла), '''MWS''' ({{lang-en|mid wavelength sensitive ; чутливі до середніх довжин хвиль світла }}), , '''SWS1''' ({{lang-en|short wavelength sensitive 1}}; чутливі до коротких довжин хвиль 1) і '''SWS2'''.<ref name="BaylorNunn1987">{{cite journal |author=Baylor D A, Nunn B J, and Schnapf J L| title=Spectral sensitivity of cones of the monkey Macaca fascicularis.|journal=The Journal of Physiology|volume=390|issue=1|year=1987|pages=145–160|issn=00223751|doi=10.1113/jphysiol.1987.sp016691}}</ref><ref name="SchnapfKraft1987">{{cite journal| author=Schnapf J. L., Kraft T. W., and Baylor D. A.|title=Spectral sensitivity of human cone photo-receptors|journal=Nature|volume=325|issue=6103|year=1987|pages=439–441|issn=0028-0836|doi=10.1038/325439a0}}</ref><ref name="SchnapfKraft2009">{{cite journal| author=Schnapf J.L., Kraft T.W., Nunn B.J. and Baylor D.A.| title=Spectral sensitivity of primate photoreceptors|journal=Visual Neuroscience|volume=1|issue=03|year=2009|pages=255–261|issn=0952-5238|doi=10.1017/S0952523800001917}}</ref>. |
|||
З точки зору властивостей зорових пігментів, в людини та ін. триколірних тварин доречно виділяти три, а не два типи фоторецепторів, оскільки колбочковий SMS1 пігмент настільки ж віддалено пов'язаний із колбочковими M/LWS пігментами, як вони із RH1 колбочковим пігментом<ref name="Mollon1977">{{cite journal|author=Mollon J. D.|title=The oddity of blue|journal=Nature|volume=268|issue=5621|year=1977|pages=587–588|issn=0028-0836|url=https://www.nature.com/nature/journal/v268/n5621/pdf/268587a0.pdf|doi=10.1038/268587a0}}</ref><ref name=" Ebrey2006">{{cite book|author=Ebrey T.G. and Kumauchi M.|editor=Briggs W.R. & Spudich J.L.|title=Handbook of Photosensory Recep-tors|url=https://books.google.com/books?id=Gnb6xjOfThQC|date=2006-03-06|publisher=John Wiley & Sons|isbn=978-3-527-60485-2|pages=43–72|chapter=Visual Pigments as Photoreceptors}}</ref>. |
|||
Фотопігмент паличок, [[родопсин]], складається із [[опсин]]у та світлопоглинаючого [[хромофор]]у, {{не перекладено|ретиналь|ретиналю|||Retinal}} ([[альдегід]] [[вітамін А|вітаміну A1]]), що надає родопсину характерного рожевого кольору (звідси ''родо'' з грецької ''rhódon'' - ''рожевий''). Родопсин в паличках є найбільш чутливими до довжини хвилі світла 498 нм (зелений-синій). Фотопігменти колбочок складаються з інших опсинів, зв'язаних з ретиналем. Саме структура цих опсинів визначає яку частину спектру видимого світла поглинає ретиналь, обумовлюючи відмінність у спектрах поглинання колбочок<ref name="Dowling1987" />. |
|||
Традиційно три типи колбочок, які відповідають за триколірний зір у людини та деяких [[мавпові|мавпових]], називались «си-ні», «зелені» та «червоні», припускаючи, що збудження даного типу колбочки визначало відповідне кольорове сприйняття. Однак така термінологія наразі вважається некоректною, оскільки кольорові назви не відповідають ні довжинам хвиль максимальної чутливості колбочок, ні кольоровим сприйняттям, які постають після збудження одиничних колбочок<ref name="DowlingDowling2016" />. Натомість сьогодні загальноприйнятим є позначення колбочок як '''S'''-, '''M'''- та '''L'''-колбочки, залежно від тієї частини видимого спектра, до якої кожна є найбільш чутливою (від англ. «Short», «Middle» та «Long»)<ref name=" Ebrey2006" />. Хоча спектри поглинання фотопігментів S-, M- та L-колбочок значно перекриваються, їх довжини хвиль максимального поглинання (''λ''<sub>max</sub>) знаходяться в різних частинах видимого спектру: '''420''', '''530''' та '''558''' нм відповідно.<ref name="Sharpe2001">{{cite book|author= Sharpe LT, Stockman A, Jagle H, and Nathans J.|editor=Gegenfurtner K.R. and Sharpe L.|title=Color Vision: From Genes to Perception|url=https://books.google.com/books?id=4zQMQLLVkFYC|date=2001-05-28|publisher=Cambridge University Press|isbn=978-0-521-00439-8|pages=3–52|chapter=Opsin genes, cone photopigments, color vision, and color blindness}}</ref>. |
|||
Природа поглинання фотона зоровим пігментом фоторецепторів означає, що після його поглинання, вся інформація про енергію фотона (довжину хвилі) втрачена. Відповідно з {{Не перекладено|Принцип уніваріантності|'''принципом уніваріантності'''||| Principle of Univariance }}, фоторецептори сигналізують вищій зоровій системі лише частоту, з якою фотон був поглинений, а не довжину хвилі<ref name="Rushton1972">{{cite journal|author=Rushton W. A. H.|title=Pigments and signals in colour vision.Review Lecture. |journal=The Journal of Physiology|volume=220|issue=3|year=1972|pages=1–31|issn=00223751|doi=10.1113/jphysiol.1972.sp009719}}</ref>. Тому як помірний потік фотонів поблизу довжини хвилі максимальної чутливості, так і високий потік фотонів біля довжини хвилі меншої чутливості генеруватимуть однакову частоту поглинання. Це означає, що стимули світла з різними спектральними розподілами будуть сприйматись як ідентичні, якщо призводитимуть до однакових поглинань в трьох колбочках, та різними в протилежному випадку. Відтак, кольоровий зір (розрізнення на основі довжини хвиль) потребує порівняння поглинання фотонів в різних колбочках, а не одній. |
|||
== Теорія подвійності зору == |
== Теорія подвійності зору == |
||
=== Відкриття фоторецепторів === |
=== Відкриття фоторецепторів === |
||
[[File:Treviranus photoreceptors 1837.png|thumb|Одне з перших зображень фоторецепторів (паличок), зроблене Готфрідом Тревіранусом, 1837]] |
[[File:Treviranus photoreceptors 1837.png|thumb|Одне з перших зображень фоторецепторів (паличок), зроблене Готфрідом Тревіранусом, 1837]] |
||
| Рядок 123: | Рядок 112: | ||
У поєднанні із результатами досліджень сітківок геконів, дослідження змій припускають, що на відміну від сталої подвійної сітківки риб, птахів та ссавців, фоторецептори плазунів зазнавали повторюваних і радикальних змін. |
У поєднанні із результатами досліджень сітківок геконів, дослідження змій припускають, що на відміну від сталої подвійної сітківки риб, птахів та ссавців, фоторецептори плазунів зазнавали повторюваних і радикальних змін. |
||
==Зоровий пігмент== |
|||
==Палички і колбочки: відмінність та подібність== |
|||
Чутливість фоторецепторів до світла обумовлюється [[Спектр поглинання |спектром поглинання]] їх зорових [[Пігмент (біологія) |пігментів]] ({{не перекладено|фотопігмент|фотопігментів|en|Photopigment}}), що знаходяться в зовнішньому сегменті фоторецептору<ref name="Dowling1987" />. |
|||
===Структура фотопігменту=== |
|||
Зоровий пігмент складається із [[опсин]]у та світлопоглинаючого '''[[хромофор]]у''', {{не перекладено|ретиналь|ретиналю|en|Retinal}} ([[альдегід]] [[вітамін А|вітаміну A1]]), що ковалентно зв'язаний з опсином через [[основи Шиффа]]. <ref name="Shichida2009">{{cite journal|author=Shichida Y. and Matsuyama T.| title=Evolution of opsins and phototransduction| journal=Philosophical Transactions of the Royal Society B: Biological Sciences|volume=364|issue=1531|year=2009|pages=2881–2895|issn=0962-8436|doi=10.1098/rstb.2009.0051}}</ref>. |
|||
'''Опсини''' – це [[Трансмембранні білки| трансмембранні]] семиспіральні білки, єдиний поліпептидний ланцюг яких складається з 364 (гени фотопігменту M- та L-колбочок) або 348 (ген фотопігменту S-колбочки) [[Амінокислоти |амінокислотних]] {{не перекладено|залишок (хімія)|залишків|en| Residue (chemistry)}}<ref name="ArshavskyLamb2002">{{cite journal|author=Arshavsky V.Y., Lamb T.D. and Pugh E.N.| title=G Proteins and Phototransduction |journal=Annual Review of Physiology|volume=64|issue=1|year=2002|pages=153–187|issn=0066-4278|doi=10.1146/annurev.physiol.64.082701.102229}}</ref>. Поєднуючись із хромофорами, опсини формують світлочутливі комплекси фоторецепторів. Хромофором фоторецепторів хребетних є 11-''цис''-ретиналь. Поглинання фотону ретина лем є початком зору, після чого через близько пікосенкуди, ретиналь [[ Ізомеризація |ізомеризується]], приводячи до конформаційної зміни опсину, запускаючи сигнальний біохімічний каскад, наслідком якого є зміна мембранного потенціалу фоторецептора, що змінює вивільнення [[нейромедіатори|нейромедіатора]] [[синапс]]ами і сигналізує нейронам другого порядку про світловий стимул<ref name="YauHardie2009">{{cite journal|author=Yau K.-W. and Hardie R.C.|title=Phototransduction Motifs and Variations|journal=Cell|volume=139|issue=2|year=2009|pages=246–264|issn=00928674|doi=10.1016/j.cell.2009.09.029}}</ref>. |
|||
===Спектральна чутливість фотопігменту=== |
|||
Зоровий пігмент має широкий спектр максимальної {{не перекладено|спектральна поглинальна здатність| поглинальної здатності|en|Absorbance}}, що характеризується великим піком та малим піком (''β''-діапазон або вторинний пік чутливості) для коротших довжин хвиль <ref name="FeinSzuts1982" />. Оскільки спектри поглинання зорових пігментів мають схожі форми, то спектральна чутливість фоторецепторів виражається через довжину хвилі максимальної {{не перекладено|спектральна поглинальна здатність| поглинальної здатності|en|Absorbance}} (''λ''<sub>max</sub> або максимум поглинання) <ref name="Lamb1995">{{cite journal|author=Lamb T.D.|title=Photoreceptor spectral sensitivities: Common shape in the long-wavelength region|journal=Vision Research|volume=35|issue=22|year=1995|pages=3083–3091|issn=00426989|doi=10.1016/0042-6989(95)00114-F}}</ref>. |
|||
''λ''<sub>max</sub> даного фотопігменту обумовлюється послідовністю амінокислот опсину та взаємодією конкретного опсину з ретиналем <ref name="KochendoerferLin1999">{{cite journal|author=Kochendoerfer G.G., Lin S.W., Sakmar T. P. and Mathies R.A.|title=How color visual pigments are tuned|journal=Trends in Biochemical Sciences|volume=24|issue=8|year=1999|pages=300–305|issn=09680004|doi=10.1016/S0968-0004(99)01432-2}}</ref>. Оскільки всі зорові пігменти ссавців містять ретиналь, а їх ''λ''<sub>max</sub> коливається в діапазоні від ~360 нм в ближній [[Ультрафіолетове випромінювання|УФ-області спектру ]] (миші та морські свинки) до ~565 нм в червоній області спектру (примати і люди), то точна максимальна чутливість даного фотопігменту визначається послідовністю амінокислот опсину та взаємодією специфічних амінокислот із ретиналем в [[Ділянка зв'язування|ділянці зв'язування ]] опсину <ref name="Bowmaker1998">{{cite journal| author=Bowmaker J.K.| title=Visual Pigments and Molecular Genetics of Color Blindness. | journal=News in physiological sciences | year= 1998 | volume= 13 | issue= | pages= 63-69 | pmid=11390764 | pmc= | url=http://physiologyonline.physiology.org/content/13/2/63.short }} </ref>. |
|||
===Класи фотопігментів=== |
|||
[[File:Rhodopsin.jpg|thumb|3D структура родопсину сітківки бика]] |
|||
Зорові пігменти фоторецепторів класифікуються відповідно до спектру поглинання фотонів, що описує відносну ймовірність поглинання фотона з певною енергією. Існує кілька класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком в найбільш переважній довжині хвилі світла. |
|||
Зорові пігменти фоторецепторів класифікуються відповідно до спектру поглинання фотону, який описує відносну ймовірність поглинання фотона з певною енергією. Існує багато класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком в найбільш переважній довжині хвилі світла. В паличках та колбочках виявлені п'ять різних типів зорових пігментів: тип [[Родопсин]] 1 (позначається: '''Rh1''') найчастіше знаходиться в паличках і має максимальну чутливість (''λ''<sub>max</sub>) 498 нм, тоді як в колбочках знаходяться інші чотири типи пігментів: '''Rh2''' , '''LWS''' ({{lang-en|long wavelength sensitive}}, чутливі до довгих довжин хвиль світла), із ''λ''<sub>max</sub> 500–570 нм; '''MWS''' ({{lang-en|''mid wavelength sensitive'' ; чутливі до середніх довжин хвиль світла }}) із ''λ''<sub>max</sub> 480–530 нм , '''SWS1''' і '''SWS2''' ({{lang-en|''short wavelength sensitive'' }}; чутливі до коротких довжин хвиль ) із ''λ''<sub>max</sub> 355–445 нм і 400–470 нм, відповідно. <ref name="BaylorNunn1987">{{cite journal |author=Baylor D A, Nunn B J, and Schnapf J L| title=Spectral sensitivity of cones of the monkey Macaca fascicularis.|journal=The Journal of Physiology|volume=390|issue=1|year=1987|pages=145–160|issn=00223751|doi=10.1113/jphysiol.1987.sp016691}}</ref><ref name="SchnapfKraft1987">{{cite journal| author=Schnapf J. L., Kraft T. W.|, and Baylor D. A.|title=Spectral sensitivity of human cone photoreceptors|journal=Nature|volume=325|issue=6103|year=1987|pages=439–441|issn=0028-0836|doi=10.1038/325439a0}}</ref><ref name="SchnapfKraft2009">{{cite journal| author=Schnapf J.L., Kraft T.W., Nunn B.J. and Baylor D.A.| title=Spectral sensitivity of primate photoreceptors|journal=Visual Neuroscience|volume=1|issue=03|year=2009|pages=255–261|issn=0952-5238|doi=10.1017/S0952523800001917}}</ref>. |
|||
Зорові пігменти хребетних еволюціонували близько 500 млн. років тому і походять із п'яти класів генів опсину: чотири спектрально відмінні класи генів опсину колбочок та один клас опсину палички<ref name="Bowmaker2008">{{cite journal|author=Bowmaker J.K.|title=Evolution of vertebrate visual pigments |journal=Vision Research|volume=48|issue=20|year=2008|pages=2022–2041|issn=00426989|doi=10.1016/j.visres.2008.03.025}}</ref>. Опсинні класи колбочок еволюціонували через [[дуплікація генів|дуплікацію генів]], а клас опсину палички еволюціонував скоріш за все через дуплікацію гену Rh2-опсину колбочки <ref name="Okano1992">{{cite journal| author=Okano T, Kojima D, Fukada Y, Shichida Y, and Yoshizawa T| title=Primary structures of chicken cone visual pigments: vertebrate rhodopsins have evolved out of cone visual pigments. | journal=Proceedings of the National Academy of Sciences of the United States of America | year= 1992 | volume= 89 | issue= 13 | pages= 5932-6 | pmid=1385866 | pmc=402112 | url=http://www.pnas.org/content/89/13/5932.short }} </ref> . |
|||
Нічний спосіб життя ранніх ссавців призвів до зменшення кількості класів генів зорових пігментів колбочок із чотирьох до двох. А деякі одноколірні нічні та морські види потім втратили і один з цих двох класів генів. Тому триколірність деяких примат і людини пов'язана або з дуплікацією одного з цих двох класів генів або з [[Поліморфізм (біологія)| поліморфізмом]] <ref name="Yokoyama2000">{{cite journal| author=Yokoyama S.| title=Molecular evolution of vertebrate visual pigments|journal=Progress in Retinal and Eye Research|volume=19|issue=4|year=2000|pages=385–419|issn=13509462|doi=10.1016/S1350-9462(00)00002-1}}</ref>. На відміну від ссавців, птахи зберегли гени чотирьох фотопігментів колбочок, чия експресія присутня в їх одиничних та подвійних колбочках. Тоді як птахи і ссавців разом втратили чутливість до ультрафіолетового світла, яка присутня лише в кількох видів ссавців (гризуни та сумчасті), тоді як у птахів вона заново набута <ref name="Martin2017">{{cite book|author=Martin, Graham R. |title=The Sensory Ecology of Birds|url=https://books.google.com/books?id=YKKPDgAAQBAJ|series=320|date=30 March 2017|publisher=OUP Oxford|isbn=978-0-19-252054-8}}</ref>. |
|||
Адаптація тварин до нових умов також позначається на варіації класів зорових пігментів, які по-різному налаштовуються до конкретних спектральних областей чи нових зорових завдань. Мутація в гені опсину може призвести до спектрального зміщення максимальної чутливості фотопігменту, коли навіть заміна одного [[Нуклеотидна послідовність |нуклеотиду]] може призвести до заміщення ключової амінокислоти, що змінить взаємодію між хрофомором та опсином і, відповідно спектральне зміщення чутливості пігменту <ref name="FitzgibbonHope1995">{{cite journal|author=Fitzgibbon J1, Hope A, Slobodyanyuk SJ, Bellingham J, Bowmaker JK, and Hunt DM.|title=The rhodopsin-encoding gene of bony fish lacks introns|journal=Gene|volume=164|issue=2|year=1995|pages=273–277|issn=03781119|doi=10.1016/0378-1119(95)00458-I}}</ref><ref name="HuntCarvalho2007">{{cite journal| author=Hunt D.M., Carvalho L.S., Cowing J.A., Parry J. W. L. , Wilkie S.E., Davies W.L. and Bowmaker J.K.|title=Spectral Tuning of Shortwave-sensitive Visual Pigments in Vertebrates|journal=Photochemistry and Photobiology|volume=83|issue=2|year=2007|pages=303–310|issn=00318655|doi=10.1562/2006-06-27-IR-952}}</ref>. |
|||
Модифікація спектральної чутливості класів фотопігментів також здійснюється через зміну хромофору. Вітамін А має в хребетних дві форми – вітамін А<sub>1</sub> і вітамін А<sub>2</sub>. Зорові пігменти, сформовані із ретиналю (альдегід вітаміну А А<sub>1</sub>) називаються родопсинами (поширені серед морських та наземних тварин), тоді як пігменти, які містять 3-{{не перекладено|дегідроретиналь|||dehydroretinal}} (похідний вітаміну А<sub>2</sub>) називаються {{не перекладено|порфиропсин|'''порфиропсинами'''|de|Porphyropsin}} (поширені серед риб, земноводних, плазунів) <ref name="Bridges1972">{{cite book|author= Bridges C.D.B.|editor=Dartnall, H.J.A.|title=Photochemistry of Vision|url=https://books.google.com/books?id=XWDvCAAAQBAJ&pg=PA417|year=1972|publisher=Springer |isbn=978-3-642-65066-6|pages=417–480|chapter=The Rhodopsin-Porphyropsin Visual System}}</ref>. Хромофор складається із [[Кон'югована система | кон'югованого]] ланцюга атомів [[вуглець|вуглецю]], прикріплених до β-{{не перекладено|іонон|іононового кільця|en|Ionone}}, а 3-дегідроретиналь ще містить додатковий [[подвійні зв'язки |подвійний зв'язок]] в кільці. Тому з’єднання 3-дегідроретиналю з опсином зміщує ''λ''<sub>max</sub> зорових пігментів до довших довжин хвиль <ref name="Harosi1994">{{cite journal| author=Hárosi F. I.| title=An analysis of two spectral properties of vertebrate visual pigments|journal=Vision Research|volume=34|issue=11|year=1994|pages=1359–1367|issn=00426989|doi=10.1016/0042-6989(94)90134-1}}</ref>. Таке зміщення залежить від довжини хвилі, досягаючи 50-60 нм із зоровими пігментами, чутливими до довгих хвиль (LWS) і лише кілька нанометрів з короткохвильовими пігментами (SWS1, SWS2) <ref name="ParryBowmaker2000">{{cite journal|author=Parry J.W.L. and Bowmaker J.K.| title=Visual pigment reconstitution in intact goldfish retina using synthetic retinaldehyde isomers|journal=Vision Research|volume=40|issue=17|year=2000|pages=2241–2247|issn=00426989|doi=10.1016/S0042-6989(00)00101-2}}</ref>. Відтак, лише шляхом зміни хромофорів в процесі розвитку чи сезонних змін, зорові пігменти можуть істотно змінювати максимальну спектральну чутливість, приводячи до змін кольорового зору. |
|||
===Перетворення світла в нейронний сигнал=== |
|||
Фоторецептори сигналізують нижчестоячим нейронам поглинання світла через перетворення поглиненого фотону в електричний сигнал. Цей процес, відомий як '''фототрансдукція''', реалізується через складний каскад взаємодії молекул, що в кінці кінців призводить до гіперполяризції фоторецептора (у хребетних, тоді як у безхребетних – до деполяризації) , тобто до значної зміни його електричного потенціалу <ref name="Copenhagen1989">{{cite journal| author=Copenhagen D.R., and Jahr C.E.| title=Release of endogenous excitatory amino acids from turtle photoreceptors|journal=Nature|volume=341|issue=6242|year=1989|pages=536–539|issn=0028-0836|doi=10.1038/341536a0}}</ref><ref name="Hargrave1992">{{cite journal| author=Hargrave P.A. and McDowell J.H.| title= Rhodopsin and phototransduction: a model system for G protein-linked receptors. | journal= The FASEB Journal | year= 1992 | volume= 6 | issue= 6 | pages= 2323-31 | pmid=1544542 | url=http://www.fasebj.org/content/6/6/2323.short }} </ref>. |
|||
Коли фотопігмент поглинає світло, то енергія фотону поглинається хромофором (ретиналем), [[Конформаційна ізомерія|конформаційний стан]] якого змінюється із вигнутої в пряму (із 11-''цис''-ретиналь в все-транс ретиналь), що в свою чергу призводить до структурної зміни білка опсину <ref name="Arshavsky2012">{{cite journal| author=Arshavsky V. Y. and Burns M. E.|title=Photoreceptor Signaling: Supporting Vision across a Wide Range of Light Intensities| journal=Journal of Biological Chemistry|volume=287|issue=3|year=2012|pages=1620–1626|issn=0021-9258|doi=10.1074/jbc.R111.305243}}</ref>. Новий конфірмаційний стан опсину активує трансдуцин ('''G'''<sub>t</sub>) ({{не перекладено|гетеротримерний G-білок||| Heterotrimeric G protein }} фоторецептора), який в свою чергу активує фермент {{не перекладено|фосфодіестераза| фосфодіестерази |en|Phosphodiesterase}} ('''ФДЕ'''). Активована ФДЕ [[гідроліз]]ує {{не перекладено|циклічнний гуанозинмонофосфат||en|Cyclic guanosine monophosphate}} ('''цГМФ''') до ГМФ, який на відміну від циклічного ГМФ не є сигналізуючою молекулою <ref name="LuoXue2008">{{cite journal|author=Luo D.-G., Xue T. and Yau K.-W.|title=How vision begins: An odyssey| journal=Proceedings of the National Academy of Sciences|volume=105|issue=29|year=2008|pages=9855–9862|issn=0027-8424|doi=10.1073/pnas.0708405105}}</ref>. |
|||
В темновому стані (до ізомеризації ретиналю) цГМФ регулює відкриття [[Іонні канали|іонних каналів]], через які проходять іони натрію (Na<sup>+</sup>). Після гідролізу цГМФ фосфодіестаразою Na<sup>+</sup>-канали закриті, що спричиняє гіперполяризацію фоторецептора та зниження вивільнення його синапсом нейромедіатора [[глутамат]]у, таким чином сигналізуючи нижчестоячим нейронам про схоплення фотону<ref name="Arshavsky2012" />. Тож, на відміну від інших нейронів, реакція на світло постсинаптичних до фоторецептора нейронів сітківки пов’язана не із збільшенням вивільнення рецептором нейромедіатора, а із зменшенням. |
|||
Каскад фототрансдукції істотно підсилює сигнал, оскільки один фотон (і, відповідно, єдина ізомеризація) призводить до гідролізу ~10<sup>5</sup> молекул цГМФ <ref name="Hargrave1992" />. Однак фототрансдукція так само ефективно зупиняє передачу сигналу, задля швидкої реакції фоторецептора на новий стимул. |
|||
Припинення сигналізування розпочинається із [[фосфорилювання]] активованого родопсину ферментом {{не перекладено|Родопсинкіназа|'''родпсинкінази'''|en|Rhodopsin kinase}}, що призводить до зв’язування фосфорильованого родопсину з білком {{не перекладено|арестин|''арестином''|en|Arestin}}. В результаті цього опсинний комплекс втрачає все-транс ретиналь з арестином та фосфорилюється ферментом [[Фосфатаза|'''фосфатазою''']] (PP2А) <ref name="Arshavsky2012" />. Як наслідок, іонні канали в зовнішніх сегментах відчиняються і фоторецепторний мембранний потенціал повертається до темновго, деполяризаційного рівня. А все-транс ретиналь знов ізомеризується до 11-''цис'' конфірмаційного стану, знову зв’язуючись з опсином і починає новий цикл фототрансдукції<ref name="LuoXue2008" />. |
|||
===Принцип уніваріантності=== |
|||
Природа поглинання фотона зоровим пігментом фоторецепторів означає, що після його поглинання, вся інформація про енергію фотона (довжину хвилі світла) втрачена. Відповідно з {{Не перекладено|Принцип уніваріантності|'''принципом уніваріантності'''||| Principle of Univariance }}, фоторецептори сигналізують вищій зоровій системі лише частоту, з якою фотон був поглинений, а не довжину хвилі<ref name="Rushton1972">{{cite journal|author=Rushton W. A. H.|title=Pigments and signals in colour vision.Review Lecture. |journal=The Journal of Physiology|volume=220|issue=3|year=1972|pages=1–31|issn=00223751|doi=10.1113/jphysiol.1972.sp009719}}</ref>. Тому, як помірний потік фотонів поблизу довжини хвилі максимальної чутливості, так і високий потік фотонів біля довжини хвилі меншої чутливості генеруватимуть однакову частоту поглинання. Це означає, що стимули світла з різними спектральними розподілами будуть сприйматись як ідентичні, якщо призводитимуть до однакових поглинань в трьох колбочках, та різними в протилежному випадку. Відтак, кольоровий зір (розрізнення на основі довжини хвиль) потребує порівняння поглинання фотонів в різних колбочках, а не одній. |
|||
== Класифікація фоторецепторів == |
|||
Традиційно три типи колбочок, які відповідають за триколірний зір у людини та деяких [[мавпові|мавпових]], називались «сині», «зелені» та «червоні», припускаючи, що збудження даного типу колбочки визначало відповідне кольорове сприйняття. Однак така термінологія наразі вважається некоректною, оскільки кольорові назви не відповідають ні довжинам хвиль максимальної чутливості колбочок, ні кольоровим сприйняттям, які постають після збудження одиничних колбочок<ref name="DowlingDowling2016" />. |
|||
Натомість сьогодні загальноприйнятим є позначення колбочок як '''S'''-, '''M'''- та '''L'''-колбочки, залежно від тієї частини видимого спектра, до якої кожна є найбільш чутливою (від {{lang-en| Short}}-, {{lang-en| Middle}}- та {{lang-en| Long-wave sensitive}}, відповідно: коротко-, середньо- і довгохвильові колбочки)<ref name=" Ebrey2006" />. Хоча спектри поглинання фотопігментів S-, M- та L-колбочок значно перекриваються, їх довжини хвиль максимального поглинання (''λ''<sub>max</sub>) знаходяться в різних частинах видимого спектру: '''420''', '''530''' та '''558''' нм відповідно.<ref name="Sharpe2001">{{cite book|author= Sharpe LT, Stockman A, Jagle H, and Nathans J.|editor=Gegenfurtner K.R. and Sharpe L.|title=Color Vision: From Genes to Perception|url=https://books.google.com/books?id=4zQMQLLVkFYC|date=2001-05-28|publisher=Cambridge University Press|isbn=978-0-521-00439-8|pages=3–52|chapter=Opsin genes, cone photopigments, color vision, and color blindness}}</ref>. Хоча фоторецептори можуть поглинати світло і на 50 нм більше чи менше від їх максимальних довжин хвиль, вони такі фотони поглинають менш сильно і тому їх реакція на світло спадає чим далі його довжина хвилі від оптимальної для даного фоторецептора довжини хвилі. |
|||
З точки зору властивостей зорових пігментів, в людини та ін. триколірних тварин доречно виділяти три, а не два типи фоторецепторів, оскільки колбочковий SMS1 пігмент настільки ж віддалено пов'язаний із колбочковими M/LWS пігментами, як вони із RH1 паличковим пігментом<ref name="Mollon1977">{{cite journal|author=Mollon J. D.|title=The oddity of blue|journal=Nature|volume=268|issue=5621|year=1977|pages=587–588|issn=0028-0836|url=https://www.nature.com/nature/journal/v268/n5621/pdf/268587a0.pdf|doi=10.1038/268587a0}}</ref><ref name=" Ebrey2006">{{cite book|author=Ebrey T.G. and Kumauchi M.|editor=Briggs W.R. & Spudich J.L.|title=Handbook of Photosensory Recep-tors|url=https://books.google.com/books?id=Gnb6xjOfThQC|date=2006-03-06|publisher=John Wiley & Sons|isbn=978-3-527-60485-2|pages=43–72|chapter=Visual Pigments as Photoreceptors}}</ref>. |
|||
===Типи паличок === |
|||
В більшості сітківок тварин наявний лише один тип паличок, і тільки [[земноводні]] мають два типи паличок<ref name="Walls1942">{{cite book |author=Walls, Gordon Lynn |title=The Vertebrate Eye and Its Adaptive Radiation|url=https://archive.org/stream/vertebrateeyeits00wall#page/n5/mode/2up|year=1942|publisher=Bloomfield Hills, Mich., Cranbrook Institute of Science| page=818}}</ref>. |
|||
====«Зелені» та «червоні» палички земноводних==== |
|||
Подібно до інших хребетних, у земноводних наявні палички з родопсином Rh1, що має максимум поглинання з довжиною хвилі 500 нм (т.зв. «червоні палички»), які були описані ще Максом Шульце (1867 р.) в сітківці жаб. Однак 1874 р. німецький анатом {{не перекладено|Швальбе, Густав|Густав Швальбе|en|Gustav Schwalbe}} виявив <ref name="Schwalbe1874">{{cite book|author=Schwalbe, G. |editor=Graefe A. & Saemisch T.|title=Handbuch der gesammten Augenheilkunde: Anatomie und Physiologie|url=https://books.google.com/books?id=1EfpAAAAIAAJ&pg=PR321|year=1874|publisher=Wilhelm Engelmann|language=German|pages=321–479|chapter=Mikroskopische Anatomie der Sehnerven, der Netzhaut und des Glaskörpers}}</ref>, що дорослі жаби мають особливий з поміж інших тип паличок - т.зв. «зелені палички» (або «палички Швальбе»), в яких коротший циліндричний зовнішній сегмент (~5-8 мкм в діаметрі та 60 мкм в довжину<ref name="LuoYue2011">{{cite journal|author=Luo D.-G., Yue W. W. S., Ala-Laurila P., and Yau K.-W.|title=Activation of Visual Pigments by Light and Heat|journal=Science|volume=332|issue=6035|year=2011|pages=1307–1312|issn=0036-8075|doi=10.1126/science.1200172}}</ref>) та довший тонкий міоїд внутрішнього сегменту в порівнянні з «червоними» паличками. <ref>{{aut|Arey L.B.}}{{cite journal|title=Changes in the rod-visual cells of the frog due to the action of light|journal=The Journal of Comparative Neurology|volume=26|issue=4|year=1916|pages=429–442|issn=0021-9967|doi=10.1002/cne.900260406}}</ref><ref>{{aut|Nilsson S.E.G.|}}{{cite journal|title=An electron microscopic classification of the retinal receptors of the leopard frog (Rana pipiens)|journal=Journal of Ultrastructure Research|volume=10|issue=5-6|year=1964|pages=390–416|issn=00225320|doi=10.1016/S0022-5320(64)80018-6}}</ref><ref name="Donner1976">{{cite book|author=Donner K. O. and Reuter T. |editor=Llinas R. & Precht W. |title=Frog Neurobiology: A Handbook|url=https://books.google.com/books?id=11XmCAAAQBAJ&pg=PA251|year=1976|publisher=Springer |isbn=978-3-642-66316-1|pages=251–277|chapter=Visual Pigments and Photoreceptor Function}}</ref>. Максимум поглинання зорового пігменту зелених паличок 432 нм<ref>{{aut|Denton E. J. and Wyllie J. H.}}{{cite journal|title=Study of the photosensitive pigments in the pink and green rods of the frog|journal=The Journal of Physiology|volume=127|issue=1|year=1955|pages=81–89|issn=00223751|doi=10.1113/jphysiol.1955.sp005239}}</ref><ref>{{aut|Dartnall H.J.A.}}{{cite journal|title=The visual pigment of the green rods|journal=Vision Research|volume=7|issue=1-2|year=1967|pages=1–16|issn=00426989|doi=10.1016/0042-6989(67)90022-3}}</ref> |
|||
Назви цих паличок не пов'язані з їх спектральною чутливістю, а з притаманним їм кольором у препарованій тканині сітківки, коли їх розглядати під мікроскопом: у більшості земноводних зелені палички мають колір трави, хоча у [[Саламандра вогняна|вогняної саламандри]] їм притаманний блідий сіро-зелений колір<ref name="Roth1987">{{cite book|author= Roth, Gerhard|title=Visual Behavior in Salamanders|url=https://books.google.com/books?id=yefrCAAAQBAJ|series= Studies of Brain Function|volume=14|year=1987|publisher=Springer |isbn=978-3-642-72713-9|page=301}}</ref>. Адаптовані до темряви червоні палички, подібно до інших хребетних, найбільш чутливі до жовто-зеленого світла, тоді як зелені палички – до фіолетового-синього (подібно до S-колбочок інших хребетних), пропускаючи зелений колір, звідси їх назва. <ref name="Harosi1975">{{cite journal|author=Harosi F.|title=Absorption spectra and linear dichroism of some amphibian photoreceptors|journal=The Journal of General Physiology|volume=66|issue=3|year=1975|pages=357–382|issn=0022-1295|doi=10.1085/jgp.66.3.357}}</ref> <ref name="MakinoGroesbeek1999">{{cite journal|author=Makino C.L., Groesbeek M., Lugtenburg J., and Baylor D.A.|title=Spectral Tuning in Salamander Visual Pigments Studied with Dihydroretinal Chromophores|journal=Biophysical Journal|volume=77|issue=2|year=1999|pages=1024–1035|issn=00063495|doi=10.1016/S0006-3495(99)76953-5}}</ref>. Хоча колір фотопігменту зелених паличок, виходячи з його спектру поглинання, повинен бути жовтим, під мікроскопом ці фоторецептори виглядають зеленими, можливо через поєднання оптичних властивостей зелених паличок (дуже тонкий міоїд внутрішнього сегменту неефективний для передачі жовтого світла <ref name="MillerSnyder1972">{{cite journal|author=Miller W.H. and Snyder A.W.|title=Optical function of myoids|journal=Vision Research|volume=12|issue=11|year=1972|pages=1841–1848|issn=00426989|doi=10.1016/0042-6989(72)90074-0}}</ref>) та людського кольорового зору (із-за контрасту пігменту «зелених» паличок з багрянисто-червоним фоном родопсинових «червоних» паличок) <ref name="GovardovskiiReuter2014">{{cite journal|author=Govardovskii V.I. and Reuter T.|title=Why do green rods of frog and toad retinas look green?|journal=Journal of Comparative Physiology A|volume=200|issue=9|year=2014|pages=823–835|issn=0340-7594|doi=10.1007/s00359-014-0925-z}}</ref>. |
|||
У [[Жаба леопардова|жаби леопардової]] зелені палички складають 8% всіх фоторецепторів, а червоні палички – 50% <ref name="LiebmanEntine1968">{{cite journal|author=Liebman P.A. and Entine G.|title=Visual pigments of frog and tadpole (Rana pipiens)|journal=Vision Research|volume=8|issue=7|year=1968|pages=761–IN7|issn=00426989|doi=10.1016/0042-6989(68)90128-4}}</ref>, тоді як у [[Амбістома тигрова|тигрової саламандри]] червоні палички складають 98,6% всіх паличок, а зелені – 1,4 %<ref name="ZhangWu2009">{{cite journal|author=Zhang J. and Wu S.M.|title=Immunocytochemical analysis of photoreceptors in the tiger salamander retina|journal=Vision Research|volume=49|issue=1|year=2009|pages=64–73|issn=00426989|doi=10.1016/j.visres.2008.09.031}}</ref>. Подібно до міоїдів колбочок жаб, міоїд зелених та червоних паличок жаб витягується у відповідь на адаптацію до світла, щоб краще схоплювати падаючі фотони<ref name="Donner1976" />. |
|||
====Колбочковий фотопігмент «зелених паличок»==== |
|||
Зелені палички земноводних мають однаковий з S-колбочками опсин, тому сформований цим опсином пігмент («SWS2,P432», {{lang-en|Short-wavelength sensitive opsin of class 2}}) зелених паличок має ту саму спектральну чутливість, що й SWS1 пігмент S-колбочки<ref name="Hisatomi1999">{{cite journal|author=Hisatomi O., Takahashi Y, Taniguchi Y, Tsukahara Y, Tokunaga F.|title=Primary structure of a visual pigment in bullfrog green rods|journal=FEBS Letters|volume=447|issue=1|year=1999|pages=44–48|issn=00145793|doi=10.1016/S0014-5793(99)00209-4}}</ref><ref name="MaZnoiko2001">{{cite journal|author=Ma J, Znoiko S, Othersen KL, Ryan JC, Das J, Isayama T, Kono M, Oprian DD, Corson DW, Cornwall MC, Cameron DA, Harosi FI, Makino CL, and Crouch RK.|title=A Visual Pigment Expressed in Both Rod and Cone Photoreceptors|journal=Neuron|volume=32|issue=3|year=2001|pages=451–461|issn=08966273|doi=10.1016/S0896-6273(01)00482-2}}</ref><ref name="Darden2003">{{cite journal| author=Darden AG, Wu BX, Znoiko SL, Hazard ES 3rd, Kono M, Crouch RK, and Ma JX.| title=A novel Xenopus SWS2, P434 visual pigment: structure, cellular location, and spectral analyses. | journal=Molecular Vision| year= 2003 | volume= 9 | issue= | pages= 191-9 | pmid=12764253 | url=http://www.molvis.org/molvis/v9/a28/}} </ref>. Подібно до колбочкових пігментів, фотопігмент зеленої палички також руйнується (знебарлюється) за присутності [[гідроксиламін]]у <ref name="Reuter1966">{{cite journal|author=Reuter T.|title=The synthesis of photosensitive pigments in the rods of the frog's retina|journal=Vision Research|volume=6|issue=1-2|year=1966|pages=15–38|issn=00426989|doi=10.1016/0042-6989(66)90011-3}}</ref> <ref name="Dartnall1967">{{cite journal|author=Dartnall H.J.A.|title=The visual pigment of the green rods|journal=Vision Research|volume=7|issue=1-2|year=1967|pages=1–16|issn=00426989|doi=10.1016/0042-6989(67)90022-3}}</ref>. |
|||
Хоча зелені палички та S-колбочки містять один і той же зоровий пігмент, у тигрової саламандри була виявлена унікальна з поміж усіх хребетних особливість: зелені палички та S-колбочки мають відмінні молекули трансдуцину (паличкову a-субодиницю трансдуцину в зеленій паличці та колбочкову а-субодиницю в S-колбочці), які активуються одним і тим же пігментом, однак це не впливає на світлову чутливість чи кінетику реакцій цих двох фоторецепторів<ref name="MaZnoiko2001" /> Тож, хоча морфологічно зелені палички є паличками, їх опсини є колбочковими, порушуючи усталений поділ фоторецепторів відповідно до їх морфології і прив'язку функції рецептора до його морфології. Оскільки вважається, що палички еволюціонували із колбочко-подібних фоторецепторів і родопсин еволюціонував із колбочкових пігментів SWS2<ref name="KojimaOkano1992">{{cite journal| author=Kojima D., Okano T., Fukada Y., Shichida Y., Yoshizawa T. and Ebrey T. G.| title=Cone visual pigments are present in gecko rod cells.| journal=Proceedings of the National Academy of Sciences of the United States of America |volume=89|issue=15|year=1992|pages=6841–6845|issn=0027-8424|doi=10.1073/pnas.89.15.6841}}</ref><ref name="Okano1992">{{cite journal| author=Okano T, Kojima D, Fukada Y, Shichida Y, Yoshizawa T| title=Primary structures of chicken cone visual pigments: vertebrate rhodopsins have evolved out of cone visual pigments. | journal=processing of the national academy of sciences of the united states of america| year= 1992 | volume= 89 | issue= 13 | pages= 5932-6 | pmid=1385866 | pmc=402112 | url=http://www.pnas.org/content/89/13/5932}} </ref>, то характерні риси зелених паличок можуть свідчити про те, що ці фоторецептори є проміжною ланкою в еволюційній трансформації колбочок в палички. <ref name="MaZnoiko2001" />. |
|||
Іншою унікальною рисою зелених паличок земноводних є те, що їх подібний до S-колбочок опсин є надзвичайно стабільним<ref name="Matthews1984">{{cite journal|author=Matthews G.|title=Dark noise in the outer segment membrane current of green rod photoreceptors from toad retina.|journal=The Journal of Physiology|volume=349|issue=1|year=1984|pages=607–618|issn=00223751|doi=10.1113/jphysiol.1984.sp015176}}</ref>: зелені палички мають дуже малий рівень спонтанної теплової [[ізомеризація|ізомеризації]] - <10<sup>-14</sup>сек<sup>-1</sup> при 23С<ref name="LuoYue2011" />. З цього випливає, що SWS2 (колбочковий) пігмент зеленої палички земноводних спонтанно активується в середньому один раз кожні ~10<sup>14</sup>сек, тобто ~4000 років, що робить його найбільш стабільним із всіх відомих опсинів, включно з родопсинами<ref name="Lamb2013">{{cite journal|author=Lamb T.D.|title=Evolution of phototransduction, vertebrate photoreceptors and retina|journal=Progress in Retinal and Eye Research|volume=36|year=2013|pages=52–119|issn=13509462|doi=10.1016/j.preteyeres.2013.06.001}}</ref>, які з поміж всіх інших зорових опсинів мають найменший рівень спонтанної теплової ізомеризації (~0,01 сек<sup>-1</sup>)<ref name="Donner1992">{{cite journal|author=Donner K.|title=Noise and the absolute thresholds of cone and rod vision|journal=Vision Research|volume=32|issue=5|year=1992|pages=853–866|issn=00426989|doi=10.1016/0042-6989(92)90028-H}}</ref>. |
|||
Зелені палички наявні тільки в земноводних і хоча мають схожу з паличками морфологію, для них характерна поведінка S-колбочок, тому ці палички розширюють діапазон чутливості S-колбочок і можуть бути залучені в трикольоровий зір, зокрема в розрізнення кольорів на мезопічному рівні освітлення та відповідати за інстинктивну, позитивну [[фототаксис|фототаксичну]] реакцію на синє світло, характерну для багатьох [[безхвості|безхвостих]] <ref name="Muntz1962">{{cite journal|author=Muntz W. R. A.|title=Effectiveness of different colors of light in releasing positive phototactic behavior of frogs, and a possible function of retinal projection to diencephalon |journal=Journal of Neurophysiology|volume=25|issue=4893|year=1962|pages=712-720|url=http://jn.physiology.org/content/25/6/712}}</ref><ref name="Muntz1963">{{cite journal|author=Muntz W. R. A.|title=Phototaxis and Green Rods in Urodeles|journal=Nature|volume=199|issue=4893|year=1963|pages=620–620|issn=0028-0836|doi=10.1038/199620a0}}</ref> |
|||
===Типи колбочок=== |
|||
Cеред більшості видів тварин палички мають відносно однакову структуру, відрізняючись лише довжиною та діаметром зовнішніх сегментів. Тоді як колбочки характеризуються більшими відмінностями поміж різних видів. |
|||
====Подвійні колбочки==== |
|||
Якщо одиничні колбочки є характерними для більшості хребетних, то деякі з них мають окрім одиничних, також {{не перекладено|подвійна колбочка| подвійні колбочки |en|Double cone (biology)}} колбочки, як то птахи, плазуни, земноводні, [[кісткові ганоїди]] та [[костисті риби]] <ref name="Walls1942" /><ref name="AliKlyne1985">{{cite book| author=Ali M. A. and Klyne M.A.| title=Vision in Vertebrates|url=https://books.google.com/books?id=0ojgBwAAQBAJ|year=1985|publisher=Springer |isbn=978-1-4684-9129-6|pages=272 }}</ref><ref name="Wagner1978">{{cite book|author=Wagner, Hans-Joachim |title=Cell Types and Connectivity Patterns in Mosaic Retinas|url=https://books.google.com/books?id=BWUlBAAAQBAJ|year=1978|publisher=Springer |isbn=978-3-642-67071-8|pages=84 }}</ref>. А в деяких груп костистих риб навіть були виявлені потрійні колбочки <ref name="Cameron1995">{{cite journal| author=Cameron D.A. and Easter S.S.| title=Cone photoreceptor regeneration in adult fish retina: phenotypic determination and mosaic pattern formation | journal=Journal of Neuroscience| year= 1995 | volume= 15 | issue= 3 Pt 2 | pages= 2255-71 | pmid=7891164 | url=http://www.jneurosci.org/content/15/3/2255.short }} </ref> <ref name="Hess2009">{{cite journal|author=Heß Martin|title=Triple cones in the retinae of three anchovy species: Engraulis encrasicolus, Cetengraulis mysticetus and Anchovia macrolepidota (Engraulididae, Teleostei)|journal=Vision Research|volume=49|issue=12|year=2009|pages=1569–1582|issn=00426989|doi=10.1016/j.visres.2009.03.016}}</ref>. |
|||
Подвійні колбочки зазвичай складаються із двох відмінних колбочок, злитих разом в їх міоїдах внутрішніх сегментів та значно різняться розмірами<ref name="AliKlyne1985" />. Більша («основна») колбочка із подвійних колбочок часто має олійні краплини, тоді як менша («додаткова») містить великий параболоїд, хоча в різних видів присутні різні комбінації розмірів та структур подвійних колбочок. |
|||
Подвійні колбочки скоріш за все еволюціонував близько 350-400 млн. років тому і хоча вони наявні в сітківках майже більшості [[Чотириногі|наземних хребетних]] (включаючи [[однопрохідні]] та [[сумчасті]]), він цілком відсутній в сітківках [[дводишні|дводишних]] та [[плацентарні|плацентрарних ссавців]], в тім числі в людини <ref name="Crescitelli1972">{{cite book|author=Crescitelli, F|editor= Dartnall, H. J.A.|title=Photochemistry of Vision|url=https://books.google.com/books?id=XWDvCAAAQBAJ|series=Handbook of Sensory Physiology|volume=VII/1|year=1972|publisher=Springer|location=Berlin|isbn=978-3-642-65066-6|chapter=The Visual Cells and Visual Pigments of the Vertebrate Eye}}</ref> <ref name="Bowmaker2012">{{cite book|author= Bowmaker J.K.|editor= Lazareva O.G., Shimizu T. & Wasserman E.A.|title=How Animals See the World: Comparative Behavior, Biology, and Evolution of Vision|url=https://books.google.com/books?id=KOv6cHWdjG8C&pg=PA441|date=2012-04-19|publisher=Oxford University Press |isbn=978-0-19-533465-4|pages=441–472|chapter=Evolution of the vertebrate eye}}</ref>. |
|||
====Квадратна мозаїка подвійних колбочок==== |
|||
В сітківці костистих риб подвійні колбочки організовані у характерну впорядковану мозаїку (у формі квадрату чи в ряд) <ref name="Lyall1957">{{cite journal|author=Lyall A.H. |title=Cone Arrangements in Teleost Retinae |journal=Journal of Microscopical Science|volume=98|year=1957|pages=189-201| url=http://jcs.biologists.org/content/s3-98/42/189.short}}</ref> <ref name="Engstrom1963">{{cite journal|author=Engström K.|title=Cone Types and Cone Arrangements in Teleost Retinae|journal=Acta Zoologica|volume=44|issue=1-2|year=1963|pages=179–243|issn=00017272|doi=10.1111/j.1463-6395.1963.tb00408.x}}</ref> <ref name="Wagner1990">{{cite book|author=Wagner H.-J.|editor= Douglas R. & Djamgoz M.|title=The Visual System of Fish|url=https://books.google.com/books?id=ahcyBwAAQBAJ&pg=PA109|year=1990|publisher=Springer |isbn=978-94-009-0411-8|pages=109–157|chapter=Retinal structure of fishes}}</ref>. Як правило, в квадратній мозаїці подвійні колбочки (найчастіше довгохвильові L-колбочки) формують сторони квадрату, а в центрі знаходиться одинична колбочка (короткохвильова S-колбочка), і одиничні колбочки (деякі чутливі до [[Ультрафіолетове випромінювання |ультрафіолету]]) по кутах квадрату<ref name="Ali1978">{{cite journal| author=Ali MA, Hárosi FI, and Wagner HJ| title=Photoreceptors and visual pigments in a cichlid fish, Nannacara anomala. | journal=Sensory processes | year= 1978 | volume= 2 | issue= 2 | pages= 130-45 | pmid=715468 | doi= | pmc= | url=https://www.ncbi.nlm.nih.gov/pubmed/715468}} </ref>. Хоча такий порядок колбочок варіюється і в одних костистих риб можуть бути відсутні центральні, а в інших кутові одиничні колбочки <ref name="Wagner1978" />. |
|||
Для пояснення переваг квадратної мозаїки було запропоновано кілька гіпотез. Одні припускають, що така впорядкованість подвійних колбочок уможливлює краще виявлення руху швидкої жертви <ref name="Lyall1957" /><ref name="Engstrom1963" />, тоді як відповідно до інших квадратна мозаїка також покращує кольоровій зір <ref name="Wagner1978" /><ref name="Wagner1990" />. Однак наразі відсутні експериментальні дані, котрі б підтверджували переваги впорядкованої мозаїки у порівнянні із невпорядкованою для виявлення жертви костистими рибами. |
|||
Інші гіпотези припускають, що квадратна мозаїка може бути залучена для виявлення [[Поляризоване світло| поляризованого світла]] шляхом поєднання ортогонально розміщених подвійних та ультрафіолетових одиничних колбочок, зокрема для орієнтації в підводних світлових полях [[лососеві|лососевими рибами]]<ref name="Flamarique1998">{{cite journal|author=Flamarique I.N., Hawryshyn C. W., and Hárosi F.I.|title=Double-cone internal reflection as a basis for polarization detection in fish|journal=Journal of the Optical Society of America A|volume=15|issue=2|year=1998|pages=349|issn=1084-7529|doi=10.1364/JOSAA.15.000349}}</ref> <ref name="Hawryshyn2000">{{cite journal|author=Hawryshyn, Craig W.|title=Ultraviolet polarization vision in fishes: possible mechanisms for coding e-vector|journal=Philosophical Transactions of the Royal Society B: Biological Sciences|volume=355|issue=1401|year=2000|pages=1187–1190|issn=0962-8436|doi=10.1098/rstb.2000.0664}}</ref>. Хоча який саме механізм відповідає за чутливість колбочок до поляризованого світла і в яких видів костистих риб, залишається предметом дискусій <ref name="Roberts2014">{{cite book|author=Roberts N.W.|editor=Horváth G.|title=Polarized Light and Polarization Vision in Animal Sciences|url=https://books.google.com/books?id=5g0fBQAAQBAJ&pg=PA225|series= Springer Series in Vision Research|volume=2|date=2014-10-30|publisher=Springer|isbn=978-3-642-54718-8|pages=225–247|chapter=Polarisation Vision of Fishes}}</ref>. Класична модель припускає, що градієнти показників заломлення у внутрішніх сегментах подвійних колбочок можуть функціювати, як [[анізотропія|анізотропні]] поляризаційні [[хвилевід|хвилеводи]], тому ці колбочки діють як [[аналізатор (оптика)|аналізатор]] поляризації <ref name="CameronPugh1991">{{cite journal|author=Cameron D.A. and Pugh E.N.|title=Double cones as a basis for a new type of polarization vision in vertebrates|journal=Nature|volume=353|issue=6340|year=1991|pages=161–164|issn=0028-0836|doi=10.1038/353161a0}}</ref><ref name="Rowe1994">{{cite journal|author=Rowe M. P., Engheta N., Easter S. S. and Pugh E. N.|title=Graded-index model of a fish double cone exhibits differential polarization sensitivity|journal=Journal of the Optical Society of America A|volume=11|issue=1|year=1994|pages=55|issn=1084-7529|doi=10.1364/JOSAA.11.000055}}</ref>. Однак нещодавні електрофізологічні дослідження подвійних колбочок {{не перекладено|зелений сонцевик|зеленого сонцевика|en|green sunfish}} не підтвердили подібне припущення для цього виду <ref name="Flamarique997">{{cite journal|author=Flamarique I.N. and Hawryshyn C.W.|title=No Evidence of Polarization Sensitivity in Freshwater Sunfish from Multi-unit Optic Nerve Recordings|journal=Vision Research|volume=37|issue=8|year=1997|pages=967–973|issn=00426989|doi=10.1016/S0042-6989(96)00243-X}}</ref>, а в іншому дослідженні середньохвильової колбочки із подвійних колбочок сітківки [[карась китайський|золотої рибки]] було виявлене [[ізотропія|ізотропне]] поширення поляризованого світла через внутрішні сегменти (осьовий лінійний [[дихроїзм]]) колбочок <ref name="Roberts2007">{{cite journal|author=Roberts N.W. and Needham M.G.|title=A Mechanism of Polarized Light Sensitivity in Cone Photoreceptors of the Goldfish Carassius auratus|journal=Biophysical Journal|volume=93|issue=9|year=2007|pages=3241–3248|issn=00063495|doi=10.1529/biophysj.107.112292}}</ref><ref name="Roberts2014" />. |
|||
====Морфологія та фотопігменти подвійних колбочок==== |
|||
Подвійні колбочки характеризуються різноманіттям морфології та зорових пігментів. Дві половинки подвійних колбочок можуть мати різні розміри та містити однакові чи спектрально відмінні фотопігменти. Найбільше різноманіття подвійних колбочок виявлене в [[костисті риби|костистих риб]] <ref name="Bowmaker2012" />, в яких дві половинки можуть бути: морфологічно ідентичними та містити однаковий фотопігмент (ідентичні «колбочки-близнюки»); морфологічно ідентичні, але спектрально відмінними пігментами (неідентичні колбочки-близнюки); морфологічно відмінні з ідентичними пігментами (ідентичні подвійні колбочки); морфологічно відмінні з різними пігментами (не ідентичні подвійні колбочки) <ref name="Loew1978">{{cite journal|author=Loew E.R. and Lythgoe J.N.|title=The ecology of cone pigments in teleost fishes|journal=Vision Research|volume=18|issue=6|year=1978|pages=715–722|issn=00426989|doi=10.1016/0042-6989(78)90150-5}}</ref> <ref name=" Levine 1979">{{Cite journal | author = Levine J. S. & MacNichol Jr, E. F.| title = Visual pigments in teleost fishes: effects of habitat, microhabitat, and behavior on visual system evolution | journal = Sensory processes | volume = 3 | issue = 2 | pages = 95–131 | year = 1979 | month = June | pmid = 545702|url= http://psycnet.apa.org/psycinfo/1981-12145-001}}</ref><ref name="Wagner1990" /> <ref name="FangLi2009">{{cite journal|author=Fang M, Li J, Wai SM, Kwong WH, Kung LS, and Yew DT.|title=Retinal twin cones or retinal double cones in fish: misnomer or different morphological forms?|journal=International Journal of Neuroscience|volume=115|issue=7|year=2009|pages=981–987|issn=0020-7454|doi=10.1080/00207450590901422}}</ref>. |
|||
В деяких видів риб між двома половинками подвійних колбочок існують електричні з’єднання через [[щілинні контакти]] і вони діють як один фоторецептор<ref name="Burkhardt1980">{{cite journal|author=Burkhardt D.A., Hassin G., Levine J.S. and MacNichol E.F.|title=Electrical responses and photopigments of twin cones in the retina of the walleye.|journal=The Journal of Physiology|volume=309|issue=1|year=1980|pages=215–228|issn=00223751|doi=10.1113/jphysiol.1980.sp013505}}</ref><ref name="Marchiafava1985">{{cite journal|author=Marchiafava P. L.|title=Cell Coupling in Double Cones of the Fish Retina|journal=Proceedings of the Royal Society B: Biological Sciences|volume=226|issue=1243|year=1985|pages=211–215|issn=0962-8452|doi=10.1098/rspb.1985.0091}}</ref><ref name="Millert1993">{{cite journal|author=Miller James L. and Korenbrot J.I.|title=Phototransduction and adaptation in rods, single cones, and twin cones of the striped bass retina: A comparative study|journal=Visual Neuroscience|volume=10|issue=04|year=1993|pages=653–667|issn=0952-5238|doi=10.1017/S0952523800005356}}</ref>. Ідентичні колбочки-близнята, в яких обидві половинки містять однаковий пігмент, через електричне з’єднання просто діятимуть, як відносно великий фоторецептор, що схоплює рідкісні фотони при низькому освітленні і тому зустрічаються у видів риб що живуть в глибоких, каламутних чи забруднених водах <ref name="BowmakerGovardovskii1994">{{cite journal|author=Bowmaker JK , Govardovskii VI , Shukolyukov SA , Zueva LV , Hunt DM , Sideleva VG , and Smirnova OG |title=Visual pigments and the photic environment: The cottoid fish of Lake Baikal|journal=Vision Research|volume=34|issue=5|year=1994|pages=591–605|issn=00426989|doi=10.1016/0042-6989(94)90015-9}}</ref>. |
|||
На відміну від примат, птахи мають окремі групи фоторецепторів для сприйняття кольору (чотири одиничні колбочки для чотирьоколірності) та яскравості світла, форми і руху (подвійні колбочки) <ref name="OsorioVorobyev2005">{{cite journal|author=Osorio D. and Vorobyev M.|title=Photoreceptor sectral sensitivities in terrestrial animals: adaptations for luminance and colour vision|journal=Proceedings of the Royal Society B: Biological Sciences|volume=272|issue=1574|year=2005|pages=1745–1752|issn=0962-8452|doi=10.1098/rspb.2005.3156}}</ref>. В птахів подвійні колбочки складаються із однієї великої та однієї малої колбочки, які називаються «головними» та «додатковими», відповідно <ref name="Walls1942" /> і використовуються ними для виявлення руху, контурів, текстури та яскравості світла <ref name="JonesOsorio2004">{{cite journal|author=Jones C.D. and Osorio D.|title=Discrimination of oriented visual textures by poultry chicks|journal=Vision Research|volume=44|issue=1|year=2004|pages=83–89|issn=00426989|doi=10.1016/j.visres.2003.08.014}}</ref> <ref name="Hart2001">{{cite journal|author=Hart N.|title=Variations in cone photoreceptor abundance and the visual ecology of birds|journal=Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology|volume=187|issue=9|year=2001|pages=685–697|issn=0340-7594|doi=10.1007/s00359-001-0240-3}}</ref> <ref name="HartNS2001">{{cite journal|author=Hart N.S.|title=The Visual Ecology of Avian Photoreceptors|journal=Progress in Retinal and Eye Research|volume=20|issue=5|year=2001|pages=675–703|issn=13509462|doi=10.1016/S1350-9462(01)00009-X}}</ref>. Дві половинки подвійних колбочок у птахів не є морфологічно ідентичними. |
|||
Також, на відміну від примат, птахи зберегли всі чотири класи колбочкових зорових пігментів: в подвійних та одиничних колбочках вони мають LWS пігмент, а Rh2, SWS1 та SWS2 в інших одиничних колбочоках (Hart & Hunt 2007). В птахів, що активні в день, ~50% всіх колбочок становлять подвійні колбочоки, ~20% LWS- та ~20% Rh2-одиничні колбочки, і 10% - SWS1- та SWS2-колбочки (Bowmaker 2008). |
|||
===Палички і колбочки: відмінність та подібність=== |
|||
Сітківка людини має чотири типи фоторецепторів (1 тип паличок і 3 типи колбочок), кожен з яких є найбільш чутливим до конкретного діапазону електромагнітного випромінювання <ref name="BowmakerDartnall1980">{{cite journal|author=Bowmaker JK, Dartnall HJA, and Mollon JD.|title=Microspectrophotometric demonstration of four classes of photoreceptor in an old world primate, Macaca fascicularis.|journal=The Journal of Physiology|volume=298|issue=1|year=1980|pages=131–143|issn=00223751|doi=10.1113/jphysiol.1980.sp013071}}</ref>. |
Сітківка людини має чотири типи фоторецепторів (1 тип паличок і 3 типи колбочок), кожен з яких є найбільш чутливим до конкретного діапазону електромагнітного випромінювання <ref name="BowmakerDartnall1980">{{cite journal|author=Bowmaker JK, Dartnall HJA, and Mollon JD.|title=Microspectrophotometric demonstration of four classes of photoreceptor in an old world primate, Macaca fascicularis.|journal=The Journal of Physiology|volume=298|issue=1|year=1980|pages=131–143|issn=00223751|doi=10.1113/jphysiol.1980.sp013071}}</ref>. |
||
| Рядок 134: | Рядок 219: | ||
На відміну від інших [[нейрон]]ів, палички та колбочки {{Comment| '''гіперполяризуються''' |Гіперполяризація - підвищення різниці потенціалів між внутрішніми та зовнішніми сторонами мембрани нейрону, що знаходиться в стані спокою, тобто, підвищення потенціалу спокою}} у відповідь на стимул (світло), за відсутності якого (в темряві), вони є відносно {{Comment| '''деполяризованими''' |Деполяризація - зниження різниці потенціалів між внутрішніми та зовнішніми сторонами мембрани нейрону, що знаходиться в стані спокою, тобто, зниження потенціалу спокою}} і безперервно вивільняють їх [[Нейромедіатори|нейромедіатор]] – [[Глутамінова кислота |глутамат]]<ref name="Dowling1987" />. На користь цього парадоксального феномену свідчать не тільки чисельні дані [[Електрофізіологія#Внутрішньоклітинні вимірювання|внутрішньоклітинних реєстрацій]] <ref name="Bortoff1964">{{cite journal| author=Bortoff A.| title=Localization of slow potential responses in the Necturus retina| journal=Vision Research|volume=4|issue=11-12|year=1964|pages=627–IN9|issn=00426989|doi=10.1016/0042-6989(64)90048-3}}</ref><ref name="Trifonov1968">{{cite journal| author=Трифонов, Юрий А.| title=[Изучение синаптической передачи между фоторецептором и горизонтальной клеткой при помощи электрических раздражении сетчатки| journal=Биофизика | year= 1968 | volume= 13 | issue= 5 | pages= 809-17 | pmid=4318318 | url=http://psycnet.apa.org/psycinfo/1969-10906-001}} </ref> <ref name="ToyodaNosaki1969">{{cite journal| author=Toyoda J.-I., Nosaki H., and Tomita T.| title=Light-induced resistance changes in single photoreceptors of necturus and gekko|journal=Vision Re-search|volume=9|issue=4|year=1969|pages=453–463|issn=00426989|doi=10.1016/0042-6989(69)90134-5}}</ref> <ref name="BaylorFuortes1970">{{cite journal| author=Baylor D. A. and Fuortes M. G. F.| title=Electrical responses of single cones in the retina of the turtle|journal=The Journal of Physiology|volume=207|issue=1|year=1970|pages=77–92|issn=00223751|doi=10.1113/jphysiol.1970.sp009049}}</ref><ref name="Tomita1970">{{cite journal|author=Tomita T.|title=Electrical activity of vertebrate photoreceptors|journal=Quarterly Reviews of Biophysics|volume=3|issue=02|year=1970|pages=179|issn=0033-5835|doi=10.1017/S0033583500004571|url=http://journals.cambridge.org/article_S0033583500004571}}</ref>, а й виявлена висока частота зміни фоторецепторних [[синапс|синаптичних]] [[везикула|везикул]] в темряві <ref name="Schaeffer1978">{{cite journal| author=Schaeffer S. F. and Raviola E.|title=Membrane recycling in the cone cell endings of the turtle retina|journal=The Journal of Cell Biolo-gy|volume=79|issue=3|year=1978|pages=802–825|issn=0021-9525|doi=10.1083/jcb.79.3.802}}</ref>. |
На відміну від інших [[нейрон]]ів, палички та колбочки {{Comment| '''гіперполяризуються''' |Гіперполяризація - підвищення різниці потенціалів між внутрішніми та зовнішніми сторонами мембрани нейрону, що знаходиться в стані спокою, тобто, підвищення потенціалу спокою}} у відповідь на стимул (світло), за відсутності якого (в темряві), вони є відносно {{Comment| '''деполяризованими''' |Деполяризація - зниження різниці потенціалів між внутрішніми та зовнішніми сторонами мембрани нейрону, що знаходиться в стані спокою, тобто, зниження потенціалу спокою}} і безперервно вивільняють їх [[Нейромедіатори|нейромедіатор]] – [[Глутамінова кислота |глутамат]]<ref name="Dowling1987" />. На користь цього парадоксального феномену свідчать не тільки чисельні дані [[Електрофізіологія#Внутрішньоклітинні вимірювання|внутрішньоклітинних реєстрацій]] <ref name="Bortoff1964">{{cite journal| author=Bortoff A.| title=Localization of slow potential responses in the Necturus retina| journal=Vision Research|volume=4|issue=11-12|year=1964|pages=627–IN9|issn=00426989|doi=10.1016/0042-6989(64)90048-3}}</ref><ref name="Trifonov1968">{{cite journal| author=Трифонов, Юрий А.| title=[Изучение синаптической передачи между фоторецептором и горизонтальной клеткой при помощи электрических раздражении сетчатки| journal=Биофизика | year= 1968 | volume= 13 | issue= 5 | pages= 809-17 | pmid=4318318 | url=http://psycnet.apa.org/psycinfo/1969-10906-001}} </ref> <ref name="ToyodaNosaki1969">{{cite journal| author=Toyoda J.-I., Nosaki H., and Tomita T.| title=Light-induced resistance changes in single photoreceptors of necturus and gekko|journal=Vision Re-search|volume=9|issue=4|year=1969|pages=453–463|issn=00426989|doi=10.1016/0042-6989(69)90134-5}}</ref> <ref name="BaylorFuortes1970">{{cite journal| author=Baylor D. A. and Fuortes M. G. F.| title=Electrical responses of single cones in the retina of the turtle|journal=The Journal of Physiology|volume=207|issue=1|year=1970|pages=77–92|issn=00223751|doi=10.1113/jphysiol.1970.sp009049}}</ref><ref name="Tomita1970">{{cite journal|author=Tomita T.|title=Electrical activity of vertebrate photoreceptors|journal=Quarterly Reviews of Biophysics|volume=3|issue=02|year=1970|pages=179|issn=0033-5835|doi=10.1017/S0033583500004571|url=http://journals.cambridge.org/article_S0033583500004571}}</ref>, а й виявлена висока частота зміни фоторецепторних [[синапс|синаптичних]] [[везикула|везикул]] в темряві <ref name="Schaeffer1978">{{cite journal| author=Schaeffer S. F. and Raviola E.|title=Membrane recycling in the cone cell endings of the turtle retina|journal=The Journal of Cell Biolo-gy|volume=79|issue=3|year=1978|pages=802–825|issn=0021-9525|doi=10.1083/jcb.79.3.802}}</ref>. |
||
Поглинання фоторецепторами фотону призводить до активації фоточутливого пігменту, що запускає каскад складних біохімічних реакцій, відомих, як '''фототрансдукція''' – процес трансформації світла в нейронний сигнал. Поглинання фотону спричиняє каскад подій, результатом яких є закриття в мембрані фоторецептора залежних від циклічного гуанозинмонофосфату ('''цГМФ''') [[катіон]]них каналів, що призводить до гіперполяризації та істотного зниження вивільнення глутамату<ref name="Copenhagen1989">{{cite journal| author=Copenhagen D.R., and Jahr C.E.| title=Release of endogenous excitatory amino acids from turtle photoreceptors|journal=Nature|volume=341|issue=6242|year=1989|pages=536–539|issn=0028-0836|doi=10.1038/341536a0}}</ref>. Тож, на відміну від інших нейронів, реакція на світло постсинаптичних до фоторецептора нейронів сітківки пов'язана не із збільшенням вивільнення рецептором нейромедіатора, а із зменшенням. |
|||
Палички і колбочки мають схожі механізми фототрансдукції та гіперполяризації, але різні молекулярні складові, швидкості внутріклітинних процесів та синаптичні зв'язки із постсинаптичними нейронами сітківки, що призводить до відмінних реакцій паличок і колбочок на різні діапазони інтенсивностей світла<ref name="FeinSzuts1982" />. Ці відмінності між двома класами фоторецепторів обумовлені тим, що палички, аби забезпечувати надійний зір при тьмяному світлі, повинні бути максимально чутливими до світла. Унікальна анатомічна структура та молекулярні складові паличок уможливлюють їх чутливість до одиничних фотонів, хоча надійне виявлення тьмяного спалаху світла потребує сигналів від 5 до 10 паличок<ref name="Hecht1942" /> <ref name="HechtS1942">{{cite journal| author=Hecht S.| title=The Quantum Relations of Vision|journal=Journal of the Optical Society of Ameri-ca|volume=32|issue=1|year=1942|pages=42|issn=0030-3941|doi=10.1364/JOSA.32.000042}}</ref>. |
Палички і колбочки мають схожі механізми фототрансдукції та гіперполяризації, але різні молекулярні складові, швидкості внутріклітинних процесів та синаптичні зв'язки із постсинаптичними нейронами сітківки, що призводить до відмінних реакцій паличок і колбочок на різні діапазони інтенсивностей світла<ref name="FeinSzuts1982" />. Ці відмінності між двома класами фоторецепторів обумовлені тим, що палички, аби забезпечувати надійний зір при тьмяному світлі, повинні бути максимально чутливими до світла. Унікальна анатомічна структура та молекулярні складові паличок уможливлюють їх чутливість до одиничних фотонів, хоча надійне виявлення тьмяного спалаху світла потребує сигналів від 5 до 10 паличок<ref name="Hecht1942" /> <ref name="HechtS1942">{{cite journal| author=Hecht S.| title=The Quantum Relations of Vision|journal=Journal of the Optical Society of Ameri-ca|volume=32|issue=1|year=1942|pages=42|issn=0030-3941|doi=10.1364/JOSA.32.000042}}</ref>. |
||
| Рядок 160: | Рядок 243: | ||
Для паличок характерні циліндричні ЗС, які в ссавців 1,2-2 мкм в діаметрі та 20-40 мкм в довжину, що коливається залежно від часу дня, інтенсивності світла та розміщення в сітківці <ref name="NickellPark2007">{{cite journal|author=Nickell S., Park P.S., Baumeister W., and Palczewski K.|title=Three-dimensional architecture of murine rod outer segments determined by cryoelectron tomography |journal=The Journal of Cell Biology|volume=177|issue=5|year=2007|pages=917–925|issn=0021-9525|doi=10.1083/jcb.200612010}}</ref><ref name="Gilliam2012">{{cite journal|author=Gilliam JC, Chang JT, Sandoval IM, Zhang Y, Li T, Pittler SJ, Chiu W, and Wensel TG.|title=Three-Dimensional Architecture of the Rod Sensory Cilium and Its Disruption in Retinal Neurodegeneration|journal=Cell|volume=151|issue=5|year=2012|pages=1029–1041|issn=00928674|doi=10.1016/j.cell.2012.10.038}}</ref>. Внутрішній об'єм ЗС палички, включаючи міждисковий та [[цитоплазма]]тичний простір, складає 32×10<sup>-12</sup> [[Літр#метричні одиниці|мл]], тоді як [[цитоплазма]] заповнює 10×10<sup>-12</sup> мл ЗС <ref name="NickellPark2007"/>. Відтак, цитоплазматичний простір, потрібний для процесу фототрансдукції, заповнює лише ~30% простору всередині ЗС палички, що свідчить про важливість внутрішніх мембранних структур для фототрансдукції. |
Для паличок характерні циліндричні ЗС, які в ссавців 1,2-2 мкм в діаметрі та 20-40 мкм в довжину, що коливається залежно від часу дня, інтенсивності світла та розміщення в сітківці <ref name="NickellPark2007">{{cite journal|author=Nickell S., Park P.S., Baumeister W., and Palczewski K.|title=Three-dimensional architecture of murine rod outer segments determined by cryoelectron tomography |journal=The Journal of Cell Biology|volume=177|issue=5|year=2007|pages=917–925|issn=0021-9525|doi=10.1083/jcb.200612010}}</ref><ref name="Gilliam2012">{{cite journal|author=Gilliam JC, Chang JT, Sandoval IM, Zhang Y, Li T, Pittler SJ, Chiu W, and Wensel TG.|title=Three-Dimensional Architecture of the Rod Sensory Cilium and Its Disruption in Retinal Neurodegeneration|journal=Cell|volume=151|issue=5|year=2012|pages=1029–1041|issn=00928674|doi=10.1016/j.cell.2012.10.038}}</ref>. Внутрішній об'єм ЗС палички, включаючи міждисковий та [[цитоплазма]]тичний простір, складає 32×10<sup>-12</sup> [[Літр#метричні одиниці|мл]], тоді як [[цитоплазма]] заповнює 10×10<sup>-12</sup> мл ЗС <ref name="NickellPark2007"/>. Відтак, цитоплазматичний простір, потрібний для процесу фототрансдукції, заповнює лише ~30% простору всередині ЗС палички, що свідчить про важливість внутрішніх мембранних структур для фототрансдукції. |
||
Колбочки мають конусоподібний ЗС , який є коротшим (маючи зазвичай половину довжини ЗС палички) із більшим діаметром в основі, що поступово звужується, набуваючи конусоподібної форми ближче до верхівки<ref name="HendricksonDrucker1992">{{cite journal|author=Hendrickson Anita and Drucker David|title=The development of parafoveal and mid-peripheral human retina|journal=Behavioural Brain Research|volume=49|issue=1|year=1992|pages=21–31|issn=01664328|doi=10.1016/S0166-4328(05)80191-3}}</ref>. Так, ЗС колбочки миші ~1,2 мкм в діаметрі та 13 мкм в довжині <ref name="Carter-DawsonLavail1979">{{cite journal|author=Carter-Dawson L. D. and Lavail M.M.|title=Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy|journal=The Journal of Comparative Neurology|volume=188|issue=2|year=1979|pages=245–262|issn=0021-9967|doi=10.1002/cne.901880204}}</ref>. |
Колбочки в сітківці ссавців мають більш циліндричний ЗС, тоді як в не ссавців для колбочок характерний конусоподібний ЗС , який є коротшим (маючи зазвичай половину довжини ЗС палички) із більшим діаметром в основі, що поступово звужується, набуваючи конусоподібної форми ближче до верхівки<ref name="HendricksonDrucker1992">{{cite journal|author=Hendrickson Anita and Drucker David|title=The development of parafoveal and mid-peripheral human retina|journal=Behavioural Brain Research|volume=49|issue=1|year=1992|pages=21–31|issn=01664328|doi=10.1016/S0166-4328(05)80191-3}}</ref>. Так, ЗС колбочки миші ~1,2 мкм в діаметрі та 13 мкм в довжині <ref name="Carter-DawsonLavail1979">{{cite journal|author=Carter-Dawson L. D. and Lavail M.M.|title=Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy|journal=The Journal of Comparative Neurology|volume=188|issue=2|year=1979|pages=245–262|issn=0021-9967|doi=10.1002/cne.901880204}}</ref>. В центральній ямці сітківки примат колбочки мають довші ЗС, ~45 мкм. |
||
Структурні відмінності в зовнішньому сегменті між паличками та колбочками обумовлюють і їх функціональні відмінності. Оптика ока спрямовує промені світла вздовж майже прямої лінії від ВС до ЗС і далі вздовж ЗС. В прямих ЗС інтенсивність світла зменшується вздовж їх довжини: молекули зорових пігментів в основі ЗС поглинають фотони, тим самим зменшуючи кількість фотонів, доступних для зорових пігментів на верхівці ЗС, т.зв. [[Фоторецептор#Самоекранування|ефект самоекранування]] (див. нижче) <ref name="Harosi2012">{{cite journal| author=Hárosi F.I. and Novales F.I.| title=Functional significance of the taper of vertebrate cone photoreceptors|journal=The Journal of General Physiology|volume=139|issue=2|year=2012|pages=159–187|issn=0022-1295|doi=10.1085/jgp.201110692}}</ref>. Внаслідок [[хвилевід]]ної природи фоторецептора (див. нижче [[Фоторецептор#Фоторецептор, як хвилевід| Фоторецептор, як хвилевід]]), конусоподібний ЗС зменшує ефект самоекранування, зберігаючи високу інтенсивність світла аж до місця знаходження зорового пігменту. Тому конусоподібний ЗС, поєднаний із специфічною геометрією ВС, покращує оптичну ефективність колбочок, дозволяючи ВС фокусувати світло на ЗС де воно ефективно взаємодіє з фотопігментом <ref name="Harosi2012" />. |
Структурні відмінності в зовнішньому сегменті між паличками та колбочками обумовлюють і їх функціональні відмінності. Оптика ока спрямовує промені світла вздовж майже прямої лінії від ВС до ЗС і далі вздовж ЗС. В прямих ЗС інтенсивність світла зменшується вздовж їх довжини: молекули зорових пігментів в основі ЗС поглинають фотони, тим самим зменшуючи кількість фотонів, доступних для зорових пігментів на верхівці ЗС, т.зв. [[Фоторецептор#Самоекранування|ефект самоекранування]] (див. нижче) <ref name="Harosi2012">{{cite journal| author=Hárosi F.I. and Novales F.I.| title=Functional significance of the taper of vertebrate cone photoreceptors|journal=The Journal of General Physiology|volume=139|issue=2|year=2012|pages=159–187|issn=0022-1295|doi=10.1085/jgp.201110692}}</ref>. Внаслідок [[хвилевід]]ної природи фоторецептора (див. нижче [[Фоторецептор#Фоторецептор, як хвилевід| Фоторецептор, як хвилевід]]), конусоподібний ЗС зменшує ефект самоекранування, зберігаючи високу інтенсивність світла аж до місця знаходження зорового пігменту. Тому конусоподібний ЗС, поєднаний із специфічною геометрією ВС, покращує оптичну ефективність колбочок, дозволяючи ВС фокусувати світло на ЗС де воно ефективно взаємодіє з фотопігментом <ref name="Harosi2012" />. |
||
| Рядок 205: | Рядок 288: | ||
Внутрішній сегмент (ВС) фоторецептора - це тіло клітини, в якому містяться ядро, мітохондрія та ін. клітинні органели. Його анатомія спеціалізована для забезпечення високого рівня енергії та синтезу білків, необхідних для підтримки функціювання фоторецептора. |
Внутрішній сегмент (ВС) фоторецептора - це тіло клітини, в якому містяться ядро, мітохондрія та ін. клітинні органели. Його анатомія спеціалізована для забезпечення високого рівня енергії та синтезу білків, необхідних для підтримки функціювання фоторецептора. |
||
У колбочок ВС зазвичай більш об'ємисті із щільно упакованими в еліпсоїдному регіоні округленими мітохондріями, тоді як у паличок ВС |
У колбочок ВС зазвичай більш об'ємисті із щільно упакованими в еліпсоїдному регіоні округленими мітохондріями, тоді як у паличок ВС містять менше мітохондрій, які є довшими та тоншими від колбочкових. Те, що колбочки мають більший ВС ніж палички пов'язане скоріш за все з їх більшими метаболічними потребами у порівнянні із паличками<ref name="ChenSampath2012" />. |
||
На відміну від ЗС, ВС паличок і колбочок не є шаруватими, але в них щільно упаковані мітохондрії |
На відміну від ЗС, ВС паличок і колбочок не є шаруватими, але в них щільно упаковані мітохондрії. <ref name="De Robertis1956">{{cite journal|author=De Robertis E.|title=Electron microscope observations on the submicroscopic organization of the retinal rods|journal=The Journal of Cell Biology|volume=2|issue=3|year=1956|pages=319–330|issn=0021-9525|doi=10.1083/jcb.2.3.319}}</ref> |
||
ВС прийнято ділити на дві частини: еліпсоїд та міоїд<ref name="Rodieck1998" />. |
ВС прийнято ділити на дві частини: еліпсоїд та міоїд<ref name="Rodieck1998" />. |
||
| Рядок 221: | Рядок 304: | ||
Мітохондрії у фоторецепторах виконують подвійну функцію. Як і в інших клітинах, у фоторецепторах вони виконують метаболічні функції, будучи генераторами [[аденозинтрифосфат]]у (АТФ). Фоторецептори, зокрема їх ВС, характеризуються високим споживанням кисню <ref name="ZuckermanWeiter1980">{{cite journal| author=Zuckerman, R. and Weiter, J.J. |title=Oxygen transport in the bullfrog retina| journal=Experimental Eye Research|volume=30|issue=2|year=1980|pages=117–127|issn=00144835|doi=10.1016/0014-4835(80)90106-2}}</ref> <ref name="Linsenmeier1986">{{cite journal| author=Linsenmeier R. A.| title=Effects of light and darkness on oxygen distribution and consumption in the cat retina |journal=The Journal of General Physiology|volume=88|issue=4|year=1986|pages=521–542|issn=0022-1295|doi=10.1085/jgp.88.4.521}}</ref><ref name="Linsenmeier2007">{{cite book| author= Linsenmeier, Robert A.| editor=He, Bin |title=Neural Engineering|url=https://books.google.com/books?id=iw9pi1otD1EC&pg=PA458|edition=1|date=31 December 2007|publisher=Springer |isbn=978-0-306-48610-4|pages=458–461|chapter=Chapter 13. Retinal Bioengineering}}</ref>. ВС колбочок мають інтенсивне [[Імуногістохімія |гістохімічне фарбування]] {{не перекладено|Цитохром с-оксидаза|цитохром с-оксидази ||| Cytochrome c oxidase }} та відносно високе споживання кисню <ref name="Kageyama1984">{{cite journal| author=Kageyama GH and Wong-Riley MT| title=The histochemical localization of cytochrome oxidase in the retina and lateral geniculate nucleus of the ferret, cat, and monkey, with particular reference to retinal mosaics and ON/OFF-center visual channels. | journal= Journal of Neuroscience | year= 1984 | volume= 4 | issue= 10 | pages= 2445-59 | pmid=6092560 | url=http://www.jneurosci.org/content/4/10/2445.short }} </ref> <ref name="Ahmed1993">{{cite journal| author=Ahmed J, Braun RD, Dunn R and Linsenmeier RA| title=Oxygen distribution in the macaque retina. | journal=Investigative Ophthalmology & Visual Science | year= 1993 | volume= 34 | issue= 3 | pages= 516-21 | pmid=8449672 | url=http://iovs.arvojournals.org/article.aspx?articleid=2179162}} </ref>. Більшість з енергії, яка генерується у ВС колбочок, підтримує перекачування іонів натрію та обмін цГМФ <ref name="Kimble1980">{{cite journal| author=Kimble, E.A., Svoboda, R.A. and Ostroy, S.E.|title=Oxygen consumption and ATP changes of the vertebrate photoreceptor |journal=Experimental Eye Re-search|volume=31|issue=3|year=1980|pages=271–288|issn=00144835|doi=10.1016/S0014-4835(80)80037-6}}</ref> <ref name="Ames1992">{{cite journal| author=Ames A, Li YY, Heher EC, and Kimble CR| title=Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. | journal=Journal of Neuroscience| year= 1992 | volume= 12 | issue= 3 | pages= 840-53 | pmid=1312136 | url=http://www.jneurosci.org/content/12/3/840.short }} </ref> <ref name="Haugh-ScheidtGriff1995">{{cite journal| author=Haugh-Scheidt L.M., Griff E.R. and Linsenmeier R.A.| title=Light-evoked oxygen responses in the isolated toad retina| journal=Experimental Eye Re-search|volume=61|issue=1|year=1995|pages=73–81|issn=00144835|doi=10.1016/S0014-4835(95)80060-3}}</ref>. В темряві, за відсутності світлового стимулювання, [[натрій-калієвий насос]] в плазматичній мембрані ВС характеризується надзвичайно швидкою активністю, потрібною для балансування великого потоку натрію через багато відкритих цГМФ-регульованих каналів в ЗС <ref name="OkawaSampath2008">{{cite journal| author=Okawa H., Sampath A.P., Laughlin S.B., and Fain G.L.| title=ATP Consumption by Mammalian Rod Photoreceptors in Darkness and in Light|journal=Current Biology|volume=18|issue=24|year=2008|pages=1917–1921|issn=09609822|doi=10.1016/j.cub.2008.10.029}}</ref> |
Мітохондрії у фоторецепторах виконують подвійну функцію. Як і в інших клітинах, у фоторецепторах вони виконують метаболічні функції, будучи генераторами [[аденозинтрифосфат]]у (АТФ). Фоторецептори, зокрема їх ВС, характеризуються високим споживанням кисню <ref name="ZuckermanWeiter1980">{{cite journal| author=Zuckerman, R. and Weiter, J.J. |title=Oxygen transport in the bullfrog retina| journal=Experimental Eye Research|volume=30|issue=2|year=1980|pages=117–127|issn=00144835|doi=10.1016/0014-4835(80)90106-2}}</ref> <ref name="Linsenmeier1986">{{cite journal| author=Linsenmeier R. A.| title=Effects of light and darkness on oxygen distribution and consumption in the cat retina |journal=The Journal of General Physiology|volume=88|issue=4|year=1986|pages=521–542|issn=0022-1295|doi=10.1085/jgp.88.4.521}}</ref><ref name="Linsenmeier2007">{{cite book| author= Linsenmeier, Robert A.| editor=He, Bin |title=Neural Engineering|url=https://books.google.com/books?id=iw9pi1otD1EC&pg=PA458|edition=1|date=31 December 2007|publisher=Springer |isbn=978-0-306-48610-4|pages=458–461|chapter=Chapter 13. Retinal Bioengineering}}</ref>. ВС колбочок мають інтенсивне [[Імуногістохімія |гістохімічне фарбування]] {{не перекладено|Цитохром с-оксидаза|цитохром с-оксидази ||| Cytochrome c oxidase }} та відносно високе споживання кисню <ref name="Kageyama1984">{{cite journal| author=Kageyama GH and Wong-Riley MT| title=The histochemical localization of cytochrome oxidase in the retina and lateral geniculate nucleus of the ferret, cat, and monkey, with particular reference to retinal mosaics and ON/OFF-center visual channels. | journal= Journal of Neuroscience | year= 1984 | volume= 4 | issue= 10 | pages= 2445-59 | pmid=6092560 | url=http://www.jneurosci.org/content/4/10/2445.short }} </ref> <ref name="Ahmed1993">{{cite journal| author=Ahmed J, Braun RD, Dunn R and Linsenmeier RA| title=Oxygen distribution in the macaque retina. | journal=Investigative Ophthalmology & Visual Science | year= 1993 | volume= 34 | issue= 3 | pages= 516-21 | pmid=8449672 | url=http://iovs.arvojournals.org/article.aspx?articleid=2179162}} </ref>. Більшість з енергії, яка генерується у ВС колбочок, підтримує перекачування іонів натрію та обмін цГМФ <ref name="Kimble1980">{{cite journal| author=Kimble, E.A., Svoboda, R.A. and Ostroy, S.E.|title=Oxygen consumption and ATP changes of the vertebrate photoreceptor |journal=Experimental Eye Re-search|volume=31|issue=3|year=1980|pages=271–288|issn=00144835|doi=10.1016/S0014-4835(80)80037-6}}</ref> <ref name="Ames1992">{{cite journal| author=Ames A, Li YY, Heher EC, and Kimble CR| title=Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. | journal=Journal of Neuroscience| year= 1992 | volume= 12 | issue= 3 | pages= 840-53 | pmid=1312136 | url=http://www.jneurosci.org/content/12/3/840.short }} </ref> <ref name="Haugh-ScheidtGriff1995">{{cite journal| author=Haugh-Scheidt L.M., Griff E.R. and Linsenmeier R.A.| title=Light-evoked oxygen responses in the isolated toad retina| journal=Experimental Eye Re-search|volume=61|issue=1|year=1995|pages=73–81|issn=00144835|doi=10.1016/S0014-4835(95)80060-3}}</ref>. В темряві, за відсутності світлового стимулювання, [[натрій-калієвий насос]] в плазматичній мембрані ВС характеризується надзвичайно швидкою активністю, потрібною для балансування великого потоку натрію через багато відкритих цГМФ-регульованих каналів в ЗС <ref name="OkawaSampath2008">{{cite journal| author=Okawa H., Sampath A.P., Laughlin S.B., and Fain G.L.| title=ATP Consumption by Mammalian Rod Photoreceptors in Darkness and in Light|journal=Current Biology|volume=18|issue=24|year=2008|pages=1917–1921|issn=09609822|doi=10.1016/j.cub.2008.10.029}}</ref> |
||
Крім того, мітохондрії еліпсоїда забезпечують високу частоту синтезу білків в міоїді ВС для забезпечення високого рівня фототрансдукції білків в ЗС. Так, ЗС палички містить до 5×10<sup>7</sup> молекул родопсину, із яких 10% [[фагоцитоз|фагоцитуються]] пігментним епітелієм сітківки з настанням світла кожного дня, тому для постійної підтримки кількості родопсину в ЗС, в еліпсоїді щодня синтезується до |
Крім того, мітохондрії еліпсоїда забезпечують високу частоту синтезу білків в міоїді ВС для забезпечення високого рівня фототрансдукції білків в ЗС. Так, ЗС палички містить до 5×10<sup>7</sup> молекул родопсину, із яких 10% [[фагоцитоз|фагоцитуються]] пігментним епітелієм сітківки з настанням світла кожного дня, тому для постійної підтримки кількості родопсину в ЗС, в еліпсоїді щодня синтезується до 5×10<sup>6</sup> молекул родопсину і переміщається до основи ЗС<ref name="ChenSampath2012" />. |
||
| Рядок 233: | Рядок 316: | ||
Оптичні, більш ніж метаболічні, функції фоторецепторних мітохондрій дозволяють пояснити відмінність між кількістю мітохондрій у ВС паличок та колбочок (особливо периферійних) сітківок людей та мавп. Їх широкі та конічні ВС, у порівнянні з вузькими та широко розставленими ЗС, можуть сприяти у схопленні та спрямуванні світла до фотопігменту в ЗС <ref name="Hoang2002">{{cite journal| author=Hoang Q.V., Linsenmeier R.A., Chung C.K. and Curcio C.A.|title=Photoreceptor inner segments in monkey and human retina: Mitochondrial density, optics, and regional variation| journal=Visual Neuroscience|volume=19|issue=04|year=2002|pages=395–407|issn=0952-5238|doi=10.1017/S0952523802194028}}</ref>. На відміну від мавп та людини, різниця між діаметрами ЗС та ВС паличок і колбочок сітківок мишей та кішок не така значна, тому між ними і менша різниця в кількості мітохондрій та метаболічній активності, що вказує на меншу важливість еліпсоїдних мітохондрій колбочок для хвилевідних властивостей><ref name="Carter-Dawson1979">{{cite journal|author=Carter-Dawson Louvenia D. and Lavail Matthew M.|title=Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy |journal=The Journal of Comparative Neurology|volume=188|issue=2|year=1979|pages=245–262|issn=0021-9967|doi=10.1002/cne.901880204}}</ref>. |
Оптичні, більш ніж метаболічні, функції фоторецепторних мітохондрій дозволяють пояснити відмінність між кількістю мітохондрій у ВС паличок та колбочок (особливо периферійних) сітківок людей та мавп. Їх широкі та конічні ВС, у порівнянні з вузькими та широко розставленими ЗС, можуть сприяти у схопленні та спрямуванні світла до фотопігменту в ЗС <ref name="Hoang2002">{{cite journal| author=Hoang Q.V., Linsenmeier R.A., Chung C.K. and Curcio C.A.|title=Photoreceptor inner segments in monkey and human retina: Mitochondrial density, optics, and regional variation| journal=Visual Neuroscience|volume=19|issue=04|year=2002|pages=395–407|issn=0952-5238|doi=10.1017/S0952523802194028}}</ref>. На відміну від мавп та людини, різниця між діаметрами ЗС та ВС паличок і колбочок сітківок мишей та кішок не така значна, тому між ними і менша різниця в кількості мітохондрій та метаболічній активності, що вказує на меншу важливість еліпсоїдних мітохондрій колбочок для хвилевідних властивостей><ref name="Carter-Dawson1979">{{cite journal|author=Carter-Dawson Louvenia D. and Lavail Matthew M.|title=Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy |journal=The Journal of Comparative Neurology|volume=188|issue=2|year=1979|pages=245–262|issn=0021-9967|doi=10.1002/cne.901880204}}</ref>. |
||
Найбільш очевидними оптичні властивості мітохондрій фоторецепторів є в [[тупаєподібні|тупаєподібних]] та [[мідицеві|землерийок]], чиї колбочки містять поряд з меншими мітохондріями кілька великих мітохондрій («мегамітохондрій»), що мають нерегулярні [[крісти]] і діють як мікролінзи, підсилюючи оптичні функції колбочок<ref name="Knabe1997">{{cite journal |author=Knabe W., Skatchkov S., and Kuhn H.-J.| title=“Lens Mitochondria” in the Retinal Cones of the Tree-shrew Tupaia belangeri| journal=Vision Research|volume=37|issue=3|year=1997|pages=267–271|issn=00426989|doi=10.1016/S0042-6989(96)00199-X}}</ref><ref name="Lluch2003">{{cite journal| author=Lluch S., López-Fuster M.J. and Ventura J.| title=Giant mitochondria in the retina cone inner seg-ments of shrews of genus Sorex (Insectivora, Soricidae)|journal=The Anatomical Record Part A: Discoveries in Molecular, Cellular, and Evolutionary Biology|volume=272A|issue=2|year=2003|pages=484–490|issn=15524884|doi=10.1002/ar.a.10066}}</ref>. Такі великі мітохондрії могли з'явитись заміщення {{не перекладено|олійні краплини |олійних краплин |en| Oil droplet}}, які були в пращурів тупаєподібних. Середній показник заломлення ізольованого ВС колбочки малайської тупайї (''Tupaia belangeri'') вищий (1,405), ніж будь-якого іншого вивченого ссавця<ref name="Knabe1997">{{cite journal |author=Knabe W., Skatchkov S., and Kuhn H.-J.| title=“Lens Mitochondria” in the Retinal Cones of the Tree-shrew Tupaia belangeri| journal=Vision Research|volume=37|issue=3|year=1997|pages=267–271|issn=00426989|doi=10.1016/S0042-6989(96)00199-X}}</ref>. |
Найбільш очевидними оптичні властивості мітохондрій фоторецепторів є в [[тупаєподібні|тупаєподібних]] та [[мідицеві|землерийок]], чиї колбочки містять поряд з меншими мітохондріями кілька великих мітохондрій («мегамітохондрій»), що мають нерегулярні [[крісти]] і діють як мікролінзи, підсилюючи оптичні функції колбочок<ref name="Knabe1997">{{cite journal |author=Knabe W., Skatchkov S., and Kuhn H.-J.| title=“Lens Mitochondria” in the Retinal Cones of the Tree-shrew Tupaia belangeri| journal=Vision Research|volume=37|issue=3|year=1997|pages=267–271|issn=00426989|doi=10.1016/S0042-6989(96)00199-X}}</ref><ref name="Lluch2003">{{cite journal| author=Lluch S., López-Fuster M.J. and Ventura J.| title=Giant mitochondria in the retina cone inner seg-ments of shrews of genus Sorex (Insectivora, Soricidae)|journal=The Anatomical Record Part A: Discoveries in Molecular, Cellular, and Evolutionary Biology|volume=272A|issue=2|year=2003|pages=484–490|issn=15524884|doi=10.1002/ar.a.10066}}</ref>. Такі великі мітохондрії могли з'явитись як заміщення {{не перекладено|олійні краплини |олійних краплин |en| Oil droplet}}, які були в пращурів тупаєподібних. Середній показник заломлення ізольованого ВС колбочки малайської тупайї (''Tupaia belangeri'') вищий (1,405), ніж будь-якого іншого вивченого ссавця<ref name="Knabe1997">{{cite journal |author=Knabe W., Skatchkov S., and Kuhn H.-J.| title=“Lens Mitochondria” in the Retinal Cones of the Tree-shrew Tupaia belangeri| journal=Vision Research|volume=37|issue=3|year=1997|pages=267–271|issn=00426989|doi=10.1016/S0042-6989(96)00199-X}}</ref>. |
||
Вивчення мітохондріальних еліпсоїдів ВС одиничних колбочок [[курка|курки]] (‘’Gallus gallus domesticus’’) показало, що у фоторецепторів птахів еліпсоїди слугують не для покращення схоплення світла, а скоріш для зменшення погіршення оптичних функцій фоторецептора через розсіяння світла по ньому<ref name="Wilby2014">{{cite book|author=Wilby, David |title=Optics and Photoreception in the Avian Retina (PhD the-sis)|url=https://www.researchgate.net/publication/309771649_Optics_and_Photoreception_in_the_Avian_Retina|date=December 2014|publisher=University of Bristol|doi=10.13140/RG.2.2.18130.15043}}</ref>. У колбочок птахів еліпсоїд має ту саму ширину, що й олійна кольорова краплина і змінює {{не перекладено| апертурний кут||| Acceptance angle }} фоторецептора, тому незначним чином покращує передачу світла від ВС до ЗС<ref name="WilbyToomey2015">{{cite journal| author=Wilby D., Toomey M.B., Olsson P., Frederiksen R., Cornwall M.C., Oulton R., Kelber A., Corbo J. C., and Roberts N.W.|title=Optics of cone photoreceptors in the chicken (Gallus gallus domesticus)|journal=Journal of The Royal Society Interface|volume=12|issue=111|year=2015|pages=20150591|issn=1742-5689|doi=10.1098/rsif.2015.0591}}</ref>. |
Вивчення мітохондріальних еліпсоїдів ВС одиничних колбочок [[курка|курки]] (‘’Gallus gallus domesticus’’) показало, що у фоторецепторів птахів еліпсоїди слугують не для покращення схоплення світла, а скоріш для зменшення погіршення оптичних функцій фоторецептора через розсіяння світла по ньому<ref name="Wilby2014">{{cite book|author=Wilby, David |title=Optics and Photoreception in the Avian Retina (PhD the-sis)|url=https://www.researchgate.net/publication/309771649_Optics_and_Photoreception_in_the_Avian_Retina|date=December 2014|publisher=University of Bristol|doi=10.13140/RG.2.2.18130.15043}}</ref>. У колбочок птахів еліпсоїд має ту саму ширину, що й олійна кольорова краплина і змінює {{не перекладено| апертурний кут||| Acceptance angle }} фоторецептора, тому незначним чином покращує передачу світла від ВС до ЗС<ref name="WilbyToomey2015">{{cite journal| author=Wilby D., Toomey M.B., Olsson P., Frederiksen R., Cornwall M.C., Oulton R., Kelber A., Corbo J. C., and Roberts N.W.|title=Optics of cone photoreceptors in the chicken (Gallus gallus domesticus)|journal=Journal of The Royal Society Interface|volume=12|issue=111|year=2015|pages=20150591|issn=1742-5689|doi=10.1098/rsif.2015.0591}}</ref>. |
||
| Рядок 253: | Рядок 336: | ||
Через з'єднувальні війки відбувається потік величезної кількості ліпідів та білків із ВС, де вони синтезуються, до ЗС, де беруть участь у фототрансдукції чи підтримці функціювання ЗС. Щохвилини до 2 тис. молекул транспортується із ВС до ЗС<ref name="InsinnaBesharse2008">{{cite journal|author=Insinna C. and Besharse J.C.|title=Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors|journal=Developmental Dynamics|volume=237|issue=8|year=2008|pages=1982–1992|issn=10588388|doi=10.1002/dvdy.21554}}</ref>. |
Через з'єднувальні війки відбувається потік величезної кількості ліпідів та білків із ВС, де вони синтезуються, до ЗС, де беруть участь у фототрансдукції чи підтримці функціювання ЗС. Щохвилини до 2 тис. молекул транспортується із ВС до ЗС<ref name="InsinnaBesharse2008">{{cite journal|author=Insinna C. and Besharse J.C.|title=Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors|journal=Developmental Dynamics|volume=237|issue=8|year=2008|pages=1982–1992|issn=10588388|doi=10.1002/dvdy.21554}}</ref>. |
||
===Ядро=== |
|||
==Аксон та синапси== |
|||
[[Клітинне ядро|Ядра]] паличок та колбочок формують [[зовнішній ядерний шар]] сітківки хребетних. У колбочці ядро міститься у внутрішньому сегменті, тоді як в паличці ядро знаходиться в клітинному тілі, відокремленому від внутрішнього сегменту зовнішнім волокном<ref name="Lommel2012">{{cite book| author=van Lommel, Alfons T.L. |title=From Cells to Organs: A Histology Textbook and Atlas| url=https://books.google.com/books?id=nHbgBwAAQBAJ|date=6 December 2012|publisher=Springer |isbn=978-1-4615-0353-8|page=322}}</ref>. Ядро паличок та колбочок характеризується високим рівнем транскрипції, оскільки мембранні диски зовнішніх сегментів неперервно оновлюються, тому фоторецептори функціюють як свого роду {{не перекладено|апокринні залози|||Apocrine}} з високою активністю<ref name="Solovei2009">{{cite journal| author=Solovei I., Kreysing M., Lanctôt C., Kösem S., Peichl L., Cremer T., Guck J, and Joffe B.| title=Nuclear Architecture of Rod Photoreceptor Cells Adapts to Vision in Mammalian Evolution|journal=Cell|volume=137|issue=2|year=2009|pages=356–368|issn=00928674|doi=10.1016/j.cell.2009.01.052}}</ref>. |
|||
Клітинні ядра відмінні в паличок та колбочок <ref name="Lommel2012" />. Ядро палички більш округле, відносно мале і характеризується розміщенням [[гетерохроматин]]у в одне щільне скупчення (хромоцентр), яке виглядає більш темнішим коли забарвлене [[нуклеофільні реагенти|нуклеофільним]] [[барви|фарбуванням]] <ref name="Carter-Dawson1979" />. Ядро колбочки є відносно великим та овальним, часто формуючи єдиний шар, що проникає до [[Зовнішня погранична мембрана|зовнішньої пограничної мембрани]] <ref name="ChenSampath2012" />. Колбочкові ядра характеризуються великою кількістю [[еухроматин]]у і менше гетерохроматину, який організований в кілька невеликх скупчень і тому ці ядра мають менш інтенсивне контрастне фарбування<ref name="Sokol1970">{{cite journal| author=Sokol S.|title=Cortical and retinal spectral sensitivity of the hooded rat|journal=Vision Research|volume=10|issue=3|year=1970|pages=253–262|issn=00426989|doi=10.1016/0042-6989(70)90130-6}}</ref><ref name="LaVail1971">{{cite journal| author=LaVail M.M. and Hild W. |title= Histotypic organization of the rat retina in vitro| journal=Zeitschrift fur Zellforschung und Mikroskopische Anatomie|volume=114|issue=4|year=1971|pages=557–579|issn=0302-766X|doi=10.1007/BF00325640}}</ref>. |
|||
=== Аксонний термінал === |
|||
====Перевернуте ядро палички==== |
|||
В більшості [[ядерні|еукаріотних]] клітин пакування [[хроматин]]ових ниток має дві форми: 1) [[еухроматин]] (не щільна, відкрита форма із активними генами), що знаходиться ближче до ядра, де проходить більша частина [[транскрипція (біологія)|транскрипції]]; та 2) [[гетерохроматин]] (ущільнена форма), що часто скупчений довкола [[ядерце|ядерець]] та на периферії ядра і містить транскрипційно неактивні ділянки геному<ref name="CremerCremer2001">{{cite journal| author=Cremer T. and Cremer C. |title=Chromosome territories, nuclear architecture and gene regulation in mammalian cells |journal=Nature Reviews Genetics|volume=2|issue=4|year=2001|pages=292–301|issn=14710056|doi=10.1038/35066075}}</ref><ref name="Chakalova2005">{{cite journal| author=Chakalova L., Debrand E., Mitchell J.A., Osborne C.S. and Fraser P. |title=Replication and transcription: Shaping the landscape of the genome| journal=Nature Reviews Genetics|volume=6|issue=9|year=2005|pages=669–677|issn=1471-0056|doi=10.1038/nrg1673}}</ref>. На відміну від цієї усталеної архітектури ядра, в паличках мишей була виявлена незвична перевернута архітектура ядра: гетерохроматин тут зосереджений в центрі ядра, тоді як еухроматин і [[фактори транскрипції]] знаходяться на периферії, де в інших ядер гени не представлені <ref name="Solovei2009" />. Така архітектура ядер паличок має важливі функціональні наслідки для нічного зору ссавців, наділяючи їх оптичними властивостями. |
|||
При народженні (післяпологовий день P0) палички миші мають звичну для інших еукаріотних клітин архітектуру ядра, але після закінчення проліферації клітин (P5) та відкриття очей (P13) їх ядра набувають перевернуту архітектуру, яка остаточно оформлюється через місяць опісля народження. Аналіз ядра паличок сітківок інших нічних ссавців також виявив перевернуту ядерну архітектуру та її стійку кореляцію з концентрацією паличок і відношенням паличок до колбочок<ref name="Solovei2009" />. |
|||
У більшості ссавців, що ведуть денний способі життя, перевернутої організації ядра палички не було виявлено<ref name="Solovei2009" />. Винятком є денні [[лемурові|лемури]] – сіфака (Propithecus) та лемур звичайний (Eulemur fulvus), палички яких мають перевернуту архітектуру ядра<ref name="Joffe2013">{{cite journal|author=Joffe B., Peichl L., Hendrickson A., Leonhardt H., and Solovei I.|title=Diurnality and Nocturnality in Primates: An Analysis from the Rod Photoreceptor Nuclei Perspective|journal=Evolutionary Biology|year=2013|issn=0071-3260|doi=10.1007/s11692-013-9240-9}}</ref>. Цей виняток може бути пояснений з урахуванням останніх поведінкових досліджень, які показали, що денні лемури насправді ведуть {{не перекладено|змішаний спосіб життя|||Cathemerality}}, будучи активними в день і вночі<ref name="Donati2013">{{cite journal |author=Donati G., Santini L., Razafindramanana J., Boitani L., and Borgognini-Tarli S.| title=(Un-)expected nocturnal activity in “Diurnal” Lemur cattasupports cathemerality as one of the key adaptations of the lemurid radiation |journal=American Journal of Physical Anthropology|volume=150|issue=1|year=2013|pages=99–106|issn=00029483|doi=10.1002/ajpa.22180}}</ref>. З іншого боку, ядро палички корови має проміжну архітектуру: гетерохроматин знаходиться в центрі і поширюється на периферію, що може свідчити про перехід від перевернутої ядерної архітектури до традиційної, обумовлений скоріш за все адаптацією корів від нічного до денного способу життя після одомашнення <ref name="Solovei2009" />. І навпаки, паличкові ядра [[нічна мавпа|нічної мавпи]] характеризуються переходом від усталеної архітектури хроматину до перевернутої, оскільки мають хроматин як на периферії (усталена архітектура), так і в центрі ядра (перевернута архітектура), де він є хромоцентром<ref name="Joffe2013" />. Подібна перехідна форма свідчить про повернення нічних мавп від денної активності до нічної, яку вели пращури примат. Унікальною є сітківка активних в ночі [[довгоп'ятові|довгоп'ятових]], в якій, подібно до інших нічних ссавців, менша загальна щільність колбочок, однак присутня характерна для денних примат центральна ямка і їх паличкові ядра мають усталену архітектуру паличкового ядра, що різнить їх з поміж всіх інших нічних ссавців<ref name="Joffe2013" />. Чому довгоп'ятові зберегли усталену архітектуру ядра, - попри те що значно давніше адаптувались до нічного життя (~40-45 млн. років тому), аніж нічні мавпи (~5-19 млн. років тому), - наразі залишається незрозумілим. |
|||
====Оптичні властивості перевернутого ядра==== |
|||
Перевернуті ядра впливають на оптичні властивості паличок, оскільки ці ядра мають нижчий [[показник заломлення]] на периферії і вищий, хоч і однорідний, показник заломлення в центрі, де скупчений гетерохроматин. Подібна різниця показників заломлення значно зменшує розсіяння ядром рідкісного в ночі світла та покращує його фокусування для проходження до зорового пігменту в зовнішньому сегменті фоторецептора, поліпшуючи нічний зір<ref name="Solovei2009" />.Формування перевернутого ядра в паличці миші в перший місяць після народження відповідає значному скороченню ефективної [[фокусна відстань|фокусної відстані]] ядра із ~27 мкм новонародженої миші до ~12 мкм в дорослої миші <ref name="Blaszczak2014">{{cite journal| author=Błaszczak Z., Kreysing M. and Guck J.| title=Direct observation of light focusing by single photoreceptor cell nuclei| journal=Optics Express|volume=22|issue=9|year=2014|pages=11043|issn=1094-4087|doi=10.1364/OE.22.011043}}</ref>. |
|||
Перевернута організація паличкового ядра свідчить про те, що воно, подібно до інших сегментів фоторецептора, еволюціонувало для оптимізації проходження світла через перевернуту сітківку до зорового пігменту фоторецептора. На користь цього свідчать числові моделювання поширення світла через перевернуті ядра паличок з допомогою [[не перекладено|метод скінченних різниць в часовій області|скінченно-різницевого методу в часовій області|en|Finite-difference time-domain metod}} (FDTD) в двох <ref name="Solovei2009" /> та трьох вимірах <ref name="Kreysing2010">{{cite journal|author=Kreysing M. , Boyde L., Guck J., and Chalut K.J.|title=Physical insight into light scattering by photoreceptor cell nuclei| journal=Optics Letters|volume=35|issue=15|year=2010|pages=2639|issn=0146-9592|doi=10.1364/OL.35.002639}}</ref>. FDTD-моделювання вказує на те, що перевернуті ядра функціонують подібно до [[Лінза#Типи лінз|збиральних лінз]] для проходячого світла, тоді як ядра з усталеною організацією постають, як дифракційно-подібні перешкоди поширенню світла до зовнішнього сегменту палички <ref name="Blaszczak2014" />. |
|||
Завдяки округлій формі та оберненій організації хроматину, перевернуте ядро палички володіє [[Центральна симетрія|центральною симетрією]] і оптичні властивості паличкового ядра відокремлені від його просторової орієнтації. Тому перевернуте ядро не тільки більш ефективно фокусує світло у паличці, аніж усталене ядро, але й зберігає свої фокусуючі властивості незалежно від його орієнтації. Ці характеристики перевернутого паличкового ядра мають важливі наслідки для [[зовнішній ядерний шар|зовнішнього ядерного шару]], в якому знаходяться клітинні тіла паличок і який в нічних ссавців значно товстіший ніж в денних. В зовнішньому ядерному шарі паличкові ядра розміщені в 6-8 шарів і згруповані у вертикальні колонки, вирівняні таким чином, що знаходяться приблизно на одній лінії з проходячим світлом<ref name="Carter-Dawson1979" /><ref name="Solovei2009" />. Моделювання з використанням FDTD-методу показало, що організація перевернутих ядер паличок в колонки зменшує розсіяння світла і забезпечує (подібно до центральної ямки) ефективний оптичний шлях через всю сітківку нічної тварини<ref name="Kreysing2010" /><ref name="Blaszczak2014" />. Крім того, зменшення розсіяння в колонках перевернутих ядер паличок стійке до нерегулярностей колонок. <ref name="Solovei2009" />. |
|||
Відносна товщина зовнішнього ядерного шару може бути причиною перевернутої архітектури паличкового ядра нічних ссавців, яка дозволяє в такому потовщеному шарі зменшити розсіяння фотонів і збільшити ймовірність їх схоплення фотопігментом в зовнішньому сегменті палички. Крім того, округла форма перевернутих паличкових ядер з їх центральною симетрією уможливлює фокусування світла без необхідності їх впорядкованого розміщення в зовнішньому ядерному шарі<ref name="Blaszczak2014" />. |
|||
Оберненість сітківки і необхідність проходження світла через її клітинні шари перш ніж воно досягне зорового пігменту, вказує на те, що оптичні властивості фоторецепторів та їх складових не менш важливі, ніж їх фізіологічні функції. |
|||
==Аксонний термінал== |
|||
В результаті поглинання фотону фоторецептором у його зовнішньому сегменті запускається каскад фототрансдукції, що призводить до градуйованих змін трансмембранного потенціалу зовнішнього сегменту, який {{не перекладено|Електротонічний потенціал|електротонічно|||Electrotonic potential}} поширюється до [[аксон|аксонного терміналу]], звідки передається іншим нейронам двома способами. Один спосіб – через електричні [[синапс]]и: пасивне перенесення електричного потенціалу до прилеглих фоторецепторів через внутрішньоклітинні з’єднання ([[щілинні контакти]]) з низьким опором. Другий спосіб – через хімічні синапси: зміни мембранного потенціалу на аксонному терміналі міняють внутрішньоклітинну концентрацію [[іон]]ів [[кальцій|кальцію]] Са<sup>2+</sup> та регулюють частоту злиття синаптичних [[везикула|везикул]] із плазматичною мембраною і вивільнення [[Нейромедіатори|нейромедіатора]] (глутамату) на постсинаптичні нейрони сітківки другого порядку<ref name="Dowling1987">{{cite book|author=Dowling, John E. |title=The Retina: An Approachable Part of the Brain|url=https://books.google.com/books?id=DDNnUZYOi0QC+|year=1987|publisher=Harvard University Press|isbn=978-0-674-76680-8|pages=282 }}</ref>. |
В результаті поглинання фотону фоторецептором у його зовнішньому сегменті запускається каскад фототрансдукції, що призводить до градуйованих змін трансмембранного потенціалу зовнішнього сегменту, який {{не перекладено|Електротонічний потенціал|електротонічно|||Electrotonic potential}} поширюється до [[аксон|аксонного терміналу]], звідки передається іншим нейронам двома способами. Один спосіб – через електричні [[синапс]]и: пасивне перенесення електричного потенціалу до прилеглих фоторецепторів через внутрішньоклітинні з’єднання ([[щілинні контакти]]) з низьким опором. Другий спосіб – через хімічні синапси: зміни мембранного потенціалу на аксонному терміналі міняють внутрішньоклітинну концентрацію [[іон]]ів [[кальцій|кальцію]] Са<sup>2+</sup> та регулюють частоту злиття синаптичних [[везикула|везикул]] із плазматичною мембраною і вивільнення [[Нейромедіатори|нейромедіатора]] (глутамату) на постсинаптичні нейрони сітківки другого порядку<ref name="Dowling1987">{{cite book|author=Dowling, John E. |title=The Retina: An Approachable Part of the Brain|url=https://books.google.com/books?id=DDNnUZYOi0QC+|year=1987|publisher=Harvard University Press|isbn=978-0-674-76680-8|pages=282 }}</ref>. |
||
====Ніжки і сферули==== |
|||
Аксонний термінал фоторецепторів розгалужується в [[Зовнішній сітчастий шар|зовнішньому сітчастому шарі]] сітківки. Аксонний термінал паличок називається '''сферулою''' (від лат. ''spherule'' = мала сфера), колбочок -'''ніжкою''' (лат. ''pedicle'' = мала нога)<ref name="DowlingBoycott1966">{{cite journal| author=Dowling J. E. and Boycott B. B.| title=Organization of the Primate Retina: Electron Microscopy |journal=Proceedings of the Royal Society B: Biological Sciences| volume=166|issue=1002|year=1966|pages=80–111|issn=0962-8452|doi=10.1098/rspb.1966.0086}}</ref>. У сітківці ссавців, периферійні колбочки мають значно більші ніжки (можуть мати понад 50 синаптичних щілин), аніж колбочки в центральній ямі і залежно від розташування в сітківці, можуть мати діаметр від 5 до 8 мкм<ref name="HaverkampGrünert2000">{{cite journal| author=Haverkamp Silke, Grünert Ulrike and Wässle Heinz| title=The Cone Pedicle, a Complex Synapse in the Retina|journal=Neuron|volume=27|issue=1|year=2000|pages=85–95|issn=08966273|doi=10.1016/S0896-6273(00)00011-8}}</ref>. У сітківці примат, поблизу центральної ями, аксони багатьох колбочок групуються [[радіальна симетрія|радіально]] таким чином, що ніжки формують кільцевий масив довкола центру.<ref name="Schmitz2009">{{cite journal|author=Schmitz Frank|title=The Making of Synaptic Ribbons: How They Are Built and What They Do|journal=The Neuroscientist|volume=15|issue=6|year=2009|pages=611–624|issn=1073-8584|doi=10.1177/1073858409340253}}</ref> |
Аксонний термінал фоторецепторів розгалужується в [[Зовнішній сітчастий шар|зовнішньому сітчастому шарі]] сітківки. Аксонний термінал паличок називається '''сферулою''' (від лат. ''spherule'' = мала сфера), колбочок -'''ніжкою''' (лат. ''pedicle'' = мала нога)<ref name="DowlingBoycott1966">{{cite journal| author=Dowling J. E. and Boycott B. B.| title=Organization of the Primate Retina: Electron Microscopy |journal=Proceedings of the Royal Society B: Biological Sciences| volume=166|issue=1002|year=1966|pages=80–111|issn=0962-8452|doi=10.1098/rspb.1966.0086}}</ref>. У сітківці ссавців, периферійні колбочки мають значно більші ніжки (можуть мати понад 50 синаптичних щілин), аніж колбочки в центральній ямі і залежно від розташування в сітківці, можуть мати діаметр від 5 до 8 мкм<ref name="HaverkampGrünert2000">{{cite journal| author=Haverkamp Silke, Grünert Ulrike and Wässle Heinz| title=The Cone Pedicle, a Complex Synapse in the Retina|journal=Neuron|volume=27|issue=1|year=2000|pages=85–95|issn=08966273|doi=10.1016/S0896-6273(00)00011-8}}</ref>. У сітківці примат, поблизу центральної ями, аксони багатьох колбочок групуються [[радіальна симетрія|радіально]] таким чином, що ніжки формують кільцевий масив довкола центру.<ref name="Schmitz2009">{{cite journal|author=Schmitz Frank|title=The Making of Synaptic Ribbons: How They Are Built and What They Do|journal=The Neuroscientist|volume=15|issue=6|year=2009|pages=611–624|issn=1073-8584|doi=10.1177/1073858409340253}}</ref> |
||
| Рядок 279: | Рядок 384: | ||
Фоторецепторні синапси також мають ряд молекулярних відмінностей від інших синапсів в нервовій системі. Синаптичні стрічки не містять {{не перекладено|синапсини|синапсинів|en|synapsin}}, - білків, що регулюють вивільнення нейромедіаторів в синапсах інших нейронів <ref>{{aut|Mandell JW, Townes-Anderson E, Czernik AJ, Cameron R, Greengard P, and De Camilli P.}}{{cite journal|title=Synapsins in the vertebrate retina: Absence from ribbon synapses and heterogeneous distribution among conventional synapses|journal=Neuron|volume=5|issue=1|year=1990|pages=19–33|issn=08966273|doi=10.1016/0896-6273(90)90030-J}}</ref>. На відміну від більшості нейронів, екзоцитоз та вивільнення нейромедіатора у паличках та колбочках регулюють [[Потенціалзалежні іонні канали |потенціалзалежні ]] кальцієві канали L-типу Ca<sub>v</sub>1.4 (складені із α1F та α1D субодиниць, відповідно) та цГМФ-регульовані канали в колбочках<ref name="SchmitzWitkovsky1997">{{cite journal|author=Schmitz Y. and Witkovsky P.|title=Dependence of photoreceptor glutamate release on a dihydropyridine-sensitive calcium channel|journal=Neuroscience|volume=78|issue=4|year=1997|pages=1209–1216|issn=03064522|doi=10.1016/S0306-4522(96)00678-1}}</ref><ref name="Nachman-ClewnerSt. Jules1999">{{cite journal|author=Nachman-Clewner M., St. Jule R., and Townes-Anderson E.|title=L-type calcium channels in the photoreceptor ribbon synapse: Localization and role in plasticity|journal=The Journal of Comparative Neurology|volume=415|issue=1|year=1999|pages=1–16|issn=0021-9967|doi=10.1002/(SICI)1096-9861(19991206)415:1<1::AID-CNE1>3.0.CO;2-G}}</ref><ref name="RiekeSchwartz1994">{{cite journal|author=Rieke F. and Schwartz E.A.|title=A cGMP-gated current can control exocytosis at cone synapses|journal=Neuron|volume=13|issue=4|year=1994|pages=863–873|issn=08966273|doi=10.1016/0896-6273(94)90252-6}}</ref>. Крім того, замість {{не перекладено|синтаксин|синтаксину 1|en| syntaxin}}, що здійснює злиття везикул із цитоплазматичною мембраною, в синаптичних стрічках присутній синтаксис 3 <ref name="Morgans1996">{{cite journal| author=Morgans CW, Brandstätter JH, Kellerman J, Betz H, Wässle H| title=A SNARE complex containing syntaxin 3 is present in ribbon synapses of the retina. | journal=Journal of Neuroscience | year= 1996 | volume= 16 | issue= 21 | pages= 6713-21 | pmid=8824312 | url=http://www.jneurosci.org/content/16/21/6713.short }} </ref>. |
Фоторецепторні синапси також мають ряд молекулярних відмінностей від інших синапсів в нервовій системі. Синаптичні стрічки не містять {{не перекладено|синапсини|синапсинів|en|synapsin}}, - білків, що регулюють вивільнення нейромедіаторів в синапсах інших нейронів <ref>{{aut|Mandell JW, Townes-Anderson E, Czernik AJ, Cameron R, Greengard P, and De Camilli P.}}{{cite journal|title=Synapsins in the vertebrate retina: Absence from ribbon synapses and heterogeneous distribution among conventional synapses|journal=Neuron|volume=5|issue=1|year=1990|pages=19–33|issn=08966273|doi=10.1016/0896-6273(90)90030-J}}</ref>. На відміну від більшості нейронів, екзоцитоз та вивільнення нейромедіатора у паличках та колбочках регулюють [[Потенціалзалежні іонні канали |потенціалзалежні ]] кальцієві канали L-типу Ca<sub>v</sub>1.4 (складені із α1F та α1D субодиниць, відповідно) та цГМФ-регульовані канали в колбочках<ref name="SchmitzWitkovsky1997">{{cite journal|author=Schmitz Y. and Witkovsky P.|title=Dependence of photoreceptor glutamate release on a dihydropyridine-sensitive calcium channel|journal=Neuroscience|volume=78|issue=4|year=1997|pages=1209–1216|issn=03064522|doi=10.1016/S0306-4522(96)00678-1}}</ref><ref name="Nachman-ClewnerSt. Jules1999">{{cite journal|author=Nachman-Clewner M., St. Jule R., and Townes-Anderson E.|title=L-type calcium channels in the photoreceptor ribbon synapse: Localization and role in plasticity|journal=The Journal of Comparative Neurology|volume=415|issue=1|year=1999|pages=1–16|issn=0021-9967|doi=10.1002/(SICI)1096-9861(19991206)415:1<1::AID-CNE1>3.0.CO;2-G}}</ref><ref name="RiekeSchwartz1994">{{cite journal|author=Rieke F. and Schwartz E.A.|title=A cGMP-gated current can control exocytosis at cone synapses|journal=Neuron|volume=13|issue=4|year=1994|pages=863–873|issn=08966273|doi=10.1016/0896-6273(94)90252-6}}</ref>. Крім того, замість {{не перекладено|синтаксин|синтаксину 1|en| syntaxin}}, що здійснює злиття везикул із цитоплазматичною мембраною, в синаптичних стрічках присутній синтаксис 3 <ref name="Morgans1996">{{cite journal| author=Morgans CW, Brandstätter JH, Kellerman J, Betz H, Wässle H| title=A SNARE complex containing syntaxin 3 is present in ribbon synapses of the retina. | journal=Journal of Neuroscience | year= 1996 | volume= 16 | issue= 21 | pages= 6713-21 | pmid=8824312 | url=http://www.jneurosci.org/content/16/21/6713.short }} </ref>. |
||
====Регулювання вивільнення глутамату==== |
=====Регулювання вивільнення глутамату===== |
||
{{не перекладено|Тонічний (фізіологія)|Тонічна|en| Tonic (physiology) }} деполяризація фоторецепторів за відсутності стимулу може призводити до зниження чутливості (десенсибілізації) багатьох типів іонних каналів, викликати в мембранному потенціалі осциляції з частотою 3-4 Гц та переповнити ВС іонами кальцію <ref name="Szikra2008">{{cite book|author=Szikra T. and Krizaj D.|editor= Tombran-Tink J. & Barnstable C.J.|title=Visual Transduction And Non-Visual Light Perception|chapter= Multiple Signaling Pathways Govern Calcium Homeostasis in Photoreceptor Inner Segments|url=https://books.google.com/books?id=uyDv6XbYlVoC|date=2008-08-11|publisher=Springer |isbn=978-1-59745-374-5|pages=197–223}}</ref> . Стійке регулювання вивільнення глутамату залежно від змін мембранного потенціалу здійснюється через розміщений близько до активної зони в сферулі та ніжці потенціал-залежний кальцієвий канал L-типу ({{не перекладено| Cav1.4|Ca<sub>v</sub>1.4|en| Cav1.4}}. Через цей канал відбувається входження Ca<sup>2+</sup>, а відтак і регулювання нейромедіаторного вивільнення. На ці Ca<sup>2+</sup> L-типу канали не діє потенціал- чи С<sup>2+</sup>-залежна десенсибілізація, тому вони можуть підтримувати неперервне вивільнення глутамату за відсутності стимулу<ref name="Koschak2003">{{cite journal| author=Koschak A, Reimer D, Walter D, Hoda JC, Heinzle T, Grabner M and Striessnig J.| title=Cav1.4alpha1 subunits can form slowly inactivating dihydropyridine-sensitive L-type Ca2+ channels lacking Ca2+-dependent inactivation. | journal=Journal of Neuroscience| year= 2003 | volume= 23 | issue= 14 | pages= 6041-9 | pmid=12853422 | doi= | pmc= | url= http://www.jneurosci.org/content/23/14/6041 12853422 }} </ref><ref name="HaeseleerImanishi2004">{{cite journal|author=Haeseleer Françoise, Imanishi oshikazu , Maeda Tadao, Possin Daniel E., Maeda Akiko, Lee Amy, Rieke Fred and Palczewski Krzysztof|title=Essential role of Ca2+-binding protein 4, a Cav1.4 channel regulator, in photoreceptor synaptic function|journal=Nature Neuroscience|volume=7|issue=10|year=2004|pages=1079–1087|issn=1097-6256|doi=10.1038/nn1320}}</ref> . |
{{не перекладено|Тонічний (фізіологія)|Тонічна|en| Tonic (physiology) }} деполяризація фоторецепторів за відсутності стимулу може призводити до зниження чутливості (десенсибілізації) багатьох типів іонних каналів, викликати в мембранному потенціалі осциляції з частотою 3-4 Гц та переповнити ВС іонами кальцію <ref name="Szikra2008">{{cite book|author=Szikra T. and Krizaj D.|editor= Tombran-Tink J. & Barnstable C.J.|title=Visual Transduction And Non-Visual Light Perception|chapter= Multiple Signaling Pathways Govern Calcium Homeostasis in Photoreceptor Inner Segments|url=https://books.google.com/books?id=uyDv6XbYlVoC|date=2008-08-11|publisher=Springer |isbn=978-1-59745-374-5|pages=197–223}}</ref> . Стійке регулювання вивільнення глутамату залежно від змін мембранного потенціалу здійснюється через розміщений близько до активної зони в сферулі та ніжці потенціал-залежний кальцієвий канал L-типу ({{не перекладено| Cav1.4|Ca<sub>v</sub>1.4|en| Cav1.4}}. Через цей канал відбувається входження Ca<sup>2+</sup>, а відтак і регулювання нейромедіаторного вивільнення. На ці Ca<sup>2+</sup> L-типу канали не діє потенціал- чи С<sup>2+</sup>-залежна десенсибілізація, тому вони можуть підтримувати неперервне вивільнення глутамату за відсутності стимулу<ref name="Koschak2003">{{cite journal| author=Koschak A, Reimer D, Walter D, Hoda JC, Heinzle T, Grabner M and Striessnig J.| title=Cav1.4alpha1 subunits can form slowly inactivating dihydropyridine-sensitive L-type Ca2+ channels lacking Ca2+-dependent inactivation. | journal=Journal of Neuroscience| year= 2003 | volume= 23 | issue= 14 | pages= 6041-9 | pmid=12853422 | doi= | pmc= | url= http://www.jneurosci.org/content/23/14/6041 12853422 }} </ref><ref name="HaeseleerImanishi2004">{{cite journal|author=Haeseleer Françoise, Imanishi oshikazu , Maeda Tadao, Possin Daniel E., Maeda Akiko, Lee Amy, Rieke Fred and Palczewski Krzysztof|title=Essential role of Ca2+-binding protein 4, a Cav1.4 channel regulator, in photoreceptor synaptic function|journal=Nature Neuroscience|volume=7|issue=10|year=2004|pages=1079–1087|issn=1097-6256|doi=10.1038/nn1320}}</ref> . |
||
В сферулах паличок Ca<sub>v</sub>1.4 канали пов'язані із кальцій-зв'язуючим білком 4 ({{lang-en|CAlcium-Binding Protein 4}}; CABP4), модуляція яким зміщує потенціал-залежну чутливість Ca<sub>v</sub>1.4 каналу до більш гіперполяризованих мембранних потенціалів. Завдяки цьому Ca<sub>v</sub>1.4 канали модулюються по всьому фізіологічному діапазону потенціалу палички<ref name="MorgansBayley2005">{{cite journal|author=Morgans C.W., Bayley P. R., Oesch N. W., Ren G., Akileswaran L. and Taylor W. R.|title=Photoreceptor calcium channels: Insight from night blindness|journal=Visual Neuroscience|volume=22|issue=05|year=2005|pages=561–568|issn=0952-5238|doi=10.1017/S0952523805225038}}</ref>. |
В сферулах паличок Ca<sub>v</sub>1.4 канали пов'язані із кальцій-зв'язуючим білком 4 ({{lang-en|CAlcium-Binding Protein 4}}; CABP4), модуляція яким зміщує потенціал-залежну чутливість Ca<sub>v</sub>1.4 каналу до більш гіперполяризованих мембранних потенціалів. Завдяки цьому Ca<sub>v</sub>1.4 канали модулюються по всьому фізіологічному діапазону потенціалу палички<ref name="MorgansBayley2005">{{cite journal|author=Morgans C.W., Bayley P. R., Oesch N. W., Ren G., Akileswaran L. and Taylor W. R.|title=Photoreceptor calcium channels: Insight from night blindness|journal=Visual Neuroscience|volume=22|issue=05|year=2005|pages=561–568|issn=0952-5238|doi=10.1017/S0952523805225038}}</ref>. |
||
==Міжрецепторні електричні з’єднання== |
==Міжрецепторні електричні з’єднання== |
||
| Рядок 404: | Рядок 508: | ||
===Чутливість фоторецепторів до напрямку світла=== |
===Чутливість фоторецепторів до напрямку світла=== |
||
{{main|Ефект Стайлса-Кроуфорда}} |
|||
Зображення на сітківці формується із світла, що надходить з багатьох різних місць в зіниці. Якість цього зображення залежить як від властивостей кришталика та рогівки ока, так і від того, скільки світла, що надійде до кожного місця (точки) в зіниці буде схоплене фоторецепторами. Характерною рисою зору, відмінною від штучних світлочутливих фотоелементів, є чутливість фоторецепторів сітківки до напрямку променя світла<ref name="FeinSzuts1982">{{cite book| author= Fein Alan and Szuts Ete Zoltan |title=Photoreceptors: Their Role in Vision|url=https://books.google.com/books?id=jj45AAAAIAAJ|date=31 August 1982|publisher=CUP Archive| isbn=978-0-521-28684-8}}</ref>. |
Зображення на сітківці формується із світла, що надходить з багатьох різних місць в зіниці. Якість цього зображення залежить як від властивостей кришталика та рогівки ока, так і від того, скільки світла, що надійде до кожного місця (точки) в зіниці буде схоплене фоторецепторами. Характерною рисою зору, відмінною від штучних світлочутливих фотоелементів, є чутливість фоторецепторів сітківки до напрямку променя світла<ref name="FeinSzuts1982">{{cite book| author= Fein Alan and Szuts Ete Zoltan |title=Photoreceptors: Their Role in Vision|url=https://books.google.com/books?id=jj45AAAAIAAJ|date=31 August 1982|publisher=CUP Archive| isbn=978-0-521-28684-8}}</ref>. |
||
====Ефект Стайлса-Кроуфорда І (ЕСКІ)==== |
|||
Чутливість фоторецепторів нормального ока є найбільшою по відношенню до світла, що входить до ока біля центру зіниці і спадає майже симетрично, коли точка входу світла зміщується в напрямку до периферії зіниці. Така зміна відносної [[світлова віддача|світлової ефективності]] як функція від положення на сітківці називається «'''ефект Стайлса-Кроуфорда І порядку'''» ('''ЕСКІ'''), які вперше її виявили психофізично в 1933 р<ref name="StilesCrawford1933">{{cite journal| author= Stiles W. S. and Crawford B. H. |title=The Luminous Efficiency of Rays Entering the Eye Pupil at Different Points|journal=Proceedings of the Royal Society B: Biological Sciences|volume=112|issue=778|year=1933|pages=428–450|issn=0962-8452|doi=10.1098/rspb.1933.0020}}</ref> . |
Чутливість фоторецепторів нормального ока є найбільшою по відношенню до світла, що входить до ока біля центру зіниці і спадає майже симетрично, коли точка входу світла зміщується в напрямку до периферії зіниці. Така зміна відносної [[світлова віддача|світлової ефективності]] як функція від положення на сітківці називається «'''ефект Стайлса-Кроуфорда І порядку'''» ('''ЕСКІ'''), які вперше її виявили психофізично в 1933 р<ref name="StilesCrawford1933">{{cite journal| author= Stiles W. S. and Crawford B. H. |title=The Luminous Efficiency of Rays Entering the Eye Pupil at Different Points|journal=Proceedings of the Royal Society B: Biological Sciences|volume=112|issue=778|year=1933|pages=428–450|issn=0962-8452|doi=10.1098/rspb.1933.0020}}</ref> . |
||
Eксперимент Стайлса і Кроуфорда показав, що коли світло входить до ока в [[оптична вісь|позаосьовій]] точці зіниці, воно є менш ефективним у генеруванні зорового сприйняття внаслідок того, що він падає під косим кутом на сітківку. При денному світлі, аби генерувати те саме суб'єктивне відчуття яскравості, що й промінь, який входить через центр зіниці, то промінь, який входить через периферію зіниці, повинен мати в 5 - 10 раз більшу енергетичну світність <ref name="Goldmann1942">{{cite journal | author= Goldmann, Hans|title=Stiles-Crawford-Effekt|language=German|journal=Ophthalmologica|volume=103|issue=4|year=1942|pages=225–229|issn=1423-0267| url=http://www.karger.com/Article/PDF/300022|doi=10.1159/000300022}}</ref>. За 2-3 мм від місця пікової чутливості на сітківці, світло на половину менш ефективне у порівнянні із оптимальним положенням. |
|||
Пізніші теоретичні та експериментальні дослідження переконливо показали, що ключовою причиною ЕСКІ є не властивості оптики ока (рогівки, кришталика чи зіниці), а унікальна оптика фоторецепторів, зокрема '''[[хвилевід]]ні''' властивості колбочок, оскільки їх форма та показник заломлення надають їм чутливість до напрямку світла <ref name="Enoch1964" /> <ref name="SnyderPask1973" /><ref name="Enoch1991">{{cite book| author=Enoch, J.M., and Lakshminarayanan, V. |editor=Charman W.N. |title=Visual Optics and Instrumentation|url=https://books.google.com/books?id=nulqAAAAMAAJ|volume=Vol. 1 : Visual Optics and Instrumentation| year=1991|publisher=CRC Press|isbn=978-0-8493-7501-9|pages=280–309|chapter= Retinal Fibre Optics }}</ref>. |
|||
ЕСКІ вперше чітко показав, що сітківка є складною оптичною системою, чиї властивості відіграють ключову роль в обробці зорової інформації. Існує також '''ефект Стайлса-Кроуфорда ІІ порядку''' (ЕСКІІ), коли промені світла, рухаючись від центру, характеризуються певним кольоровим зміщенням<ref name="Westheimer2008">{{cite journal |author=Westheimer G.|title=Directional sensitivity of the retina: 75 years of Stiles-Crawford effect |journal=Proceedings of the Royal Society B: Biological Sciences|volume=275|issue=1653|year=2008|pages=2777–2786|issn=0962-8452|doi=10.1098/rspb.2008.0712}}</ref>. |
|||
Зовнішні сегменти колбочок паралельні і зорієнтовані майже перпендикулярно до зовнішньої оболонки очного яблука, будучи спрямовані до центру зіниці в нормальних очей, таким чином постійно вирівнюючись з найсвітлішою областю зіниці<ref name="LatiesEnoch1971">{{cite journal| author=Laties AM and Enoch JM| title=An analysis of retinal receptor orientation. I. Angular relationship of neighboring photoreceptors. | journal=Investigative ophthalmology | year= 1971 | volume= 10 | issue= 1 | pages= 69-77 | pmid=4992333 | url=https://www.ncbi.nlm.nih.gov/pubmed/4992333 }} </ref>. Існують чисельні свідчення того, що подібне точне вирівнювання колбочок відносно центру зіниці ока пов'язане з тим, що колбочки є [[Фототропізм|фототропіничими]] та активно орієнтуються до світла, подібно до соняшника в полі <ref name="Bonds1978">{{cite journal| author=Bonds AB and MacLeod DI| title=A displaced Stiles-Crawford effect associated with an eccentric pupil. | journal=Investigative Ophthalmology & Visual Science | year= 1978 | volume= 17 | issue= 8 | pages= 754-61 | pmid=681135 | url=https://www.ncbi.nlm.nih.gov/pubmed/681135 }} </ref><ref name="Applegate1981">{{cite journal| author=Applegate RA and Bonds AB| title=Induced movement of receptor alignment toward a new pupillary aperture. | journal= Investigative Ophthalmology & Visual Science | year= 1981 | volume= 21 | issue= 6 | pages= 869-72 | pmid=7309438 | url=https://www.ncbi.nlm.nih.gov/pubmed/7309438 }} </ref><ref name="KonoEnoch2001">{{cite journal |author=Kono M., Enoch J.M., Strada E., Shih P., Srinivasan R., Lakshminarayanan V., Susilasate W. and Graham A. |title=Stiles–Crawford effect of the first kind: assessment of photoreceptor alignments following dark patching| journal=Vision Research|volume=41|issue=1|year=2001|pages=103–118|issn=00426989|doi=10.1016/S0042-6989(00)00228-5}}</ref>. |
|||
====Фоторецепторна природа ЕСКІ==== |
|||
Вже Стайлс і Кроуфорд в їх першому дослідженні ЕСКІ висунули припущення, що виявлений ефект пов'язаний не з оптикою ока, а із сітківкою, зокрема із колбочками в центральній області очного дна. Пізніше Стайлс виявив, що пороги парафовеальних колбочок для світла, що входить до ока за 3 мм від центра зіниці є вчетверо вищими, ніж в центрі<ref name="Stiles1962">{{cite journal| author=Stiles WS| title=The directional sensitivity of the retina. Edridge-Green Lecture delivered at the Royal College of Surgeons of England on 27th March 1961 | journal= The Annals of The Royal College of Surgeons of England | year= 1962 | volume= 30 | issue= | pages= 73-101 | pmid=13917231 | pmc=2414163 | url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2414163/ }} </ref>. Втім, для більшості очей людей, оптимальне місце для сприйняття світла розміщене в назальний бік, 0,5 мм від центру зіниці, що вказує на те, що колбочки вирівняні по відношенню до центра зіниці в дещо назально-постеріорному напрямку. |
|||
Перше пряме свідчення на користь рецепторного походження ЕКСІ було отримане в оригінальному експерименті австрійсько-швейцарського офтальмолога та винахідника {{не перекладено| Ханс Гольдман|Ханса Гольдмана||| Hans Goldmann }} <ref name="Goldmann1942" /> <ref name="GoldmannWuerger1994">{{cite journal | author= Goldmann, Hans and Wuerger, Sophie )||title=Stiles-Crawford-Effect (Translation and Commentary by Sophie Wuerger)|journal=Color Research and Application| volume=19|issue=2|year=1994|pages=134-138| url=http://onlinelibrary.wiley.com/doi/10.1111/j.1520-6378.1994.tb00073.x/full|doi=10.1111/j.1520-6378.1994.tb00073.x}}</ref>. Він використав офтальмоскоп для обстеження очного дна, коли суб'єкт дивився на двостороннє [[фотометрія|фотометричне поле]]. Два пучка світла були спрямовані в центр зіниці ока. Для спрямування одного пучка на периферію зіниці, в [[Діафрагма (оптика)| діафрагму поля зору]] була поміщена призма. Після чого дослідник відрегулював інтенсивності двох пучків світла з різними кутами падіння таким чином, щоб вони здавались однаково яскравими в задній частині ока суб'єкта. Якби причиною ЕСКІ була оптика ока, то ці два промені світла також сприймались б суб'єктом, як однаково яскраві. Однак Гольдман виявив, що суб'єкт сприймав два промені не як однаково яскраві, тим самим підтвердивши фоторецепторне походження ЕСКІ. |
|||
Теоретичні та експериментальні дослідження переконливо показали, що ключовою причиною ЕСКІ є не аподизаційний фільтр в оптичному шляху чи площині зіниці, а '''[[хвилевід]]ні''' властивості колбочок, оскільки їх форма та показник заломлення надають їм чутливість до напрямку світла <ref name="Enoch1964" /> <ref name="SnyderPask1973" /><ref name="Enoch1991">{{cite book| author=Enoch, J.M., and Lakshminarayanan, V. |editor=Charman W.N. |title=Visual Optics and Instrumentation|url=https://books.google.com/books?id=nulqAAAAMAAJ|volume=Vol. 1 : Visual Optics and Instrumentation| year=1991|publisher=CRC Press|isbn=978-0-8493-7501-9|pages=280–309|chapter= Retinal Fibre Optics }}</ref>. Щільне пакування дисків в колбочках забезпечує їх вищий показник заломлення у порівнянні з оточуючим середовищем. |
|||
Теорія хвилевідності фоторецепторів також коректно передбачає, що для колбочок посередині центральної ямки та паличок неподалік від неї притаманний менший ЕСКІ, аніж для периферійних колбочок, які мають більш циліндричну форму<ref name="Westheimer1967">{{cite journal| author=Westheimer Gerald|title=Dependence of the magnitude of the Stiles-Crawford effect on retinal location|journal=The Journal of Physiology|volume=192|issue=2|year=1967|pages=309–315|issn=00223751|doi=10.1113/jphysiol.1967.sp008301}}</ref>. |
|||
====Фототропізм фоторецепторів==== |
|||
Одним з наслідків ЕСКІ є те, що якщо зіниця ока децентрована відносно осі рецептора, то світло, яке входить до ока, матиме менший візуальний вплив. Однак, для більшості людей, вісь колбочок та положення зіниці вирівняні одне відносно одного, як випливає з досліджень, які показали що пік функції ЕСКІ центрований близько до середини зіниці<ref name="Vos1960">{{cite journal |author=Vos J. J.| title=Some New Aspects of Color Stereoscopy |journal=Journal of the Optical Society of America|volume=50|issue=8|year=1960|pages=785|issn=0030-3941|doi=10.1364/JOSA.50.000785}}</ref><ref name="Dunnewold1964">{{cite book| author=Cornelis Johan Willem Dunnewold| title=On the Campbell and Stiles-Crawford effects and their clinical importance (M.D. Thesis)|url=https://books.google.com/books?id=Cg5rAAAAMAAJ|year=1964|publisher=Van Gorcum, Rijksuniversiteit Utrecht, The Nether-lands|page=84}}</ref><ref name="ApplegateLakshminarayanan1993">{{cite journal| author=Applegate R.A. and Lakshminarayanan V.| title=Parametric representation of Stiles–Crawford functions: normal variation of peak location and directionality| journal=Journal of the Optical Society of America A|volume=10|issue=7|year=1993|pages=1611|issn=1084-7529|doi=10.1364/JOSAA.10.001611}}</ref> |
|||
ЗС колбочок паралельні і зорієнтовані майже перпендикулярно до зовнішньої оболонки очного яблука, будучи спрямовані до центру зіниці в нормальних очей, таким чином постійно вирівнюючись з найсвітлішою областю зіниці<ref name="LatiesEnoch1971">{{cite journal| author=Laties AM and Enoch JM| title=An analysis of retinal receptor orientation. I. Angular relationship of neighboring photoreceptors. | journal=Investigative ophthalmology | year= 1971 | volume= 10 | issue= 1 | pages= 69-77 | pmid=4992333 | url=https://www.ncbi.nlm.nih.gov/pubmed/4992333 }} </ref>. Існують чисельні свідчення того, що подібне точне вирівнювання колбочок відносно центру зіниці ока пов'язане з тим, що колбочки є [[Фототропізм|фототропіничими]] та активно орієнтуються до світла, подібно до соняшника в полі <ref name="Bonds1978">{{cite journal| author=Bonds AB and MacLeod DI| title=A displaced Stiles-Crawford effect associated with an eccentric pupil. | journal=Investigative Ophthalmology & Visual Science | year= 1978 | volume= 17 | issue= 8 | pages= 754-61 | pmid=681135 | url=https://www.ncbi.nlm.nih.gov/pubmed/681135 }} </ref><ref name="Applegate1981">{{cite journal| author=Applegate RA and Bonds AB| title=Induced movement of receptor alignment toward a new pupillary aperture. | journal= Investigative Ophthalmology & Visual Science | year= 1981 | volume= 21 | issue= 6 | pages= 869-72 | pmid=7309438 | url=https://www.ncbi.nlm.nih.gov/pubmed/7309438 }} </ref><ref name="KonoEnoch2001">{{cite journal |author=Kono M., Enoch J.M., Strada E., Shih P., Srinivasan R., Lakshminarayanan V., Susilasate W. and Graham A. |title=Stiles–Crawford effect of the first kind: assessment of photoreceptor alignments following dark patching| journal=Vision Research|volume=41|issue=1|year=2001|pages=103–118|issn=00426989|doi=10.1016/S0042-6989(00)00228-5}}</ref>. |
|||
Хоча в деяких людей пік ЕСКІ функції є децентрованим природно <ref name="ApplegateLakshminarayanan1993">{{cite journal| author=Applegate R.A. and Lakshminarayanan V.| title=Parametric representation of Stiles–Crawford functions: normal variation of peak location and directionality| journal=Journal of the Optical Society of America A|volume=10|issue=7|year=1993|pages=1611|issn=1084-7529|doi=10.1364/JOSAA.10.001611}}</ref>, в більшості ЕСКІ вирівняний по відношенню до центру зіниці. Однак у випадках, коли зіниці децентровані, колбочки активно переорієнтовуються таким чином, щоб спрямовуватись до нового центру зіниці й продовжувати схоплювати більше світла. В експерименті, де суб'єкти носили контактні лінзи в яких штучна апертура на кілька міліметрів була децентрована відносно їх природних зіниць, протягом 5 днів відбувалось невелике зміщення (на ~1 мм) піку ЕСКІ функції для компенсації цієї децентрації<ref name="EnochBirch1981">{{cite journal| author=Enoch J. M. and Birch D. G.| title=Inferred Positive Phototropic Activity in Human Photoreceptors| journal=Philosophical Transactions of the Royal Society B: Biological Sciences|volume=291|issue=1051|year=1981|pages=323–351|issn=0962-8436|doi=10.1098/rstb.1981.0002}}</ref>. Після зняття таких лінз, пік ЕСКІ повертався до нормального положення, також протягом 5 днів<ref name="Applegate1981">{{cite journal| author=Applegate RA and Bonds AB| title=Induced movement of receptor alignment toward a new pupillary aperture. | journal= Investigative Ophthalmology & Visual Science | year= 1981 | volume= 21 | issue= 6 | pages= 869-72 | pmid=7309438 | url=https://www.ncbi.nlm.nih.gov/pubmed/7309438 }} </ref>. |
|||
Одним з найбільш переконливих свідчень фототропічної природи колбочок є випадок активного вирівнювання протягом 10 днів піку ЕСКІ функції в бік центру зіниці в дорослого пацієнта після того, як у нього була видалена подвійна вроджена [[катаракта]]. Катаракта затемняла всю зіницю пацієнта, крім її [[Скронева кістка |скроневого]] краю, до якого, як найбільш освітленого, були зорієнтовані колбочки його сітківки до операції з видалення <ref name="SmallmanMacLeod2001">{{cite journal| author=Smallman Harvey S., MacLeod Donald I. A. and Doyle Peter|journal=Nature|volume=412|issue=6847|year=2001|pages=604–605|issn=00280836|doi=10.1038/35088126}}</ref>. |
|||
Ці дослідження підтверджують динамічну природу колбочок і їх здатність активно орієнтуватись до світла для максимізації власної ефективності у схопленні фотонів. |
|||
Механізм фототропізму колбочок наразі незрозумілий. На відміну від [[Костисті риби|костистих риб]], чиї фоторецептори мають молекулярні механізми необхідні для їх руху<ref name="BurnsideNagle1983">{{cite journal |author=Burnside B. and Nagle B.| title= Retinomotor movements of photoreceptors and retinal pigment epithelium: Mechanisms and regulation| journal=Progress in Retinal Research|volume=2|year=1983|pages=67–109|issn=02784327|doi=10.1016/0278-4327(83)90004-4}}</ref>, у ссавців таких механізмів наразі не виявлено<ref name="Burnside2001">{{cite book| author=Burnside B.| editor=Dowling J. E. |title=Concepts and Challenges in Retinal Biology|url=https://books.google.com/books?id=7RAlA4Q9aSQC&pg=PA477|date=January 2001|publisher=Taylor & Francis|isbn=978-0-444-51484-4|pages=477–485|chapter=Light and circadian regulation of retinomotor movement}}</ref>. З іншого боку, не виключена можливість того, що причина фототропічної поведінки фоторецепторів знаходиться не в них самих, а в пігментному епітелії сітківки, який містить молекулярні складові, необхідні для поглинання світла та рухливості<ref name="Coudrier2007">{{cite journal| author=Coudrier E.| title=Myosins in melanocytes: to move or not to move?|journal=Pigment Cell Research|volume=20|issue=3|year=2007|pages=153–160|issn=0893-5785|doi=10.1111/j.1600-0749.2007.00376.x}}</ref>. |
|||
====Значення ЕСКІ для зору==== |
|||
ЕСКІ має кілька важливих наслідків для якості оптичного зображення та чутливості до світла. Одним з наслідків ЕСКІ є зменшення кількості фотонів, які надійдуть до фотопігментів колбочки. |
|||
Іншим наслідком ЕСКІ є покращення якості зображення для зіниць, що мають великі розміри. Оскільки поблизу межі зіниці світло [[загасання|загасає]], ЕСКІ є еквівалентним до зменшення діаметра зіниці. Такий ефект затінення зіниці для різного загасання світла вздовж зіниці називається {{не перекладено |аподизація|аподизацією||| Apodization}} Стайлса-Кроуфорда<ref name="Metcalf1965">{{cite journal|author=Metcalf Harold| title=Stiles–Crawford Apodization| journal=Journal of the Optical Society of America|volume=55|issue=1|year=1965|pages=72|issn=0030-3941|doi=10.1364/JOSA.55.000072}}</ref>. Оскільки якість зображення є оптимальною для зіниць з діаметром від 2 до 3 мм<ref name="CampbellGubisch1966">{{cite journal| author=Campbell F. W. and Gubisch R. W.| title=Optical quality of the human eye| journal=The Journal of Physiology|volume=186|issue=3|year=1966|pages=558–578|issn=00223751|doi=10.1113/jphysiol.1966.sp008056}}</ref>, то для більших зіниць зменшення ефективного розміру зіниці призведе до покращення якості зображення. |
|||
Крім того, вибірковість колбочок до напрямку сприяє покращенню оптичної ефективності ока. Поєднання фоторецепторної чутливості до напрямку з їх орієнтацією до центру зіниці звужує схоплення світла до тих фотонів, що надходять до ока поблизу [[Оптична вісь|оптичної осі]], тим самим усуваючи периферійні промені світла з більш високою [[Аберація оптичних систем|аберацією]] <ref name="Packer2003">{{cite book|author=Packer O and Williams DR|editor=Shevell S.K. |title=The Science of Color|url=https://books.google.com/books?id=-fNJZ0xmTFIC|edition=2|date=11 July 2003|publisher=Elsevier|isbn=978-0-08-052322-4|pages=41–102|chapter=Chapter 2. Light, the Retinal Image, and Photoreceptors}}</ref>. Розсіяне світло вдаряє у сітківку випадково під будь-яким кутом і саме таке світло, через його кути падіння, має менший вплив на колбочки, аніж промені світла, що надходять до них під прямим кутом. |
|||
Однак в серії теоретичних та експериментальних досліджень Девід А. Етчісон ({{lang-en|David A. Atchison}}) з колегами показали, що для добре сфокусованих очей напрямкова чутливість фоторецепторів надає просторовому зору лише незначне покращення <ref name="AtchisonJoblin1998">{{cite journal|author=Atchison David A., Joblin Anthony and Smith George|title=Influence of Stiles–Crawford effect apodization on spatial visual performance|journal=Journal of the Optical Society of America A|volume=15|issue=9|year=1998|pages=2545|issn=1084-7529|doi=10.1364/JOSAA.15.002545}}</ref><ref name="AtchisonScott2002">{{cite journal|author=Atchison David A. and Scott Dion H.|title=The Stiles–Crawford effect and subjective measurement of aberrations|journal=Vision Research|volume=42|issue=9|year=2002|pages=1089–1102|issn=00426989|doi=10.1016/S0042-6989(02)00028-7}}</ref><ref name="Atchison2002">{{cite journal|author=Atchison David A and Scott Dion H|title=Contrast sensitivity and the Stiles–Crawford effect|journal=Vision Research|volume=42|issue=12|year=2002|pages=1559–1569|issn=00426989|doi=10.1016/S0042-6989(02)00084-6}}</ref>. І хоча ЕСКІ обумовлений сітківкою, його вплив на якість зображення в будь-якій даній точці на сітківці пов'язаний із зменшенням розміру зіниці внаслідок меншої ефективності світла, що проникає на периферії зіниці. Крім того, колбочки по середині центральної ямки, які у випадку ЕСКІ мали б отримати найбільшу перевагу з покращенням оптичної якості зображення на сітківці, проявляють слабку чутливість до напрямку <ref name="Atchison2000">{{cite book|author=Atchison David A. and Smith George|title= Optics of the Human Eye |url=http://www.sciencedirect.com/science/book/9780750637756|date=29th February 2000 |publisher=Butterworth-Heinemann |isbn=978-0-7506-3775-6|page=288}}</ref>. Проте Етчісон та ін. в їх поясненні незначущості ЕСКІ для просторового зору не врахували шкідливий вплив світла, яке проходить через [[Білкова оболонка ока |склеру]] та {{не перекладено |очне дно|||Fundus (eye)}}, і ними розсіюється. Таке розсіяне світло однорідно покриває сітківку, зменшуючи контраст зображення на сітківці. Відтак, ЕСКІ може відігравати ключову роль у запобіганні поглинання цього світла фоторецепторами<ref name="Packer2003">{{cite book|author=Packer O and Williams DR|editor=Shevell S.K. |title=The Science of Color|url=https://books.google.com/books?id=-fNJZ0xmTFIC|edition=2|date=11 July 2003|publisher=Elsevier|isbn=978-0-08-052322-4|pages=41–102|chapter=Chapter 2. Light, the Retinal Image, and Photoreceptors}}</ref>. |
|||
Інші дослідження показали,що ЕСКІ має більші переваги для кращої якості зображення на сітківці, коли таке зображення розфокусоване внаслідок затримки [[акомодація ока|акомодації]] та ін. аберацій <ref name="Legge1987">{{cite journal |author=Legge Gordon E., Mullen Kathy T. , Woo George C. and Campbell F. W.| title=Tolerance to visual defocus| journal=Journal of the Optical Society of America A|volume=4|issue=5|year=1987|pages=851|issn=1084-7529|doi=10.1364/JOSAA.4.000851}}</ref> <ref name="ZhangYe1999">{{cite journal| author=Zhang Xiaoxiao, Ye Ming, Bradley Arthur and Thibos Larry| title=Apodization by the Stiles–Crawford effect moderates the visual impact of retinal image defocus| journal=Journal of the Optical Society of America A|volume=16|issue=4|year=1999|pages=812|issn=1084-7529|doi=10.1364/JOSAA.16.000812}}</ref>. Також одним з пояснень фоторецепторної вибірковості до напрямку світла може бути те, що вона постає як результат обмеження фотопігмента в ЗС малих діаметрів. Побудова та утримання малих ЗС потребує менших метаболічних затрат, тому в таких ЗС хвилевідні властивості фоторецепторыв уможливлюють однакову частоту схоплення фотонів фотопігментами. <ref name="Packer2003">{{cite book|author=Packer O and Williams DR|editor=Shevell S.K. |title=The Science of Color|url=https://books.google.com/books?id=-fNJZ0xmTFIC|edition=2|date=11 July 2003|publisher=Elsevier|isbn=978-0-08-052322-4|pages=41–102|chapter=Chapter 2. Light, the Retinal Image, and Photoreceptors}}</ref>. |
|||
===Фоторецептор, як хвилевід=== |
===Фоторецептор, як хвилевід=== |
||
| Рядок 492: | Рядок 563: | ||
==Мозаїка фоторецепторів== |
==Мозаїка фоторецепторів== |
||
==Дискретизація зображення фоторецепторами== |
|||
Оброблення зорової інформації розпочинається вже на рівні оптики ока, яка складається із трьох головних компонент: рогівки, зіниці та кришталика. Ці оптичні компоненти формують чітке зображення на рівні фоторецепторів, які дискретизують неперервне зображення на сітківці і перекодовують його в електричні сигнали. |
Оброблення зорової інформації розпочинається вже на рівні оптики ока, яка складається із трьох головних компонент: рогівки, зіниці та кришталика. Ці оптичні компоненти формують чітке зображення на рівні фоторецепторів, які дискретизують неперервне зображення на сітківці і перекодовують його в електричні сигнали. |
||
| Рядок 539: | Рядок 610: | ||
Найбільш переконливо на користь того, що межа Найквіста не є нездоланною для ока, свідчить оригінальний експеримент, в якому спостерігачам показувались високочастотні синусоїдальні ґратки, використовуючи [[лазер]]ну [[Інтерферометрія| інтерферометрію]] щоб уникнути зменшення контрастності, що має місце коли стимул проходить через оптику ока<ref name="WilliamsColetta1987">{{cite journal| author=Williams David R. and Coletta Nancy J.| title=Cone spacing and the visual resolution limit| journal=Journal of the Optical Society of America A|volume=4|issue=8|year=1987|pages=1514|issn=1084-7529|doi=10.1364/JOSAA.4.001514}}</ref>. Було виявлено, що спостерігачі могли надійно розрізнити ґратки з частотою до 150 циклів/градус, що в 2,5 перевершує межу Найквіста в позафовеальній сітківці<ref name="Williams1985">{{cite journal|author=Williams D.R.|title=Aliasing in human foveal vision|journal=Vision Research|volume=25|issue=2|year=1985|pages=195–205|issn=00426989|doi=10.1016/0042-6989(85)90113-0}}</ref>. І хоча дискримінація просторових частот стає надзвичайно поганою для частот, що перевершують межу Найквіста, в цих просторових частотах зберігається незначна інформація про орієнтацію ґраток <ref name="ChalupaWerner2004" />. |
Найбільш переконливо на користь того, що межа Найквіста не є нездоланною для ока, свідчить оригінальний експеримент, в якому спостерігачам показувались високочастотні синусоїдальні ґратки, використовуючи [[лазер]]ну [[Інтерферометрія| інтерферометрію]] щоб уникнути зменшення контрастності, що має місце коли стимул проходить через оптику ока<ref name="WilliamsColetta1987">{{cite journal| author=Williams David R. and Coletta Nancy J.| title=Cone spacing and the visual resolution limit| journal=Journal of the Optical Society of America A|volume=4|issue=8|year=1987|pages=1514|issn=1084-7529|doi=10.1364/JOSAA.4.001514}}</ref>. Було виявлено, що спостерігачі могли надійно розрізнити ґратки з частотою до 150 циклів/градус, що в 2,5 перевершує межу Найквіста в позафовеальній сітківці<ref name="Williams1985">{{cite journal|author=Williams D.R.|title=Aliasing in human foveal vision|journal=Vision Research|volume=25|issue=2|year=1985|pages=195–205|issn=00426989|doi=10.1016/0042-6989(85)90113-0}}</ref>. І хоча дискримінація просторових частот стає надзвичайно поганою для частот, що перевершують межу Найквіста, в цих просторових частотах зберігається незначна інформація про орієнтацію ґраток <ref name="ChalupaWerner2004" />. |
||
==Фототрансдуція== |
|||
==Реакція фоторецепторів на світло== |
|||
===Фоторецепторний струм=== |
|||
===Фоторецепторний шум=== |
|||
== Джерела == |
== Джерела == |
||
Версія за 01:18, 8 травня 2017

Фоторецептори — безспайкові світлочутливі сенсорні нейрони сітківки ока, які містяться у зовнішньому ядерному шарі сітківки.
Фоторецепторний шар сітківки утворює двовимірну мозаїку, що перетворює безперервне зображення тривимірного світу, сформоване кришталиком та рогівкою ока, в масив дискретних сигналів, які потім обробляються нижчестоячими нейронами сітківки і через оптичний нерв передаються до мозку, до вищої зорової системи.
Після проходження світла через оптику ока і формування зображення на сітківці, фоторецептори перетворюють його в нейронний сигнал. Унікальна морфологія фоторецепторів наділяє їх рисами, подібними до оптичних хвилеводів.
Фоторецептори відповідають гіперполяризацією (а не деполяризацією як інші нейрони) у відповідь на адекватний цим рецепторам сигнал — світло[1].
Сітківка хребетних містить два класи фоторецепторів — палички та колбочки, що мають чотири характерні лише для фоторецепторів структурно-функціональні складові: зовнішній сегмент, внутрішній сегмент, з'єднувальна війка та унікальні в усій нервовій системі синаптичні закінчення, які неперервно вивільняють нейромедіатор за відсутності стимулу. Колбочки і палички різняться між собою морфологією, чутливістю та реакцією на світло, структурою фоточутливих пігментів і діапазоном покриття інтенсивностей світла.
Палички, яких в сітківці людини лише один тип, відповідають за зір при тьмяному і нічному освітлені (скотопічний зір) і дозволяють зоровій системі досягнути меж, накладених поглинанням одиничних фотонів. Коли палички повністю адаптовані до темряви, то можуть реагувати на одиничні фотони[2][3].
Колбочки менш чутливі до світла, але забезпечують гостроту зору. Сітківка більшості ссавців має два типи колбочок, а людини і деяких мавпових три типи, які є максимально чутливими до трьох кольорів (червоного, зеленого та синього). Поєднання відносних інтенсивностей цих трьох основних кольорів дозволяє людському зору визначити колір будь-якого об’єкту. Відтак, колбочки відповідальні за денний (фототопічний) зір.
Колбочки у центральній ямці сітківці примат формують регулярну трикутну мозаїку[4] [5][6], тоді як поза центральною ямкою мозаїка колбочок втрачає регулярність, яка швидко спадає із ексцентриситетом[7][8].
Потреба підтримувати градієнт концентрації іонів у фоторецепторах і їх тонічна деполяризація за відсутності світла робить сітківку однією з найбільш метаболічно активних з усіх тканин тіла [9]. Тому перетворення фоторецепторами світла в електричні сигнали (фототрансдукція) є одним з найбільш енергозатратних процесів організму тварин[10]. [10].
Фоторецептори формують та передають всю просторово-часову інформацію, що доступна вищим рівням зорової системи. Розмір, щільність розташування, спектральна чутливість та електричні реакції фоторецепторів накладають нездоланні обмеження на часову, просторову та хроматичну інформацію, яку ЦНС може вилучити із зображення на сітківці[11]
Фоторецепторний шар сітківки

Сітківка — це шар тканини ока, що трансформує світло у зорові сигнали, які передають інформацію про видимий зовнішній світ до мозку. Трансформація світла в електричні сигнали починається на рівні двох класів фоторецепторів сітківки — паличок та колбочок.[12].
Сітківка хребетних знаходиться попереду пігментного епітелію, клітини якого заповнені темним пігментом меланіном, що поглинає все те світло, яке не схоплюється сітківкою. Це унеможливлює відбиття світла назад у сітківку і погіршення зорового зображення[13].
Фоторецептори знаходяться на задній стінці ока, одразу перед пігментним епітелієм, тому всі інші нейрони сітківки розміщені перед фоторецепторами, ближче до кришталика ока. Така перевернута будова сітківки призводить до того, що світло повинно пройти через всі шари її нейронів, перш ніж потрапить до фоторецепторів. Щоб світло дійшло до фоторецепторів без поглинання та значного розсіяння, нейронні аксони в ближчих шарах сітківки позбавлені мієлінової оболонки, забезпечуючи відносну прозорість цих шарів[14][15].
Палички і колбочки щільно розміщені в сітківці, займаючи ~90 % двовимірного фоторецепторного шару, інші 10 % — це позаклітинний простір[16]. У сітківках тварин, що ведуть денний і нічний спосіб життя (напр., людина, макака, кішка, кролик), близько 5 % всіх рецепторів становлять колбочки, всі інші — палички. Оскільки потік фотонів при денному світлі є значно більшим, ніж вночі, то вдень сітківка може спиратись на меншу кількість фоторецепторів, які ефективно схоплюють надлишкову кількість фотонів, тоді як в темряві важливий кожен фотон, що потребує більшої кількості паличок[17].
Близько 90% світла, яке надходить до ока, не схоплюється фоторецепторами, а поглинається нижчестоячими нейронами сітківки та пов'язаними з ними кровоносними судинами; чи просто входить до фоторецептора і виходить з іншого боку, не будучи ним поглинутим. Інші 10% падаючого світла буде поглинута будь-якою молекулою фотопігменту («зоровий пігмент»), що знаходиться в зовнішньому сегменті і визначає чутливість фотороцепетора до світла [18]. Імовірність, що фотон буде поглинутий даним фоторецептором залежить як від енергії фотону (довжини хвилі світла), так і від типу фоторецептору. Щойно фотон поглинається зоровим пігментом, той хімічно змінюється і запускає ланцюг подій (фототрансдукцію), результатом чого є сигналізування нижчестоячим нейронам схоплення фотону.
Фоторецептори в центральній ямці
Протягом еволюції ока відбулась характерна спеціалізація сітківки — істотне зміщення щільності фоторецепторів та нейронів. Тоді як в ссавців нижчого порядку, напр., щурів та мишей, щільність клітин в сітківці є рівномірною, то в центрі сітківки ссавців вищого порядку, як котів та примат, з'явилось невелике поглиблення — т. зв. центральна ямка (fovea centralis, ~1 мм в діаметрі, покриває близько 3 градусів зорового поля) — де нейрони зміщені в бік, дозволяючи фоторецепторам в цій ділянці отримувати найменш викривлене зорове зображення[19]. Таке зміщення є найбільш явним в середині центральної ямки, фовеолі[en] (~300 мкм в діаметрі). В фовеолі відсутні палички і є найбільша концентрація колбочок, які уможливлюють найкращу гостроту та високу роздільну здатність зору[20]. Замість збільшення фоторецепторів та інших нейронів в усій сітківці для забезпечення вищої гостроти зору, що б також потребувало істотного збільшення розмірів ока, подібна спеціалізація обмежена невеликою ділянкою ока. Щоб фіксувати погляд на речах і могти розгледіти їх більш детально, очі повинні постійно рухатись, уможливлюючи проекцію зорового зображення на центральну ямку. Тому протягом споглядання, людина робить чисельні рухи очей, близько 3 рухів/сек[21].

Центральна ямка в очах людини є неглибокою і має ~570 мкм в діаметрі, містячи до 200 тис. довгохвильових та середньохвильових колбочок / мм2, середня відстань (від центру до центру) між якими становить від 2 до 2,5 мкм[22], тобто, ~120 колбочок / градус зорового кута[en] , що достатньо для формування нейронного зображення найдетальніших ґраток, з 60 циклами/градус зорового кута — межа роздільної здатності зору людини[23][24]). (Для порівняння, щільність колбочок в центральній ямці сітківки орла клинохвостого становить ~1 млн колбочок/ мм2, що відповідає вдвічі більшій гостроті зору (143 цикли/градус), ніж у людини, досягаючи біофізичної межі можливої щільності колбочок, оскільки ще більша щільність колбочок потребуватиме тонших внутрішніх сегментів, чий хвилевідний механізм не зможе запобігти розсіянню фотонів на сусідні колбочки[25][26].)
З ексцентриситетом в 5 градусів від центральної ямки сітківки людини, щільність колбочок спадає в 10 разів (до 20 тис. колбочок/мм2), а з ексцентриситетом в 10 градусів спадає на половину (10 тис. колбочок/ мм2)[27][28]. Із збільшенням ексцентриситета від центру сітківки також збільшується і діаметр колбочок: від 1 до 2 мкм в діаметрі у центральній ямці і від 4 до 10 мкм в діаметрі із ексцентриситетом в 10 градусів, після чого їх діаметр залишається відносно сталим[29][16] . Тварини, які мають менш гострий денний зір, ніж людина, але кращий зір вночі, мають зменшену щільність колбочок в центральній ямці задля збільшення кількості паличок в сітківці. Так, щільність колбочок в центральній ямці кішки майже в десятеро менша (30 тис. / мм2) ніж в людини, завдяки чому у них збільшується щільність паличок до 200 тис. / мм2[30].

На відміну від колбочок, палички відсутні в фовеолі, однак їх щільність швидко зростає із ексцентриситетом, досягаючи максимальної щільності за 3 мм (20 градусів) від центральної ямки (160 тис. паличок/ мм2). Звідси концентрація паличок спадає більш поступово, досягаючи 35 тис./ мм2 на периферії сітківки[29]. Також, на відміну від колбочок, діаметр паличок швидко не зростає із збільшенням їх щільності, залишаючись відносно сталим (~1,5 мкм) одразу з їх появою поза фовеолою і збільшуючись на периферії сітківки (4 мкм)[16] .
Сітківка також містить ділянку, відому як оптичний диск — місце, де зоровий нерв відходить із сітківки до мозку. В цій ділянці не знаходиться жодного фотороцептору, тому вона постає як сліпа пляма в зоровому полі[13]. Зоровий нерв містить 106нервових волокон (утворюються аксонами гангліозних клітин), що з урахуванням кількості колбочок і паличок в сітківці (6,5×106 та 120×106, відповідно) вказує на високий коефіцієнт конвергенції із фоторецепторів до гангліозних клітин, порядку 120/1[14].
Фоторецептори сітківки організовані мозаїчно в один шар, що формує синаптичні зв'язки з нижчестоячими нейронами — горизонтальними та біполярними нейронами в зовнішньому сітчастому шарі[12].
Теорія подвійності зору
Відкриття фоторецепторів

1722 р., вивчаючи сітківку людини, Антоні ван Левенгук скоріш за все був одним з перших, хто через мікроскоп побачив фото-рецептори, хоча він не розумів їх функціональної ролі[31]. Тільки через століття фоторецептори в зовнішній сітківці були виявлені, виокремлені та описані. В 1830-х рр. німецький лікар та природознавець Готфрід Тревіранус [en] виявив фоторецептори,[32][33], вивчаючи під мікроскопом сітківки риб, земноводних, ссавців та птахів[34]. Хоча він і пов'язав функцію виявлених ним паличок (які він назвав «пухирцями») із сприйняттям світла[35], Тревіранус вважав, що фоторецептори спрямовані до склоподібної камери ока, а не від неї, і оптичний нерв (чиї закінчення він, продовжуючи декартівську традицію, вважав рецепторними елементами) на його думку повинен був відходити позаду рецепторів[36].
Як відзначали пізніше інші дослідники сітківки, "хоча дослідження (анатомії сітківки) Тревірануса були хибними майже у всьому, вони були корисними, оскільки стимулювали одразу серію нових досліджень "[37]. Вперше на те, що фоторецептори перевернуті, вказав анатом та фізіолог Фрідріх Біддер[en] (1839), який виявив, що закінчення паличок витягнуті до хоріоідеї ока[38][32]. Однак і Біддер, подібно до Тревірануса, не міг зрозуміти, яким чином перевернуті фоторецептори можуть реагувати на світло, тому зводив їх функцію лише до віддзеркалення світла через волокна оптичного нерву[32].
Німецький анатом та фізіолог Генріх Мюллер[en] в 50-х рр. ХІХ ст. описав перевернуту природу фоторецепторів і, паралельно з швейцарським фізіологом Альбертом фон Кьоллікером[en][39], та вперше вказав два окремі їх типи (палички і колбочки)[40][41]. Вказавши, що палички на відміну від колбочок мають багрянистий колір, Мюллер однак ще не зміг визначити, що ці фоторецептори мають різні зорові функції[32].
Теорія подвійності Шульце
Першим хто однозначно вказав на функціональну відмінність між паличками та колбочками, був відомий німецький анатом Макс Шульце[en][42][32], який у серії статей 1866—1867 рр. показав подвійність сітківки хребетних і заклав основи теорії подвійності зору[43][44][45].
Для розрізнення паличок від колбочок, Шульце спирався на їх морфологію, що стало врешті класичним критерієм для виділен-ня типів фоторецепторів. Він помітив, що фоторецептор не є однорідним, але поділений на сегменти — зовнішній та внутрішній. Відповідно до морфології зовнішніх сегментів фоторецепторів, Шульце їх назвав Stäbchen (паличками) та Zapfen (колбочками.) У паличках Шульце виділив довгі, циліндричні зовнішні сегменти; тонкі та видовжені внутрішні сегменти, тоді як в колбочок — короткі, конусоподібні зовнішні сегменти та більш ширші і сплющені внутрішні сегменти. Крім того, наявність чи відсутність у внутрішньому сегменті фоторецепторів спеціалізованих структур, — «олійних краплин»[en], що притаманні сітківкам птахів та деяких плазунів, — слугувало основою для відокремлення колбочок (які їх мають), від паличок (які позбавлені таких вкраплень)[42].
Чітко виділивши внутрішні та зовнішні сегменти фоторецепторів і їх відмінність між паличками та колбочками, Шульце встановив відмінну роль, яку вони відіграють у процесі зору. Паличкам він відвів роль у безколірному нічному зорі, тоді як колбочки вважав відповідальними за кольоровий денний зір . Порівняно з більш розвиненими колбочками, палички Шульце вважав більш примітивним органом зору. Він встановив, що найбільша концентрація колбочок знаходиться в центрі сітківки (центральна ямка) людини, тоді як палички переважають на її периферії. Порівнявши свої гістологічні дані із поведінковими відкриттями фізіолога Германа Обера [en][46]про те, що із збільшенням відстані від центральної ямки, розрізнення кольорів та гострота зору спадають, Шульце прийшов до висновку, що тільки колбочки відповідальні за кольоровий та просторовий зір з високою роздільною здатністю[33].
Порівняльні дослідження Шульцем сітківок тварин, які вели нічний чи денний спосіб життя, підтвердили його припущення про функціональну відмінність двох типів фоторецепторів. Вивчаючи сітківки нічних тварин (сов, кажанів, кротів, їжаків), Шульце виявив, що вони мають мало чи взагалі не мають колбочок[42]. Так само він виявив лише невелику кількість паличок у тварин, найбільш активних лише протягом дня (ящірки, змії, хамелеони, деякі види птахів)[47]. Оскільки людський зір не розрізняє кольори вночі, Шульце прийшов до загального висновку, що палички відповідальні за безкольорове сприйняття при тьмяному світлі, заклавши основи «Duplizitätstheorie» («теорії подвійності») зору, термін який в 90-х рр. ХІХ ст. ввів німецький фізіолог та психолог Йоганн фон Кріс[en][32].
Не зважаючи на свою новизну та обґрунтованість солідними порівняльними дослідженнями, ідеї Шульце щодо подвійної природи сітківки не отримали одразу належного визнання серед тогочасних фізіологів, а видатний німецький фізіолог Герман фон Гельмгольц навіть не згадав їх у другому виданні свого славнозвісного «Керівництва з фізіологічної оптики» (1896)[33]. Пізніше французький офтальмолог Анрі Паріно[en] незалежно від Шульце, прийшов до висновку про існування двох класів фоторецепторів. Він виявив, що така хвороба очей, яка нікталопія (нездатність бачити при тьмяному світлі чи вночі) не призводила до втрати чутливості колбочок в центральній ямці сітківки і встановив, що вона була пов'язана з паличками: пошкодження пігментного епітелію призводило до нічної сліпоти, а оскільки, як було встановлено не задовго перед цим, пігментний епітелій потрібен для регенерації родопсину, який міститься тільки в паличках, то нічний зір спирається на палички[48]. На основі цих відкриттів, Паріно висунув ідею «deux retines» (двох сітківок), і припустив як і Шульце, що палички та колбочки виконують різні функції і саме завдяки цьому є можливим денний та нічний зір[49]. Однак подібно до ідей Шульце, ідеї Паріно не привернули уваги колег[33].
Тільки завдяки німецькому фізіологу Йоганну Крісу, який включив ідеї Мюллера, Шульце та Паріно до власної теорії подвійності (1896)[50] та присвятив їм окремий розділ в реда-гованому ним третьому виданні «Керівництва з фізіологічної оптики» (1909) Гельмгольца[51], теорія по-двійності зору отримала широке визнання та підтримку серед науковців[33].
Існування двох відмінних систем фотосприйняття у відповідності з теорією подвійності було також підтверджене психофізично. 1933 р. Стайлс і Кроуфорд виявили парадоксальний феномен: для денного зору, світло, яке проходить через периферію сітківки є менш ефективним, ніж світло, яке проходить через її центр (т. зв. «Ефект Стайлса-Кроуфорда», див. нижче)[52]. Цей ефект пов'язаний з колбочками, які більш чутливі до світла, що надходить до них вздовж їх осі, аніж під похилим кутом. Однак така чутливість до напрямку світла не проявлялась в нічному зору і не виявлялась для паличок[53].
1937 р. відомий американський фізіолог Селіг Хегт[en] опублікував ґрунтовний огляд всіх наявних на той час свідчень, які вказували на те, що майже всі вимірювання зорової активності можна розділити на дві частини — 1) рівень низького освітлення, за який відповідають палички і пов'язаний з нічним зором 2) рівень високого освітлення, що спирається на колбочки і пов'язаний з денним зором[54]. . На основі аналізу накопичених з часів Мюллера і Шульца даних, Хегт прийшов до висновку, що теорія подвійності зору адекватно описує зір і його фоторецепторну природу і повинна слугувати основою для подальших досліджень фоторецепторів.
Теорія трансмутації фоторецепторів
Розрізнення між паличками та колбочками довгий час ґрунтувалось виключно на їх морфології. Хоча таке розрізнення є однозначним для багатьох примітивних та древніх груп хребетних, воно неоднозначне для багатьох груп тварин, що еволюціонували відносно нещодавно і які трансформували свої фоторецептори під час зміни активності в середовищі один раз (напр. геконоподібні) або навіть двічі (деякі змії). Для врахування цих складностей класифікації фоторецепторів, американський фізіолог Гордон Волльс[en] запропонував «теорію перетворення (трансмутації)» (1934 р.), відповідно до якої в процесі еволюції тварини трансформували свої фоторецептори для адаптації до нових умов середовища[55].
Волльс припустив, що палички і колбочки не є відокремленими та незмінними типами рецепторів, але могли еволюціонувати, трансформуючись одне в одне через серію морфологічно різних проміжних ланок. Він вважав, що палички могли заново еволюціонувати із колбочок в тих тварин, що втратили колбочки, і навпаки — палички із колбочок[55].

Волльс сформулював та розвивав свою теорію вивчаючи морфологію фоторецепторів сітківок представників роду лускатих, зокрема нічних і денних геконоподібних та змій. Він виявив, що сітківки деяких з цих видів мали лише колбочки або лише палички, або ж проміжні фоторецептори (суміш властивостей паличок і колбочок), хоча їх еволюційні пращури мали протилежні сітківки — відповідно, виключно з паличками, або ж виключно з колбочками. Крім того Волльс дослідив, що а) на відміну від денних тварин, фоторецептори в нічних тварин втратили забарвлені олійні краплини чи взагалі не мали таких вкраплень, б) фоторецептори нічних тварин мали більш видовжену форму, із надзвичайно довгими зовнішніми сегментами[55]. Всі ці свідчення трансмутації фоторецепторів різних видів лускатих Волльс виклав у своїй фундаментальній праці «Очі хребетних та їх адаптивна радіація» (1942 р.)[56].
Не зважаючи на всю радикальність теорії Волльса, вона не суперечила головному аспекту теорії подвійності зору — функціональній відмінності між нічним та денним зором, що спирався на палички та колбочки. Однак теорія трансмутації дозволила по-іншому підійти до вивчення фоторецепторів, їх еволюції та адаптації до середовища і відмовитись від їх трактування, як фіксованих та відокремлених класів фотосприйняття. Теорію Волльса пізніше підтримав і розвинув відомий британський герпетолог Гарт Л. Андервуд (Garth L. Underwood, 1919—2002)[57][58][59][60].
Хоча Волльс вивчав тільки морфологічні аспекти трансмутації, він вважав ключовою відмінністю між нічними та денними фоторецепторами наявність паличкового зорового пігменту (родопсину, RH1) в адаптованих до темряви паличках та його відсутність в колбочках. Не знайшовши паличкового родопсину в сітківках різних представників нічних та денних полозових змій, Волльс припустив, що нічні полозові із винятково паличковими сітківками еволюціонували від денних полозових із винятково колбочковими сітківками[55]. Однак він не мав достатніх даних для підтвердження цієї теорії трансмутації, оскільки в його час не було засобів, потрібних для ідентифікації зорових пігментів, що є молекулярними ознаками різних типів фоторецепторів[61].
За винятком робіт Волльса та Андервуда, не зважаючи на прогрес молекулярної біології, теорія трансмутації не отримала належної уваги дослідників, які вивчали головним чином молекулярні складові фоторецепторів птахів, риб та ссавців. Винятком було дослідження фоторецепторів геконів, в яких було виявлено пігменти та диски зовнішніх сегментів, які зазвичай присутні в колбочках, і яким була притаманна експресія генів опсину, пов'язаного із денним зором, незалежно від того чи це нічні види геконів, із винятково паличковими сітківками, чи денні, із винятково колбочковими сітківками[62][42][63][64][65].
Волльс також припустив, що фоторецептори «простих сітківок» (з виключно одним типом рецепторів) також є результатом трансмутації. Однак вивчення фоторецепторів змій в контексті теорії трансмутації розпочалось лише в 1990-х рр. і також спочатку стосувалось вивчення лише морфологічних відмінностей. В сітківці звичайної котячої змії було виявлено, що паличкові фоторецептори мають дещо конусоподібний (як у колбочок) зовнішній сегмент та невіддільність дисків зовнішніх сегментів від плазматичної мембрани, що є характерним для колбочок[66]. Це свідчило про те, що такі палички є трансмутованими паличкоподібними колбочками.
Застосування молекулярних технік (імуномаркування[en] зовнішніми раманівськими мітками) та мікроспектрофотометрії[en] для дослідження зорових пігментів винятково паличкової сітківки нічного вужа, виявило в них колбочкові пігменти[67][68]. Ці дані підтвердили морфологічні дослідження та припущення Волльса, який вважав, що сітківка цього виду має сильно трансмутовані паличко-подібні колбочки[55].

Лабораторія Белінди Чанг (англ. Belinda Chang) з Торонтського університету сьогодні є однією з провідних у світі по вивченню молекулярних складових фотосприйняття змій і відома рядом відкриттів, які підтримують та поглиблюють теорію трансмутації Волльса. Використавши широкий спектр технік (секвенування ДНК, філогенетичний та молекулярно-еволюційний аналіз, in vitro експресію фотопігментів, мікроспект-рофотометрію, електронну мікроскопію та імуногістохімію) для дослідженні сітківки денної підв'язкової змії західної, яка має один тип подвійних і три типи одиничних колбочок, Чанг з колегами виявили, що деяким малим одиничним колбочкам притаманні паличкоподібні диски зовнішніх сегментів, відмінні від колбочок еліпсоїди внутрішніх сегментів та експресія гену паличкових родопсину (Rh1) і трансдуцину[en] (Gt)[69][70][71]. Відтак, ці малі одиничні колбочки не є справжніми колбочками, а трансмутованими паличками, що є першим прямим свідченням трансмутації в сітківці змій та першим молекулярним свідченням трансмутації від палички до колбочки[70].

На основі отриманих даних, Чанг з колегами припустили, що винятково колбочкові сітківки еволюціонували не шляхом втрати паличок, а, як припускав Волльс[55], через еволюційну трансмутацію давніх паличок в колбочко-подібні фоторецептори для того, щоб повернути потрібну для денного життя спектральну чутливість та розрізнення кольорів, втрачені разом з опсинами (SWS2 та RH2) «зелених» колбочок протягом ранньої, можливо землерийної, еволюції змій[71] .
Схожі результати були отримані лабораторією Чанг при вивченні винятково колбочкової сітківки денної соснової змії чорно-білої[72], в зовнішніх сегментах колбочок яких було виявлено експресію гену паличкового родопсину (Rh1), який однак, знебарвлювався за присутності гідроксиламіну, що характерно для опсинів колбочок[73]. Результати Чанг та колег однозначно вказують на трансмутацію колбочок соснової змії із паличок, що, в цілому, може свідчити про поширеність феномену трансмутацій серед полозових змій[72].
Теорія трансмутації Волльса знайшла також підтримку в нещодавньому молекулярно-філогенетичному дослідженні цілого ряду полозових змій, в чиїх винятково-паличкових та винятково колбочкових сітківках була виявлена експресія генів колбочокових та паличкових опсинів, відповідно[61] . Хоча отримані результати цього дослідження свідчать про дещо складніший сценарій, ніж припускав Волльс: паличкоподібні колбочки та колбочкоподібні палички змій могли еволюціонувати щонайменше двічі.
У поєднанні із результатами досліджень сітківок геконів, дослідження змій припускають, що на відміну від сталої подвійної сітківки риб, птахів та ссавців, фоторецептори плазунів зазнавали повторюваних і радикальних змін.
Зоровий пігмент
Чутливість фоторецепторів до світла обумовлюється спектром поглинання їх зорових пігментів (фотопігментів[en]), що знаходяться в зовнішньому сегменті фоторецептору[19].
Структура фотопігменту
Зоровий пігмент складається із опсину та світлопоглинаючого хромофору, ретиналю[en] (альдегід вітаміну A1), що ковалентно зв'язаний з опсином через основи Шиффа. [74].
Опсини – це трансмембранні семиспіральні білки, єдиний поліпептидний ланцюг яких складається з 364 (гени фотопігменту M- та L-колбочок) або 348 (ген фотопігменту S-колбочки) амінокислотних залишків[75]. Поєднуючись із хромофорами, опсини формують світлочутливі комплекси фоторецепторів. Хромофором фоторецепторів хребетних є 11-цис-ретиналь. Поглинання фотону ретина лем є початком зору, після чого через близько пікосенкуди, ретиналь ізомеризується, приводячи до конформаційної зміни опсину, запускаючи сигнальний біохімічний каскад, наслідком якого є зміна мембранного потенціалу фоторецептора, що змінює вивільнення нейромедіатора синапсами і сигналізує нейронам другого порядку про світловий стимул[76].
Спектральна чутливість фотопігменту
Зоровий пігмент має широкий спектр максимальної поглинальної здатності[en], що характеризується великим піком та малим піком (β-діапазон або вторинний пік чутливості) для коротших довжин хвиль [11]. Оскільки спектри поглинання зорових пігментів мають схожі форми, то спектральна чутливість фоторецепторів виражається через довжину хвилі максимальної поглинальної здатності[en] (λmax або максимум поглинання) [77].
λmax даного фотопігменту обумовлюється послідовністю амінокислот опсину та взаємодією конкретного опсину з ретиналем [78]. Оскільки всі зорові пігменти ссавців містять ретиналь, а їх λmax коливається в діапазоні від ~360 нм в ближній УФ-області спектру (миші та морські свинки) до ~565 нм в червоній області спектру (примати і люди), то точна максимальна чутливість даного фотопігменту визначається послідовністю амінокислот опсину та взаємодією специфічних амінокислот із ретиналем в ділянці зв'язування опсину [79].
Класи фотопігментів
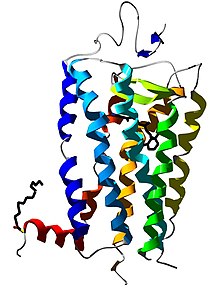
Зорові пігменти фоторецепторів класифікуються відповідно до спектру поглинання фотонів, що описує відносну ймовірність поглинання фотона з певною енергією. Існує кілька класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком в найбільш переважній довжині хвилі світла.
Зорові пігменти фоторецепторів класифікуються відповідно до спектру поглинання фотону, який описує відносну ймовірність поглинання фотона з певною енергією. Існує багато класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком в найбільш переважній довжині хвилі світла. В паличках та колбочках виявлені п'ять різних типів зорових пігментів: тип Родопсин 1 (позначається: Rh1) найчастіше знаходиться в паличках і має максимальну чутливість (λmax) 498 нм, тоді як в колбочках знаходяться інші чотири типи пігментів: Rh2 , LWS (англ. long wavelength sensitive, чутливі до довгих довжин хвиль світла), із λmax 500–570 нм; MWS ([mid wavelength sensitive ; чутливі до середніх довжин хвиль світла ] помилка: {{lang-xx}}: текст вже має курсивний шрифт (допомога)) із λmax 480–530 нм , SWS1 і SWS2 ([short wavelength sensitive ] помилка: {{lang-xx}}: текст вже має курсивний шрифт (допомога); чутливі до коротких довжин хвиль ) із λmax 355–445 нм і 400–470 нм, відповідно. [80][81][82].
Зорові пігменти хребетних еволюціонували близько 500 млн. років тому і походять із п'яти класів генів опсину: чотири спектрально відмінні класи генів опсину колбочок та один клас опсину палички[83]. Опсинні класи колбочок еволюціонували через дуплікацію генів, а клас опсину палички еволюціонував скоріш за все через дуплікацію гену Rh2-опсину колбочки [84] .
Нічний спосіб життя ранніх ссавців призвів до зменшення кількості класів генів зорових пігментів колбочок із чотирьох до двох. А деякі одноколірні нічні та морські види потім втратили і один з цих двох класів генів. Тому триколірність деяких примат і людини пов'язана або з дуплікацією одного з цих двох класів генів або з поліморфізмом [85]. На відміну від ссавців, птахи зберегли гени чотирьох фотопігментів колбочок, чия експресія присутня в їх одиничних та подвійних колбочках. Тоді як птахи і ссавців разом втратили чутливість до ультрафіолетового світла, яка присутня лише в кількох видів ссавців (гризуни та сумчасті), тоді як у птахів вона заново набута [86].
Адаптація тварин до нових умов також позначається на варіації класів зорових пігментів, які по-різному налаштовуються до конкретних спектральних областей чи нових зорових завдань. Мутація в гені опсину може призвести до спектрального зміщення максимальної чутливості фотопігменту, коли навіть заміна одного нуклеотиду може призвести до заміщення ключової амінокислоти, що змінить взаємодію між хрофомором та опсином і, відповідно спектральне зміщення чутливості пігменту [87][88].
Модифікація спектральної чутливості класів фотопігментів також здійснюється через зміну хромофору. Вітамін А має в хребетних дві форми – вітамін А1 і вітамін А2. Зорові пігменти, сформовані із ретиналю (альдегід вітаміну А А1) називаються родопсинами (поширені серед морських та наземних тварин), тоді як пігменти, які містять 3-дегідроретиналь[en] (похідний вітаміну А2) називаються порфиропсинами[de] (поширені серед риб, земноводних, плазунів) [89]. Хромофор складається із кон'югованого ланцюга атомів вуглецю, прикріплених до β-іононового кільця[en], а 3-дегідроретиналь ще містить додатковий подвійний зв'язок в кільці. Тому з’єднання 3-дегідроретиналю з опсином зміщує λmax зорових пігментів до довших довжин хвиль [90]. Таке зміщення залежить від довжини хвилі, досягаючи 50-60 нм із зоровими пігментами, чутливими до довгих хвиль (LWS) і лише кілька нанометрів з короткохвильовими пігментами (SWS1, SWS2) [91]. Відтак, лише шляхом зміни хромофорів в процесі розвитку чи сезонних змін, зорові пігменти можуть істотно змінювати максимальну спектральну чутливість, приводячи до змін кольорового зору.
Перетворення світла в нейронний сигнал
Фоторецептори сигналізують нижчестоячим нейронам поглинання світла через перетворення поглиненого фотону в електричний сигнал. Цей процес, відомий як фототрансдукція, реалізується через складний каскад взаємодії молекул, що в кінці кінців призводить до гіперполяризції фоторецептора (у хребетних, тоді як у безхребетних – до деполяризації) , тобто до значної зміни його електричного потенціалу [92][93].
Коли фотопігмент поглинає світло, то енергія фотону поглинається хромофором (ретиналем), конформаційний стан якого змінюється із вигнутої в пряму (із 11-цис-ретиналь в все-транс ретиналь), що в свою чергу призводить до структурної зміни білка опсину [94]. Новий конфірмаційний стан опсину активує трансдуцин (Gt) (гетеротримерний G-білок[en] фоторецептора), який в свою чергу активує фермент фосфодіестерази [en] (ФДЕ). Активована ФДЕ гідролізує циклічнний гуанозинмонофосфат[en] (цГМФ) до ГМФ, який на відміну від циклічного ГМФ не є сигналізуючою молекулою [95].
В темновому стані (до ізомеризації ретиналю) цГМФ регулює відкриття іонних каналів, через які проходять іони натрію (Na+). Після гідролізу цГМФ фосфодіестаразою Na+-канали закриті, що спричиняє гіперполяризацію фоторецептора та зниження вивільнення його синапсом нейромедіатора глутамату, таким чином сигналізуючи нижчестоячим нейронам про схоплення фотону[94]. Тож, на відміну від інших нейронів, реакція на світло постсинаптичних до фоторецептора нейронів сітківки пов’язана не із збільшенням вивільнення рецептором нейромедіатора, а із зменшенням.
Каскад фототрансдукції істотно підсилює сигнал, оскільки один фотон (і, відповідно, єдина ізомеризація) призводить до гідролізу ~105 молекул цГМФ [93]. Однак фототрансдукція так само ефективно зупиняє передачу сигналу, задля швидкої реакції фоторецептора на новий стимул.
Припинення сигналізування розпочинається із фосфорилювання активованого родопсину ферментом родпсинкінази, що призводить до зв’язування фосфорильованого родопсину з білком арестином[en]. В результаті цього опсинний комплекс втрачає все-транс ретиналь з арестином та фосфорилюється ферментом фосфатазою (PP2А) [94]. Як наслідок, іонні канали в зовнішніх сегментах відчиняються і фоторецепторний мембранний потенціал повертається до темновго, деполяризаційного рівня. А все-транс ретиналь знов ізомеризується до 11-цис конфірмаційного стану, знову зв’язуючись з опсином і починає новий цикл фототрансдукції[95].
Принцип уніваріантності
Природа поглинання фотона зоровим пігментом фоторецепторів означає, що після його поглинання, вся інформація про енергію фотона (довжину хвилі світла) втрачена. Відповідно з принципом уніваріантності[en], фоторецептори сигналізують вищій зоровій системі лише частоту, з якою фотон був поглинений, а не довжину хвилі[96]. Тому, як помірний потік фотонів поблизу довжини хвилі максимальної чутливості, так і високий потік фотонів біля довжини хвилі меншої чутливості генеруватимуть однакову частоту поглинання. Це означає, що стимули світла з різними спектральними розподілами будуть сприйматись як ідентичні, якщо призводитимуть до однакових поглинань в трьох колбочках, та різними в протилежному випадку. Відтак, кольоровий зір (розрізнення на основі довжини хвиль) потребує порівняння поглинання фотонів в різних колбочках, а не одній.
Класифікація фоторецепторів
Традиційно три типи колбочок, які відповідають за триколірний зір у людини та деяких мавпових, називались «сині», «зелені» та «червоні», припускаючи, що збудження даного типу колбочки визначало відповідне кольорове сприйняття. Однак така термінологія наразі вважається некоректною, оскільки кольорові назви не відповідають ні довжинам хвиль максимальної чутливості колбочок, ні кольоровим сприйняттям, які постають після збудження одиничних колбочок[17].
Натомість сьогодні загальноприйнятим є позначення колбочок як S-, M- та L-колбочки, залежно від тієї частини видимого спектра, до якої кожна є найбільш чутливою (від англ. Short-, англ. Middle- та англ. Long-wave sensitive, відповідно: коротко-, середньо- і довгохвильові колбочки)[97]. Хоча спектри поглинання фотопігментів S-, M- та L-колбочок значно перекриваються, їх довжини хвиль максимального поглинання (λmax) знаходяться в різних частинах видимого спектру: 420, 530 та 558 нм відповідно.[98]. Хоча фоторецептори можуть поглинати світло і на 50 нм більше чи менше від їх максимальних довжин хвиль, вони такі фотони поглинають менш сильно і тому їх реакція на світло спадає чим далі його довжина хвилі від оптимальної для даного фоторецептора довжини хвилі.
З точки зору властивостей зорових пігментів, в людини та ін. триколірних тварин доречно виділяти три, а не два типи фоторецепторів, оскільки колбочковий SMS1 пігмент настільки ж віддалено пов'язаний із колбочковими M/LWS пігментами, як вони із RH1 паличковим пігментом[99][97].
Типи паличок
В більшості сітківок тварин наявний лише один тип паличок, і тільки земноводні мають два типи паличок[56].
«Зелені» та «червоні» палички земноводних
Подібно до інших хребетних, у земноводних наявні палички з родопсином Rh1, що має максимум поглинання з довжиною хвилі 500 нм (т.зв. «червоні палички»), які були описані ще Максом Шульце (1867 р.) в сітківці жаб. Однак 1874 р. німецький анатом Густав Швальбе[en] виявив [100], що дорослі жаби мають особливий з поміж інших тип паличок - т.зв. «зелені палички» (або «палички Швальбе»), в яких коротший циліндричний зовнішній сегмент (~5-8 мкм в діаметрі та 60 мкм в довжину[101]) та довший тонкий міоїд внутрішнього сегменту в порівнянні з «червоними» паличками. [102][103][104]. Максимум поглинання зорового пігменту зелених паличок 432 нм[105][106]
Назви цих паличок не пов'язані з їх спектральною чутливістю, а з притаманним їм кольором у препарованій тканині сітківки, коли їх розглядати під мікроскопом: у більшості земноводних зелені палички мають колір трави, хоча у вогняної саламандри їм притаманний блідий сіро-зелений колір[107]. Адаптовані до темряви червоні палички, подібно до інших хребетних, найбільш чутливі до жовто-зеленого світла, тоді як зелені палички – до фіолетового-синього (подібно до S-колбочок інших хребетних), пропускаючи зелений колір, звідси їх назва. [108] [109]. Хоча колір фотопігменту зелених паличок, виходячи з його спектру поглинання, повинен бути жовтим, під мікроскопом ці фоторецептори виглядають зеленими, можливо через поєднання оптичних властивостей зелених паличок (дуже тонкий міоїд внутрішнього сегменту неефективний для передачі жовтого світла [110]) та людського кольорового зору (із-за контрасту пігменту «зелених» паличок з багрянисто-червоним фоном родопсинових «червоних» паличок) [111].
У жаби леопардової зелені палички складають 8% всіх фоторецепторів, а червоні палички – 50% [112], тоді як у тигрової саламандри червоні палички складають 98,6% всіх паличок, а зелені – 1,4 %[113]. Подібно до міоїдів колбочок жаб, міоїд зелених та червоних паличок жаб витягується у відповідь на адаптацію до світла, щоб краще схоплювати падаючі фотони[104].
Колбочковий фотопігмент «зелених паличок»
Зелені палички земноводних мають однаковий з S-колбочками опсин, тому сформований цим опсином пігмент («SWS2,P432», англ. Short-wavelength sensitive opsin of class 2) зелених паличок має ту саму спектральну чутливість, що й SWS1 пігмент S-колбочки[114][115][116]. Подібно до колбочкових пігментів, фотопігмент зеленої палички також руйнується (знебарлюється) за присутності гідроксиламіну [117] [118].
Хоча зелені палички та S-колбочки містять один і той же зоровий пігмент, у тигрової саламандри була виявлена унікальна з поміж усіх хребетних особливість: зелені палички та S-колбочки мають відмінні молекули трансдуцину (паличкову a-субодиницю трансдуцину в зеленій паличці та колбочкову а-субодиницю в S-колбочці), які активуються одним і тим же пігментом, однак це не впливає на світлову чутливість чи кінетику реакцій цих двох фоторецепторів[115] Тож, хоча морфологічно зелені палички є паличками, їх опсини є колбочковими, порушуючи усталений поділ фоторецепторів відповідно до їх морфології і прив'язку функції рецептора до його морфології. Оскільки вважається, що палички еволюціонували із колбочко-подібних фоторецепторів і родопсин еволюціонував із колбочкових пігментів SWS2[63][84], то характерні риси зелених паличок можуть свідчити про те, що ці фоторецептори є проміжною ланкою в еволюційній трансформації колбочок в палички. [115].
Іншою унікальною рисою зелених паличок земноводних є те, що їх подібний до S-колбочок опсин є надзвичайно стабільним[119]: зелені палички мають дуже малий рівень спонтанної теплової ізомеризації - <10-14сек-1 при 23С[101]. З цього випливає, що SWS2 (колбочковий) пігмент зеленої палички земноводних спонтанно активується в середньому один раз кожні ~1014сек, тобто ~4000 років, що робить його найбільш стабільним із всіх відомих опсинів, включно з родопсинами[120], які з поміж всіх інших зорових опсинів мають найменший рівень спонтанної теплової ізомеризації (~0,01 сек-1)[121].
Зелені палички наявні тільки в земноводних і хоча мають схожу з паличками морфологію, для них характерна поведінка S-колбочок, тому ці палички розширюють діапазон чутливості S-колбочок і можуть бути залучені в трикольоровий зір, зокрема в розрізнення кольорів на мезопічному рівні освітлення та відповідати за інстинктивну, позитивну фототаксичну реакцію на синє світло, характерну для багатьох безхвостих [122][123]
Типи колбочок
Cеред більшості видів тварин палички мають відносно однакову структуру, відрізняючись лише довжиною та діаметром зовнішніх сегментів. Тоді як колбочки характеризуються більшими відмінностями поміж різних видів.
Подвійні колбочки
Якщо одиничні колбочки є характерними для більшості хребетних, то деякі з них мають окрім одиничних, також подвійні колбочки [en] колбочки, як то птахи, плазуни, земноводні, кісткові ганоїди та костисті риби [56][124][125]. А в деяких груп костистих риб навіть були виявлені потрійні колбочки [126] [127].
Подвійні колбочки зазвичай складаються із двох відмінних колбочок, злитих разом в їх міоїдах внутрішніх сегментів та значно різняться розмірами[124]. Більша («основна») колбочка із подвійних колбочок часто має олійні краплини, тоді як менша («додаткова») містить великий параболоїд, хоча в різних видів присутні різні комбінації розмірів та структур подвійних колбочок.
Подвійні колбочки скоріш за все еволюціонував близько 350-400 млн. років тому і хоча вони наявні в сітківках майже більшості наземних хребетних (включаючи однопрохідні та сумчасті), він цілком відсутній в сітківках дводишних та плацентрарних ссавців, в тім числі в людини [42] [128].
Квадратна мозаїка подвійних колбочок
В сітківці костистих риб подвійні колбочки організовані у характерну впорядковану мозаїку (у формі квадрату чи в ряд) [129] [130] [131]. Як правило, в квадратній мозаїці подвійні колбочки (найчастіше довгохвильові L-колбочки) формують сторони квадрату, а в центрі знаходиться одинична колбочка (короткохвильова S-колбочка), і одиничні колбочки (деякі чутливі до ультрафіолету) по кутах квадрату[132]. Хоча такий порядок колбочок варіюється і в одних костистих риб можуть бути відсутні центральні, а в інших кутові одиничні колбочки [125].
Для пояснення переваг квадратної мозаїки було запропоновано кілька гіпотез. Одні припускають, що така впорядкованість подвійних колбочок уможливлює краще виявлення руху швидкої жертви [129][130], тоді як відповідно до інших квадратна мозаїка також покращує кольоровій зір [125][131]. Однак наразі відсутні експериментальні дані, котрі б підтверджували переваги впорядкованої мозаїки у порівнянні із невпорядкованою для виявлення жертви костистими рибами.
Інші гіпотези припускають, що квадратна мозаїка може бути залучена для виявлення поляризованого світла шляхом поєднання ортогонально розміщених подвійних та ультрафіолетових одиничних колбочок, зокрема для орієнтації в підводних світлових полях лососевими рибами[133] [134]. Хоча який саме механізм відповідає за чутливість колбочок до поляризованого світла і в яких видів костистих риб, залишається предметом дискусій [135]. Класична модель припускає, що градієнти показників заломлення у внутрішніх сегментах подвійних колбочок можуть функціювати, як анізотропні поляризаційні хвилеводи, тому ці колбочки діють як аналізатор поляризації [136][137]. Однак нещодавні електрофізологічні дослідження подвійних колбочок зеленого сонцевика[en] не підтвердили подібне припущення для цього виду [138], а в іншому дослідженні середньохвильової колбочки із подвійних колбочок сітківки золотої рибки було виявлене ізотропне поширення поляризованого світла через внутрішні сегменти (осьовий лінійний дихроїзм) колбочок [139][135].
Морфологія та фотопігменти подвійних колбочок
Подвійні колбочки характеризуються різноманіттям морфології та зорових пігментів. Дві половинки подвійних колбочок можуть мати різні розміри та містити однакові чи спектрально відмінні фотопігменти. Найбільше різноманіття подвійних колбочок виявлене в костистих риб [128], в яких дві половинки можуть бути: морфологічно ідентичними та містити однаковий фотопігмент (ідентичні «колбочки-близнюки»); морфологічно ідентичні, але спектрально відмінними пігментами (неідентичні колбочки-близнюки); морфологічно відмінні з ідентичними пігментами (ідентичні подвійні колбочки); морфологічно відмінні з різними пігментами (не ідентичні подвійні колбочки) [140] [141][131] [142].
В деяких видів риб між двома половинками подвійних колбочок існують електричні з’єднання через щілинні контакти і вони діють як один фоторецептор[143][144][145]. Ідентичні колбочки-близнята, в яких обидві половинки містять однаковий пігмент, через електричне з’єднання просто діятимуть, як відносно великий фоторецептор, що схоплює рідкісні фотони при низькому освітленні і тому зустрічаються у видів риб що живуть в глибоких, каламутних чи забруднених водах [146].
На відміну від примат, птахи мають окремі групи фоторецепторів для сприйняття кольору (чотири одиничні колбочки для чотирьоколірності) та яскравості світла, форми і руху (подвійні колбочки) [147]. В птахів подвійні колбочки складаються із однієї великої та однієї малої колбочки, які називаються «головними» та «додатковими», відповідно [56] і використовуються ними для виявлення руху, контурів, текстури та яскравості світла [148] [149] [150]. Дві половинки подвійних колбочок у птахів не є морфологічно ідентичними.
Також, на відміну від примат, птахи зберегли всі чотири класи колбочкових зорових пігментів: в подвійних та одиничних колбочках вони мають LWS пігмент, а Rh2, SWS1 та SWS2 в інших одиничних колбочоках (Hart & Hunt 2007). В птахів, що активні в день, ~50% всіх колбочок становлять подвійні колбочоки, ~20% LWS- та ~20% Rh2-одиничні колбочки, і 10% - SWS1- та SWS2-колбочки (Bowmaker 2008).
Палички і колбочки: відмінність та подібність
Сітківка людини має чотири типи фоторецепторів (1 тип паличок і 3 типи колбочок), кожен з яких є найбільш чутливим до конкретного діапазону електромагнітного випромінювання [151].
Палички, що відповідають за зір в темряві та при зоряному світлі, складають ~95% всіх фоторецепторів ссавців, мають тонкі довгі зовнішні сегменти, складені з окремих дисків, відокремлених від плазматичної мембрани і є в 1000 разів більш чутливими до світла, ніж колбочки[15]. Людська сітківка містить близько 100 млн. паличок[22]
Три типи колбочок, що відповідають за гострий зір при денному світлі, складають лише ~5% фоторецепторів, є більшими за розміром, мають коротші конусоподібні зовнішні сегменти, диски яких неперервно з’єднані з мембраною [22] [152]. Сітківка людини містить ~5 млн. колбочок [153]. Для порівняння, сітківка миші містить ~190 тис. колбочок, де вони складають 2,8% від всіх фоторецепторів [154].
Подібно до деяких інших сенсорних рецепторів, палички та колбочки не генерують потенціалів дії, але реагують на стимул (світло) через градуйовані зміни мембранного потенціалу [155]. Хоча палички мають високу чутливість, вони реагують на світло повільніше, оскільки інтегрують реакції на фотони протягом довшого періоду (~100 мсек)[1]. Така повільна реакція дозволяє паличкам виявити слабке світло, але її недоліком є те, що палички не в змозі побачити мерехтіння світла з частотою, швидшою ніж 10-15 Гц. Колбочки, хоч і в 100 разів менш чутливі ніж палички, мають швидшу та коротшу, порівняно з паличками, реакцію на світло (від 10 до 20 мсек при вищих рівнях світла) та інтегрують реакції на фотони в коротшому проміжку часу, будучи спроможними розрізнити мерехтіння світла з частотою 80-90 Гц. Хоча за нормальних візуальних умов, ця частота значно менша – 16-20 Гц [156]. Крім того, унікальна здатність колбочок до адаптування до різних діапазонів денного світла, дозволяє їм надійно кодувати інтенсивності світла при найяскравішому світлі, коли палички насичуються й більше не реагують на зміну інтенсивностей [157].
На відміну від інших нейронів, палички та колбочки гіперполяризуються у відповідь на стимул (світло), за відсутності якого (в темряві), вони є відносно деполяризованими і безперервно вивільняють їх нейромедіатор – глутамат[19]. На користь цього парадоксального феномену свідчать не тільки чисельні дані внутрішньоклітинних реєстрацій [158][159] [160] [161][162], а й виявлена висока частота зміни фоторецепторних синаптичних везикул в темряві [163].
Палички і колбочки мають схожі механізми фототрансдукції та гіперполяризації, але різні молекулярні складові, швидкості внутріклітинних процесів та синаптичні зв'язки із постсинаптичними нейронами сітківки, що призводить до відмінних реакцій паличок і колбочок на різні діапазони інтенсивностей світла[11]. Ці відмінності між двома класами фоторецепторів обумовлені тим, що палички, аби забезпечувати надійний зір при тьмяному світлі, повинні бути максимально чутливими до світла. Унікальна анатомічна структура та молекулярні складові паличок уможливлюють їх чутливість до одиничних фотонів, хоча надійне виявлення тьмяного спалаху світла потребує сигналів від 5 до 10 паличок[3] [164].
Висока чутливість паличкового нейронного шляху в сітківці пов'язана з тим, що, залежно від виду тварин, від 20 до 100 паличок відсилають сигнал до одного паличкового біполярного нейрону[165][166]. Тоді як для генерування реакції на стимул колбочкам потрібно більше 100 фотонів, оскільки внутріклітинний струм, генерований в колбочках одиничним фотоном є відносно малим і його важко відрізнити від фонового шуму[167].
Структура фоторецепторів

1 — мембранні диски зовнішнього сегменту;
2 — мітохондрія;
3 — ядро;
4 — синаптичний термінал;
5 — з'єднувальна війка;
6 — зовнішній сегмент;
7 — внутрішній сегмент.
Морфологія та фізіологія фоторецепторів підсилює їх функцію, як світлочутливих клітин. Палички і колбочки є видовженими клітинами із сильно вираженою полярністю[en], які складаються із п’яти головних компонентів: зовнішній сегмент (ЗС), внутрішній сегмент (ВС), з'єднувального війка (ЗВ), ядра та синаптичного терміналу. ЗС локалізований на зовнішній або дистальній частині сітківці, в ньому схоплюються фотони та відбувається його перетворення в електричний сигнал в процесі фототрансдукції. ВС локалізований більш проксимально в сітківці і знаходиться під ЗС; в ньому містяться органели, відповідальні за синтез білків (комплекс Ґольджі та ендоплазматичний ретикулум) та регуляцію метаболічної активності (мітохондрія) клітини. Синаптичний термінал утворює контакт із цільовим нейроном фоторецептора. З'єднувальні війки сполучають ЗС із ВС, забезпечуючи перехід білків із ВС до ЗС.
Світло, після проходження шару нейронів у внутрішній сітківці, надходить до внутрішнього сегменту фоторецептора, звідки спрямовується до зовнішнього сегменту, де взаємодіє з фотопігментом. Реагуючи на світло фоторецептор генерує сигнали які пасивно поширюються вниз по його аксону (~75 мкм в довжину) до синаптичного терміналу в зовнішньому плексиформному шарі. Фоторецептор має відмінну від інших нейронів структуру синаптичного терміналу, який містить т.зв. синаптичну стрічку[en], яка сприяє неперервному вивільненню збуджу-вального нейромедіатора глутамату на нижчестоячі (біполярні та горизонтальні ) нейрони[17].
Зовнішній сегмент
В кожному Фі знаходиться зоровий пігмент, родопсин, який розміщений в стопках мембранних дисків в паличко- та колбочко-подібному зовнішньому сегменті (ЗС) (показник заломлення в паличці - 1,41, в колбочці – 1,39), в якому присутні всі компоненти, потрібні для процесу фототрансдукції[11].
В 1860-х рр. М.Шульце описав загальну морфологію сітківки жаби та показав, що під впливом світла ЗС паличок розпадались на пластинки[168]. Використовуючи поляризаційний мікроскоп, В.Шмідт в 1930-х рр. зміг показати, що ЗС паличок були двозаломні, вказуючи на те що вони є високовпорядкованими, шаруватими структурами (ламелами), які складаються з ліпідів та білків [169]
В кінці 40-х початку 50-х рр., використовуючи електронний мікроскоп, відомий шведський фізіолог Фіртьоф Сьостранд[en] показав, що ЗС палички морської свинки дійсно були ламелами, чиї поверхні є 75 Å завтовшки [170][171] [172].
Подальші дослідження з допомогою електронного мікроскопу показали, що ЗС колбочок і паличок сітківок всіх хребетних складаються з двомембранних дисків (ламел), приблизно 250Å завтовшки, будучи відокремлені одна від одної водою, ферментами та розчинними солями. Товщина кожної з двох мембран диску варіюється від 50 Å до 75 Å. [173][174] [175][176][177][178]

Циліндричні та конусоподібні зовнішні сегменти
Для паличок характерні циліндричні ЗС, які в ссавців 1,2-2 мкм в діаметрі та 20-40 мкм в довжину, що коливається залежно від часу дня, інтенсивності світла та розміщення в сітківці [179][180]. Внутрішній об'єм ЗС палички, включаючи міждисковий та цитоплазматичний простір, складає 32×10-12 мл, тоді як цитоплазма заповнює 10×10-12 мл ЗС [179]. Відтак, цитоплазматичний простір, потрібний для процесу фототрансдукції, заповнює лише ~30% простору всередині ЗС палички, що свідчить про важливість внутрішніх мембранних структур для фототрансдукції.
Колбочки в сітківці ссавців мають більш циліндричний ЗС, тоді як в не ссавців для колбочок характерний конусоподібний ЗС , який є коротшим (маючи зазвичай половину довжини ЗС палички) із більшим діаметром в основі, що поступово звужується, набуваючи конусоподібної форми ближче до верхівки[181]. Так, ЗС колбочки миші ~1,2 мкм в діаметрі та 13 мкм в довжині [182]. В центральній ямці сітківки примат колбочки мають довші ЗС, ~45 мкм.
Структурні відмінності в зовнішньому сегменті між паличками та колбочками обумовлюють і їх функціональні відмінності. Оптика ока спрямовує промені світла вздовж майже прямої лінії від ВС до ЗС і далі вздовж ЗС. В прямих ЗС інтенсивність світла зменшується вздовж їх довжини: молекули зорових пігментів в основі ЗС поглинають фотони, тим самим зменшуючи кількість фотонів, доступних для зорових пігментів на верхівці ЗС, т.зв. ефект самоекранування (див. нижче) [183]. Внаслідок хвилевідної природи фоторецептора (див. нижче Фоторецептор, як хвилевід), конусоподібний ЗС зменшує ефект самоекранування, зберігаючи високу інтенсивність світла аж до місця знаходження зорового пігменту. Тому конусоподібний ЗС, поєднаний із специфічною геометрією ВС, покращує оптичну ефективність колбочок, дозволяючи ВС фокусувати світло на ЗС де воно ефективно взаємодіє з фотопігментом [183].
Мембранні диски

Палички та колбочки по-різному синтезують мембранні диски ЗС. Диски в ЗС колбочок не відокремлені від плазматичної мембрани, формуючи в ній складки, відкриті до позаклітинного простору, тоді як диски в паличках відокремлені від плазматичної мембрани і закриті від позаклітинного простору будучи відкритими тільки при війчастій основі ЗС[184][185]
ЗС палички ссавців має складну мембранну структуру, що розділяє цитоплазматичний простір майже на тисячу рівномірно відокремлених функціональних відсіків (дисків), накладених один на оден, з відстанню між ними в 30 нм[186]. Кожен диск є закритою структурою, що складається із двох сплюснутих мембран[179]. Такі диски організовують фототрансдукцію в окремі регіони, в яких поглинання одиничних фотонів перетворюється в електричний сигнал [187].
Відокремлені мембранні диски роблять фототрансдукцію більш ефективною, оскільки білки, залучені в початковий каскад трансдукції світлового сигналу є мембранозв'язаними (родопсин є інтегральним мембранним білком, а трансдуцин[en] та фосфодіестераза[en] прикріплені до мембранних дисків через ліпідні кріплення[en] [188]. Приєднання білків до мембрани підсилює та збільшує швидкість фототрансдукції, позаяк, замість трьох вимірів, дифузія білків обмежується двома.
Наявність великої кількості внутрішніх дисків уможливлює високу концентрацію мембрано-зв'язаних білків в ЗС палички. До прикладу , ЗС палички миші містить ~800 мембранних дисків, що заповнюють 50% об'єму ЗС, що істотно збільшує ймовірність поглинання фотонів [189]. Складені в стопку мембранні диски збільшують загальну мембранну поверхню в ~1500 разів у порівнянні із самою поверхнею плазматичної мембрани, що уможливлює розміщення величезної кількості зорових пігментів в ЗС[190].
Молекули родопсину, - яких в ЗС ~140 млн. і складають ~80-90% всіх білків в мембранному диску [17], - організовані у формі олігомерів вищого порядку і надзвичайно щільно розміщені в дискових ламелах (від 30 до 55 тис. молекул/мкм2, або 108 молекул/паличку) [191] [192][193][194]. Попри таку щільність, родопсин вільно переміщається в дисковій мембрані, завдяки чому він зустрічає і активує молекули трансдуцину для підсилення світлового сигналу[186]. В ЗС палички миші, що має 24 мкм в довжину і 1,4 мкм в діаметрі, ефективна концентрація родопсину в 3 ммоль збільшує ймовірність поглинання фотона, що проходить через ЗС, до 60%[195].
Іншими інтегральними мембранними білками фототрансдукції , які розташовані в дисках ЗС, є дві ізоформи[en] гуанілатциклази, RetGC1 та RetGC2, які є трансмембранними білками що перетинають мембрану однократно. Інші білки, що беруть участь у фототрансдукції (трансдуцин, фосфодіестерази 6, рековерин та білки-активатори гуанілатциклази (БАГЦ)) є периферійними[en] мембранними білками[184].
Окрім білків, які беруть участь у фототрансдукції, в ЗС наявні також спеціалізовані білки, які регулюють рух іонів із та в ЗС. Одним із таких білків є добре вивчені цГМФ-регульовані (ЦГР) катіонні канали в плазматичній мембрані ЗС. Через ці канали до ЗС проходять іони Na+ та Ca2+ в адаптованих до темряви паличок і колбочок. У паличок кальцій складає ~10% «темнового струму», що переноситься ЦГР-каналами[196], а в К - ~20% і більше [197]. В паличках і колбочках Na+ викачується із ВС через натрій-калієвий насос. Такий потік іонів формує основу циркулюючого темного струму, більша частина якого переноситься натрієм. Ймовірність відкриття ЦГР каналу, що в свою чергу визначає розмір циркулючого струму, залежить від кількості вільних [цГМФ]. В темряві концентрація вільних [цГМФ] становить 3-4 мкмоль[198], при якій канал відкривається лише з ймовірністю 0,1-0,2 [199].
В плазматичній мембрані палички втікання Ca2+ через ЦГР канал балансується виведенням Ca2+ з допомогою Na+/Ca2+-K+ білка-обмінника (NCKX), завдяки чому внутріклітинний рівень Ca2+ зберігається на відносно сталому рівні [200].
Відновлення зовнішніх сегментів
Для підтримки максимальної чутливості фоторецепторів до світла, ЗС відносно швидко відновлюються [201]. До прикладу, в фоторецепторах мишей, щурів та шпоркової жаби гладенької для відновлення ЗС потрібно до 10 днів. Однак відновлення ЗС у жаби леопардової триває понад 6 тижнів[202] [203][204].
Синтез нових дисків відбувається в основі ЗС паличок, а старі диски переміщаються до верхівки ЗС, з поверхні якого вони скидаються пачками (від 8 до 30 дисків) і врешті фагоцитуються пігментним епітелієм сітківки[205]. Оскільки ЗС палички містить ~140 млн. молекул родопсину, то кожна паличка повинна синтезувати ~10 млн. нових молекул родопсину на ЗС щодня, або півмільйона молекул на паличку щогодини[205].
У колбочках відбувається подібний до паличок процес відновлення ЗС, але оскільки диски колбочок не відокремлені від плазматичної мембрани, має місце змішання нових та старих компонентів мембранних дисків[205]. Відновлення дисків в колбочках також відбувається через включення нових компонентів та скидання і фагоцитоз частини мембрани ЗС[206][207][208].
Відновлення дисків ЗС відбувається в циркадний спосіб: в паличках синтез нових дисків відбувається перед світанком, а скидання вранці, коли зір переключається із паличок на колбочки; у колбочок навпаки – скидання дисків перед сутінками, а синтез вранці[209]Крім того, на відміну від паличок, колбочки зберігають їх форму через додаткові утворення складок в напрямку довжини ЗС, що дозволяє їм збільшити довжину за рахунок ширини[208].
Втрата зовнішніх сегментів в ховрахів
Часткова чи повна втрата зовнішніх сегментів колбочок була виявлена у впадаючих в зимову сплячку ховрахів, чия сітківка мітстить ~85% колбочок [210].
В одних з перших досліджень впливу сплячки на сітківку ховрахів було показано, що після входження в зимову сплячку, зовнішні сегменти колбочок ховраха тринадцятисмугового ставали коротшими[211] чи взагалі зникали [212], а діаметр дисків зменшувався, однак без якого-небудь збільшення кількості фагосомів пігментного епітелію сітківки. Порівняно із ЗС колбочок, ЗС паличок ховраха не змінювались протягом сплячки [213].
Разом із змінами ЗС, змінювались також інші складові колбочки ховраха, що перебував у сплячці: зменшення кількості та довжини мітохондрії у внутрішньому сегменті, зниження кількості синаптичних везикул та синаптичних ніжок [211]. Часткове повернення до нормальної довжини ЗС у ховраха відбувалось через один тиждень після пробудження із сплячки, і закінчувалось повністю ще через тиждень [212]. Відновлення синаптичної морфології та мітохондрій відбувався скоріш, приблизно за 3 дні [211].
Внутрішній сегмент
Внутрішній сегмент (ВС) фоторецептора - це тіло клітини, в якому містяться ядро, мітохондрія та ін. клітинні органели. Його анатомія спеціалізована для забезпечення високого рівня енергії та синтезу білків, необхідних для підтримки функціювання фоторецептора.
У колбочок ВС зазвичай більш об'ємисті із щільно упакованими в еліпсоїдному регіоні округленими мітохондріями, тоді як у паличок ВС містять менше мітохондрій, які є довшими та тоншими від колбочкових. Те, що колбочки мають більший ВС ніж палички пов'язане скоріш за все з їх більшими метаболічними потребами у порівнянні із паличками[184].
На відміну від ЗС, ВС паличок і колбочок не є шаруватими, але в них щільно упаковані мітохондрії. [174]
ВС прийнято ділити на дві частини: еліпсоїд та міоїд[15].
Еліпсоїд
Еліпсоїд це віддалена частина ВС (ближча до ЗС), що містить щільно розміщені видовжені мітохондрії, які вирівняні по колу вздовж осі фоторецептора [214]. Діаметр мітохондріального еліпсоїда колбочок людини становить 2,5 – 5 мкм[215], тоді як, до прикладу, в черепах – 7 – 12 мкм[216], а в курей – 2-3 мкм [217].
В макак, колбочки містять в 9-10 разів більше мітохондрій ніж палички. В них мітохондрії складають 74-85% еліпсоїдів колбочок, та 54-66% еліпсоїдів паличок. Об'єм їх еліпсоїда з ексцентриситетом збільшується в 2,4 рази для паличок, та більше ніж в 6 разів для колбочок з ексцентриситетами до ~13 мм , в той час як об'єм ЗС є сталим для обох фоторецепторів [218]. Більша кількість мітохондрій в колбочці ніж в паличці є дивним, з огляду на те, що механізм фототрансдукції в них майже однаковий.
Метаболічні функції мітохондрій
Мітохондрії у фоторецепторах виконують подвійну функцію. Як і в інших клітинах, у фоторецепторах вони виконують метаболічні функції, будучи генераторами аденозинтрифосфату (АТФ). Фоторецептори, зокрема їх ВС, характеризуються високим споживанням кисню [219] [220][221]. ВС колбочок мають інтенсивне гістохімічне фарбування цитохром с-оксидази та відносно високе споживання кисню [222] [223]. Більшість з енергії, яка генерується у ВС колбочок, підтримує перекачування іонів натрію та обмін цГМФ [224] [225] [226]. В темряві, за відсутності світлового стимулювання, натрій-калієвий насос в плазматичній мембрані ВС характеризується надзвичайно швидкою активністю, потрібною для балансування великого потоку натрію через багато відкритих цГМФ-регульованих каналів в ЗС [227]
Крім того, мітохондрії еліпсоїда забезпечують високу частоту синтезу білків в міоїді ВС для забезпечення високого рівня фототрансдукції білків в ЗС. Так, ЗС палички містить до 5×107 молекул родопсину, із яких 10% фагоцитуються пігментним епітелієм сітківки з настанням світла кожного дня, тому для постійної підтримки кількості родопсину в ЗС, в еліпсоїді щодня синтезується до 5×106 молекул родопсину і переміщається до основи ЗС[184].
Оптичні функції мітохондрій
Крім метаболічних функцій, фоторецепторні мітохондрії у ВС мають також і оптичні функції. Показник заломлення ВС та ЗС є вищим від показника заломлення проміжного середовища, завдяки чому у фоторецепторі є можливим повне внутрішнє відбиття, що обмежує світло в границях рецептора і він діє як хвилевід [228][229].
Еліпсоїд має вищий показник заломлення порівняно з іншими частинами фоторецептора, що обумовлено щільністю мітохондрій, які тому повинні виконувати також оптичні функції[230][231][232][137]. Завдяки вищому показнику заломлення, поперечна площа ВС, а не ЗС, визначає площу схоплення фотонів фоторецептора і дозволяє еліпсоїду спрямовувати світло до ЗС. Вимірювання подвійних колбочок зелених сонячних окунів (Lepomis cyanellus) виявили систематичні градієнти показника заломлення у ВС колбочок, який збільшується від 1,38 до 1,42 уздовж поздовжньої осі ВС[233].
Місце вздовж ВС, де поєднання конічної форми та збільшеного показника заломлення порівняно з позарецепторним простором, ініціює хвилевідність в напрямку ЗС і визначається, як оптична вхідна апертура фоторецептора. В колбочках центральної ямки людини апертура добре корелює з розташуванням мітохондрій, за винятком колбочок в середині центральної ямки, в яких апертура є ближчою до зовнішньої пограничної мембрани [234][183].
Оптичні, більш ніж метаболічні, функції фоторецепторних мітохондрій дозволяють пояснити відмінність між кількістю мітохондрій у ВС паличок та колбочок (особливо периферійних) сітківок людей та мавп. Їх широкі та конічні ВС, у порівнянні з вузькими та широко розставленими ЗС, можуть сприяти у схопленні та спрямуванні світла до фотопігменту в ЗС [218]. На відміну від мавп та людини, різниця між діаметрами ЗС та ВС паличок і колбочок сітківок мишей та кішок не така значна, тому між ними і менша різниця в кількості мітохондрій та метаболічній активності, що вказує на меншу важливість еліпсоїдних мітохондрій колбочок для хвилевідних властивостей>[235].
Найбільш очевидними оптичні властивості мітохондрій фоторецепторів є в тупаєподібних та землерийок, чиї колбочки містять поряд з меншими мітохондріями кілька великих мітохондрій («мегамітохондрій»), що мають нерегулярні крісти і діють як мікролінзи, підсилюючи оптичні функції колбочок[236][237]. Такі великі мітохондрії могли з'явитись як заміщення олійних краплин [en], які були в пращурів тупаєподібних. Середній показник заломлення ізольованого ВС колбочки малайської тупайї (Tupaia belangeri) вищий (1,405), ніж будь-якого іншого вивченого ссавця[236].
Вивчення мітохондріальних еліпсоїдів ВС одиничних колбочок курки (‘’Gallus gallus domesticus’’) показало, що у фоторецепторів птахів еліпсоїди слугують не для покращення схоплення світла, а скоріш для зменшення погіршення оптичних функцій фоторецептора через розсіяння світла по ньому[217]. У колбочок птахів еліпсоїд має ту саму ширину, що й олійна кольорова краплина і змінює апертурний кут[en] фоторецептора, тому незначним чином покращує передачу світла від ВС до ЗС[238].
В деяких ящірок та міногових найближчі області еліпсоїдів колбчок містять скупчення збільшеного ендоплазматичного ретикулуму, відомі як «заломлюючі тіла», які виконують функцію збирання та спрямування світла[239][240].
Міоїд
Частина ВС фоторецептора, ближча до тіла клітини, називається міоїд і містить вільні рибосоми, шорсткий ендоплазматичний ретикулум (ШЕР) та комплекс Ґольджі, які відповідають за синтез білків у фоторецепторі [201].
Термін міоїд був запозичений із схожої області фоторецепторів земноводних, яка містить скорочувальну структуру, що відповідає за рух ЗС колбочок для їх орієнтування [241]. На відміну від земноводних, міоїд ВС людини не може скорочуватись, хоча вісь ВС та ЗС зорієнтована на вихідну зіницю ока, в такий спосіб збільшуючи ймовірність схоплення світла фоторецептором [242].
Із фоторецепторного ядра в ШЕР транспортуються матричні РНК, де транслюються на рибосомах в білки опсинів, які комплексом Ґольджі пакуються в маленькі везикули. Ці везикули транспортуються до з'єднуючого війка і потрапляють до ЗС, де включаються в мішки та плазматичні мембрани[15].
У деяких видів міногових (геотрія (Geotria australis)), ящірок (Ctenophorus ornatus) та рогозуба, міоїд колбочк та колбочко-подібних фоторецепторів цілком містить жовтий/помаранчевий пігмент, який подібно до олійних краплин, діє як спектральний фільтр, поглинаючи довжини хвиль світла нижче ~500 нм [240] [239][243][244]. У пращурів геотрії ці жовті міоїдні пігменти скоріш за все еволюціонували, як адаптація до харчування на поверхні морських вод, де на їх очі постійно впливають шкідливе (з високою енергією) короткохвильове світло[245]. Крім того, фільтр поглинаючий короткі хвилі може також запобігти фотостимуляції β-діапазону фотопігментів та звузити спектральну чутливість різних типів колбочок, зміщуючи пік їх чутливості і тим самим покращуючи розрізнення кольорів [246] [247].
З'єднувальна війка
Внутрішній сегмент фоторецептора поєднаний із зовнішнім сегментом через тонкі нерухомі з'єднувальні війки (0,3 мкм в діаметрі), що є єдиним фізичним з'єднанням між ЗС та ВС. На відміну від рухомого війка, аксонема з'єднувального війка не має двох мікротрубочок в центрі і тому, ближче до основи, має структура мікротрубочок 9×2+0. Далі від основи війка і через більшу частину ЗС дублети мікротрубочок переходять в структуру 9×1+0 синглетів-мікротрубочок[248][249].
Через з'єднувальні війки відбувається потік величезної кількості ліпідів та білків із ВС, де вони синтезуються, до ЗС, де беруть участь у фототрансдукції чи підтримці функціювання ЗС. Щохвилини до 2 тис. молекул транспортується із ВС до ЗС[250].
Ядро
Ядра паличок та колбочок формують зовнішній ядерний шар сітківки хребетних. У колбочці ядро міститься у внутрішньому сегменті, тоді як в паличці ядро знаходиться в клітинному тілі, відокремленому від внутрішнього сегменту зовнішнім волокном[251]. Ядро паличок та колбочок характеризується високим рівнем транскрипції, оскільки мембранні диски зовнішніх сегментів неперервно оновлюються, тому фоторецептори функціюють як свого роду апокринні залози з високою активністю[252].
Клітинні ядра відмінні в паличок та колбочок [251]. Ядро палички більш округле, відносно мале і характеризується розміщенням гетерохроматину в одне щільне скупчення (хромоцентр), яке виглядає більш темнішим коли забарвлене нуклеофільним фарбуванням [235]. Ядро колбочки є відносно великим та овальним, часто формуючи єдиний шар, що проникає до зовнішньої пограничної мембрани [184]. Колбочкові ядра характеризуються великою кількістю еухроматину і менше гетерохроматину, який організований в кілька невеликх скупчень і тому ці ядра мають менш інтенсивне контрастне фарбування[253][254].
Перевернуте ядро палички
В більшості еукаріотних клітин пакування хроматинових ниток має дві форми: 1) еухроматин (не щільна, відкрита форма із активними генами), що знаходиться ближче до ядра, де проходить більша частина транскрипції; та 2) гетерохроматин (ущільнена форма), що часто скупчений довкола ядерець та на периферії ядра і містить транскрипційно неактивні ділянки геному[255][256]. На відміну від цієї усталеної архітектури ядра, в паличках мишей була виявлена незвична перевернута архітектура ядра: гетерохроматин тут зосереджений в центрі ядра, тоді як еухроматин і фактори транскрипції знаходяться на периферії, де в інших ядер гени не представлені [252]. Така архітектура ядер паличок має важливі функціональні наслідки для нічного зору ссавців, наділяючи їх оптичними властивостями.
При народженні (післяпологовий день P0) палички миші мають звичну для інших еукаріотних клітин архітектуру ядра, але після закінчення проліферації клітин (P5) та відкриття очей (P13) їх ядра набувають перевернуту архітектуру, яка остаточно оформлюється через місяць опісля народження. Аналіз ядра паличок сітківок інших нічних ссавців також виявив перевернуту ядерну архітектуру та її стійку кореляцію з концентрацією паличок і відношенням паличок до колбочок[252].
У більшості ссавців, що ведуть денний способі життя, перевернутої організації ядра палички не було виявлено[252]. Винятком є денні лемури – сіфака (Propithecus) та лемур звичайний (Eulemur fulvus), палички яких мають перевернуту архітектуру ядра[257]. Цей виняток може бути пояснений з урахуванням останніх поведінкових досліджень, які показали, що денні лемури насправді ведуть змішаний спосіб життя[en], будучи активними в день і вночі[258]. З іншого боку, ядро палички корови має проміжну архітектуру: гетерохроматин знаходиться в центрі і поширюється на периферію, що може свідчити про перехід від перевернутої ядерної архітектури до традиційної, обумовлений скоріш за все адаптацією корів від нічного до денного способу життя після одомашнення [252]. І навпаки, паличкові ядра нічної мавпи характеризуються переходом від усталеної архітектури хроматину до перевернутої, оскільки мають хроматин як на периферії (усталена архітектура), так і в центрі ядра (перевернута архітектура), де він є хромоцентром[257]. Подібна перехідна форма свідчить про повернення нічних мавп від денної активності до нічної, яку вели пращури примат. Унікальною є сітківка активних в ночі довгоп'ятових, в якій, подібно до інших нічних ссавців, менша загальна щільність колбочок, однак присутня характерна для денних примат центральна ямка і їх паличкові ядра мають усталену архітектуру паличкового ядра, що різнить їх з поміж всіх інших нічних ссавців[257]. Чому довгоп'ятові зберегли усталену архітектуру ядра, - попри те що значно давніше адаптувались до нічного життя (~40-45 млн. років тому), аніж нічні мавпи (~5-19 млн. років тому), - наразі залишається незрозумілим.
Оптичні властивості перевернутого ядра
Перевернуті ядра впливають на оптичні властивості паличок, оскільки ці ядра мають нижчий показник заломлення на периферії і вищий, хоч і однорідний, показник заломлення в центрі, де скупчений гетерохроматин. Подібна різниця показників заломлення значно зменшує розсіяння ядром рідкісного в ночі світла та покращує його фокусування для проходження до зорового пігменту в зовнішньому сегменті фоторецептора, поліпшуючи нічний зір[252].Формування перевернутого ядра в паличці миші в перший місяць після народження відповідає значному скороченню ефективної фокусної відстані ядра із ~27 мкм новонародженої миші до ~12 мкм в дорослої миші [259].
Перевернута організація паличкового ядра свідчить про те, що воно, подібно до інших сегментів фоторецептора, еволюціонувало для оптимізації проходження світла через перевернуту сітківку до зорового пігменту фоторецептора. На користь цього свідчать числові моделювання поширення світла через перевернуті ядра паличок з допомогою [[не перекладено|метод скінченних різниць в часовій області|скінченно-різницевого методу в часовій області|en|Finite-difference time-domain metod}} (FDTD) в двох [252] та трьох вимірах [260]. FDTD-моделювання вказує на те, що перевернуті ядра функціонують подібно до збиральних лінз для проходячого світла, тоді як ядра з усталеною організацією постають, як дифракційно-подібні перешкоди поширенню світла до зовнішнього сегменту палички [259].
Завдяки округлій формі та оберненій організації хроматину, перевернуте ядро палички володіє центральною симетрією і оптичні властивості паличкового ядра відокремлені від його просторової орієнтації. Тому перевернуте ядро не тільки більш ефективно фокусує світло у паличці, аніж усталене ядро, але й зберігає свої фокусуючі властивості незалежно від його орієнтації. Ці характеристики перевернутого паличкового ядра мають важливі наслідки для зовнішнього ядерного шару, в якому знаходяться клітинні тіла паличок і який в нічних ссавців значно товстіший ніж в денних. В зовнішньому ядерному шарі паличкові ядра розміщені в 6-8 шарів і згруповані у вертикальні колонки, вирівняні таким чином, що знаходяться приблизно на одній лінії з проходячим світлом[235][252]. Моделювання з використанням FDTD-методу показало, що організація перевернутих ядер паличок в колонки зменшує розсіяння світла і забезпечує (подібно до центральної ямки) ефективний оптичний шлях через всю сітківку нічної тварини[260][259]. Крім того, зменшення розсіяння в колонках перевернутих ядер паличок стійке до нерегулярностей колонок. [252].
Відносна товщина зовнішнього ядерного шару може бути причиною перевернутої архітектури паличкового ядра нічних ссавців, яка дозволяє в такому потовщеному шарі зменшити розсіяння фотонів і збільшити ймовірність їх схоплення фотопігментом в зовнішньому сегменті палички. Крім того, округла форма перевернутих паличкових ядер з їх центральною симетрією уможливлює фокусування світла без необхідності їх впорядкованого розміщення в зовнішньому ядерному шарі[259].
Оберненість сітківки і необхідність проходження світла через її клітинні шари перш ніж воно досягне зорового пігменту, вказує на те, що оптичні властивості фоторецепторів та їх складових не менш важливі, ніж їх фізіологічні функції.
Аксонний термінал
В результаті поглинання фотону фоторецептором у його зовнішньому сегменті запускається каскад фототрансдукції, що призводить до градуйованих змін трансмембранного потенціалу зовнішнього сегменту, який електротонічно[en] поширюється до аксонного терміналу, звідки передається іншим нейронам двома способами. Один спосіб – через електричні синапси: пасивне перенесення електричного потенціалу до прилеглих фоторецепторів через внутрішньоклітинні з’єднання (щілинні контакти) з низьким опором. Другий спосіб – через хімічні синапси: зміни мембранного потенціалу на аксонному терміналі міняють внутрішньоклітинну концентрацію іонів кальцію Са2+ та регулюють частоту злиття синаптичних везикул із плазматичною мембраною і вивільнення нейромедіатора (глутамату) на постсинаптичні нейрони сітківки другого порядку[19].
Ніжки і сферули
Аксонний термінал фоторецепторів розгалужується в зовнішньому сітчастому шарі сітківки. Аксонний термінал паличок називається сферулою (від лат. spherule = мала сфера), колбочок -ніжкою (лат. pedicle = мала нога)[261]. У сітківці ссавців, периферійні колбочки мають значно більші ніжки (можуть мати понад 50 синаптичних щілин), аніж колбочки в центральній ямі і залежно від розташування в сітківці, можуть мати діаметр від 5 до 8 мкм[262]. У сітківці примат, поблизу центральної ями, аксони багатьох колбочок групуються радіально таким чином, що ніжки формують кільцевий масив довкола центру.[263]
Синаптична стрічка
Більшість нейронів ЦНС кодують інформацію через зміну в частоті потенціалу дії. Однак фоторецептор повинен передавати сенсорну інформацію про широкий динамічний діапазон інтенсивностей світла, коли найменші зміни в інтенсивності стимулу повинні генерувати явні зміни у вивільненні нейромедіатора. Тому фоторецептори кодують інформацію не через потенціали дії, шляхом постійного тонічного вивільнення нейромедіатора глутамату. Це дозволяє їм неперервно змінювати синаптичні вихідні сигнали залежно від градуйованих змін в інтенсивності світла, вивільняючи від одного до сотень везикул за секунду [10]. .
Високий рівень вивільнення глутамату фоторецепторами обумовлений присутністю в їх аксонному терміналі спеціалізованої синаптичної структури – «стрічки»[en] англ. ribbon synapse, що є місцем вивільнення глутамату й складається із білка RIBEYE [264]. Стрічка зв’язує глутаматергічні везикули і діє подібно до конвеєрної стрічки, щоб піднести везикули до синаптичної активної зони, де вони зливаються з плазматичною мембраною для вивільнення глутамату в синаптичну щілину. Стрічка не прямо приєднана до плазматичної мембрани, а через «дугоподібну щільність» – електрон-щільну мережу білків, прикріплену до плазматичної мембрани. [265].
В ссавців сферули паличок містять тільки одну стрічку (30-35 нм в товщину), тоді як ніжки колбочок містять декілька стрічок, чия кількість варіюється між видами [266][235]. Так, ніжки колбочок миші містять ~10 стрічок[267], а ніжки ховрахів можуть містити навіть 15 і більше стрічок[268]. Ніжки колбочок примат можуть містити 20 стрічок в центральній ямі сітківки, та 42 на периферії[269]. Така множина стрічок в кожній ніжці колбочки дозволяє передавати вихідний колбочковий сигнал багатьом класам колбочкових біполярних нейронів[270].
Колбочки формують із постсинаптичними нейронами два спеціалізовані контакти – стрічкові (інвагінуючі) та плоскі (базальні) [11] . Із деполяризуючими (ON-) біполярними та горизонтальними нейронами колбочки формують стрічкові синапси, коли дендрити заглиблюються у ніжку колбочки. Із гіперполяризуючими ( OFF-) біполярними нейронами колбочки формують плоскі контакти, коли дендрити біполярів торкаються основи ніжки колбочки[261] [271] [272].
Одна колбочка може формувати контакти із дендритами 10-12 біполярних нейронів та багатьох горизонтальних клітин, тому в заглибленні ніжки колбочки може бути вміщено до 200 відростків постсинаптичних нейронів, що робить ніжку чи не найскладнішою синаптичною структурою ЦНС[262]. Однак є і відхилення від вищеописаного правила синаптичних зв’язків між колбочками та біполярними нейронами. Нещодавно відкритий новий тип колбочкових біполярних нейронів (XBC) [273], які скоріш за все є ON-біполярами [274] [275], має нечисельні і переважно не типові, базальні контакти з колбочками [276]. Крім XBC, було виявлено що й інші типи колбочкових біполярних нейронів (5T, 5O та 8) мають менше контактів із колбочками, аніж вони повинні мати, виходячи з розміру їх дендритного поля. В середньому, вони мають контакт з менш ніж однією колбочкою, хоч на відміну від XBC, й формують типові, інвагінуючі синапси.
Аксони паличок також формують синапси як із одним типом деполяризуючих біполярних нейронів, так і з горизонтальними нейронами. Однак, на відміну від колбочок, сферули, які мають тільки одну стрічку, контактують лише з двома дендритами біполярного та двома дендритами горизонтального нейрону [276] .
Оскільки фоторецептори, за відсутності світлового стимулу, безперервно вивільняють глутамат, то спеціалізовані синаптичні стрічки призначені для підтримки високої частоти надходження Са2+ і відтак високого рівня вивільнення. До прикладу, палички повинні відокремити із фонового теплового шуму (виникає через спонтанний розпад молекул фотопігменту) та стохастичного вивільнення нейромедіатора, коротку і слабку гіперполяризацію мембрани, що сигналізує поглинання одиничного фотона [277][278]. Для цього потрібно мінімізувати фонові коливання шляхом утримання високої частоти стійкого вивільнення глутамату у темряві. Вважається, що сферула палички, яка має діаметр 2 мкм та містить дуже велику синаптичну стрічку, є спеціалізованою для підтримки такої високої частоти вивільнення нейромедіатора[279].
Сферула має єдине заглиблення, що вміщує чотири відростки – два від горизонтальних нейронів і два від дендритів паличкових біполярів, завдяки чому постсинаптичні відрости знаходяться близько до місця вивільнення глутамату, унеможливлюючи його переливання на сусідні палички[261] [280]. Ці анатомічні особливості паличкових сферул істотно зменшують коливання сигналів паличок, уможливлюючи надійне виявлення реакцій на одиничні фотони[281][282].
Фоторецепторні синапси також мають ряд молекулярних відмінностей від інших синапсів в нервовій системі. Синаптичні стрічки не містять синапсинів[en], - білків, що регулюють вивільнення нейромедіаторів в синапсах інших нейронів [283]. На відміну від більшості нейронів, екзоцитоз та вивільнення нейромедіатора у паличках та колбочках регулюють потенціалзалежні кальцієві канали L-типу Cav1.4 (складені із α1F та α1D субодиниць, відповідно) та цГМФ-регульовані канали в колбочках[284][285][286]. Крім того, замість синтаксину 1[en], що здійснює злиття везикул із цитоплазматичною мембраною, в синаптичних стрічках присутній синтаксис 3 [287].
Регулювання вивільнення глутамату
Тонічна[en] деполяризація фоторецепторів за відсутності стимулу може призводити до зниження чутливості (десенсибілізації) багатьох типів іонних каналів, викликати в мембранному потенціалі осциляції з частотою 3-4 Гц та переповнити ВС іонами кальцію [288] . Стійке регулювання вивільнення глутамату залежно від змін мембранного потенціалу здійснюється через розміщений близько до активної зони в сферулі та ніжці потенціал-залежний кальцієвий канал L-типу (Cav1.4. Через цей канал відбувається входження Ca2+, а відтак і регулювання нейромедіаторного вивільнення. На ці Ca2+ L-типу канали не діє потенціал- чи С2+-залежна десенсибілізація, тому вони можуть підтримувати неперервне вивільнення глутамату за відсутності стимулу[289][290] .
В сферулах паличок Cav1.4 канали пов'язані із кальцій-зв'язуючим білком 4 (англ. CAlcium-Binding Protein 4; CABP4), модуляція яким зміщує потенціал-залежну чутливість Cav1.4 каналу до більш гіперполяризованих мембранних потенціалів. Завдяки цьому Cav1.4 канали модулюються по всьому фізіологічному діапазону потенціалу палички[291].
Міжрецепторні електричні з’єднання
Окрім з’єднань між фоторецепторами та постсинаптичними нейронами через хімічні синапси що формують первинний шлях передачі рецепторних сигналів, існують також з’єднання між самими фоторецепторами через електричні синапси, які забезпечують вторинний шлях для рецепторних сигналів [292] [293] [294].
Прямі міжрецепторні контакти спершу були показані (1958 р.) між аксонами колбочок та паличок в зовнішньому сітчастому шарі сітківки морської свинки [295]. Згодом схожі контакти між відростками паличок і колбочок та колбочка-колбочка були виявлені в сітківці голуба, людини, макаки та вивірки сірої [296][297][298][299].
В серії анатомічних та фізіологічних досліджень було переконливо показано, що в основі електричних міжрецепторних з’єднань є щілинні контакти між синаптичними терміналами сусідніх фоторецепторів, завдяки яким здійснюється двонаправлена пряма передача сигналів між прилеглими рецепторами[300][301][302] В колбочках щілинні контакти найчастіше знаходяться на закінченнях дуже тонких відростків, телодендрій[en], які відходять від основи аксонних ніжок та формують контакти з сусідніми колбочками[303] [292]. Контакти між телодендріями прилеглих колбочок формуються через конексинні[en] (Cx36) канали щілинних контактів, завдяки яким колбочки є електрично поєднаними[304][305]. Ближче до центральної ями сітківки хребетних, аксонні ніжки колбочок щільно розміщені одна до одної та поєднані через телодендрії, які розходяться в бік від аксонних терміналів[299][306][302].
Аксонні закінчення паличок ссавців не мають телодендрії , але з ними контактують телодендрії із аксонних закінчень колбочок [305]. Одна сферула палички може містити від 3 до 5 щілинних з’єднань від телодендрій прилеглої колбочки і одна ніжка колбочки може мати до 10 контактів із сусідніми паличками [307].
Завдяки електричному міжрецепторному поєднанню зміна в потенціалі одного фоторецептора може поширитись на прилеглі фоторецептори. Вплив щілинних контактів на електричну активність одиничних фоторецепторів вперше був показаний на прикладі колбочок сітківки черепахи, які були освітлені малими (радіус 4 мкм) і великими (радіус 70 мкм) точками світла з однаковою інтенсивністю [308]. Тоді як мала точка освітлювала лише одну колбочку, велика освітлювала також сусідні колбочки. Як наслідок, освітлення більшими точками світла призводило до більшої гіперполяризації колбочок, аніж меншими точками. Відтак, рецептивні поля колбочок виявились значно більшими, аніж їх діаметри: одинична колбочка проявляла гіперполяризацію у відповідь на освітлення колбочок, що знаходились на ~40 мкм від неї. Також через пропускання струму через одну колбочку, можна було зафіксувати зміну потенціалу на сусідній колбочці [309].
Подібний феномен впливу рецепторного поєднання на потенціал клітини був відкритий і в паличках, які однак мали ширшу за площею просторову сумацію (напр., до 200 мкм в кайманової черепахи) та сильніше електричне поєднання[310][311][312][313] [314]. В експерименті, метою якого було виявити реакцію палички жаби на одиничний фотон, на її сітківку були спрямовані розсіяні спалахи світла з такою інтенсивністю, що кожна паличка в середньому повинна була поглинати фотон у ~70% випадків [315]. Якби палички були ізольовані, то реакція палички на такі стимули повинна була б бути надзвичайно мінливою. Однак реєстрація активності палички з допомогою внутріклітинних мікроелектродів виявила, що реакція одиничної палички на серію спалахів була менш мінливою, аніж передбачається пуассонівським розподілом реакцій на поглинання одиничних фотонів. Коли, до прикладу, інтенсивність стимулюючих спалахів світла була такою, що в середньому 1,4 молекул родопсину на фоторецептор повинні були знебарвитись, то пуассонівський розподіл передбачає, що ~25% спалахів не знебарвлять жодної молекули родопсину, 35% знебарвлять 1 молекулу, 24% - дві, 16% - три чи більше. Однак реєстрована гіперполяризація палички потрапляла у вузький діапазон від 440 до 660 мкВ, реагуючи на спалахи навіть тоді коли вона не поглинала жодного кванту світла і в її зовнішньому сегменті не було знебарвлено жодної молекули родопсину. Ці результати однозначно свідчили, що паличка отримує сигнали від сусідніх паличок і тому впливи від одного фотону усереднюються в понад 100 паличок[315] . Крім того, щонайменше 85% реакції, реєстрованої в одиничній паличці жаби спричинені реакціями на знебарвлення молекул родопсину в 8 - 9 тис. сусідніх паличках з площею поширення до 0,5 мм2[316].
Крім міжрецепторних контактів на рівні аксонних терміналів, існують також контакти на рівні внутрішніх сегментів, що були виявлені між фоторецепторами деяких земноводних [317][318]. Також, окрім електричних міжрецепторних контактів, існують хімічні контакти між прилеглими фоторецепторами. Це можуть бути з’єднання аксонних терміналів двох рецепторів на рівні синаптичної стрічки [319], або ж проникнення телодендрії із аксонного терміналу однієї колбочки в заглиблення аксонних терміналів прилеглих колбочок, де вони формують контакти, як на рівні синаптичної стрічки, так і базального синапсу[320][321].
З’єднання між колбочками
Зазвичай, великі щілинні з’єднання зустрічаються тільки між рецепторами одного типу, тому з’єднання колбочка-колбочка чи паличка-паличка є більшими, ніж з’єднання колбочка-паличка, що є значно меншими [300][322][323]. До прикладу, в сітківці примат середній розмір конексинних бляшок (сукупність до тисячі каналів одного щілинного контакту ) щілинних контактів між червоними/зеленими колбочками складає 0,28 мкм2, між синіми колбочками – 0,21 мкм2, а між колбочкою та паличкою - 0,12 мкм2. [305].
З іншого боку, існують переконливі свідчення електричних з’єднань між спектрально різними фоторецепторами, як червоними та зеленими колбочками в сітківці примат, що виражається в близькості їх спектральних кривих поглинання [324][325][305]. Червоні та зелені, але не сині, колбочки невибірково поєднані (зелені з зеленими, червоні з червоними, червоні з зеленими) через конексинні (Cx36) щілинні контакти, із середньою провідністю ~650 пікосименс (пСм), завдяки чому можлива ефективна передача зорових сигналів. Хоча таке невибіркове з’єднання призводить до злиття сигналів про колір, а відтак і до незначного розмиття спектрального розрізнення між колбочками, це компенсується збільшенням у розрізненні яскравості стимулу. Разом з тим, зелені/червоні колбочки формують значно менше електричних контактів з паличками[324].
Сині колбочки мають менші ніжки ніж червоні/зелені колбочки, тому їх телодендрії рідко торкаються прилеглих колбочок та не формують з ними електричні контакти[326]. Більшість з’єднань через щілинні контакти сині колбочки формують із сферулами сусідніх паличок[305]. Тому сині колбочки залишаючись відносно ізольованими в мозаїці колбочок, що виражається у віддаленості їх спектральної кривої поглинання від кривих зелених та синіх колбочок. [325][324] Через відсутність з’єднань між синіми колбочками та їх розріджену мозаїку, сині колбочки завжди оточені кільцем протилежних колбочок. Однією з причин подібної електричної ізоляції синіх колбочок може бути необхідність унеможливити значне погіршання в дискримінації кольорів [327].
З’єднання між паличками та колбочками
Щілинні контакти між аксонними терміналами колбочок та паличками дозволяють сигналам із паличок прямо надходити до колбочок, звідки вони передаються до колбочкових біполярних нейронів і згодом до гангліозних клітин [300] [301]. Оскільки паличок в сітківці примат значно більше ніж колбочок, на одну колбочку можуть впливати одразу кілька паличок. В сітківці миші, - в якій переважають палички, а колбочки становлять лише 3% від всіх фоторецепторів, - коефіцієнт конвергенції паличок до колбочок складає ~32 [267].
На користь існування електричного поєднання між паличками та колбочками отримано ряд переконливих свідчень: а) реєстрація генерованих паличками сигналів в колбочках сітківок різних модельних тварин [328] [323][329][330], б) виявлення паличкових сигналів в гангліозних клітинах після блокади первинного паличкового шляху[331]; в) чисельні свідчення психофізичних досліджень про існування кількох окремих паличкових шляхів.[332] [333] [334] [335].
Електричне поєднання паличка-колбочка формує поряд із первинним шляхом (палички-горизонтальні-біполярні нейрони) вторинний шлях для передачі сигналу паличок [336]. Вторинний паличковий шлях виконує важливу роль при проміжних інтенсивностях світла, для підтримки сутінкового зору[337][338][339]. Сутінковий зір заповнює розрив між нічним зором (спирається на палички і безколірний) та денним зором (спирається на колбочки, кольоровий) [340]. Оскільки в сутінках відбувається насичення синапсів паличок (не реагують на зміни інтенсивності), то електричне з’єднання між паличками та колбочками надає доступ паличкам до синапсів колбочок, щоб кодувати збільшення інтенсивності світла, а також уможливлює інтеграцію сигналів паличок в колбочковий нейронний шлях, оминаючи первинний, паличковий шлях [293].
Сигнали, які передаються первинним паличковим шляхом є найбільш чутливими до яскравості стимулу, тоді як сигнали, які пе-редаються вторинним паличковим шляхом , на одну логарифмічну одиницю менш чутливі [341][342]. Тому діапа-зон дії цих двох паличкових шляхів різний. Хоча первинний паличковий шлях характеризується високою чутливістю, нелінійність передачі сигналу його синаптичними зв’язками призводить до звуженого діапазону дії [343]. Відтак вторинний паличковий шлях дозволяє сигналам паличок, генерованим в умовах сутінок, досягнути гангліозних клітин тоді, коли первинний шлях насичений і не в змозі передати ці сигнали[337]. Інша відмінність між первинним та вторинним паличковим шляхом пов’язана з різними підтипами гангліозних клітин, на які вони спрямовані. Тоді як в сітківці кроликів два паличкові шляхи спрямовані на два різні підтипи гангліозних клітин [344], в сітківці миші вони сходяться на більшість OFF-гангліозних клітин[345].
Поєднання паличка-колбочка є надзвичайно пластичним і модулюється[en] циркадними ритмами, будучи максимальним протягом суб'єктивної ночі та мінімальним протягом суб'єктивного дня[346] [347][294]. Протягом дня циркадний годинник збільшує вивільнення нейромедіатора дофаміну, який активує на паличках та колбочках дофамінові рецептори D2/D4, що в свою чергу зменшує внутріклітинну активність циклічного аденозинмонофосфату (цАМФ) та цАМФ-залежної[en] протеїнкінази, внаслідок чого зменшується електрична провідність щілинних з’єднань між паличками та колбочками[348] . Тоді як зменшення вночі вивільнення дофаміну обумовлює стійку електричну єдність між колбочками та паличками[346]. Подібне модулювання щілинних контактів паличка-колбочка дозволяє вторинному паличковому шляху функціонувати при нічних умовах освітлення, підсилюючи виявлення тьмяних об'єктів: палички відсилають інформацію про тьмяне освітлення колбочкам, які її вже відсилають своїм постсинаптичним нейронам[347]. З іншого боку, зменшення провідності між паличками та колбочками вдень не допускає надходження сигналів колбочок до не функціонуючої (насиченої) за цих умов мережі паличок, що б призвело до послаблення і втрати цих сигналів[349].
Відтак, електричне поєднання між паличками та колбочками у ссавців функціює, як синаптичний механізм, через який циркадним годинником регулюється надходження сигналів від паличок до колбочок та до колбочкових нейронів нижчого порядку.
З’єднання між паличками
В сітківці ссавців був виявлений також третій паличковий шлях. В експерименті з генетично зміненими мишами, сітківки яких не мали колбочок, у їх OFF-гангліозних клітинах були виявлені характерні для паличок сигнали, навіть тоді, коли первинний паличковий шлях блокувався агоністом метаботропних глутаматних рецепторів - L-(+)-2-аміно-4-фосфономасляною кислотою (L-AP4) [en] [350] . Висувалось припущення, що за відсутності у таких мишей щілинних з’єднань між паличками та колбочками, інший шлях передачі паличкового сигналу до гангліозних клітин – через прямий хімічний синапс між паличками та OFF-біполярними нейронами. Хоча довгий час вважалось що у ссавців такі синаптичні контакти відсутні [351] [352], їх існування згодом було підтверджене в сітківці мишей і щурів [353] [267] , котів [354] та кроликів [355].
Однак, як було виявлено у сітківці миші, тільки одна з п'яти паличок формує хімічний синапс із OFF-біполярним нейроном, що могло свідчити про незначну роль третього паличкового шляху у передачі сутінкових сигналів[267]. Втім, оскільки між аксонними терміналами паличок ссавців також існують щілинні з’єднання, електричні поєднання між паличками можуть збирати сутінкові сигнали на рівні фоторецепторів і відправляти їх до гангліозних клітин через третій паличковий шлях[339]. Тому третій паличковий шлях може використовуватись в сутінках та на світанку, коли доступно більше світла ніж при зоряному світлі і сигнал зібраний через між паличкові щілинні з’єднання може ефективно кодувати слабко освітлені об'єкти[267].
Існують також фізіологічні свідчення, що прямі хімічні синапси між паличками та OFF-біполярними нейронами дійсно форму-ють третій паличковий шлях у сітківці ссавців. Зокрема, паличкові сигнали були реєстровані в гангліозних клітинах після блокування первинного та вторинного паличкового шляхів і ці клітини не отримували вхідні сигнали від двох інших шляхів[341] . Такі паличкові сигнали мають нижчу чутливість до сутінків, аніж сигнали, які передаються двома іншими шляхами, що свідчить про залучення третього паличкового шляху до зору в сутінках та на світанку. Навіть у сітківці нокаут них мишей, в яких були вимкнені гени, що кодують конексин (Cx36) та відсутні щілинні з’єднання між паличками та колбочками, зберігались паличкові сигнали, які передаються третім паличковим шляхом. Це свідчило про неушкодженість електричного поєднання між паличками і, отже, вказувало на те, що у щілинних з’єднаннях між паличками відсутній конексин Cx36[341].
Функції міжрецепторних з’єднань
З теоретичної точки зору існування міжрецепторних з’єднань, зокрема між колбочками, повинно приводити до втрати гостроти та розмивання зображення на сітківці. На основі обчислень та психофізичних експериментів було встановлено, що електричні поєднання між колбочками у центральній ямці сітківки людини призводять до розмиття зорових сигналів та зменшення гостроти зору[304].
Ще в перших дослідженнях міжрецепторного поєднання, в оригінальному експерименті з сітківкою черепахи, було виявлено стійку кореляцію між внутріклітинним шумом ( коливанням напруги) та силою з’єднань між фоторецепторами (вимірюваною через просторову сталу, λ) і зроблено висновок, що електричні з’єднання покращують співвідношення сигнал/шум (SNR) як в паличках, так і колбочках [356] [357]. В колбочках черепах ,при стимуляції розсіяним освітленням, сигнал є незалежним від сталої довжини[en] (λ), але середнє квадратичне амплітуди шуму є обернено пропорційним λ (колбочкам із короткими λ притаманний значно вищий шум, аніж колбочкам з короткими λ), тому SNR прямо збільшується із збільшенням λ. Це відношення не діє у випадку освітлення малою точкою, яка активує лише одну колбочку, оскільки із збільшенням λ сигнал спадає швидше, ніж квадратний корінь шуму [356].
Тож додавання сигналів сусідніх колбочок завдяки міжрецепторному поєднанню призводить до усунення шуму, породженого фотонами та іонними каналами, завдяки чому є можливе розрізнення найменших відмінностей в сигналі колбочки і покращення роздільної здатності зору. Хоча подібне усереднення сигналів через електричні з’єднання є теоретично можливим і на рівні біполярних нейронів, які на периферії сітківки формують контакти з багатьма фоторецепторами, однак з’єднання саме на рівні фоторецепторів значно більше покращують SNR[358]. Тому функцією фоторецепторних щілинних контактів є зменшення шуму в синапсові між рецепторами та нижчестоячими нейронами, що повинно призводити до значного покращення передачі фоторецепторного сигналу сітківкою[359]. Усереднення рецепторних сигналів повинно також зменшувати кількість синаптичних з’єднань, необхідних між фоторецепторами та нижчестоячими нейронами, яким відтак не потрібно контактувати з кожним рецептором[356].
Подальші численні дослідження міжрецепторних з’єднань переконливо показали, що електричне поєднання колбочок зменшує шум і підсилює сигнали, корельовані між сусідніми фоторецепторами[360][293] [336]. Оскільки процесу внутріклітинної фототрансдукції притаманний шум (внаслідок квантової природи світла, спонтанного знебарвлення зорового пігменту та коливання провідності іонних каналів), то внутрішній шум в кожній колбочці є незалежним від шуму сусідніх колбочок. Тоді як обумовлена зором активність одиничної колбочки корелює із такою ж активністю прилеглих колбочок внаслідок сприйняття спільних стимулів у зображенні та розсіяння світла під час його проходження через рогівку та кришталик ока. Тому електричне поєднання між колбочками призводить до сумації корельованих зорових сигналів та зменшення несинхронного шуму. [361].
Обчислення передбачають, що електричне поєднання між колбочками центральної ямки сітківки ховрахів покращує SNR кожної колбочки на 77%, призводячи до вищої роздільної здатності зору[304]. Моделювання щілинних контактів між фоторецепторами також показали, що покращення SNR завдяки електричному міжрецепторному поєднанню дозволяє сітківці краще виявляти та локалізувати границі між областями з різною яскравістю [362]. Це пов'язане з тим, що щілинні контакти зменшують не тільки часовий шум, який постає внаслідок спонтанності внутріклітинних процесів та надходження фотонів, але також і некорельований просторовий шум у вихідних сигналах фоторецепторів, який притаманний просторовому розподілу яскравості. Фоторецептори, які моделювались як електрично ізольовані, були не в змозі виявити розширені між областями з різною яскравістю низько-контрастні границі, тоді як поєднання фоторецепторів через щілинні контакти згладжувало вихідні потенціали, уможливлюючи легке виявлення сітківкою границь, хоча й ціною втрати певних низько-контрастних деталей із просторового розподілу яскравості, що згладжувались разом з некорельованим шумом [362].
В цілому, поєднання між колбочками покращує чутливість та достовірність зорових сигналів, хоча і за рахунок певного «нейронного розмиття» зображення. Однак на відміну від розмиття зображення, спричиненого оптикою ока, нейронне розмиття є значно меншим[336]. Міжрецепторне поєднання колбочок також усуває шум на рецепторному рівні, перш ніж він потрапить до нижчестоячих нейронів сітківки[293].
Крім того, електричне поєднанням між фоторецепторами виконує інтегративну функцію. Збільшення рецептивного поля внаслідок електричного з’єднання призводить до підсилення реакції колбочок та паличок навіть на невелике збільшення площі стимулу освітлення[363][310][311][364].
Електричне поєднання між зеленими/червоними колбочками сприяє виявленню змін в яскравості через усереднення шуму в популяції колбочок із корельованими вхідними сигналами. Моделювання колбочок черепахи свідчать, що для стимулів яскравості, рівних чи більших, ніж площа поєднаних колбочок, SNR в колбочках збільшується на 35%[356]. На відміну від яскравості, кольоровий зір спирається на некорельовані сигнали між колбочками різних спектральних типів. В цьому випадку електричне поєднання між червоними та зеленими колбочками повинно призводити до зменшення SNR для кольорових сигналів. Однак виявлена у примат невибірковість електричного поєднання зелених-червоних колбочок може відображати обчислювальний компроміс, потрібний для кодування обмеженим масивом фоторецепторів як інформації про колір, так і про яскравість стимулів[324]. Тож хоча з’єднання червоних та зелених колбочок і призводить до незначного зменшення здатності до розрізнення кольорів, воно значно підвищує розрізнюваність яскравості.
Крім того, зелені та червоні колбочки формують хоч і регулярну, але окрему мозаїку в сітківці, наслідком чого є висока ймовірність з’єднань між спектрально однаковими колбочками та менша ймовірність з’єднання між спектрально відмінними колбочками. Така окремішність мозаїк червоних та зелених колбочок зменшує спектральне згладжування, спричинене електричним поєднанням[365].
Іншою важливою функцією міжрецепторного поєднання є перехрестя шляхів передачі паличкових та колбочкових сигналів. Тоді як у фоторецепторів черепахи та земноводних таке перехрестя найбільш помітне в паличках (поява додаткових компонентів в кривих чутливості паличок; зміна кінетики реакції паличок; підсилення здатності реагувати на високочастотні стимули) [366][359] [367] [348] , то в сітківці ссавців, які мають відмінну архітектуру фоторецепторів та їх поєднань, вплив поєднання паличка-колбочка найбільш помітний в колбочках (поява високої чутливості у колбочок та повільної інактивації реакції на світло, що притаманне паличкам) [323][368].
Оптичні властивості фоторецепторів
Формування фоторецепторами зорового зображення залежить від їх апертури та міжрецепторними інтервалами. Апертура фоторецептора визначає його здатність до збирання падаючого світла, тоді як інтервал між фоторецепторами визначає межі дискретизації зображення мозаїкою рецепторів.
Апертури фоторецепторів
Після потрапляння до сітківки, світло спрямовується через шари нейронів до фоторецепторів, в яких воно проходить через внутрішній сегмент (ВС) до зовнішнього сегменту (ЗС), де знаходяться фотопігменти. Оскільки фоторецептори збирають світло на конечній просторовій ділянці (т.зв. вхідній апертурі фоторецептора), вони виконують певного роду просторову інтеграцію падаючих фотонів. Це явище, відоме як ефект апертури, призводить до розмиття зображення на сітківціref name="Hughes1986">Hughes, A. (18 December 1986). The schematic eye comes of age. У Pettigrew, J., Sanderson, K.J. and Levick, W.R. (ред.). Visual Neuroscience. Cambridge University Press. с. 60—89. ISBN 978-0-521-25829-6.</ref>.
Розмір апертури колбочок має важливе значення, оскільки колбочки повинні виявляти різниці в контрастності зображення на сітківці, але разом з тим вони також мають зберігати важливі просторові деталі зображення. Велика апертура має нижчу просторову роздільну здатність, - оскільки збирає всі фотони, які до неї потрапляють, - та усереднює просторові деталі. З іншого боку, велика апертура забезпечує більшу чутливість фоторецептора, оскільки може збирати більше фотонів[156]. Тож хоча наявність конечної апертури фоторецептора може мати негативний вплив на якість зображення на сітківці, апертура також обумовлює скільки світла фоторецептор може поглинути. Чим більше світла поглинається фоторецептором, тим більше інформації про розрізнення передається нейронам сітківки. Це пов'язане з тим, що фотонний шум є пуасонівським процесом, тому SNR збільшується із збільшенням схоплення фотонів. Крім того, у порівнянні із оптикою ока, розмивання зображення на сітківці апертурою фоторецептора є значно меншим[369].
Дослідження з допомогою інтерференційно-контрастного мікроскопа Номарського[en] та психофізіологічні вимірювання апертури показали, що фоторецепторна апертура розміщена на рівні ВС, де показник заломлення паличок та колбочок різниться від позаклітинного простору і фоторецептори оптично відокремленіодин від одного. [370][371] [372]. Тому більшість з того світла, яке входить до ВС колбочок, буде спрямоване в ЗС і діаметр апертури дорівнюватиме діаметру ВС. Відтак, мозаїка колбочкових внутрішніх сегментів, які у центральній ямці щільно розміщені одна до одної, постає також мозаїкою дискретизуючих елементів, які збирають світло та покривають площину зображення на сітківці.
З усіх фоторецепторів, тільки колбочки в центральній ямці мають відносно прямий доступ до зображення на сітківці, оскільки в цьому регіоні внутрішня сітківка та судинна система відсунуті в бік. Діаметр ВС колбочок в макак посередині центральної ямки становить приблизно 2,5 мкм, а з ексцентриситетом в 20 градусів від центральної ямки, діаметр ВС вже складає 8 мкм і ще більше, 11 мкм, на краю скроневої половини сітківки. Діаметр ВС паличок макаки також збільшується від 1,5 мкм одразу після фовеоли до більше 4 мкм біля скроневого краю сітківки, маючи апертуру ~12′′ (12 сек дуги) [373] Оскільки діаметр ВС колбочки на відміну від палички суттєво збільшується з ексцентриситетом, то ефект апертури колбочки також збільшується з ексцентриситетом, тоді як ефект апертури палички залишається майже однаковим. Розмір апертури колбочок в центральній ямці сітківки людини був визначений психофізично і складає приблизно половину анатомічного діаметра колбочки, хоча ймовірно це лише нижча межа її істинного значення [372].
Оптичні властивості ВС колбочок центральної ямки визначають їх здатність до збирання світла, тому збільшення внутрішнього діаметру ВС (при фіксованому міжколбочковому інтервалі) збільшує схоплення ними падаючих фотонів та зменшує невизначеність щодо їх інтенсивності , спричинену фотонним шумом. Потенційно негативним наслідком збільшення діаметру ВС є розмивання зображення внаслідок інтегрування схоплюваного світла апертурою колбочки[374][370]. Втім, відповідно з анатомічними даними, ВС колбочок центральної ямки сітківки людини заповнюють майже весь простір між ними[153] . Це, скоріш за все, свідчить про те, що шкода для якості зображення, спричинена інтегруванням світла апертурою, є незначною за повсякденних візуальних умов [375].
Те, що розмір колбочки в центральній ямці не обмежує якість зображення пов'язане з тим, що апертура колбочки є меншою у порівнянні з функцією розсіювання точки зображення характерною для ока. Тоді як функціональна апертура колбочки в центральній ямці не більша 2,5 мкм в діаметрі чи менша, то функція розсіювання точки ока, навіть при найкращих зорових умовах, становить ~5 мкм в ширину на половинній висоті. Відтак, втрата контрасту, пов'язаного з апертурою колбочки, становить не більше 25% навіть при 60 циклах /градус-1 [375].
Оптична густина фотопігменту
Ізомеризація якомога більшої кількості фотопігменту фотонами, схопленими фоторецепторними апертурами, забезпечує високу зорову чутливість. Однак не все світло, що надходить до фоторецептора, однаково ефективно поглинається фотопігментом.
Здатність середовища поглинати світло характеризується його оптичною густиною, D, що визначається через десятковий логарифм відношення інтенсивності падаючого світла I0 до інтенсивності пройшовшого світла (коефіцієнт пропускання), IT.
Чим вища оптична густина, тим менший коефіцієнт пропускання. [376]
Відповідно до закону Бугера — Ламберта — Бера, оптична густина фотопігменту в фоторецепторі залежить від концентрації фотопігменту в ЗС, c0p, довжини ЗС, l, та коефіцієнту екстинкції фотопігменту (ймовірності поглинання фотону), ε(λ),
де c0 p- концентрація фотопігменту в адаптованому до темряви оці, p – частка не знебарвленого фотопігменту[369]. Фоторецептори поглинають ~50% падаючих фотонів максимальної довжини хвилі світла (λmax)[376].
Осьова оптична густина ЗС фоторецептора є добутком довжини ЗС та питомої густини фотопігменту [377]. Довжина ЗС фоторецепторів, а відтак їх поглинальна здатність, змінюються із збільшення ексцентриситету. Якщо в адаптованому до темряви оці концентрація фотопігменту , c0, є постійною для даного класу фоторецептора , то збільшення довжини ЗС збільшує величину світла, яка може бути накопичене фоторецептором, що призводить до зростання співвідношення сигнал-шум (SNR) [369].
Осьова оптична густина фотопігменту для колбочок, але не для паличок, істотно спадає із ексцентриситетом, як результат морфологічних змін колбочок: периферійні колбочки більш коротші з меншими ЗС, ніж колбочки в центральній ямці. ЗС колбочок є найдовшими у центральній ямці і тому мають тут найбільшу концентрацію фотопігменту на одиницю площі сітківки [378][379]. Довжина ЗС, а відтак і осьова оптична густина фотопігменту, спадає із відстанню від центральної ямки сітківки, коливаючись в діапазоні від 40 до 60 мкм в центральній ямці для L- та M-колбочок, і спадаючи до ~10 мкм на периферії[380].
Зміни в осьовій оптичній густині не впливають на пікову чутливість фотопігменту, однак вони змінюють його спектральну поглинальну здатність, а відтак і спектральну чутливість, що врешті вливає на спектральну світлову ефективність. Чим більшою є оптична густина фотопігменту, тим ширшим є спектр поглинальної здатності, а відтак ширшим є і крива спектральної чутливості. Ширші криві чутливості дозволяють схоплювати більше фотонів, тоді як звуження кривих спектральної чутливості може покращити розрізнення кольорів [381][382] [383]. Це пояснює, чому колбочки на периферії сітківки, які мають низьку оптичну густину у порівнянні із колбочками посередині центральної ямки, характеризуються більш звуженими кривими спектральної чутливості [384].
Наближене значення оптичної густини фотопігменту в даному фоторецепторі може бути отримане із різниць між спектральними чутливостями чи відповідностями кольорів, що вимірюються за нормальної та зменшеної концентрації фотопігменту. Для цього використовують або психофізичні методи (порівняння даних, отриманих коли фотопігмент знебарвлений чи не-знебарвлений або ж оцінки ефекту Стайлса-Кроуфорда), або об'єктивні методи (мікроспектрохімію чи денситометрію сітківки). Отримані психофізичними методами значення середньої пікової оптичної густини для L- та M-колбочок в центральній ямці сітківки людини коливаються від 0,3 до 0,6 (при вимірюванні фотопігменту в стані знебарвлення) та від 0,7 до 1,0 (при аналізі ефекту Стайлса-Кроуфорда) [385][386][387][388][379][389]. Тоді як отримані з допомогою об'єктивних методів значення середньої пікової оптичної густини фотопігменту для L- та M-колбочок коливаються від 0,35 до 0,57[390][391][392][393][384].
Тож, відповідно до психофізичних та об'єктивних методів, осьова оптична густина фотопігменту в ЗС колбочок істотно варіюється між індивідами. Однак в центральній ямці (зокрема в фовеолі) не було виявлено істотної різниці між оптичною густиною M- (0,66) та L-колбочок (0,65), які є винятково ефективними, поглинаючи ~78% фотонів [394].
Визначити оптичну густину фотопігменту S-колбочки значно складніше, оскільки світло, яке його знебарвлює, може призвести до повної втрати чутливості цими колбочками [395]. Опосередковано, на основі порівняння анатомічних властивостей L-, M- та S-колбочок та психофізичних методів, було встановлено, що середня пікова оптична густина фотопігменту S-колбчоок повинна становити ~0,4 для центральної сітківки (з ексцентриситетом 1 градус), та ~30 для периферії (ексцентриситет 13 градусів) [380][396]
Фотопігмент палички, що характеризується рівномірним розподілом поза центром сітківки, має меншу оптичну густину, ніж колбочки, не перевершуючи 0,2 логарифмічних одиниць.[397].
Самоекранування
Вплив оптичної густини фотопігменту на спектральну чутливість фоторецептора пов'язаний з процесом «самоекранування» (англ. «self-screening»), суть якого полягає в тому, що наявність великої кількості молекул фотопігменту в ЗС фоторецептора змінює його загальну спектральну чутливість[398].
Фотони різних довжин хвиль, які проходять по напрямку осі фоторецептора до ЗС, поглинаються неоднорідно: фотони з довжинами хвиль, ближчими до піку чутливості фотопігменту, мають більшу ймовірність бути поглинутими верхніми молекулами фотопігменту, а фотони з іншими довжинами хвиль будуть поглинуті нижче в ЗС. Таким чином, фотопігмент фільтрує падаюче світло, яке проходить через фоторецептор. Внаслідок цього крива спектральної чутливості фоторецептора є ширшою аніж крива чутливості фотопігмента, вимірюваного в розбавленому розчині. Зростання оптичної густини фотопігменту приводить до того, що крива чутливості колбочки стає ширшою. Відтак, до прикладу, дві колбочки, що мають той самий фотопігмент з різними оптичними густинами, матимуть і різні спектральні чутливості [399]. Порівняння вихідних сигналів цих двох колбочок лежить в основі дискримінації кольорів. Крім того, колбочка з вищою оптичною густиною є також більш чутливою по всьому видимому спектру (оскільки більше фотопігменту означає більш фотоізомеризацій).
Чутливість фоторецепторів до напрямку світла
Зображення на сітківці формується із світла, що надходить з багатьох різних місць в зіниці. Якість цього зображення залежить як від властивостей кришталика та рогівки ока, так і від того, скільки світла, що надійде до кожного місця (точки) в зіниці буде схоплене фоторецепторами. Характерною рисою зору, відмінною від штучних світлочутливих фотоелементів, є чутливість фоторецепторів сітківки до напрямку променя світла[11].
Чутливість фоторецепторів нормального ока є найбільшою по відношенню до світла, що входить до ока біля центру зіниці і спадає майже симетрично, коли точка входу світла зміщується в напрямку до периферії зіниці. Така зміна відносної світлової ефективності як функція від положення на сітківці називається «ефект Стайлса-Кроуфорда І порядку» (ЕСКІ), які вперше її виявили психофізично в 1933 р[52] .
Eксперимент Стайлса і Кроуфорда показав, що коли світло входить до ока в позаосьовій точці зіниці, воно є менш ефективним у генеруванні зорового сприйняття внаслідок того, що він падає під косим кутом на сітківку. При денному світлі, аби генерувати те саме суб'єктивне відчуття яскравості, що й промінь, який входить через центр зіниці, то промінь, який входить через периферію зіниці, повинен мати в 5 - 10 раз більшу енергетичну світність [400]. За 2-3 мм від місця пікової чутливості на сітківці, світло на половину менш ефективне у порівнянні із оптимальним положенням.
Пізніші теоретичні та експериментальні дослідження переконливо показали, що ключовою причиною ЕСКІ є не властивості оптики ока (рогівки, кришталика чи зіниці), а унікальна оптика фоторецепторів, зокрема хвилевідні властивості колбочок, оскільки їх форма та показник заломлення надають їм чутливість до напрямку світла [228] [229][401].
Зовнішні сегменти колбочок паралельні і зорієнтовані майже перпендикулярно до зовнішньої оболонки очного яблука, будучи спрямовані до центру зіниці в нормальних очей, таким чином постійно вирівнюючись з найсвітлішою областю зіниці[402]. Існують чисельні свідчення того, що подібне точне вирівнювання колбочок відносно центру зіниці ока пов'язане з тим, що колбочки є фототропіничими та активно орієнтуються до світла, подібно до соняшника в полі [403][404][405].
Фоторецептор, як хвилевід
Одним із методів вивчення сітківки на мікроскопічному рівні в неушкодженому оці є спрямування на сітківку променя світла і відслідковування тієї невеликої частки, яка відбивається назад на зіницю (техніка, відома як «рефлектометрія[en] очного дна»). Тільки ~1% світла, із того що входить до ока, відбивається назад від сітківки, інше нею або розсіюється, або ж поглинається[406]. З того світла, яке поглинається, лише частка схоплюється фотопігментами. До прикладу, із того світла, яке входить до ВС колбочки, лише близько 30% поглинається фотопігментом[407].
Частка світла, що відбивається назад від ока, обумовлена тим, що дещо плоска тканина сітківки діє подібно до слабкого дзеркала, що має значний спрямовуючий компонент. Причиною цієї спрямованості є довга, тонка структура фоторецепторів, що мають вищий показник заломлення аніж оточуюче їх середовище.[408]. Завдяки цій структурі фоторецептори діють, як біологічні оптоволоконні хвилеводи, ефективно скеровуючи світло уздовж всієї їх довжини шляхом повного внутрішнього відбиття і тому можуть бути оптично ізольованими один від іншого, уникаючи розсіяння світла на сусідні клітини і розмиття зображення. [409] [410] [411] [412] [413][414][215]. Хоча нещодавно була запропонована альтернативна від хвилевідної теорія для пояснення фоторецепторної спрямованості, в основі якої є модель дипольної антени, що розглядає кожен фотопігмент, як окремий емітер або приймач випромінювання. [415].
В 1843 р. німецький лікар та фізіолог Ернст Брюкке вперше вказав на те, що показник заломлення колбочок є вищим від оточуючого їх середовища. [416] Враховуючи вищий показник заломлення колбочок та їх майже циліндричну форму, він припустив, що промені світла, які потрапляють до них під відповідним кутом, повинні багаторазово відбиватись в кожному його сегменті (повне внутрішнє відбиття) аж до фотопігмента у зовнішньому сегменті.[417] Брюкке також припустив, що подібне багаторазове відбиття в циліндричній частині фоторецептора унеможливить втечу променів світла через його поздовжню поверхню і розсіяння оптичного зображення в сітківці, таким чином покращуючи гостроту зору.[418] [419] [420].
Хвилевідність світла в фоторецепторі
Оптичний хвилевід має серцевину[en] із високим показником заломлення, яку оточує оболонка[en] із нижчим показником заломлення, тому промінь світла, що входить до хвилеводу поза критичним кутом, не заломлюється, а безперервно відбивається від стінок хвилеводу допоки не досягне іншого кінця. Крім того, для зменшення перехресних перешкод між оптоволоконними елементами, вони мають бути відокремлені (середовищем з нижчим показником заломлення) одне від одного на відстань, що приблизно дорівнює або є більшою ніж довжина хвилі світла[421].
ВС та ЗС фоторецептора відповідає властивостям оптичного хвилеводу, оскільки їх цитоплазма постає як серцевина, а цитоплазматична мембрана та оточуюча рідина фоторецептора, як оболонка[229]. Фоторецептор має високу концентрацію великих молекул (білків, ліпідів, ліпопротеїнів, які забезпечують вищий рівень показника заломлення у порівнянні із оточуючим проміжним (інтерстиціальним) матриксом. Так, у сітківці примат ЗС паличок мають показник заломлення 1,4, а ЗСи колбочок центральної ямки – 1,419, тоді як значення показника заломлення для проміжного матрикса коливається між 1,334 та 1,347 [230]. Відстань між фоторецепторами зазвичай складає ~0,51 мкм, що узгоджується з найменшою відстанню для матеріалу з оптично-волоконними властивостями , яка становить 0,5 мкм (1 довжина хвилі в зеленій частині спектра) [228].
Хвилевідна природа фоторецепторів, є більш важливою для колбочок аніж для паличок [422] З ексцентриситетом ~2,5° від середини центральної ямки розташовані колбочки, що характеризуються найбільш вибірковим спрямуванням світла[423].
Хвилевідні моди фоторецептора
Коли світло поширюється через фотоерцептор, чий діаметр наближається до довжини хвилі світла (~0,5 мкм), то оптична поведінка фоторецептора відповідає принципам хвилевідної оптики і тому найкраще описується хвильовою оптикою, а не традиційною геометричною оптикою [424].
Геометрична оптика дозволяє описати як оптичне волокно може схопити та скеровувати промені світла, однак вона не в змозі точно охарактеризувати властивості тих оптоволокон, чий діаметр наближається до довжини хвилі видимого світла, де важливими є ефекти дифракції. Оптичні властивості таких волокон найкраще описуються хвильовою оптикою, яка замінює промені у хвилеводі на електромагнітні поля. Коли хвилі світла поширюються в хвилеводі, то інтерферують, що призводить до формування всередині та довкола хвилеводу стабільних форм коливань світла – мод, кожна з яких пов'язана із характерним тривимірним розподілом густини енергії в хвилеводі[421]. Такі моди є єдиним способом, яким світло поширюється через хвилевід і вони можуть бути згруповані в кілька порядків, пов'язаних з числом модальних поверхонь, на яких електромагнітні поля прямують до нуля: мода першого порядку (основна), другого, третього, четвертого і т.д. Порядок моди, яка поширюється в хвилеводі, залежить від його діаметру: менші моди (нижчого порядку) поширюються у тонших світловодах, а збільшення діаметру призводить до поширення все більших порядків мод. Однак основна мода поширюється завжди, незалежно від діаметра хвилеводу[425].

В кінцевій точці хвилеводу, волокно постає як антена, випромінюючи енергію світла. Спостерігаючи такий кінець хвилеводу під мікроскопом можна побачити більш менш складні форми світла, які через передані моди приблизно відтворюють поперечний перетин волокна. Одним з перших, хто побачив хвилевідні моди в Фах був фізіолог Адольф Ганновер[da] в 1843, хоча і вважав їх лише витонченими клітинними структурами [426]. Тільки з відкриттям ефекту Стайлса-Кроуфорда І відродилась цікавість до напрямкових властивостей фоторецепторів та намагання з їх допомогою пояснити ефект. На початку 1960-х рр. вперше були виявлені хвилевідні модальні структури у Фах [409][411] [412]
Оптичні властивості ідеального хвилеводу, що має поперечний діаметр d (у випадку фоторецептора – ефективна апертура) та показник заломлення n1, і оточений середовищем з показником заломлення n2 (<n1), цілком описуються безрозмірним «хвилевідним параметром», V:
де λ – довжина хвилі світла. Для даного хвилеводу V змінюється із зміною довжини хвилі. За винятком моди найнижчого порядку, кожна з мод хвилеводу пов'язана з порогом, Vc, нижче якого світло не може поширюватись в такій моді волокном нескінченно.
Для фоторецепторів, не враховуючи основні моди, які завжди поширюються, для інших допустимих мод V знаходиться в діапазоні між 2,4 та ~5,5[412]. Для міоїда та ЗС колбочок центральної ямки хвилевідний параметр V = 3,38 та 2,58 відповідно [427]. Відтак, тільки моди HE11 (2 моди), TE01 (1 мода), TM01 (1 мода) та HE21 (2 моди) мають нижчі граничні значення і тому можуть поширюватись через міоїд, еліпсоїд та ЗС фоторецептора.
Важливою властивістю мод є те, що не вся їх енергія поширюється всередині світловоду. Частина енергії моди поширюється поза хвилеводом і чим більший порядок моди, тим більшою є ця частка. Це істотно впливає на просторову роздільну здатність зору: чим більше світла поширюється поза даним фоторецептором, тим більше світла поглинається сусідніми з ним фоторецепторами. Такі фоторецептори стають оптично поєднаними, що погіршує роздільну здатність зору. Тільки енергія мод в межах фоторецептора взаємодіє з фотопігментом. [428] [429]
Функції хвилевідності
Хвилевідна природа уможливлює високе поглинання фоторецептором світла при відносно малих затратах фотопігменту, оскільки поглинання фотонів залежить головним чином від довжини фоторецептора і значно менше від його діаметра та форми. [228] Найменший можливий діаметр фоторецептора визначається ефектом оптичного хвилеводу. Нижче критичного діаметру в середину хвилеводу потрапляє менше світла, що робить його менш ефективним[430].
Хвилевідні властивості колбочок обумовлюють залежність ефективності схоплення фотонів сітківкою від точки входу світла в зіницю (ефект Стайлса-Кроуфорда І типу). Щойно світло входить до ВС колбочки, то внутрішні відбиття від стінок фоторецептора спрямовують світло вздовж його довгої осі до ЗС, де міститься фотопігмент. Одним із наслідків цього є більш ефективне схоплення та використання апертурами фотонів, оскільки вони можуть бути зібрані вздовж більшого діапазону положень та кутів променя світла. Світло, що прямо входить у ВС найкраще схоплюється фоторецептором та спрямовується до ЗС, тоді як світло, яке надходить до ВС під більшими кутами, хоча і може бути схоплене, але матиме меншу ефективність у проходженні до ЗС [428][425].
Хвилевідність також є ефективною для світла, яке через фоторецептор відбивається назад, оскільки оптичні системи є зворотними. Колбочки мають два головні відбиваючі компоненти: 1) анатомічне з’єднання між ВС та ЗС, та 2) з’єднання між ЗС та пігментним епітелієм сітківки. Відтак, іншим наслідком хвилевідної природи фоторецептора є те, що внутрішні відбиття світла здатні знову спрямувати вздовж прямого шляху входження ту його частину, яка вдаряється у ці з’єднання та може розсіятись.[408]
Хвилевідні властивості фоторецепторів є результатом еволюції їх тонких, видовжених структур, які самі постали в процесі оптимізації витрат фотопігменту та квантового поглинання[430].
Мозаїка фоторецепторів
Дискретизація зображення фоторецепторами
Оброблення зорової інформації розпочинається вже на рівні оптики ока, яка складається із трьох головних компонент: рогівки, зіниці та кришталика. Ці оптичні компоненти формують чітке зображення на рівні фоторецепторів, які дискретизують неперервне зображення на сітківці і перекодовують його в електричні сигнали.
Правило Гельмгольца
Щільність розміщення колбочок в центральній ямці є важливою для забезпечення високої роздільної здатності зору. Найменша кутова відстань між сусідніми об'єктами, яку може розрізнити зір, називається «мінімально-розрізнюваною гостротою» зору [431]. Мінімально-розрізнювана гострота зору оцінюється через визначення найчіткіших чорних та білих смуг, які можуть бути розрізнені спостерігачем. За ідеальних умов (при високій контрастності та яскравості) людина з відмінним зором може розрізнити ґратки змінюваних чорних та білих смуг, коли один цикл утворює кут в ~1 мінуту дуги (0,017 кутових градусів). Така мінімально-розрізнювана гострота є одним з головних обмежень просторового зору, будучи найчіткішою деталлю високої контрастності, що може бути розрізнена людським оком. Для зору, що спирається на центральну ямку сітківки, однією з головних причин такого обмеження є інтервал між колбочками.

Зовнішній світ, доступний зору, представлений як безперервна варіація в інтенсивності світла. Однак візуальна система, дивлячись на розподіл світла через одиничні фоторецептори, формує із безперервної варіації дискретні «вибірки». Тому початком процесу бачення є трансформація (дискретизація) щільною мозаїкою фоторецепторів безперервного зображення на сітківці в дискретні вибірки. Чим більш щільно розміщені фоторецептори, тим краще зорова система може відображати розподіл світла[432].
Те, що зір починається із просторової дискретизації зображення на сітківці дискретними фоторецепторами, вперше відзначив в 1850-х рр. німецький анатом Генріх Мюллер, коли виявив, що палички та колбочки є світлочутливими елементами сітківки. Однак сам Мюллер спочатку вважав, що для того, щоб зір сприймав дві точки світла як окремі , достатньо щоб ці точки стимулював дві окремі колбочки[433]. Проте, як відзначив Карл Бергман (1858), в такому випадку зір не зможе відрізнити безперервну лінію від ряду точок[434].
Бергман, а згодом учень Г.Мюллера, Герман фон Гельмгольц (1860) висунули іншу гіпотезу (сьогодні відому як «правило Гельмгольца»): для розрізнення двох точок, потрібно щоб один не стимульований фоторецептор був розміщений між двома стимульованими фоторецепторами[435][436]. Хоча це правило було сформульоване у контексті розрізнення двох точок, воно також застосовне у випадку розрізнення одиничних смуг синусоїдальних ґраток. Для випадку таких ґраток із чорних та білих смуг, правило Гельмгольца постулює необхідність існування двох точок вибірки на один цикл ґратки, тоді чорні та світлі смуги можуть окремо стимулювати фоторецептори.
Межа Найквіста
Зображення ґратки, яке відповідно до правила Гельмгольца узгоджується із дискретизуючою мозаїкою, знаходиться на частоті зрізу цієї мозаїки, fc, оскільки є найвищою просторовою частотою, яку система може розрізнити та надіслати до вихідних елементів. Ґратка, що має нижчу просторову частоту аніж частота зрізу, хоч і передискретизується, але уможливлює генерування множини вихідних значень, що без спотворень визначають вхідний стимул та дозволяють його точно реконструювати, fc/2. Тільки ґратка, що має частоту, вищу від частоти зрізу (3fc ), субдескритизується системою та призводить до втрати інформації дискретизуючим елементами. В цьому випадку вхідний стимул не може бути реконструйований і передається як сигнал із нижчою частотою. Таке спотворення інформації відоме як аліасинг [437].
Гіпотеза Бергмана та Гельмгольца була чітко формалізована через півстоліття у відомій в теорії інформації «теоремі дискретизації» (або теорема відліків) у відповідності з якою, для відновлення одновимірного сигналу з дискретної послідовності n рівновіддалених вибірок , частота дискретизації повинна бути рівною або у два рази більшою від максимальної частоти сигналу, fc:fc=n/2[438][439]. Інакше кажучи, теорема постулює, що в результаті дискретизації безперервного сигналу ніяка інформація не буде втрачена, за умови якщо процес дискретизації безпомилковий і найвища частота в сигналі становить не більше половини частоти дискретизації. Частота зрізу (половина частоти дискретизації) називається межею Найквіста[440].
У застосуванні до фоторецепторів теорема дискретизації припускає, що максимальна просторова частота, що може бути реконструйована (дискретизована) без спотворень, повинна вдвічі перевищувати інтервал між фоторецепторами. Тому для будь-якого даного інтервалу між фоторецепторами існує верхня межа (межа Найквіста) і будь-які просторові частоти в безперервному зображенні, що перевершують цю межу, будуть спотворені, як такі що мають нижчу просторову частоту (аліасинг).
Межа Найквіста для фоторецепторів обчислюється із середнього інтервалу між фоторецепторами, хоча однозначно визначеною вона є лише для випадку ідеально впорядкованих мозаїк, тоді як навіть мозаїка колбочок в центральній ямці далека від такої регулярності.[374] Для ока людини межа дискретизації Найквіста становить приблизно 60 циклів/градус, стільки ж скільки й вища просторова частота зрізу оптики ока. Людське око не в змозі виявити частоти вище ніж 60 циклів/градус, оскільки частота дискретизації колбочок в центральній ямці становить ~120 циклів/градус [441][442].
Тільки окремі види птахів мають гостріший зір, аніж примати. Так, орлан білоголовий має гостроту вище 120 циклів/градус, що досягається не шляхом більш щільного пакування фоторецепторів, а шляхом більш глибшої центральної ямки, завдяки чому колбочки сітківки орлана схоплюють вищі просторові частоти, аніж колбочки людської сітківки.
Аліасинг
Кодування фоторецепторами зображення у формі дискретних вибірок має два важливі наслідки для зору. Перший полягає в тому, що зорова система стикається з проблемою аліасинга: при реконструкції безперервного оптичного зображення із значень дискретних вибірок, розбіжність між смугою пропускання зображення та частотою дискретизації приводить до появи просторових ілюзій, коли високі просторові частоти [en] (вимірюється в циклах на кутовий градус) первинного зображення при його реконструкції постають як низькі просторові частоти [443]. Іншим наслідком є те, що інтервал між одиничними вибірками, що відповідає інтервалу між фоторецепторами, накладає обмеження на просторову роздільну здатність зору. Причиною аліасинга, - який по суті є формуванням низькочастотного муарового візерунку, - є субдескритизація зображення на сітківці, що має місце тоді, коли частота дискретизації регулярної мозаїки точок в два рази менша від найвищої просторової частоти, що відображена на цій мозаїці.
Застосування теореми дискретизації до мозаїки колбочок демонструє, що максимальна просторова частота, яка може бути відтворена без спотворень (аліасинга), рівна половині частоти дискретизації мозаїки колбочок. Однак хоча теорема дискретизації часто застосовується до мозаїки колбочок, ця мозаїка не є ні регулярною, ні одновимірною, будучи двовимірним нерегулярним дискретизуючим масивом. Хоча для цього випадку також існує багатовимірна теорема дискретизації [444]. Але теорема дискретизації для одновимірного випадку підходить для колбочок в центральній ямці, які мають достатньо регулярну мозаїку, яка здатна генерувати муарові візерунки, схожі на смуги зебри. Поза центральною ямкою аліасинг постає як двовимірний просторовий шум [432]
У випадку, коли мозаїка колбочок дискретизує два синусоїдальні стимули, зорова система не в змозі визначити, чи отримані дискретні вибірки із нижчих частот, що були дискретизовані достатньою кількістю фоторецепторів, чи ці вибірки із вищих частот, що були субдескритизовані. У випадку субдескритизації зображення на сітківці мозаїкою фоторецепторів, просторові частоти вище межі Найквіста хибно тлумачаться зоровою системою як низькочастотні, породжуючи «змішані ефекти». Зорова система не в змозі відрізнити такі змішані ефекти від природних низьких просторових частот і тому спотворює дискретизовану репрезентацію зображення на сітківці, інтерпретуючи субдескритизовані зображення наче вони чіткі[445].
Спектр просторових частот зображення на сітківці визначається просторово-частотним спектром візуальної сцени та модуляційною [en] передавальною функцією. Хоча спектри просторових частот природних візуальних сцен варіюються, в цілому вони мають амплітуди, які спадають обернено пропорційно просторовій частоті, що саме по собі допомагає зоровій системі уникати змішаних ефектів (аліасинга) [446]. Аліасинг виникає тільки у випадку, коли модуляційна передавальна функція перевищує межу Найквіста.
Оскільки аліасинг не може одразу бути виправлений процесами що мають місце після дискретизації, він накладає фундаментальні обмеження на будову (design) систем передачі зображення. Загальноприйнятим вирішенням цієї проблеми в інженерії є недопущення надходження просторових частот вище межі Найквіста до дискретизуючого масиву. Це здійснюється через попередню фільтрацію зображення, тобто обмеження смуги частот [en] зображення до початку дискретизації, коли частоти, що призведуть до аліасинга, відфільтровуються оптичною передавальною функцією [en] камери [447].
На відміну від інженерних систем, зорова система людини не вирішує проблему аліасинга шляхом обмеження смуги частот зображення, а подекуди навіть його допускає. Більшій частині сітківки притаманна значна невідповідність між границями смуги пропускання зображення на сітківці, накладеними оптикою ока, та частотами Найквіста, що випливає із загальної кількості фоторецепторів, доступних для дискретизації цього зображення[448]. Винятком є середина центральної ямки (фовеола), де середня міжрецепторна відстань (від центру до центру) складає (120)-1 градусів кута поля зору [31] . Позаяк в центральній ямці межа Найквіста становить ~60±10 циклів/градус зорового кута, що наближається до найдетальнішої структури, яка може бути сприйнята оптичним апаратом ока за оптимальних умов, то зір людини що спирається на колбочки центральної ямки, добре захищений від аліасинга оптичними властивостями ока, які відфільтровують просторові частоти, що перевершують межу Найквіста мозаїки колбочок центральної ямки[449][450]. Внаслідок такого фільтрування людина не в змозі візуально сприймати властивості зовнішнього світу (на рівні атомів та молекул), виражені в просторових частотах вище 60 циклів/градус.
Фовеола є єдиною областю сітківки ока людини, якій притаманна чітка підігнаність між межею Найквіста фоторецепторної мозаїки та шириною смуги пропускання зображень, які можуть бути сформовані на цій мозаїці при нормальнім зорові. Гельмгольц вперше висловив думку, що таке співвідношення між оптикою ока та мозаїкою фотоерцепторів свідчить про їх підігнаність (узгодженість) одне до одного [436]. Хоча це в першому наближенні справедливо для мозаїки колбочок в фовеолі, поза цією областю оптика ока істотно перевершує роздільну здатність периферійної мозаїки колбчок. Із збільшенням ексцентриситету від центральної ямки, ширина смуга пропускання оптики ока спадає повільніше, тоді як міжцентровий інтервал колбочок швидко зростає, внаслідок чого зображення на сітківці субдескритизовані й периферійний зір повинен сприймати аліасинг. [451] . Однак не зважаючи на невідповідність між шириною смуги пропускання зображення поза центральною ямкою та щільністю фоторецепторів, зорова система здатна запобігати аліасингу.
Однією з причин, чому периферійний аліасинг не є відчутним при повсякденному функціонуванні зору, є різна оптична якість зору поміж різних індивідів. До прикладу, такі аберації периферійної оптики, як астигматизм ока з косими осями значно зменшують силу саме тих просторових частот, що можуть викликати змішані ефекти [452]. Крім того, поєднання ряду інших факторів (напр., розфокусування внаслідок затримки акомодації [453]; незначна присутність в природних сценах високих просторових частот [454]; поперечна хронічна аберація [455]; просторова нерегулярність периферійної мозаїки колбочок через присутність паличок [448] [456]) також зменшують вплив периферійного аліасинга на нормальне функціонування зору.
Крім того, еволюційні механізми повинні були спрямовувати частоту зрізу оптики ока до частот, вищих від межі Найквіста, оскільки покращення контрастності зображення при просторових частотах нижче межі Найквіста більш ніж компенсує згубні ефекти будь-якого аліасинга просторових частот вище цієї межі [457]. Тому однією з переваг субдескритизації мозаїкою колбочок зашумлених зображень на сітківці може бути підвищення різкості зображення на високих просторових частотах. Також зорова система може використовувати з’єднання між колбочками через щілинні контакти для покращення чутливості до нижчих просторових частот без істотного зниження візуальної роздільної здатності чи збільшення ефектів аліасинга[365].
Тож, відповідність між межею Найквіста і найбільшою просторовою частотою, яка може бути виявлена зором, не є нездоланним бар'єром для роздільної здатності людського ока.[458]. Сам по собі процес дискретизації не має впливу на контрастність зображення. Зменшуючи розмірність зображення, дискретизація призводить до появи неоднозначності лише тому, що сигнал між двома точками вибірки невідомий. Тому функцією пострецепторних нейронів є відтворення та інтерпретація двозначного зображення.
Найбільш переконливо на користь того, що межа Найквіста не є нездоланною для ока, свідчить оригінальний експеримент, в якому спостерігачам показувались високочастотні синусоїдальні ґратки, використовуючи лазерну інтерферометрію щоб уникнути зменшення контрастності, що має місце коли стимул проходить через оптику ока[442]. Було виявлено, що спостерігачі могли надійно розрізнити ґратки з частотою до 150 циклів/градус, що в 2,5 перевершує межу Найквіста в позафовеальній сітківці[459]. І хоча дискримінація просторових частот стає надзвичайно поганою для частот, що перевершують межу Найквіста, в цих просторових частотах зберігається незначна інформація про орієнтацію ґраток [432].
Джерела
- ↑ а б Aidley, David J. (3 вересня 1998). The Physiology of Excitable Cells. Cambridge University Press. с. 477. ISBN 978-0-521-57421-1.
- ↑ Baylor DA, Lamb TD, Yau KW (1979). Responses of retinal rods to single photons. The Journal of physiology. 288: 613—634. doi:10.1113/jphysiol.1979.sp012716. PMID 112243.
- ↑ а б Hecht S., Shlaer S., and Pirenne M.H. (1942). Energy, quanta, and vision. The Journal of General Physiology. 25 (6): 819—840. doi:10.1085/jgp.25.6.819. ISSN 0022-1295.
- ↑ Borwein B., Borwein D., Medeiros J., and William M. J. (1980). The ultrastructure of monkey foveal photoreceptors, with special reference to the structure, shape, size, and spacing of the foveal cones. American Journal of Anatomy. 159 (2): 125—146. doi:10.1002/aja.1001590202. ISSN 0002-9106.
- ↑ Hirsch J. and Hylton R. (1984). Quality of the primate photoreceptor lattice and limits of spatial vision. Vision Research. 24 (4): 347—355. doi:10.1016/0042-6989(84)90060-9. ISSN 0042-6989.
- ↑ Chui T.Y., Song HX., and Burns S.A. (2008). Adaptive-optics imaging of human cone photoreceptor distribution. Journal of the Optical Society of America A. 25 (12): 3021. doi:10.1364/JOSAA.25.003021. ISSN 1084-7529.
- ↑ Wassle H. and Riemann H. J. (1978). The Mosaic of Nerve Cells in the Mammalian Retina. Proceedings of the Royal Society B: Biological Sciences. 200 (1141): 441—461. doi:10.1098/rspb.1978.0026. ISSN 0962-8452.
- ↑ Hirsch J. and Miller W. H. (1987). Does cone positional disorder limit resolution?. Journal of the Optical Society of America A. 4 (8): 1481. doi:10.1364/JOSAA.4.001481. ISSN 1084-7529.
- ↑ Laughlin S. (2001). Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology. 11 (4): 475—480. doi:10.1016/S0959-4388(00)00237-3. ISSN 0959-4388.
- ↑ а б в Sterling P. and Laughlin S. (22 травня 2015). Principles of Neural Design. MIT Press. ISBN 978-0-262-02870-7.
- ↑ а б в г д е Fein Alan and Szuts Ete Zoltan (31 August 1982). Photoreceptors: Their Role in Vision. CUP Archive. ISBN 978-0-521-28684-8.
- ↑ а б Masland R.H. (1986). The functional architecture of the retina. Scientific American. 255 (6): 102—11. PMID 2881349.
- ↑ а б Davson, Hugh (1990). Physiology of the Eye (вид. 4). Elsevier Science. с. 654. ISBN 978-0-323-16216-6.
- ↑ а б Buser, Pierre A. and Imbert, Michel (1992). Vision. MIT Press. с. 559. ISBN 978-0-262-02336-8.
- ↑ а б в г Rodieck, Robert W. (1998). The First Steps in See-ing. Sinauer Associates. с. 562. ISBN 978-0-87893-757-8.
- ↑ а б в Packer O. and Hendrickson A. E., and Curcio C. A. (1989). Photoreceptor topography of the retina in the adult pigtail macaque (Macaca nemestrina). The Journal of Comparative Neurology. 288 (1): 165—183. doi:10.1002/cne.902880113. ISSN 0021-9967.
- ↑ а б в г Dowling J.E. and Dowling J.L. (25 березня 2016). Vision: How It Works and What Can Go Wrong. MIT Press. с. 204. ISBN 978-0-262-03461-6.
- ↑ Baylor D.A. (1987). Photoreceptor signals and vision. Proctor lecture. Investigative Ophthalmology & Visual Science January. 28 (1): 34—49. PMID 3026986.
- ↑ а б в г Dowling, John E. (1987). The Retina: An Approachable Part of the Brain. Harvard University Press. с. 282. ISBN 978-0-674-76680-8.
- ↑ Wikler K.C., Williams R.W., and Rakic P. (1990). Photoreceptor mosaic: Number and distribution of rods and cones in the rhesus monkey retina. The Journal of Comparative Neurology. 297 (4): 499—508. doi:10.1002/cne.902970404. ISSN 0021-9967.
- ↑ Schiller P.H. and Tehovnik E.J. (2015). Vision and the Visual System. Oxford University Press. с. 416. ISBN 978-0-19-993653-3.
- ↑ а б в Curcio C.A., Sloan K.R., Kalina R.E. and Hendrickson A.E. (1990). Human photoreceptor topography. The Journal of Comparative Neurology. 292 (4): 497—523. doi:10.1002/cne.902920402. ISSN 0021-9967.
- ↑ Smallman HS, MacLeod DI, He S, and Kentridge RW (1996). Fine grain of the neural representation of human spatial vision. Journal of Neuroscience. 16 (5): 1852—9. PMID 8774453.
- ↑ Williams D.R. (1 січня 1992). Photoreceptor sampling and aliasing in human vision. У Moore, D.T. (ред.). Tutorials in Optics. Washington : Optical Society of America. с. 15—27. ISBN 978-1-55752-038-8.
- ↑ Shlaer R. An Eagle's Eye: Quality of the Retinal Image. Science. 176 (4037): 920—922. 1972. doi:10.1126/science.176.4037.920. ISSN 0036-8075.
- ↑ Reymond L. Spatial visual acuity of the eagle Aquila audax: a behavioural, optical and anatomical investigation. Vision Research. 25 (10): 1477—1491. 1985. doi:10.1016/0042-6989(85)90226-3. ISSN 0042-6989.
- ↑ Carroll J., Yoon G. , and Williams D. R. (18 вересня 2009). The cone photoreceptor mosaic in normal and defective color vision. У Gazzaniga, Michael S. (ред.). The Cognitive Neurosciences. MIT Press. с. 383—394. ISBN 978-0-262-01341-3.
- ↑ Wikler K.C. and Rakic P. (1990). Distribution of photoreceptor subtypes in the retina of diurnal and nocturnal primates (PDF). The Journal of neuroscience. 10 (10): 3390—401. PMID 2145402.
- ↑ а б Samy C.N. and Hirsch J. (1989). Comparison of human and monkey retinal photoreceptor sampling mosaics. Visual Neuroscience. 3 (03): 281—285. doi:10.1017/S0952523800010038. ISSN 0952-5238.
- ↑ Williams D, Sekiguchi N, and Brainard D (1993). Color, contrast sensitivity, and the cone mosaic. Proceedings of the National Academy of Sciences of the United States of America. 90 (21): 9770—7. PMC 47655. PMID 8234313.
- ↑ а б Osterberg, Gustav (1935). Topography of the Layer of Rods and Cones in the Human Retina. Acta ophthalmologica: Supple-mentum. Levin & Munksgaard. с. 102.
- ↑ а б в г д е Finger, Stanley (2001). Origins of Neuroscience: A History of Explorations Into Brain Func-tion. Oxford University Press. с. 462. ISBN 978-0-19-514694-3.
- ↑ а б в г д Stabell, Bjørn and Stabell, Ulf (13 серпня 2009). Duplicity Theory of Vision: From Newton to the Present. Cambridge University Press. с. 223. ISBN 978-0-521-11117-1.
- ↑ Treviranus, Gottfried R. (1828). Beiträge zur Anatomie und Physiologie der Sinneswerkzeuge des Menschen und der Thiere ; Erstes Heft, Beiträge zur Lehre von den Gesichtswerkzeugen und dem Sehen des Menschen und der Thiere (German) . Heyse. с. 91.
- ↑ Treviranus, Gottfried R. (1837). Resultate neuer Untersuchungen über die Theorie des Sehens und über den innern Bau der Netzhaut des Auges. Beiträge zur Aufklärung der Erscheinungen und Gesetze des organischen Lebens (German) . Т. 3. Heyse. с. 109.
- ↑ Sir Stewart Duke-Elder and Kenneth C. Wybar (1961). The anatomy of the visual system. System of Ophthalmology. H. Kimpton. с. 901.
- ↑ Wade N.J (2004). Visual Neuroscience before the Neuron. Perception. 33 (7): 869—889. doi:10.1068/p5153. ISSN 0301-0066.
- ↑ Bidder, F (1839). Zur Anatomie der Retina, insbesondere zur Würdigung der stabförmigen Körper inderselben. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin (German) . Veit und Comp. с. 371—385.
- ↑ Kölliker, Albert von (1852). Zur Anatomie und Physiologie der Retina. Verhandlungen der Physikalisch-Medizinischen Gesellschaft zu Würz-burg (German) . Stürtz [in Komm.]. с. 316—335.
- ↑ Muller, H. (1856). Observations sur la structure de la rétine de certains animaux. Comptes Rendus Hebdomadaires des Seances de L'Academie des Sciences. Т. 43. с. 743—745.
- ↑ Müller, H. (1857). Anatomisch-physiologische Untersuchungen über die Retina bei Menschen und Wirbelthieren.. Zeitschrift für wissenschaftliche Zoolo-gie. Т. 8. с. 1—122.
- ↑ а б в г д Crescitelli, F (1972). The Visual Cells and Visual Pigments of the Vertebrate Eye. У Dartnall, H. J.A. (ред.). Photochemistry of Vision. Handbook of Sensory Physiology. Т. VII/1. Berlin: Springer. ISBN 978-3-642-65066-6.
- ↑ Schultze, Max (1866). Zur Anatomie und Physiologie der Retina (German) . Cohen. с. 112.
- ↑ Schultze, M. (1867). Ueber Stäbchen und Zapfen der Retina. Archiv fuer mikroskopische anatomie (German) . Т. 3. с. 215—247.
- ↑ Schultze M. (1867). Bemerkungen über Bau und Entwickelung der Retina. Archiv fuer mikroskopische anatomie (German) . с. 371—382.
- ↑ Aubert, Hermann R. (1865). Physiologie der Netzhaut (German) . Morgenstern. с. 394.
- ↑ Schultze M. (1872). Sehorgan. I. Die Retina. У Stricker S. (ред.). Handbuch der Lehre von den Geweben des Menschen und der Thiere (German) . Engelmann. с. 977—1034.
- ↑ Parinaud, H. (1884). L'hemeralopie et les fonctions du pourpre visuel.. Comptes rendus hebdomadaires des séances de l'Académie des scienc-es. Т. 93. Paris. с. 286—287.
- ↑ Parinaud H. (1898). La Vision: étude physi-ologique. Octave Dion. с. 218.
- ↑ Kries, J. von (1896). Über die Funktion der Netzhautstabchen. Zeitschrift für Psychologie und Physiologie der Sinnesor-gane (German) . Т. 9. J.A. Barth. с. 81—123.
- ↑ Helmholtz, Hermann von, (1909). Kries, Johannes von (ред.). Handbuch der Physiologischen Optik (German) . Т. 2. с. 290.
- ↑ а б Stiles W. S. and Crawford B. H. (1933). The Luminous Efficiency of Rays Entering the Eye Pupil at Different Points. Proceedings of the Royal Society B: Biological Sciences. 112 (778): 428—450. doi:10.1098/rspb.1933.0020. ISSN 0962-8452.
- ↑ Stiles W. S. (1939). The Directional Sensitivity of the Retina and the Spectral Sensitivities of the Rods and Cones. Proceedings of the Royal Society B: Biological Sciences. 127 (846): 64—105. doi:10.1098/rspb.1939.0012. ISSN 0962-8452.
- ↑ Hecht S. (1937). Rods, Cones, and the Chemical Basis of Vision. Physiological Reviews. 17 (2): 239—290.
- ↑ а б в г д е Walls G.L. (1934). The reptilian retina. I. A new concept of visual cell evolution. American Journal of Ophthalmology. 17 (10): 892—915. doi:10.1016/S0002-9394(34)93309-2. ISSN 0002-9394.
- ↑ а б в г Walls, Gordon Lynn (1942). The Vertebrate Eye and Its Adaptive Radi-ation. Bloomfield Hills, Mich., Cranbrook Institute of Science. с. 818. Помилка цитування: Некоректний тег
<ref>; назва «Walls1942» визначена кілька разів з різним вмістом - ↑ Underwood, Garth (1945). On the Classification and Evolution of Geckos. с. 492.
- ↑ Underwood G. (1967). A Contribution to the Classification of Snakes. Trustees of the British Museum (Natural Histo-ry). с. 179.
- ↑ Underwood G. (1968). Some suggestions concerning vertebrate visual cells. Vision Research. 8 (4): 483—488. doi:10.1016/0042-6989(68)90117-X. ISSN 0042-6989.
- ↑ Underwood G. (1970). The eye. У Gans C. and Parsons T.S. (ред.). Biology of the Reptilia. Т. 2. London & New York: Academic Press. с. 1—97.
- ↑ а б Simões B., Sampaio F.L., Loew E.R., Sanders K.L., Fisher R.N.., Hart N.S., Hunt D.M., Partridge J.C., and Gower D. J. (2016). Multiple rod–cone and cone–rod photoreceptor transmutations in snakes: evidence from visual opsin gene expression. Proceedings of the Royal Society B: Biological Sciences. 283 (1823): 20152624. doi:10.1098/rspb.2015.2624. ISSN 0962-8452.
- ↑ Crescitelli F.The Photosensitive Retinal Pigment System of Gekko gekko. The Journal of General Physiolo-gy. 47 (1): 33—52. 1963. doi:10.1085/jgp.47.1.33. ISSN 0022-1295.
- ↑ а б Kojima D., Okano T., Fukada Y., Shichida Y., Yoshizawa T. and Ebrey T. G. (1992). Cone visual pigments are present in gecko rod cells. Proceedings of the National Academy of Sciences of the United States of America. 89 (15): 6841—6845. doi:10.1073/pnas.89.15.6841. ISSN 0027-8424.
- ↑ Röll B.Gecko vision-visual cells, evolution, and ecological constraints. Journal of Neurocytolo-gy. 29 (7): 471—484. 2000. doi:10.1023/A:1007293511912. ISSN 0300-4864.
- ↑ Yokoyama S. and Blow N.S. Molecular evolution of the cone visual pigments in the pure rod-retina of the nocturnal gecko, Gekko gek-ko. Gene. 276 (1-2): 117—125. 2001. doi:10.1016/S0378-1119(01)00643-6. ISSN 0378-1119.
- ↑ Munk O. and Rasmussen J. B. (1993). Note on the Rod-like Photoreceptors in the Retina of the Snake Telescopus fallax (Fleischmann, 1831). Acta Zoologica. 74 (1): 9—13. doi:10.1111/j.1463-6395.1993.tb01216.x. ISSN 0001-7272.
- ↑ Sillman AJ, Govardovskii VI, Rohlich P, Southard JA, and Loew ER The photoreceptors and visual pigments of the garter snake ( Thamnophis sirtalis ): a microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 181 (2): 89—101. 1997. doi:10.1007/s003590050096. ISSN 0340-7594.
- ↑ Sillman AJ, Carver JK, and Loew ER. The photoreceptors and visual pigments in the retina of a boid snake, the ball python (Python regius). Journal of Experimental Biology. 202 (Pt 14): 1931—8. 1999. PMID 10377274.
- ↑ Yang CGY. (2010) « Rod-like properties of small single cones: transmutated photoreceptors of garter snakes (Thamnophis proximus).» (MSc thesis)
- ↑ а б Schott R, Yang C, Bhattacharyya N, Chan N, Xu M, Loew E, Morrow J, Muller J, and Chang BSW (2014) « Blue-shifted rhodopsin expressed in transmuted cones of the diurnal colubrid snake Thamnophis proximus.» In Annual Meeting of the Society of Molecular Biology and Evolution Abstracts, San Juan, Puerto Rico (Abstract)
- ↑ а б Schott R. K., Müller J., Yang C.G.Y., Bhattacharyya N., Chan N., Xu M., Morrow J.M., Ghenu A.-H., Loew E.R., Tropepe V., Chang B.S. W. (2016). Evolutionary transformation of rod photoreceptors in the all-cone retina of a diurnal garter snake. Proceedings of the National Academy of Sciences. 113 (2): 356—361. doi:10.1073/pnas.1513284113. ISSN 0027-8424.
- ↑ а б Bhattacharyya N., Darren B., Schott R.S., Tropepe V., Chang B. (2016). Cone-like rhodopsin expressed in the all cone retina of the colubrid pine snake as a potential adaptation to diurnality. BioRxiv. The preprint server for biology. 113 (2): 356—361. doi:10.1101/100792. ISSN 0027-8424.
- ↑ Yoshizawa T. and Fukada Y. (1993). Preparation and Characterization of Chicken Rod and Cone Pigments. У Hargrave P.A. (ред.). Photoreceptor Cells. Methods in Neurosciences. Т. 15. Elsevier Science. с. 161—179. ISBN 978-1-4832-1754-3.
- ↑ Shichida Y. and Matsuyama T. (2009). Evolution of opsins and phototransduction. Philosophical Transactions of the Royal Society B: Biological Sciences. 364 (1531): 2881—2895. doi:10.1098/rstb.2009.0051. ISSN 0962-8436.
- ↑ Arshavsky V.Y., Lamb T.D. and Pugh E.N. (2002). G Proteins and Phototransduction. Annual Review of Physiology. 64 (1): 153—187. doi:10.1146/annurev.physiol.64.082701.102229. ISSN 0066-4278.
- ↑ Yau K.-W. and Hardie R.C. (2009). Phototransduction Motifs and Variations. Cell. 139 (2): 246—264. doi:10.1016/j.cell.2009.09.029. ISSN 0092-8674.
- ↑ Lamb T.D. (1995). Photoreceptor spectral sensitivities: Common shape in the long-wavelength region. Vision Research. 35 (22): 3083—3091. doi:10.1016/0042-6989(95)00114-F. ISSN 0042-6989.
- ↑ Kochendoerfer G.G., Lin S.W., Sakmar T. P. and Mathies R.A. (1999). How color visual pigments are tuned. Trends in Biochemical Sciences. 24 (8): 300—305. doi:10.1016/S0968-0004(99)01432-2. ISSN 0968-0004.
- ↑ Bowmaker J.K. (1998). Visual Pigments and Molecular Genetics of Color Blindness. News in physiological sciences. 13: 63—69. PMID 11390764.
- ↑ Baylor D A, Nunn B J, and Schnapf J L (1987). Spectral sensitivity of cones of the monkey Macaca fascicularis. The Journal of Physiology. 390 (1): 145—160. doi:10.1113/jphysiol.1987.sp016691. ISSN 0022-3751.
- ↑ Schnapf J. L., Kraft T. W. (1987). Spectral sensitivity of human cone photoreceptors. Nature. 325 (6103): 439—441. doi:10.1038/325439a0. ISSN 0028-0836.
{{cite journal}}: Текст «, and Baylor D. A.» проігноровано (довідка) - ↑ Schnapf J.L., Kraft T.W., Nunn B.J. and Baylor D.A. (2009). Spectral sensitivity of primate photoreceptors. Visual Neuroscience. 1 (03): 255—261. doi:10.1017/S0952523800001917. ISSN 0952-5238.
- ↑ Bowmaker J.K. (2008). Evolution of vertebrate visual pigments. Vision Research. 48 (20): 2022—2041. doi:10.1016/j.visres.2008.03.025. ISSN 0042-6989.
- ↑ а б Okano T, Kojima D, Fukada Y, Shichida Y, and Yoshizawa T (1992). Primary structures of chicken cone visual pigments: vertebrate rhodopsins have evolved out of cone visual pigments. Proceedings of the National Academy of Sciences of the United States of America. 89 (13): 5932—6. PMC 402112. PMID 1385866. Помилка цитування: Некоректний тег
<ref>; назва «Okano1992» визначена кілька разів з різним вмістом - ↑ Yokoyama S. (2000). Molecular evolution of vertebrate visual pigments. Progress in Retinal and Eye Research. 19 (4): 385—419. doi:10.1016/S1350-9462(00)00002-1. ISSN 1350-9462.
- ↑ Martin, Graham R. (30 March 2017). The Sensory Ecology of Birds. 320. OUP Oxford. ISBN 978-0-19-252054-8.
- ↑ Fitzgibbon J1, Hope A, Slobodyanyuk SJ, Bellingham J, Bowmaker JK, and Hunt DM. (1995). The rhodopsin-encoding gene of bony fish lacks introns. Gene. 164 (2): 273—277. doi:10.1016/0378-1119(95)00458-I. ISSN 0378-1119.
- ↑ Hunt D.M., Carvalho L.S., Cowing J.A., Parry J. W. L. , Wilkie S.E., Davies W.L. and Bowmaker J.K. (2007). Spectral Tuning of Shortwave-sensitive Visual Pigments in Vertebrates. Photochemistry and Photobiology. 83 (2): 303—310. doi:10.1562/2006-06-27-IR-952. ISSN 0031-8655.
- ↑ Bridges C.D.B. (1972). The Rhodopsin-Porphyropsin Visual System. У Dartnall, H.J.A. (ред.). Photochemistry of Vision. Springer. с. 417—480. ISBN 978-3-642-65066-6.
- ↑ Hárosi F. I. (1994). An analysis of two spectral properties of vertebrate visual pigments. Vision Research. 34 (11): 1359—1367. doi:10.1016/0042-6989(94)90134-1. ISSN 0042-6989.
- ↑ Parry J.W.L. and Bowmaker J.K. (2000). Visual pigment reconstitution in intact goldfish retina using synthetic retinaldehyde isomers. Vision Research. 40 (17): 2241—2247. doi:10.1016/S0042-6989(00)00101-2. ISSN 0042-6989.
- ↑ Copenhagen D.R., and Jahr C.E. (1989). Release of endogenous excitatory amino acids from turtle photoreceptors. Nature. 341 (6242): 536—539. doi:10.1038/341536a0. ISSN 0028-0836.
- ↑ а б Hargrave P.A. and McDowell J.H. (1992). Rhodopsin and phototransduction: a model system for G protein-linked receptors. The FASEB Journal. 6 (6): 2323—31. PMID 1544542.
- ↑ а б в Arshavsky V. Y. and Burns M. E. (2012). Photoreceptor Signaling: Supporting Vision across a Wide Range of Light Intensities. Journal of Biological Chemistry. 287 (3): 1620—1626. doi:10.1074/jbc.R111.305243. ISSN 0021-9258.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Luo D.-G., Xue T. and Yau K.-W. (2008). How vision begins: An odyssey. Proceedings of the National Academy of Sciences. 105 (29): 9855—9862. doi:10.1073/pnas.0708405105. ISSN 0027-8424.
- ↑ Rushton W. A. H. (1972). Pigments and signals in colour vision.Review Lecture. The Journal of Physiology. 220 (3): 1—31. doi:10.1113/jphysiol.1972.sp009719. ISSN 0022-3751.
- ↑ а б Ebrey T.G. and Kumauchi M. (6 березня 2006). Visual Pigments as Photoreceptors. У Briggs W.R. & Spudich J.L. (ред.). Handbook of Photosensory Recep-tors. John Wiley & Sons. с. 43—72. ISBN 978-3-527-60485-2.
- ↑ Sharpe LT, Stockman A, Jagle H, and Nathans J. (28 травня 2001). Opsin genes, cone photopigments, color vision, and color blindness. У Gegenfurtner K.R. and Sharpe L. (ред.). Color Vision: From Genes to Perception. Cambridge University Press. с. 3—52. ISBN 978-0-521-00439-8.
- ↑ Mollon J. D. (1977). The oddity of blue (PDF). Nature. 268 (5621): 587—588. doi:10.1038/268587a0. ISSN 0028-0836.
- ↑ Schwalbe, G. (1874). Mikroskopische Anatomie der Sehnerven, der Netzhaut und des Glaskörpers. У Graefe A. & Saemisch T. (ред.). Handbuch der gesammten Augenheilkunde: Anatomie und Physiologie (German) . Wilhelm Engelmann. с. 321—479.
- ↑ а б Luo D.-G., Yue W. W. S., Ala-Laurila P., and Yau K.-W. (2011). Activation of Visual Pigments by Light and Heat. Science. 332 (6035): 1307—1312. doi:10.1126/science.1200172. ISSN 0036-8075.
- ↑ Arey L.B.Changes in the rod-visual cells of the frog due to the action of light. The Journal of Comparative Neurology. 26 (4): 429—442. 1916. doi:10.1002/cne.900260406. ISSN 0021-9967.
- ↑ Nilsson S.E.G.An electron microscopic classification of the retinal receptors of the leopard frog (Rana pipiens). Journal of Ultrastructure Research. 10 (5-6): 390—416. 1964. doi:10.1016/S0022-5320(64)80018-6. ISSN 0022-5320.
- ↑ а б Donner K. O. and Reuter T. (1976). Visual Pigments and Photoreceptor Function. У Llinas R. & Precht W. (ред.). Frog Neurobiology: A Handbook. Springer. с. 251—277. ISBN 978-3-642-66316-1.
- ↑ Denton E. J. and Wyllie J. H.Study of the photosensitive pigments in the pink and green rods of the frog. The Journal of Physiology. 127 (1): 81—89. 1955. doi:10.1113/jphysiol.1955.sp005239. ISSN 0022-3751.
- ↑ Dartnall H.J.A.The visual pigment of the green rods. Vision Research. 7 (1-2): 1—16. 1967. doi:10.1016/0042-6989(67)90022-3. ISSN 0042-6989.
- ↑ Roth, Gerhard (1987). Visual Behavior in Salamanders. Studies of Brain Function. Т. 14. Springer. с. 301. ISBN 978-3-642-72713-9.
- ↑ Harosi F. (1975). Absorption spectra and linear dichroism of some amphibian photoreceptors. The Journal of General Physiology. 66 (3): 357—382. doi:10.1085/jgp.66.3.357. ISSN 0022-1295.
- ↑ Makino C.L., Groesbeek M., Lugtenburg J., and Baylor D.A. (1999). Spectral Tuning in Salamander Visual Pigments Studied with Dihydroretinal Chromophores. Biophysical Journal. 77 (2): 1024—1035. doi:10.1016/S0006-3495(99)76953-5. ISSN 0006-3495.
- ↑ Miller W.H. and Snyder A.W. (1972). Optical function of myoids. Vision Research. 12 (11): 1841—1848. doi:10.1016/0042-6989(72)90074-0. ISSN 0042-6989.
- ↑ Govardovskii V.I. and Reuter T. (2014). Why do green rods of frog and toad retinas look green?. Journal of Comparative Physiology A. 200 (9): 823—835. doi:10.1007/s00359-014-0925-z. ISSN 0340-7594.
- ↑ Liebman P.A. and Entine G. (1968). Visual pigments of frog and tadpole (Rana pipiens). Vision Research. 8 (7): 761—IN7. doi:10.1016/0042-6989(68)90128-4. ISSN 0042-6989.
- ↑ Zhang J. and Wu S.M. (2009). Immunocytochemical analysis of photoreceptors in the tiger salamander retina. Vision Research. 49 (1): 64—73. doi:10.1016/j.visres.2008.09.031. ISSN 0042-6989.
- ↑ Hisatomi O., Takahashi Y, Taniguchi Y, Tsukahara Y, Tokunaga F. (1999). Primary structure of a visual pigment in bullfrog green rods. FEBS Letters. 447 (1): 44—48. doi:10.1016/S0014-5793(99)00209-4. ISSN 0014-5793.
- ↑ а б в Ma J, Znoiko S, Othersen KL, Ryan JC, Das J, Isayama T, Kono M, Oprian DD, Corson DW, Cornwall MC, Cameron DA, Harosi FI, Makino CL, and Crouch RK. (2001). A Visual Pigment Expressed in Both Rod and Cone Photoreceptors. Neuron. 32 (3): 451—461. doi:10.1016/S0896-6273(01)00482-2. ISSN 0896-6273.
- ↑ Darden AG, Wu BX, Znoiko SL, Hazard ES 3rd, Kono M, Crouch RK, and Ma JX. (2003). A novel Xenopus SWS2, P434 visual pigment: structure, cellular location, and spectral analyses. Molecular Vision. 9: 191—9. PMID 12764253.
- ↑ Reuter T. (1966). The synthesis of photosensitive pigments in the rods of the frog's retina. Vision Research. 6 (1-2): 15—38. doi:10.1016/0042-6989(66)90011-3. ISSN 0042-6989.
- ↑ Dartnall H.J.A. (1967). The visual pigment of the green rods. Vision Research. 7 (1-2): 1—16. doi:10.1016/0042-6989(67)90022-3. ISSN 0042-6989.
- ↑ Matthews G. (1984). Dark noise in the outer segment membrane current of green rod photoreceptors from toad retina. The Journal of Physiology. 349 (1): 607—618. doi:10.1113/jphysiol.1984.sp015176. ISSN 0022-3751.
- ↑ Lamb T.D. (2013). Evolution of phototransduction, vertebrate photoreceptors and retina. Progress in Retinal and Eye Research. 36: 52—119. doi:10.1016/j.preteyeres.2013.06.001. ISSN 1350-9462.
- ↑ Donner K. (1992). Noise and the absolute thresholds of cone and rod vision. Vision Research. 32 (5): 853—866. doi:10.1016/0042-6989(92)90028-H. ISSN 0042-6989.
- ↑ Muntz W. R. A. (1962). Effectiveness of different colors of light in releasing positive phototactic behavior of frogs, and a possible function of retinal projection to diencephalon. Journal of Neurophysiology. 25 (4893): 712—720.
- ↑ Muntz W. R. A. (1963). Phototaxis and Green Rods in Urodeles. Nature. 199 (4893): 620—620. doi:10.1038/199620a0. ISSN 0028-0836.
- ↑ а б Ali M. A. and Klyne M.A. (1985). Vision in Vertebrates. Springer. с. 272. ISBN 978-1-4684-9129-6.
- ↑ а б в Wagner, Hans-Joachim (1978). Cell Types and Connectivity Patterns in Mosaic Retinas. Springer. с. 84. ISBN 978-3-642-67071-8.
- ↑ Cameron D.A. and Easter S.S. (1995). Cone photoreceptor regeneration in adult fish retina: phenotypic determination and mosaic pattern formation. Journal of Neuroscience. 15 (3 Pt 2): 2255—71. PMID 7891164.
- ↑ Heß Martin (2009). Triple cones in the retinae of three anchovy species: Engraulis encrasicolus, Cetengraulis mysticetus and Anchovia macrolepidota (Engraulididae, Teleostei). Vision Research. 49 (12): 1569—1582. doi:10.1016/j.visres.2009.03.016. ISSN 0042-6989.
- ↑ а б Bowmaker J.K. (19 квітня 2012). Evolution of the vertebrate eye. У Lazareva O.G., Shimizu T. & Wasserman E.A. (ред.). How Animals See the World: Comparative Behavior, Biology, and Evolution of Vision. Oxford University Press. с. 441—472. ISBN 978-0-19-533465-4.
- ↑ а б Lyall A.H. (1957). Cone Arrangements in Teleost Retinae. Journal of Microscopical Science. 98: 189—201.
- ↑ а б Engström K. (1963). Cone Types and Cone Arrangements in Teleost Retinae. Acta Zoologica. 44 (1-2): 179—243. doi:10.1111/j.1463-6395.1963.tb00408.x. ISSN 0001-7272.
- ↑ а б в Wagner H.-J. (1990). Retinal structure of fishes. У Douglas R. & Djamgoz M. (ред.). The Visual System of Fish. Springer. с. 109—157. ISBN 978-94-009-0411-8.
- ↑ Ali MA, Hárosi FI, and Wagner HJ (1978). Photoreceptors and visual pigments in a cichlid fish, Nannacara anomala. Sensory processes. 2 (2): 130—45. PMID 715468.
- ↑ Flamarique I.N., Hawryshyn C. W., and Hárosi F.I. (1998). Double-cone internal reflection as a basis for polarization detection in fish. Journal of the Optical Society of America A. 15 (2): 349. doi:10.1364/JOSAA.15.000349. ISSN 1084-7529.
- ↑ Hawryshyn, Craig W. (2000). Ultraviolet polarization vision in fishes: possible mechanisms for coding e-vector. Philosophical Transactions of the Royal Society B: Biological Sciences. 355 (1401): 1187—1190. doi:10.1098/rstb.2000.0664. ISSN 0962-8436.
- ↑ а б Roberts N.W. (30 жовтня 2014). Polarisation Vision of Fishes. У Horváth G. (ред.). Polarized Light and Polarization Vision in Animal Sciences. Springer Series in Vision Research. Т. 2. Springer. с. 225—247. ISBN 978-3-642-54718-8.
- ↑ Cameron D.A. and Pugh E.N. (1991). Double cones as a basis for a new type of polarization vision in vertebrates. Nature. 353 (6340): 161—164. doi:10.1038/353161a0. ISSN 0028-0836.
- ↑ а б Rowe M. P., Engheta N., Easter S. S. and Pugh E. N. (1994). Graded-index model of a fish double cone exhibits differential polarization sensitivity. Journal of the Optical Society of America A. 11 (1): 55. doi:10.1364/JOSAA.11.000055. ISSN 1084-7529. Помилка цитування: Некоректний тег
<ref>; назва «Rowe1994» визначена кілька разів з різним вмістом - ↑ Flamarique I.N. and Hawryshyn C.W. (1997). No Evidence of Polarization Sensitivity in Freshwater Sunfish from Multi-unit Optic Nerve Recordings. Vision Research. 37 (8): 967—973. doi:10.1016/S0042-6989(96)00243-X. ISSN 0042-6989.
- ↑ Roberts N.W. and Needham M.G. (2007). A Mechanism of Polarized Light Sensitivity in Cone Photoreceptors of the Goldfish Carassius auratus. Biophysical Journal. 93 (9): 3241—3248. doi:10.1529/biophysj.107.112292. ISSN 0006-3495.
- ↑ Loew E.R. and Lythgoe J.N. (1978). The ecology of cone pigments in teleost fishes. Vision Research. 18 (6): 715—722. doi:10.1016/0042-6989(78)90150-5. ISSN 0042-6989.
- ↑ Levine J. S. & MacNichol Jr, E. F. (June 1979). Visual pigments in teleost fishes: effects of habitat, microhabitat, and behavior on visual system evolution. Sensory processes. 3 (2): 95—131. PMID 545702.
- ↑ Fang M, Li J, Wai SM, Kwong WH, Kung LS, and Yew DT. (2009). Retinal twin cones or retinal double cones in fish: misnomer or different morphological forms?. International Journal of Neuroscience. 115 (7): 981—987. doi:10.1080/00207450590901422. ISSN 0020-7454.
- ↑ Burkhardt D.A., Hassin G., Levine J.S. and MacNichol E.F. (1980). Electrical responses and photopigments of twin cones in the retina of the walleye. The Journal of Physiology. 309 (1): 215—228. doi:10.1113/jphysiol.1980.sp013505. ISSN 0022-3751.
- ↑ Marchiafava P. L. (1985). Cell Coupling in Double Cones of the Fish Retina. Proceedings of the Royal Society B: Biological Sciences. 226 (1243): 211—215. doi:10.1098/rspb.1985.0091. ISSN 0962-8452.
- ↑ Miller James L. and Korenbrot J.I. (1993). Phototransduction and adaptation in rods, single cones, and twin cones of the striped bass retina: A comparative study. Visual Neuroscience. 10 (04): 653—667. doi:10.1017/S0952523800005356. ISSN 0952-5238.
- ↑ Bowmaker JK , Govardovskii VI , Shukolyukov SA , Zueva LV , Hunt DM , Sideleva VG , and Smirnova OG (1994). Visual pigments and the photic environment: The cottoid fish of Lake Baikal. Vision Research. 34 (5): 591—605. doi:10.1016/0042-6989(94)90015-9. ISSN 0042-6989.
- ↑ Osorio D. and Vorobyev M. (2005). Photoreceptor sectral sensitivities in terrestrial animals: adaptations for luminance and colour vision. Proceedings of the Royal Society B: Biological Sciences. 272 (1574): 1745—1752. doi:10.1098/rspb.2005.3156. ISSN 0962-8452.
- ↑ Jones C.D. and Osorio D. (2004). Discrimination of oriented visual textures by poultry chicks. Vision Research. 44 (1): 83—89. doi:10.1016/j.visres.2003.08.014. ISSN 0042-6989.
- ↑ Hart N. (2001). Variations in cone photoreceptor abundance and the visual ecology of birds. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 187 (9): 685—697. doi:10.1007/s00359-001-0240-3. ISSN 0340-7594.
- ↑ Hart N.S. (2001). The Visual Ecology of Avian Photoreceptors. Progress in Retinal and Eye Research. 20 (5): 675—703. doi:10.1016/S1350-9462(01)00009-X. ISSN 1350-9462.
- ↑ Bowmaker JK, Dartnall HJA, and Mollon JD. (1980). Microspectrophotometric demonstration of four classes of photoreceptor in an old world primate, Macaca fascicularis. The Journal of Physiology. 298 (1): 131—143. doi:10.1113/jphysiol.1980.sp013071. ISSN 0022-3751.
- ↑ Ahnelt P.K. and Kolb H. (2000). The mammalian photoreceptor mosaic-adaptive design. Progress in Retinal and Eye Research. 19 (6): 711—777. doi:10.1016/S1350-9462(00)00012-4. ISSN 1350-9462.
- ↑ а б Curcio C., Sloan K., Packer O., Hendrickson A. and Kalina R. (1987). Distribution of cones in human and monkey retina: individual variability and radial asymmetry. Science. 236 (4801): 579—582. doi:10.1126/science.3576186. ISSN 0036-8075.
- ↑ Jeon CJ, Strettoi E, and Masland RH (1998). The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21): 8936—46. PMID 9786999.
- ↑ Werblin FS and Dowling JE (1969). Organization of the retina of the mudpuppy, Necturus maculosus. II. Intracellular recording. Journal of Neurophysiology. 32 (3): 339—55. PMID 4306897.
- ↑ а б Valberg, Arne (3 лютого 2007). Light Vision Col-or. John Wiley & Sons. с. 474. ISBN 978-0-470-01212-3.
- ↑ Burkhardt DA (1994). Light adaptation and photopigment bleaching in cone photoreceptors in situ in the retina of the turtle. Journal of Neuroscience. 14 (3 Pt 1): 1091—105. PMID 8120614.
- ↑ Bortoff A. (1964). Localization of slow potential responses in the Necturus retina. Vision Research. 4 (11-12): 627—IN9. doi:10.1016/0042-6989(64)90048-3. ISSN 0042-6989.
- ↑ Трифонов, Юрий А. (1968). [Изучение синаптической передачи между фоторецептором и горизонтальной клеткой при помощи электрических раздражении сетчатки. Биофизика. 13 (5): 809—17. PMID 4318318.
- ↑ Toyoda J.-I., Nosaki H., and Tomita T. (1969). Light-induced resistance changes in single photoreceptors of necturus and gekko. Vision Re-search. 9 (4): 453—463. doi:10.1016/0042-6989(69)90134-5. ISSN 0042-6989.
- ↑ Baylor D. A. and Fuortes M. G. F. (1970). Electrical responses of single cones in the retina of the turtle. The Journal of Physiology. 207 (1): 77—92. doi:10.1113/jphysiol.1970.sp009049. ISSN 0022-3751.
- ↑ Tomita T. (1970). Electrical activity of vertebrate photoreceptors. Quarterly Reviews of Biophysics. 3 (02): 179. doi:10.1017/S0033583500004571. ISSN 0033-5835.
- ↑ Schaeffer S. F. and Raviola E. (1978). Membrane recycling in the cone cell endings of the turtle retina. The Journal of Cell Biolo-gy. 79 (3): 802—825. doi:10.1083/jcb.79.3.802. ISSN 0021-9525.
- ↑ Hecht S. (1942). The Quantum Relations of Vision. Journal of the Optical Society of Ameri-ca. 32 (1): 42. doi:10.1364/JOSA.32.000042. ISSN 0030-3941.
- ↑ Grünert U. and Martin P.R. (1991). Rod bipolar cells in the macaque monkey retina: immunoreactivity and connectivity. Journal of Neuroscience. 11 (9): 2742—58. PMID 1715391.
- ↑ Young H.M. and Vaney D.d I. (1991). Rod-signal interneurons in the rabbit retina: 1. Rod bipolar cells. The Journal of Comparative Neurology. 310 (2): 139—153. doi:10.1002/cne.903100202. ISSN 0021-9967.
- ↑ Tessier-Lavigne, M. (5 січня 2000). Visual processing by the retina. У Kandel E., Schwartz J. and Jessell T. (ред.). Principles of Neural Science, Fourth Edi-tion. McGraw-Hill. с. 507—522. ISBN 978-0-8385-7701-1.
- ↑ Schmidt W. J. (1935). Doppelbrechung, Dichroismus und Feinbau des Aussengliedes der Sehzellen vom Frosch. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 22 (4): 485—522. doi:10.1007/BF00549049. ISSN 0302-766X.
- ↑ Schmidt W. J. (1938). Polarisationsoptische Analyse eines Eiweiß-Lipoid-Systems, erläutert am Außenglied der Sehzellen. Kolloidzeitschrift. 85 (2-3): 137—148. doi:10.1007/BF01519261. ISSN 0303-402X.
- ↑ Sjöstrand Fritiof S. (1949). An electron microscope study of the retinal rods of the guinea pig eye. Journal of Cellular and Comparative Physiology. 33 (3): 383—403. doi:10.1002/jcp.1030330309. ISSN 0095-9898.
- ↑ Sjöstrand Fritiof S. (1953). The ultrastructure of the outer segments of rods and cones of the eye as revealed by the electron microscope. Journal of Cellular and Comparative Physiology. 42 (1): 15—44. doi:10.1002/jcp.1030420103. ISSN 0095-9898.
- ↑ Sjöstrand Fritiof S. (1953). The ultrastructure of the inner segments of the retinal rods of the guinea pig eye as revealed by electron microscopy. Journal of Cellular and Comparative Physiology. 42 (1): 45—70. doi:10.1002/jcp.1030420104. ISSN 0095-9898.
- ↑ Daemen Frans J.M. (1973). Vertebrate rod outer segment membranes. Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes. 300 (3): 255—288. doi:10.1016/0304-4157(73)90006-3. ISSN 0304-4157.
- ↑ а б De Robertis E. (1956). Electron microscope observations on the submicroscopic organization of the retinal rods. The Journal of Cell Biology. 2 (3): 319—330. doi:10.1083/jcb.2.3.319. ISSN 0021-9525.
- ↑ Cohen Adolph I. (1961). The fine structure of the extrafoveal receptors of the rhesus monkey. Experimental Eye Research. 1 (2): 128—IN16. doi:10.1016/S0014-4835(61)80018-3. ISSN 0014-4835.
- ↑ Cohen Adolph I. (1963). Vertebrate retinal cells and their organization. Biological Reviews. 38 (4): 427—459. doi:10.1111/j.1469-185X.1963.tb00789.x. ISSN 1464-7931.
- ↑ Dowling J. E. (1965). Foveal Receptors of the Monkey Retina: Fine Structure. Science. 147 (3653): 57—59. doi:10.1126/science.147.3653.57. ISSN 0036-8075.
- ↑ Wolken Jerome J. (1963). Structure and Molecular Organization of Retinal Photoreceptors. Journal of the Optical Society of America. 53 (1): 1. doi:10.1364/JOSA.53.000001. ISSN 0030-3941.
- ↑ а б в Nickell S., Park P.S., Baumeister W., and Palczewski K. (2007). Three-dimensional architecture of murine rod outer segments determined by cryoelectron tomography. The Journal of Cell Biology. 177 (5): 917—925. doi:10.1083/jcb.200612010. ISSN 0021-9525.
- ↑ Gilliam JC, Chang JT, Sandoval IM, Zhang Y, Li T, Pittler SJ, Chiu W, and Wensel TG. (2012). Three-Dimensional Architecture of the Rod Sensory Cilium and Its Disruption in Retinal Neurodegeneration. Cell. 151 (5): 1029—1041. doi:10.1016/j.cell.2012.10.038. ISSN 0092-8674.
- ↑ Hendrickson Anita and Drucker David (1992). The development of parafoveal and mid-peripheral human retina. Behavioural Brain Research. 49 (1): 21—31. doi:10.1016/S0166-4328(05)80191-3. ISSN 0166-4328.
- ↑ Carter-Dawson L. D. and Lavail M.M. (1979). Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy. The Journal of Comparative Neurology. 188 (2): 245—262. doi:10.1002/cne.901880204. ISSN 0021-9967.
- ↑ а б в Hárosi F.I. and Novales F.I. (2012). Functional significance of the taper of vertebrate cone photoreceptors. The Journal of General Physiology. 139 (2): 159—187. doi:10.1085/jgp.201110692. ISSN 0022-1295.
- ↑ а б в г д Chen Jeannie and Sampath Alapakkam P. (1 November 2012). Chapter 14. Structure and Function of Rod and Cone Photoreceptors. У Stephen J. Ryan, Andrew P. Schachat, Charles P. Wilkinson, David R. Hinton, SriniVas R. Sadda, Peter Wiedemann (ред.). Retina. Т. Vol. 1. Elsevier Health Sciences. с. 342—359. ISBN 1-4557-3780-1.
- ↑ Mustafi D, Engel AH, and Palczewski K. (2009). Structure of cone photoreceptors. Progress in Retinal and Eye Research. 28 (4): 289—302. doi:10.1016/j.preteyeres.2009.05.003. ISSN 1350-9462.
- ↑ а б Palczewski K. (2011). Chemistry and Biology of Vision. Journal of Biological Chemistry. 287 (3): 1612—1619. doi:10.1074/jbc.R111.301150. ISSN 0021-9258.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Reingruber J., Holcman D., and Fain G.L. (2015). How rods respond to single photons: Key adaptations of a G-protein cascade that enable vision at the physical limit of perception. BioEssays. 37 (11): 1243—1252. doi:10.1002/bies.201500081. ISSN 0265-9247.
- ↑ Oldham W.M. and Hamm H.E. (2008). Heterotrimeric G protein activation by G-protein-coupled receptors. Nature Reviews Molecular Cell Biology. 9 (1): 60—71. doi:10.1038/nrm2299. ISSN 1471-0072.
- ↑ Liang Y., Fotiadis D., Maeda T., Maeda A., Modzelewska A., Filipek S., Saperstein D. A., Engel A. and Palczewski K. (2004). Rhodopsin Signaling and Organization in Heterozygote Rhodopsin Knockout Mice. Journal of Biological Chemistry. 279 (46): 48189—48196. doi:10.1074/jbc.M408362200. ISSN 0021-9258.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Mayhew T. M. and Astle D. (1997). Photoreceptor number and outer segment disk membrane surface area in the retina of the rat: stereological data for whole organ and average photoreceptor cell. Journal of Neurocytology. 26 (1): 53—61. doi:10.1023/A:1018563409196. ISSN 0300-4864.
- ↑ Liebman P.A. and Entine G. (1974). Lateral Diffusion of Visual Pigment in Photoreceptor Disk Membranes. Science. 185 (4149): 457—459. doi:10.1126/science.185.4149.457. ISSN 0036-8075.
- ↑ Fotiadis D., Liang Y., Filipek S., Saperstein D.A., Engel A., and Palczewski K. (2003). Atomic-force microscopy: Rhodopsin dimers in native disc membranes. Nature. 421 (6919): 127—128. doi:10.1038/421127a. ISSN 0028-0836.
- ↑ Liang Y., Fotiadis D., Filipek S., Saperstein D. A. Palczewski K., and Engel A. (2003). Organization of the G Protein-coupled Receptors Rhodopsin and Opsin in Native Membranes. Journal of Biological Chemistry. 278 (24): 21655—21662. doi:10.1074/jbc.M302536200. ISSN 0021-9258.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Gunkel M., Schöneberg J., Alkhaldi W., Irsen S., Noé F., Kaupp U.B., and Al-Amoudi A. (2015). Higher-Order Architecture of Rhodopsin in Intact Photoreceptors and Its Implication for Phototransduction Kinetics. Structure. 23 (4): 628—638. doi:10.1016/j.str.2015.01.015. ISSN 0969-2126.
- ↑ Fu Y. and Yau K.-W. (2007). Phototransduction in mouse rods and cones. Pflügers Archiv - European Journal of Physiology. 454 (5): 805—819. doi:10.1007/s00424-006-0194-y. ISSN 0031-6768.
- ↑ Nakatani K. and Yau K W (1988). Calcium and magnesium fluxes across the plasma membrane of the toad rod outer segment. The Journal of Physiology. 395 (1): 695—729. doi:10.1113/jphysiol.1988.sp016942. ISSN 0022-3751.
- ↑ Picones A. and Korenbrot J.I. (1995). Permeability and interaction of Ca2+ with cGMP-gated ion channels differ in retinal rod and cone photoreceptors. Biophysical Journal. 69 (1): 120—127. doi:10.1016/S0006-3495(95)79881-2. ISSN 0006-3495.
- ↑ Pugh E.N. and Lamb T.D. (1993). Amplification and kinetics of the activation steps in phototransduction. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1141 (2-3): 111—149. doi:10.1016/0005-2728(93)90038-H. ISSN 0005-2728.
- ↑ Karpen Jeffrey W. and Ruiz MariaLuisa (1997). Single cyclic nucleotide-gated channels locked in different ligand-bound states. Nature. 389 (6649): 389—392. doi:10.1038/38744. ISSN 0028-0836.
- ↑ Yau King-Wai and Nakatani Kei (1984). Electrogenic Na–Ca exchange in retinal rod outer segment. Nature. 311 (5987): 661—663. doi:10.1038/311661a0. ISSN 0028-0836.
- ↑ а б Young R. W. (1967). The renewal of photoreceptor cell outer segments. The Journal of Cell Biology. 33 (1): 61—72. doi:10.1083/jcb.33.1.61. ISSN 0021-9525.
- ↑ Young RW (1969). A difference between rods and cones in the renewal of outer segment protein. Investigative Ophthalmology & Visual Science. 8 (2): 222—31. PMID 5777484.
- ↑ LaVail .=M. M. (1973). Kinetics of rod outer segment renewal in the developing mouse retina. The Journal of Cell Biology. 58 (3): 650—661. doi:10.1083/jcb.58.3.650. ISSN 0021-9525.
- ↑ Besharse J., Hollyfield J., and Rayborn M. (1977). Photoreceptor outer segments: accelerated membrane renewal in rods after exposure to light. Science. 196 (4289): 536—538. doi:10.1126/science.300504. ISSN 0036-8075.
- ↑ а б в Young R. W. and Bok D. (1969). Participation of the retinal pigment epithelium in the rod outer segment renewal process. The Journal of Cell Biology. 42 (2): 392—403. doi:10.1083/jcb.42.2.392. ISSN 0021-9525.
- ↑ Hogan M. J., Wood I., and Steinberg R.H. (1974). Phagocytosis by pigment epithelium of human retinal cones. Nature. 252 (5481): 305—307. doi:10.1038/252305a0. ISSN 0028-0836.
- ↑ Anderson DH, Fisher SK, Steinberg RH (1978). Mammalian cones: disc shedding, phagocytosis, and renewal. Investigative Ophthalmology & Visual Science. 17 (2): 117—33. PMID 415019.
- ↑ а б Kevany B. M. and Palczewski K. (2010). Phagocytosis of Retinal Rod and Cone Photoreceptors. Physiology. 25 (1): 8—15. doi:10.1152/physiol.00038.2009. ISSN 1548-9213.
- ↑ Bok D. (1993). The retinal pigment epithelium: a versatile partner in vision. Journal of Cell Science. 1993 (Supplement 17): 189—195. doi:10.1242/jcs.1993.Supplement_17.27. ISSN 0021-9533.
- ↑ Merriman D.K., Sajdak B.S., Li W., and Jones B.W. (2016). Seasonal and post-trauma remodeling in cone-dominant ground squirrel retina. Experimental Eye Research. 150: 90—105. doi:10.1016/j.exer.2016.01.011. ISSN 0014-4835.
- ↑ а б в Remé C.E. and Young R.W. (1977). The effects of hibernation on cone visual cells in the ground squirrel. Investigative Ophthalmology & Visual Science. 16 (9): 815—40. PMID 893032.
- ↑ а б Kuwabara T. (1975). Cytologic changes of the retina and pigment epithelium during hibernation. Investigative Ophthalmology & Visual Science. 14 (6): 457—67. PMID 166050.
- ↑ Gruber A.R., Betts K.E., Lewis G.P., Fisher S.K., and Vaughan D.K. (2006). Photoreceptor Antigens Are Altered During Seasonal Hibernation of a Cone–Dominant Rodent. ARVO Annual Meeting Abstract. Investigative Ophthalmology & Visual Science. 47 (2845): 915—8.
- ↑ Ames III Adelbert (1992). Energy requirements of CNS cells as related to their function and to their vulnerability to ischemia: a commentary based on studies on retina. Canadian Journal of Physiology and Pharmacology. 70 (S1): S158—S164. doi:10.1139/y92-257. ISSN 0008-4212.
- ↑ а б Vohnsen B., Iglesias I. and Artal P. (2005). Guided light and diffraction model of human-eye photoreceptors. Journal of the Optical Society of America A. 22 (11): 2318. doi:10.1364/JOSAA.22.002318. ISSN 1084-7529.
- ↑ Baylor D.A. and Fettiplace R. (1975). Light path and photon capture in turtle photoreceptors. The Journal of Physiology. 248 (2): 433—464. doi:10.1113/jphysiol.1975.sp010983. ISSN 0022-3751.
- ↑ а б Wilby, David (December 2014). Optics and Photoreception in the Avian Retina (PhD the-sis). University of Bristol. doi:10.13140/RG.2.2.18130.15043.
- ↑ а б Hoang Q.V., Linsenmeier R.A., Chung C.K. and Curcio C.A. (2002). Photoreceptor inner segments in monkey and human retina: Mitochondrial density, optics, and regional variation. Visual Neuroscience. 19 (04): 395—407. doi:10.1017/S0952523802194028. ISSN 0952-5238.
- ↑ Zuckerman, R. and Weiter, J.J. (1980). Oxygen transport in the bullfrog retina. Experimental Eye Research. 30 (2): 117—127. doi:10.1016/0014-4835(80)90106-2. ISSN 0014-4835.
- ↑ Linsenmeier R. A. (1986). Effects of light and darkness on oxygen distribution and consumption in the cat retina. The Journal of General Physiology. 88 (4): 521—542. doi:10.1085/jgp.88.4.521. ISSN 0022-1295.
- ↑ Linsenmeier, Robert A. (31 December 2007). Chapter 13. Retinal Bioengineering. У He, Bin (ред.). Neural Engineering (вид. 1). Springer. с. 458—461. ISBN 978-0-306-48610-4.
- ↑ Kageyama GH and Wong-Riley MT (1984). The histochemical localization of cytochrome oxidase in the retina and lateral geniculate nucleus of the ferret, cat, and monkey, with particular reference to retinal mosaics and ON/OFF-center visual channels. Journal of Neuroscience. 4 (10): 2445—59. PMID 6092560.
- ↑ Ahmed J, Braun RD, Dunn R and Linsenmeier RA (1993). Oxygen distribution in the macaque retina. Investigative Ophthalmology & Visual Science. 34 (3): 516—21. PMID 8449672.
- ↑ Kimble, E.A., Svoboda, R.A. and Ostroy, S.E. (1980). Oxygen consumption and ATP changes of the vertebrate photoreceptor. Experimental Eye Re-search. 31 (3): 271—288. doi:10.1016/S0014-4835(80)80037-6. ISSN 0014-4835.
- ↑ Ames A, Li YY, Heher EC, and Kimble CR (1992). Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. Journal of Neuroscience. 12 (3): 840—53. PMID 1312136.
- ↑ Haugh-Scheidt L.M., Griff E.R. and Linsenmeier R.A. (1995). Light-evoked oxygen responses in the isolated toad retina. Experimental Eye Re-search. 61 (1): 73—81. doi:10.1016/S0014-4835(95)80060-3. ISSN 0014-4835.
- ↑ Okawa H., Sampath A.P., Laughlin S.B., and Fain G.L. (2008). ATP Consumption by Mammalian Rod Photoreceptors in Darkness and in Light. Current Biology. 18 (24): 1917—1921. doi:10.1016/j.cub.2008.10.029. ISSN 0960-9822.
- ↑ а б в г Enoch Jay (1964). Physical properties of the retinal receptor and response of retinal receptors. Psychological Bulletin. 61 (4): 242—251. doi:10.1037/h0047646. ISSN 0033-2909.
- ↑ а б в Snyder Allan W. and Pask Colin (1973). The Stiles-Crawford effect—explanation and consequences. Vision Research. 13 (6): 1115—1137. doi:10.1016/0042-6989(73)90148-X. ISSN 0042-6989.
- ↑ а б Sidman R. L. (1957). The structure and concentration of solids in photoreceptor cells studied by refractometry and interference microscopy. Journal of Biophysical and Biochemical Cytology. 3 (1): 15—30. doi:10.1083/jcb.3.1.15. ISSN 0021-9525.
- ↑ Enoch Jay M. (1961). Visualization of Wave-Guide Modes in Retinal Receptors. American Journal of Ophthalmology. 51 (5): 1107/235–1118/246. doi:10.1016/0002-9394(61)91800-1. ISSN 0002-9394.
- ↑ Говардовский В.И., Голованевский Э.И., Зуева Л.В., Васильева И.Л. (1981). Роль клеточных органоидов в оптике фоторецепторов (исследование на СВЧ-моделях). Журнал эволюционной биохимии и физиологии. 17 (5): 492—7. PMID 7293565.
- ↑ Rowe M.P., Engheta N., Corless J.M., and Pugh Jr., E.N. (1997). Refractive Index Gradients in Sunfish Cones. У Lakshminarayanan, V. (ред.). Basic and Clinical Applications of Vision Science: The Professor Jay M. Enoch Festschrift Volume. Documenta Ophthalmologica Proceedings Series. Т. Vol. 60. Springer. с. 51—55. ISBN 978-94-011-5698-1.
- ↑ Miller W.H. and Bernard G.D. (1983). Averaging over the foveal receptor aperture curtails aliasing. Vision Re-search. 23 (12): 1365—1369. doi:10.1016/0042-6989(83)90147-5. ISSN 0042-6989.
- ↑ а б в г Carter-Dawson Louvenia D. and Lavail Matthew M. (1979). Rods and cones in the mouse retina. I. Structural analysis using light and electron microscopy. The Journal of Comparative Neurology. 188 (2): 245—262. doi:10.1002/cne.901880204. ISSN 0021-9967.
- ↑ а б Knabe W., Skatchkov S., and Kuhn H.-J. (1997). “Lens Mitochondria” in the Retinal Cones of the Tree-shrew Tupaia belangeri. Vision Research. 37 (3): 267—271. doi:10.1016/S0042-6989(96)00199-X. ISSN 0042-6989.
- ↑ Lluch S., López-Fuster M.J. and Ventura J. (2003). Giant mitochondria in the retina cone inner seg-ments of shrews of genus Sorex (Insectivora, Soricidae). The Anatomical Record Part A: Discoveries in Molecular, Cellular, and Evolutionary Biology. 272A (2): 484—490. doi:10.1002/ar.a.10066. ISSN 1552-4884.
- ↑ Wilby D., Toomey M.B., Olsson P., Frederiksen R., Cornwall M.C., Oulton R., Kelber A., Corbo J. C., and Roberts N.W. (2015). Optics of cone photoreceptors in the chicken (Gallus gallus domesticus). Journal of The Royal Society Interface. 12 (111): 20150591. doi:10.1098/rsif.2015.0591. ISSN 1742-5689.
- ↑ а б Barbour H.R., Archer M.A., Hart N.S., Thomas N., Dunlop S.A., Beazley L.D., and Shand J. (2002). Retinal characteristics of the ornate dragon lizard, Ctenophorus ornatus. The Journal of Comparative Neurology. 450 (4): 334—344. doi:10.1002/cne.10308. ISSN 0021-9967.
- ↑ а б Collin S.P., Potter I. C. and Braekevelt C.R. (1999). The Ocular Morphology of the Southern Hemisphere Lamprey Geotria australis Gray, with Special Reference to Optical Specialisations and the Characterisation and Phylogeny of Photoreceptor Types. Brain, Behavior and Evolution. 54 (2): 96—118. doi:10.1159/000006616. ISSN 1421-9743.
- ↑ Remington Lee Ann (29 July 2011). Clinical Anatomy of the Visual System. Elsevier Health Sciences. ISBN 1-4557-2777-6.
- ↑ Fine BS and Zimmerman LE (1963). Observations on the rod and cone layer of the retina. A light and electron microscopic study. Investigative ophthalmology. 2: 446—59. PMID 14069754.
- ↑ Collin S.P., Hart N.S., Shand J., and Potter I.C. (2003). Morphology and spectral absorption characteristics of retinal photoreceptors in the southern hemisphere lamprey (Geotria australis). Visual Neuroscience. 20 (02): 119—130. doi:10.1017/S0952523803202030. ISSN 0952-5238.
- ↑ Bailes H.J., Robinson S.R., Trezise A.E.O., and Collin S.P. (2006). Morphology, characterization, and distribution of retinal photoreceptors in the Australian lungfishNeoceratodus forsteri (Krefft, 1870). The Journal of Comparative Neurology. 494 (3): 381—397. doi:10.1002/cne.20809. ISSN 0021-9967.
- ↑ Collin S.P. and Trezise A.EO. (2004). The origins of colour vision in vertebrates. Clinical and Experimental Optometry. 87 (4-5): 217—223. doi:10.1111/j.1444-0938.2004.tb05051.x. ISSN 0816-4622.
- ↑ Vorobyev M. (2003). Coloured oil droplets enhance colour discrimination. Proceedings of the Royal Society B: Biological Sciences. 270 (1521): 1255—1261. doi:10.1098/rspb.2003.2381. ISSN 0962-8452.
- ↑ Hart N.S., Bailes H.J., Vorobyev M., Marshall N.J., and Collin S.P. (2008). Visual ecology of the Australian lungfish (Neoceratodus forsteri). BMC Ecology. 8 (1): 21. doi:10.1186/1472-6785-8-21. ISSN 1472-6785.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Rachel R.A., Li T., and Swaroop A. (2012). Photoreceptor sensory cilia and ciliopathies: focus on CEP290, RPGR and their interacting proteins. Cilia. 1 (1): 22. doi:10.1186/2046-2530-1-22. ISSN 2046-2530.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Falk N., Lösl M., Schröder N., and Gießl A. (2015). Specialized Cilia in Mammalian Sensory Systems. Cells. 4 (3): 500—519. doi:10.3390/cells4030500. ISSN 2073-4409.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Insinna C. and Besharse J.C. (2008). Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Developmental Dynamics. 237 (8): 1982—1992. doi:10.1002/dvdy.21554. ISSN 1058-8388.
- ↑ а б van Lommel, Alfons T.L. (6 December 2012). From Cells to Organs: A Histology Textbook and Atlas. Springer. с. 322. ISBN 978-1-4615-0353-8.
- ↑ а б в г д е ж и к Solovei I., Kreysing M., Lanctôt C., Kösem S., Peichl L., Cremer T., Guck J, and Joffe B. (2009). Nuclear Architecture of Rod Photoreceptor Cells Adapts to Vision in Mammalian Evolution. Cell. 137 (2): 356—368. doi:10.1016/j.cell.2009.01.052. ISSN 0092-8674.
- ↑ Sokol S. (1970). Cortical and retinal spectral sensitivity of the hooded rat. Vision Research. 10 (3): 253—262. doi:10.1016/0042-6989(70)90130-6. ISSN 0042-6989.
- ↑ LaVail M.M. and Hild W. (1971). Histotypic organization of the rat retina in vitro. Zeitschrift fur Zellforschung und Mikroskopische Anatomie. 114 (4): 557—579. doi:10.1007/BF00325640. ISSN 0302-766X.
- ↑ Cremer T. and Cremer C. (2001). Chromosome territories, nuclear architecture and gene regulation in mammalian cells. Nature Reviews Genetics. 2 (4): 292—301. doi:10.1038/35066075. ISSN 1471-0056.
- ↑ Chakalova L., Debrand E., Mitchell J.A., Osborne C.S. and Fraser P. (2005). Replication and transcription: Shaping the landscape of the genome. Nature Reviews Genetics. 6 (9): 669—677. doi:10.1038/nrg1673. ISSN 1471-0056.
- ↑ а б в Joffe B., Peichl L., Hendrickson A., Leonhardt H., and Solovei I. (2013). Diurnality and Nocturnality in Primates: An Analysis from the Rod Photoreceptor Nuclei Perspective. Evolutionary Biology. doi:10.1007/s11692-013-9240-9. ISSN 0071-3260.
- ↑ Donati G., Santini L., Razafindramanana J., Boitani L., and Borgognini-Tarli S. (2013). (Un-)expected nocturnal activity in “Diurnal” Lemur cattasupports cathemerality as one of the key adaptations of the lemurid radiation. American Journal of Physical Anthropology. 150 (1): 99—106. doi:10.1002/ajpa.22180. ISSN 0002-9483.
- ↑ а б в г Błaszczak Z., Kreysing M. and Guck J. (2014). Direct observation of light focusing by single photoreceptor cell nuclei. Optics Express. 22 (9): 11043. doi:10.1364/OE.22.011043. ISSN 1094-4087.
- ↑ а б Kreysing M. , Boyde L., Guck J., and Chalut K.J. (2010). Physical insight into light scattering by photoreceptor cell nuclei. Optics Letters. 35 (15): 2639. doi:10.1364/OL.35.002639. ISSN 0146-9592.
- ↑ а б в Dowling J. E. and Boycott B. B. (1966). Organization of the Primate Retina: Electron Microscopy. Proceedings of the Royal Society B: Biological Sciences. 166 (1002): 80—111. doi:10.1098/rspb.1966.0086. ISSN 0962-8452.
- ↑ а б Haverkamp Silke, Grünert Ulrike and Wässle Heinz (2000). The Cone Pedicle, a Complex Synapse in the Retina. Neuron. 27 (1): 85—95. doi:10.1016/S0896-6273(00)00011-8. ISSN 0896-6273.
- ↑ Schmitz Frank (2009). The Making of Synaptic Ribbons: How They Are Built and What They Do. The Neuroscientist. 15 (6): 611—624. doi:10.1177/1073858409340253. ISSN 1073-8584.
- ↑ Schmitz Frank, Königstorfer Andreas and Südhof Thomas C. (2000). RIBEYE, a Component of Synaptic Ribbons. Neuron. 28 (3): 857—872. doi:10.1016/S0896-6273(00)00159-8. ISSN 0896-6273.
- ↑ Jackman Skyler L., Choi Sue-Yeon, Thoreson Wallace B., Rabl Katalin, Bartoletti Theodore M. and Kramer Richard H (2009). Role of the synaptic ribbon in transmitting the cone light response. Nature Neuroscience. 12 (3): 303—310. doi:10.1038/nn.2267. ISSN 1097-6256.
- ↑ Sterling Peter and Matthews Gary (2005). Structure and function of ribbon synapses. Trends in Neuro-sciences. 28 (1): 20—29. doi:10.1016/j.tins.2004.11.009. ISSN 0166-2236.
- ↑ а б в г д Tsukamoto Y, Morigiwa K, Ueda M and Sterling P (2001). Microcircuits for night vision in mouse retina. Journal of Neuroscience. 21 (21): 8616—23. PMID 11606649.
- ↑ West Roger W. and Dowling John E. (1975). Anatomical evidence for cone and rod-like receptors in the gray squirrel, ground squirrel, and prairie dog retinas. The Journal of Comparative Neurology. 159 (4): 439—459. doi:10.1002/cne.901590402. ISSN 0021-9967.
- ↑ Chun Myung-Hoon, Grünert Ulrike, Martin Paul R. and Wässle Heinz (1996). The Synaptic Complex of Cones in the Fovea and in the Periphery of the Macaque Monkey Retina. Vision Research. 36 (21): 3383—3395. doi:10.1016/0042-6989(95)00334-7. ISSN 0042-6989.
- ↑ Hopkins J. M. and Boycott B. B (1997). The cone synapses of cone bipolar cells of primate retina. Journal of Neurocytology. 26 (5): 313—325. doi:10.1023/A:1018504718282. ISSN 0300-4864.
- ↑ Kolb H. (1970). Organization of the Outer Plexiform Layer of the Primate Retina: Electron Microscopy of Golgi-Impregnated Cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 258 (823): 261—283. doi:10.1098/rstb.1970.0036. ISSN 0962-8436.
- ↑ Hopkins J. M. and Boycott B. B. (1995). Synapses between cones and diffuse bipolar cells of a primate retina. Journal of Neurocytology. 24 (9): 680—694. doi:10.1007/BF01179818. ISSN 0300-4864.
- ↑ Helmstaedter M., Briggman K.L., Turaga S.C., Jain V., Seung H. S. and Denk W. (2013). Connectomic reconstruction of the inner plexiform layer in the mouse retina. Nature. 500 (7461): 168—174. doi:10.1038/nature12346. ISSN 0028-0836.
- ↑ Ichinose T., Fyk-Kolodziej B. and Cohn J. (2014). Roles of ON Cone Bipolar Cell Subtypes in Temporal Coding in the Mouse Retina. Journal of Neuroscience. 34 (26): 8761—8771. doi:10.1523/JNEUROSCI.3965-13.2014. ISSN 0270-6474.
- ↑ Franke K., Berens P., Schubert T., Bethge M., Euler T., and Baden T. (2017). Inhibition decorrelates visual feature representations in the inner retina. Nature. 542 (7642): 439—444. doi:10.1038/nature21394. ISSN 0028-0836.
- ↑ а б Behrens C., Schubert T., Haverkamp S., Euler T., and Berens P. (2016). Connectivity map of bipolar cells and photoreceptors in the mouse ret-ina. eLife. 5. doi:10.7554/eLife.20041. ISSN 2050-084X.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Sterling P. (2002). Needle from a Haystack. Neuron. 34 (5): 670—672. doi:10.1016/S0896-6273(02)00727-4. ISSN 0896-6273.
- ↑ Sterling P. and Smith R.G. (2004). Design for a Binary Syn-apse. Neuron. 41 (3): 313—315. doi:10.1016/S0896-6273(04)00044-3. ISSN 0896-6273.
- ↑ Sampath A.P. and Rieke F. (2004). Selective Transmission of Single Photon Responses by Saturation at the Rod-to-Rod Bipolar Synapse. Neuron. 41 (3): 431—443. doi:10.1016/S0896-6273(04)00005-4. ISSN 0896-6273.
- ↑ Rao-Mirotznik R., Harkins A.B, Buchsbaum G., and Sterling P. (1995). Mammalian rod terminal: Architecture of a binary synapse. Neuron. 14 (3): 561—569. doi:10.1016/0896-6273(95)90312-7. ISSN 0896-6273.
- ↑ Field G.D. and Rieke F. (2002). Nonlinear Signal Transfer from Mouse Rods to Bipolar Cells and Implications for Visual Sensitivity. Neuron. 34 (5): 773—785. doi:10.1016/S0896-6273(02)00700-6. ISSN 0896-6273.
- ↑ Trexler E.B., Casti A.R.R. and Zhang Y. (2010). Nonlinearity and noise at the rod—rod bipolar cell synapse. Visual Neuroscience. 28 (01): 61—68. doi:10.1017/S0952523810000301. ISSN 0952-5238.
- ↑ Mandell JW, Townes-Anderson E, Czernik AJ, Cameron R, Greengard P, and De Camilli P.Synapsins in the vertebrate retina: Absence from ribbon synapses and heterogeneous distribution among conventional synapses. Neuron. 5 (1): 19—33. 1990. doi:10.1016/0896-6273(90)90030-J. ISSN 0896-6273.
- ↑ Schmitz Y. and Witkovsky P. (1997). Dependence of photoreceptor glutamate release on a dihydropyridine-sensitive calcium channel. Neuroscience. 78 (4): 1209—1216. doi:10.1016/S0306-4522(96)00678-1. ISSN 0306-4522.
- ↑ Nachman-Clewner M., St. Jule R., and Townes-Anderson E. (1999). L-type calcium channels in the photoreceptor ribbon synapse: Localization and role in plasticity. The Journal of Comparative Neurology. 415 (1): 1—16. doi:10.1002/(SICI)1096-9861(19991206)415:1<1::AID-CNE1>3.0.CO;2-G. ISSN 0021-9967.
- ↑ Rieke F. and Schwartz E.A. (1994). A cGMP-gated current can control exocytosis at cone synapses. Neuron. 13 (4): 863—873. doi:10.1016/0896-6273(94)90252-6. ISSN 0896-6273.
- ↑ Morgans CW, Brandstätter JH, Kellerman J, Betz H, Wässle H (1996). A SNARE complex containing syntaxin 3 is present in ribbon synapses of the retina. Journal of Neuroscience. 16 (21): 6713—21. PMID 8824312.
- ↑ Szikra T. and Krizaj D. (11 серпня 2008). Multiple Signaling Pathways Govern Calcium Homeostasis in Photoreceptor Inner Segments. У Tombran-Tink J. & Barnstable C.J. (ред.). Visual Transduction And Non-Visual Light Perception. Springer. с. 197—223. ISBN 978-1-59745-374-5.
- ↑ Koschak A, Reimer D, Walter D, Hoda JC, Heinzle T, Grabner M and Striessnig J. (2003). 12853422 Cav1.4alpha1 subunits can form slowly inactivating dihydropyridine-sensitive L-type Ca2+ channels lacking Ca2+-dependent inactivation. Journal of Neuroscience. 23 (14): 6041—9. PMID 12853422.
- ↑ Haeseleer Françoise, Imanishi oshikazu , Maeda Tadao, Possin Daniel E., Maeda Akiko, Lee Amy, Rieke Fred and Palczewski Krzysztof (2004). Essential role of Ca2+-binding protein 4, a Cav1.4 channel regulator, in photoreceptor synaptic function. Nature Neuroscience. 7 (10): 1079—1087. doi:10.1038/nn1320. ISSN 1097-6256.
- ↑ Morgans C.W., Bayley P. R., Oesch N. W., Ren G., Akileswaran L. and Taylor W. R. (2005). Photoreceptor calcium channels: Insight from night blindness. Visual Neuroscience. 22 (05): 561—568. doi:10.1017/S0952523805225038. ISSN 0952-5238.
- ↑ а б Söhl G., Maxeiner S., and Willecke K. (2005). Expression and functions of neuronal gap junctions. Nature Reviews Neuroscience. 6 (3): 191—200. doi:10.1038/nrn1627. ISSN 1471-003X.
- ↑ а б в г Bloomfield S.A. and Völgyi B. (2009). The diverse functional roles and regulation of neuronal gap junctions in the retina. Nature Reviews Neuroscience. 10 (7): 495—506. doi:10.1038/nrn2636. ISSN 1471-003X.
- ↑ а б Strettoi E. and Parisi V. (2014). Fundamental Retinal Circuitry for Circadian Rhythms. У Tosini G., Iuvone P.M., McMahon D.G., Collin S.P. (ред.). The Retina and Circadian Rhythms. Springer. с. 3—26. ISBN 978-1-4614-9613-7.
- ↑ Sjöstrand F.S. (1958). Ultrastructure of retinal rod synapses of the guinea pig eye as revealed by three-dimensional reconstructions from serial sections. Journal of Ultrastructure Research. 2 (1): 122—170. doi:10.1016/S0022-5320(58)90050-9. ISSN 0022-5320.
- ↑ Cohen A.I. The fine structure of the visual receptors of the pigeon. Experimental Eye Research. 2 (1): 88—IN44. 1963. doi:10.1016/S0014-4835(63)80028-7. ISSN 0014-4835.
- ↑ Missotten L, Appelmans M, and Michiels J Ultrastructure of the synapses of the visual cells of the human retina. Bulletins et Memoires de la Societe Francaise D'ophtalmologie. 76: 59—82. 1963. PMID 14174266.
- ↑ Cohen A.I. Some Observations on the Fine Structure of the Retinal Receptors of the American Gray Squirrel. Investigative Ophthalmology. 3: 198—216. 1964. PMID 14166277.
- ↑ а б Cohen AI (1965). Some electron microscopic observations on inter-receptor contacts in the human and macaque retinae. Journal of anatomy. 99 (Pt 3): 595—610. PMC 1270699. PMID 4955215.
- ↑ а б в Raviola E. and Gilula N.B. (1973). Gap junctions between photoreceptor cells in the vertebrate retina. Proceedings of the National Academy of Sciences of the United States of America. 70 (6): 1677—81. PMID 4198274.
- ↑ а б Raviola E. and Gilula N. B. (1975). Intramembrane organization of specialized contacts in the outer plexiform layer of the retina. A freeze-fracture study in monkeys and rabbits. The Journal of Cell Biolo-gy. 65 (1): 192—222. doi:10.1083/jcb.65.1.192. ISSN 0021-9525.
- ↑ а б Witkovsky P, Shakib M, and Ripps H (1974). Interreceptoral junctions in the teleost retina. Investigative ophthalmology. 13 (12): 996—1009. PMID 4139137.
- ↑ Kraft T.W., and Burkhardt D.A. (1986). Telodendrites of cone photoreceptors: Structure and probable function. The Journal of Comparative Neurology. 249 (1): 13—27. doi:10.1002/cne.902490103. ISSN 0021-9967.
- ↑ а б в DeVries S.H., Qi X., Smith R., Makous W., and Sterling P. (2002). Electrical Coupling between Mammalian Cones. Current Biology. 12 (22): 1900—1907. doi:10.1016/S0960-9822(02)01261-7. ISSN 0960-9822.
- ↑ а б в г д O'Brien J. J., Chen X., MacLeish P. R., O'Brien J. and Massey S. C. (2012). Photoreceptor Coupling Mediated by Connexin36 in the Primate Retina. Journal of Neuroscience. 32 (13): 4675—4687. doi:10.1523/JNEUROSCI.4749-11.2012. ISSN 0270-6474.
- ↑ Lasansky A. (1971). Synaptic Organization of Cone Cells in the Turtle Retina. Philosophical Transactions of the Royal Society B: Biological Sciences. 262 (844): 365—381. doi:10.1098/rstb.1971.0101. ISSN 0962-8436.
- ↑ Li, Peter H. (2008). Gap-junctional Coupling of Mammalian Rods and Its Effect on Visual Detection Thresholds (PhD thesis). University of California, San Fran-cisco. с. 119. ISBN 978-0-549-94965-7.
- ↑ Baylor D. A., Fuortes M. G. F., and O'Bryan P. M. (1971). Receptive fields of cones in the retina of the turtle. The Journal of Physiology. 214 (2): 265—294. doi:10.1113/jphysiol.1971.sp009432. ISSN 0022-3751.
- ↑ Lasansky A. Cell junctions at the outer synaptic layer of the retina. Investigative Ophthalmology. 11 (5): 265—75. 1972. PMID 4112852.
- ↑ а б Schwartz E.A. (1973). Responses of single rods in the retina of the turtle. The Journal of Physiology. 232 (3): 503—514. doi:10.1113/jphysiol.1973.sp010283. ISSN 0022-3751.
- ↑ а б Schwartz E.A. (1975). Rod-rod interaction in the retina of the turtle. The Journal of Physiology. 246 (3): 617—638. doi:10.1113/jphysiol.1975.sp010907. ISSN 0022-3751.
- ↑ Schwartz E.A. (1976). Electrical properties of the rod syncytium in the retina of the turtle. The Journal of Physiology. 257 (2): 379—406. doi:10.1113/jphysiol.1976.sp011374. ISSN 0022-3751.
- ↑ Copenhagen D. R. and Owen W. G. (1976). Coupling between rod photoreceptors in a vertebrate retina. Nature. 260 (5546): 57—59. doi:10.1038/260057a0. ISSN 0028-0836.
- ↑ Copenhagen D.R. and Owen W.G. (1976). Functional characteristics of lateral interac-tions between rods in the retina of the snapping turtle. The Journal of Physiology. 259 (2): 251—282. doi:10.1113/jphysiol.1976.sp011465. ISSN 0022-3751.
- ↑ а б Fain G. (1975). Quantum sensitivity of rods in the toad retina. Science. 187 (4179): 838—841. doi:10.1126/science.1114328. ISSN 0036-8075.
- ↑ Fain GL, Gold GH, and Dowling JE (1976). Receptor Coupling in the Toad Retina. Cold Spring Harbor Symposia on Quantitative Biology. 40 (0): 547—561. doi:10.1101/SQB.1976.040.01.051. ISSN 0091-7451.
- ↑ Custer N.V. (1973). Structurally specialized contacts between the photoreceptors of the retina of the axolotl. The Journal of Comparative Neurolo-gy. 151 (1): 35—55. doi:10.1002/cne.901510104. ISSN 0021-9967.
- ↑ Gold GH and Dowling JE (1979). Photoreceptor coupling in retina of the toad, Bufo marinus. I. Anatomy. Journal of neuro-physiology. 42 (1 Pt 1): 292—310. PMID 107280.
- ↑ Lasansky A. (1973). Organization of the Outer Synaptic Layer in the Retina of the Larval Tiger Salamander. Philosophical Transactions of the Royal Society B: Biological Sciences. 265 (872): 471—489. doi:10.1098/rstb.1973.0033. ISSN 0962-8436.
- ↑ Normann R., Perlman I., Kolb H., Jones J., and Daly S. (1984). Direct excitatory interactions between cones of different spectral types in the turtle retina. Science. 224 (4649): 625—627. doi:10.1126/science.6710161. ISSN 0036-8075.
- ↑ Kolb H. and Jones J. (1985). Electron microscopy of Golgi-impregnated photoreceptors reveals connections between red and green cones in the turtle retina. Journal of neurophysiology. 54 (2): 304—17. PMID 4031990.
- ↑ Tsukamoto Y., Masarachia P., Schein S.J. and Sterling P. (1992). Gap junctions between the pedicles of macaque foveal cones. Vision Research. 32 (10): 1809—1815. doi:10.1016/0042-6989(92)90042-H. ISSN 0042-6989.
- ↑ а б в Nelson R. (1977). Cat cones have rod input: A comparison of the response properties of cones and horizontal cell bodies in the retina of the cat. The Journal of Comparative Neurology. 172 (1): 109—135. doi:10.1002/cne.901720106. ISSN 0021-9967.
- ↑ а б в г Hornstein E.P., Verweij J., and Schnapf J.L. (2004). Electrical coupling between red and green cones in primate retina. Nature Neuroscience. 7 (7): 745—750. doi:10.1038/nn1274. ISSN 1097-6256.
- ↑ а б Li W. and DeVries S.H. (2004). Separate blue and green cone networks in the mammalian retina. Nature Neuroscience. 7 (7): 751—756. doi:10.1038/nn1275. ISSN 1097-6256.
- ↑ Ahnelt P., Keri C., and Kolb H. (1990). Identification of pedicles of putative blue-sensitive cones in the human retina. The Journal of Comparative Neurology. 293 (1): 39—53. doi:10.1002/cne.902930104. ISSN 0021-9967.
- ↑ Hsu A., Smith R.G., Buchsbaum G., and Sterling P. (2000). Cost of cone coupling to trichromacy in primate fovea. Journal of the Optical Society of America A. 17 (3): 635. doi:10.1364/JOSAA.17.000635. ISSN 1084-7529.
- ↑ Steinberg R.H. Rod-cone interaction in S-potentials from the cat retina. Vision Re-search. 9 (11): 1331—1344. 1969. doi:10.1016/0042-6989(69)90070-4. ISSN 0042-6989.
- ↑ Schneeweis DM and Schnapf JL (1999). The photovoltage of macaque cone photorecep-tors: adaptation, noise, and kinetics. Journal of Neuroscience. 19 (4): 1203—16. PMID 9952398.
- ↑ Cangiano L., Asteriti S., Cervetto L., and Gargini C. (2012). The photovoltage of rods and cones in the dark-adapted mouse retina. The Journal of Physiology. 590 (16): 3841—3855. doi:10.1113/jphysiol.2011.226878. ISSN 0022-3751.
- ↑ DeVries S.H. and Baylor D.A. An alternative pathway for signal flow from rod photoreceptors to ganglion cells in mammalian retina. Proceedings of the National Academy of Sciences of the United States of America. 92 (23): 10658—62. 1995. PMC 40671. PMID 7479860.
- ↑ Blakemore C.B. and Rushton W.A. The rod increment threshold during dark adaptation in normal and rod monochromat. The Journal of Physiology. 181 (3): 629—640. 1965. doi:10.1113/jphysiol.1965.sp007787. ISSN 0022-3751.
- ↑ {{|Conner J.D.}} The temporal properties of rod vision. The Journal of Physiology. 332 (1): 139—155. 1982. doi:10.1113/jphysiol.1982.sp014406. ISSN 0022-3751.
- ↑ Hess R.F. and Nordby K. Spatial and temporal properties of human rod vision in the achromat. The Journal of Physiology. 371 (1): 387—406. 1986. doi:10.1113/jphysiol.1986.sp015982. ISSN 0022-3751.
- ↑ Sharpe L.T. and Stockman A. (1999). Rod pathways: the importance of seeing nothing. Trends in Neuroscienc-es. 22 (11): 497—504. doi:10.1016/S0166-2236(99)01458-7. ISSN 0166-2236.
- ↑ а б в O’Brien, J. (4 вересня 2014). Regulation of Electrical Synaptic Plasticity in the Retina by G-Protein-Coupled Receptors. У Martemyanov K., Sampath A.P. (ред.). G Protein Signaling Mechanisms in the Retina. Springer. с. 143—169. ISBN 978-1-4939-1218-6.
- ↑ а б Smith RG, Freed MA, and Sterling P (1986). Microcircuitry of the dark-adapted cat retina: functional architecture of the rod-cone network. Journal of Neuroscience. 6 (12): 3505—17. PMID 3794785.
- ↑ Demb J.B. and Pugh E.N.Connexin36 Forms Synapses Essential for Night Vi-sion. Neuron. 36 (4): 551—553. 2002. doi:10.1016/S0896-6273(02)01062-0. ISSN 0896-6273.
- ↑ а б Hornstein E. P., Verweij J, Li PH, and Schnapf JL (2005). Gap-Junctional Coupling and Absolute Sensitivity of Photoreceptors in Macaque Retina. Journal of Neuroscience. 25 (48): 11201—11209. doi:10.1523/JNEUROSCI.3416-05.2005. ISSN 0270-6474.
- ↑ Krizaj D. Mesopic state: Cellular mechanisms involved in pre- and post-synaptic mixing of rod and cone signals. Microscopy Research and Tech-nique. 50 (5): 347—359. 2000. doi:10.1002/1097-0029(20000901)50:5<347::AID-JEMT4>3.0.CO;2-D. ISSN 1059-910X.
- ↑ а б в Völgyi, B., Deans, M. R., Paul, D. L. and Bloomfield, S. A. (2004). Convergence and Segregation of the Multiple Rod Pathways in Mammalian Retina. Journal of Neuroscience. 24 (49): 11182—11192. doi:10.1523/JNEUROSCI.3096-04.2004. ISSN 0270-6474.
- ↑ Deans M.R., Volgyi B., Goodenough D.A, Bloomfield S.A, and Paul D.L.Connexin36 Is Essential for Transmission of Rod-Mediated Visual Signals in the Mammalian Ret-ina. Neuron. 36 (4): 703—712. 2002. doi:10.1016/S0896-6273(02)01046-2. ISSN 0896-6273.
- ↑ Dunn, F. A., Doan, T., Sampath, A. P. and Rieke, F. (2006). Controlling the Gain of Rod-Mediated Signals in the Mammalian Reti-na. Journal of Neuroscience. 26 (15): 3959—3970. doi:10.1523/JNEUROSCI.5148-05.2006. ISSN 0270-6474.
- ↑ DeVries S.H. and Baylor D.A. An alternative pathway for signal flow from rod photoreceptors to ganglion cells in mammalian retina. Proceedings of the National Academy of Sciences of the United States of America. 92 (23): 10658—62. 1995. PMC 40671. PMID 7479860.
- ↑ Soucy E., Wang Y., Nirenberg S., Nathans J., and Meister Markus A Novel Signaling Pathway from Rod Photoreceptors to Ganglion Cells in Mammalian Retina. Neuron. 21 (3): 481—493. 1998. doi:10.1016/S0896-6273(00)80560-7. ISSN 0896-6273.
- ↑ а б Ribelayga C., Cao Y., and Mangel S.C. (2008). The Circadian Clock in the Retina Controls Rod-Cone Coupling. Neuron. 59 (5): 790—801. doi:10.1016/j.neuron.2008.07.017. ISSN 0896-6273.
- ↑ а б Ribelayga C. and Mangel S. C. (2010). Identification of a Circadian Clock-Controlled Neural Pathway in the Rabbit Retina. PLoS ONE. 5 (6): e11020. doi:10.1371/journal.pone.0011020. ISSN 1932-6203.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ а б Krizaj D, Gabriel R, Owen WG, and Witkovsky P (1998). Dopamine D2 receptor-mediated modulation of rod-cone coupling in the Xenopus retina. The Journal of Comparative Neurology. 398 (4): 529—538. doi:10.1002/(SICI)1096-9861(19980907)398:4<529::AID-CNE5>3.0.CO;2-4. ISSN 0021-9967.
- ↑ Tosini G. and Iuvone P.M. (2014). Role of Melatonin and Dopamine in the Regulation of Retinal Circadian Rhythms. У Tosini G., Iuvone P.M., McMahon D.G., Collin S.P. (ред.). The Retina and Circadian Rhythms. Springer. с. 49—68. ISBN 978-1-4614-9613-7.
- ↑ Soucy E., Wang Y., Nirenberg S., Nathans J., and Meister Markus A Novel Signaling Pathway from Rod Photoreceptors to Ganglion Cells in Mammalian Retina. Neuron. 21 (3): 481—493. 1998. doi:10.1016/S0896-6273(00)80560-7. ISSN 0896-6273.
- ↑ Boycott B. B., Dowling J. E. and Kolb H. (1969). Organization of the Primate Retina: Light Microscopy. Philosophical Transactions of the Royal Society B: Biological Sciences. 255 (799): 109—184. doi:10.1098/rstb.1969.0004. ISSN 0962-8436.
- ↑ Boycott B.B. and Kolb H. (1973). The connections between bipolar cells and photoreceptors in the retina of the domestic cat. The Journal of Comparative Neurology. 148 (1): 91—114. doi:10.1002/cne.901480106. ISSN 0021-9967.
- ↑ Hack I, Peichl L, and Brandstätter JH An alternative pathway for rod signals in the rodent retina: rod photoreceptors, cone bipolar cells, and the localization of glutamate receptors. Proceedings of the National Academy of Sciences of the United States of America. 96 (24): 14130—5. 1999. PMC 24202. PMID 10570210.
- ↑ Fyk-Kolodziej B., Qin P., and Pourcho R.G. Identification of a cone bipolar cell in cat retina which has input from both rod and cone photoreceptors. The Journal of Comparative Neurology. 464 (1): 104—113. 2003. doi:10.1002/cne.10784. ISSN 0021-9967.
{{cite journal}}: Cite має пустий невідомий параметр:|1=(довідка) - ↑ Li.W, Keung J.W. and Massey S.C. Direct synaptic connections between rods and OFF cone bipolar cells in the rabbit retina. The Journal of Comparative Neurology. 474 (1): 1—12. 2004. doi:10.1002/cne.20075. ISSN 0021-9967.
- ↑ а б в г Lamb T.D. and Simon E.J. (1976). The relation between intercellular coupling and electrical noise in turtle photoreceptors. The Journal of Physiology. 263 (2): 257—286. doi:10.1113/jphysiol.1976.sp011631. ISSN 0022-3751.
- ↑ Lamb T. D. and Simon E. J. (1977). Analysis of electrical noise in turtle cones. The Journal of Physiology. 272 (2): 435—468. doi:10.1113/jphysiol.1977.sp012053. ISSN 0022-3751.
- ↑ Falk G. and Fatt P. (1972). Physical changes induced by light in the rod outer segment of vertebrates. У Dartnall H.J.A. (ред.). Photochemistry of Vision. Handbook of Sensory Physiology. Т. Vol. 7/1. Springer. с. 200—244. ISBN 978-3-642-65066-6.
- ↑ а б Gold G.H. (1979). Photoreceptor coupling in retina of the toad, Bufo marinus. II. Physiology. Journal of Neurophysiology. 42 (1 Pt 1): 311—28. PMID 107281.
- ↑ Laughlin Simon B.Retinal Function: Coupling Cones Clarifies Vision. Current Biology. 12 (24): R833—R834. 2002. doi:10.1016/S0960-9822(02)01345-3. ISSN 0960-9822.
- ↑ Tessier-Lavigne M. and Attwell D. The Effect of Photoreceptor Coupling and Synapse Nonlinearity on Signal: Noise Ratio in Early Visual Processing. Proceedings of the Royal Society B: Biological Scienc-es. 234 (1275): 171—197. 1988. doi:10.1098/rspb.1988.0043. ISSN 0962-8452.
- ↑ а б Lebedev D.S., Byzov A.L., and Govardovskii V.I. (1998). Photoreceptor coupling and boundary detection. Vision Research. 38 (20): 3161—3169. doi:10.1016/S0042-6989(98)00017-0. ISSN 0042-6989.
- ↑ Fuortes M.G. Responses of cones and horizontal cells in the retina of the turtle. Investigative ophthalmology. 11 (5): 275—84. 1972. PMID 5028228.
- ↑ Werblin F.S. Transmission along and between rods in the tiger salamander retina. The Journal of Physiolo-gy. 280 (1): 449—470. 1978. doi:10.1113/jphysiol.1978.sp012394. ISSN 0022-3751.
- ↑ а б Hsu Andrew, Smith Robert G., Buchsbaum Gershon and Sterling Peter (2000). Cost of cone coupling to trichromacy in primate fovea. Journal of the Optical Society of America A. 17 (3): 635. doi:10.1364/JOSAA.17.000635. ISSN 1084-7529.
- ↑ Schwartz E.A. (1975). Cones excite rods in the retina of the turtle. The Journal of Physiology. 246 (3): 639—651. doi:10.1113/jphysiol.1975.sp010908. ISSN 0022-3751.
- ↑ Wu SM and Yang XL (1988). Electrical coupling between rods and cones in the tiger salamander retina. Proceedings of the National Academy of Sciences of the United States of America. 85 (1): 275—8. PMC 279527. PMID 3422423.
- ↑ Schneeweis DM and Schnapf JL (1995). Photovoltage of rods and cones in the macaque retina. Science. 268 (5213): 1053—1056. doi:10.1126/science.7754386. ISSN 0036-8075.
- ↑ а б в Geisler W.S. and Banks M.S. (4 December 2009). Visual performance. У Bass M. та ін. (ред.). Handbook of Optics. Т. Volume III. Vision and Vision Optics (вид. 3). McGraw Hill Professional. с. 2.1—2.60. ISBN 978-0-07-162928-7.
{{cite book}}: Явне використання «та ін.» у:|editor=(довідка) - ↑ а б Miller William H. and Bernard Gary D. (1983). Averaging over the foveal receptor aperture curtails aliasing. Vision Research. 23 (12): 1365—1369. doi:10.1016/0042-6989(83)90147-5. ISSN 0042-6989.
- ↑ Chen Bing, Makous Walter and Williams David R. (1993). Serial spatial filters in vision. Vision Research. 33 (3): 413—427. doi:10.1016/0042-6989(93)90095-E. ISSN 0042-6989.
- ↑ а б Macleod Donald I.A., Williams David R. and Makous Walter (1992). A visual nonlinearity fed by single cones. Vision Research. 32 (2): 347—363. doi:10.1016/0042-6989(92)90144-8. ISSN 0042-6989.
- ↑ Packer Orin, Hendrickson Anita E. and Curcio Christine A. (1989). Photoreceptor topography of the retina in the adult pigtail macaque (Macaca nemestrina). The Journal of Comparative Neurology. 288 (1): 165—183. doi:10.1002/cne.902880113. ISSN 0021-9967.
- ↑ а б Snyder A.W. and Miller W.H. (1977). Photoreceptor diameter and spacing for highest resolving power. Journal of the Optical Society of America. 67 (5): 696. doi:10.1364/JOSA.67.000696. ISSN 0030-3941.
- ↑ а б Williams, D.R. (1986). Seeing through the photoreceptor mosaic. Trends in Neurosciences. 9: 193—198. doi:10.1016/0166-2236(86)90058-5. ISSN 0166-2236.
- ↑ а б Hsia, Y. (1965). Photochemistry of vision. У Graham, C.H. (ред.). Vision and visual perception. New York: Wiley. с. 132—153.
- ↑ Baylor D.A., Nunn B.J . and Schnapf J.L. (1984). The photocurrent, noise and spectral sensitivity of rods of the monkey Macaca fascicularis. The Journal of Physiology. 357 (1): 575—607. doi:10.1113/jphysiol.1984.sp015518. ISSN 0022-3751.
- ↑ Marcos S., Tornow R.-P., Elsner A.E., and Navarro R. (1997). Foveal cone spacing and cone photopigment density difference: Objective measurements in the same subjects. Vision Research. 37 (14): 1909—1915. doi:10.1016/S0042-6989(96)00295-7. ISSN 0042-6989.
- ↑ а б Elsner A. E. and Burns S. A.; Webb, Robert H. (1993). Mapping cone photopigment optical density. Journal of the Optical Society of America A. 10 (1): 52. doi:10.1364/JOSAA.10.000052. ISSN 1084-7529.
{{cite journal}}: Пропущено|author2=(довідка) - ↑ а б Stockman A., Sharpe L.T. and Fach C. (1999). The spectral sensitivity of the human short-wavelength sensitive cones derived from thresholds and color matches. Vision Research. 39 (17): 2901—2927. doi:10.1016/S0042-6989(98)00225-9. ISSN 0042-6989.
- ↑ He J.C. and Shevell S.K. (1995). Variation in color matching and discrimination among deuteranomalous trichromats: Theoretical implications of small differences in photopigments. Vision Research. 35 (18): 2579—2588. doi:10.1016/0042-6989(95)00007-M. ISSN 0042-6989.
- ↑ Neitz J., Neitz M., He J.C., and Shevell S. K. (1999). Trichromatic color vision with only two spectrally distinct photopigments. Nature Neuroscience. 2 (10): 884—888. doi:10.1038/13185. ISSN 1097-6256.
- ↑ Thomas P.B.M., Formankiewicz M.A. and Mollon J.D. (2011). The effect of photopigment optical density on the color vision of the anomalous trichromat. Vision Research. 51 (20): 2224—2233. doi:10.1016/j.visres.2011.08.016. ISSN 0042-6989.
- ↑ а б Berendschot T.T., van de Kraats J., and van Norren D (1996). Foveal cone mosaic and visual pigment density in dichromats. The Journal of Physiology. 492 (1): 307—314. doi:10.1113/jphysiol.1996.sp021310. ISSN 0022-3751.
- ↑ Alpern M. (1979). Lack of uniformity in colour matching. The Journal of physiology. 288: 85—105. doi:10.1113/jphysiol.1979.sp012685. PMC 1281416. PMID 313984.
- ↑ Wyszecki G. and Stiles W.S. (1980). High-level trichromatic color matching and the pigment-bleaching hypothesis. Vision Research. 20 (1): 23—37. doi:10.1016/0042-6989(80)90138-8. ISSN 0042-6989.
- ↑ Smith VC and Pokorny J (1973). Psychophysical estimates of optical density in human cones. Vision Research. 13 (6): 1199—202. PMID 4713928.
- ↑ Miller S. S. (1972). Psychophysical estimates of visual pigment densities in red-green dichromats. The Journal of Physiology. 223 (1): 89—107. doi:10.1113/jphysiol.1972.sp009836. ISSN 0022-3751.
- ↑ Walraven P. L. and Bouman M. A. (1960). Relation between Directional Sensitivity and Spectral Response Curves in Human Cone Vision. Journal of the Optical Society of America. 50 (8): 780. doi:10.1364/JOSA.50.000780. ISSN 0030-3941.
- ↑ Bowmaker J K, Dartnall H J, Lythgoe J N and Mollon J D (1978). The visual pigments of rods and cones in the rhesus monkey, Macaca mulatta. The Journal of Physiology. 274 (1): 329—348. doi:10.1113/jphysiol.1978.sp012151. ISSN 0022-3751.
- ↑ Rushton W. A. H. (1963). A cone pigment in the protanope. The Journal of Physiology. 168 (2): 345—359. doi:10.1113/jphysiol.1963.sp007196. ISSN 0022-3751.
- ↑ King-Smith P. E. (1973). The optical density of erythrolabe determined by a new method. The Journal of Physiology. 230 (3): 551—560. doi:10.1113/jphysiol.1973.sp010203. ISSN 0022-3751.
- ↑ King-Smith P. E. (1973). The optical density of erythrolabe determined by retinal densitometry using the self-screening method. The Journal of Physiology. 230 (3): 535—549. doi:10.1113/jphysiol.1973.sp010202. ISSN 0022-3751.
- ↑ Renner A.B., Knau H., Neitz M., Neitz J., and Werner J.S. (2005). Photopigment optical density of the human foveola and a paradoxical senescent increase outside the fovea. Visual Neuroscience. 21 (06): 827—834. doi:10.1017/S0952523804216030. ISSN 0952-5238.
- ↑ Harwerth R.S. and Sperling H.G. (1975). Effects of intense visible radiation on the increment-threshold spectral sensitivity of the rhesus monkey eye. Vision Research. 15 (11): 1193—1204. doi:10.1016/0042-6989(75)90162-5. ISSN 0042-6989.
- ↑ Vienot Francoise (2001). Retinal distributions of the macular pigment and the cone effective optical density from colour matches of real observers. Color Research & Application. 26 (S1): S264—S268. doi:10.1002/1520-6378(2001)26:1+<::AID-COL57>3.0.CO;2-3. ISSN 0361-2317.
- ↑ Tornow R.P. and Stilling R. (1998). Variation in Sensitivity, Absorption and Density of the Central Rod Distribution with Eccentricity. Cells Tissues Organs. 162 (2-3): 163—168. doi:10.1159/000046482. ISSN 1422-6405.
- ↑ Brindley, G.S. (1953). The effects on colour vision of adaptation to very bright lights. The Journal of Physiology. 122 (2): 332—350. doi:10.1113/jphysiol.1953.sp005003. ISSN 0022-3751.
- ↑ Knowles, A. and Dartnall, H.J.A. (1977). The Photobiology of Vision. The eye,. Т. Vol. 2, Part.2. Academic Press. с. 689. ISBN 978-0-12-206762-4.
- ↑ Goldmann, Hans (1942). Stiles-Crawford-Effekt. Ophthalmologica (German) . 103 (4): 225—229. doi:10.1159/000300022. ISSN 1423-0267.
- ↑ Enoch, J.M., and Lakshminarayanan, V. (1991). Retinal Fibre Optics. У Charman W.N. (ред.). Visual Optics and Instrumentation. Т. Vol. 1 : Visual Optics and Instrumentation. CRC Press. с. 280—309. ISBN 978-0-8493-7501-9.
- ↑ Laties AM and Enoch JM (1971). An analysis of retinal receptor orientation. I. Angular relationship of neighboring photoreceptors. Investigative ophthalmology. 10 (1): 69—77. PMID 4992333.
- ↑ Bonds AB and MacLeod DI (1978). A displaced Stiles-Crawford effect associated with an eccentric pupil. Investigative Ophthalmology & Visual Science. 17 (8): 754—61. PMID 681135.
- ↑ Applegate RA and Bonds AB (1981). Induced movement of receptor alignment toward a new pupillary aperture. Investigative Ophthalmology & Visual Science. 21 (6): 869—72. PMID 7309438.
- ↑ Kono M., Enoch J.M., Strada E., Shih P., Srinivasan R., Lakshminarayanan V., Susilasate W. and Graham A. (2001). Stiles–Crawford effect of the first kind: assessment of photoreceptor alignments following dark patching. Vision Research. 41 (1): 103—118. doi:10.1016/S0042-6989(00)00228-5. ISSN 0042-6989.
- ↑ Berendschot T., DeLint Peter Jaap and Norren Dirk van (2003). Fundus reflectance—historical and present ideas. Progress in Retinal and Eye Research. 22 (2): 171—200. doi:10.1016/S1350-9462(02)00060-5. ISSN 1350-9462.
- ↑ Packer OS, Williams DR and Bensinger DG (1996). Photopigment transmittance imaging of the primate photoreceptor mosaic. journal of neuroscience. 16 (7): 2251—60. PMID 8601805.
- ↑ а б Sincich L.C. , Sabesan R., Tuten W.S. , Roorda A. and Harmening W.M. (19 December 2016). Chapter 3. Functional Imaging of Cone Photoreceptors. У Kremers J., Baraas R.C. and Marshall N.J. (ред.). Human Color Vision. Springer Series in Vision Research, Volume 5. Springer. с. 71—104. ISBN 978-3-319-44978-4.
- ↑ а б Enoch J. M. (1961). Wave-Guide Modes in Retinal Receptors. Science. 133 (3461): 1353—1354. doi:10.1126/science.133.3461.1353. ISSN 0036-8075.
- ↑ Enoch Jay M. (1960). Waveguide Modes: Are They Present, and What Is Their Possible Role in the Visual Mechanism?*. Journal of the Optical Society of America. 50 (10): 1025. doi:10.1364/JOSA.50.001025. ISSN 0030-3941.
- ↑ а б Enoch Jay M. (1961). Nature of the Transmission of Energy in the Retinal Receptors. Journal of the Optical Society of America. 51 (10): 1122. doi:10.1364/JOSA.51.001122. ISSN 0030-3941.
- ↑ а б в Enoch Jay M. (1963). Optical Properties of the Retinal Receptors. Journal of the Optical Society of America. 53 (1): 71. doi:10.1364/JOSA.53.000071. ISSN 0030-3941.
- ↑ Enoch Jay M. (1961). Visualization of Wave-Guide Modes in Retinal Receptors. American Journal of Ophthalmology. 51 (5): 1107/235–1118/246. doi:10.1016/0002-9394(61)91800-1. ISSN 0002-9394.
- ↑ Marcos S. and Burns S. A. (1999). Cone spacing and waveguide properties from cone directionality measurements. Journal of the Optical Society of America A. 16 (5): 995. doi:10.1364/JOSAA.16.000995. ISSN 1084-7529.
- ↑ Vohnsen Brian (2014). Directional sensitivity of the retina: A layered scattering model of outer-segment photoreceptor pigments. Biomedical Optics Express. 5 (5): 1569. doi:10.1364/BOE.5.001569. ISSN 2156-7085.
- ↑ Brucke, Ersnt von (1843). Ueber den inneren Bau des Glaskörpers. Archiv für Anatomie, Physiologie und Wissenschaftliche Medicin (German) . Т. 11. Berlin: Müller, Joh. с. 345—348.
- ↑ B Brucke, Ersnt von (1844). Ueber die physiologische Bedeutung der stabförmigen Körper und der Zwillingszapfen in den Augen der Wirbelthiere. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin (German) . Berlin: Müller, Joh. с. 444—451.
- ↑ Brucke, Ersnt von (1847). Ueber das Leuchten der menschlichen Augen. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin (German) . Berlin: Muller, Joh. с. 225—227.
- ↑ Brucke, Ernst von (1847). Bemerkungen über die Bestimmung des specifischen Gewichtes der Milch. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin (German) . Berlin: Muller, Joh. с. 409—414.
- ↑ Brucke, Ernst von (1847). Nachtrag zu meinem Aufsatze über das Leuchten der Augen bei den Menschen. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin (German) . Т. 14. Berlin: Muller, Joh. с. 479—480.
- ↑ а б Snyder, A.W. and Love, J. (30 November 1983). Optical Waveguide Theory. Springer. с. 734. ISBN 978-0-412-09950-2.
- ↑ Burns Stephen A., Wu Shuang, He Ji Chang and Elsner Ann E. (1997). Variations in photoreceptor directionality across the central retina. Journal of the Optical Society of America A. 14 (9): 2033. doi:10.1364/JOSAA.14.002033. ISSN 1084-7529.
- ↑ Gorrand Jean-Marie and Delori Francois (1995). A reflectometric technique for assessing photoreceptor alignment. Vision Research. 35 (7): 999—1010. doi:10.1016/0042-6989(94)00203-X. ISSN 0042-6989.
- ↑ Francia G Toraldo di (1949). The Radiation Pattern of Retinal Receptors. Proceedings of the Physical Society. Section B. 62 (7): 461—462. doi:10.1088/0370-1301/62/7/108. ISSN 0370-1301.
- ↑ а б Snyder Allan W. (1975). Photoreceptor Optics — Theoretical Principles. У Snyder A.W., Menzel R. (ред.). Photoreceptor Optics. Springer. с. 38—55. ISBN 978-3-642-80934-7.
- ↑ Hannover, A. (1843). Mikroskopiske undersögelser af nervesystemet. Det Kongelige Danske videnskabernes selskabs naturvidenskabelige og mathematiske afhandlinger. Т. 10. Det Selskab. с. 1—112.
- ↑ Gorrand J.M. (2006). The directionality of photoreceptors in the human retina. Bulletin de la Societe belge d'ophtalmologie (302): 215—29. PMID 17265800.
- ↑ а б van Hateren, J. Hans (1989). Photoreceptor Optics, Theory and Practice (Chapter 4). У Stavenga D.G., Hardie R.C. (ред.). Facets of Vision. Springer Science & Business Media. с. 74—89. ISBN 978-3-642-74082-4.
- ↑ Snyder Allan W. and Pask Colin (1973). Waveguide modes and light absorption in photoreceptors. Vision Research. 13 (12): 2605—2608. doi:10.1016/0042-6989(73)90261-7. ISSN 0042-6989.
- ↑ а б MENZEL RANDOLF and SNYDER ALLEN W. (1983). Photoreceptor Optics - Structure and Function Of Photoreceptors. У Hoppe W. , Lohmann W., Markl H. and Ziegler H. (ред.). Biophysics. Springer. ISBN 978-3-642-68877-5.
- ↑ Levi, Dennis M. (3 March 2011). Visual Acuity (Chapter 33). У Levin L.A. та ін. (ред.). Adler's Physiology of the Eye. Elsevier Health Sciences. с. 627—647. ISBN 0-323-08116-9.
{{cite book}}: Явне використання «та ін.» у:|editor=(довідка) - ↑ а б в Williams David R. and Hofer Heidi (2004). 50. Formation and Acquisition of the Retinal Image. У Chalupa L.M. , Werner J.S. (ред.). The Visual Neurosciences. MIT Press. с. 795—810. ISBN 978-0-262-03308-4.
- ↑ Yellott, John I. (15 January 1990). The Photoreceptor Mosaic as an Image Sampling Device. У Committee on Vision, National Research Council (ред.). Advances in Photoreception: Proceedings of a Symposium on Frontiers of Visual Science. National Academies Press. с. 117—134. ISBN 978-0-309-54339-2.
- ↑ Bergmann, Carl (1858). Anatomisches und physiologisches über die Netzhaut des Auges. Zeitschrift für rationelle Medicin. Т. 2. Heidelberg- Leipzig. с. 83—108.
- ↑ D'Zmura, Michael (1996). Bergmann on Visual Resolution. Perception. 25: 1223—1234.
- ↑ а б Helmholtz, Hermann von (1867). Handbuch der physiologischen Optik (German) . Leipzig : Leopold Voss. с. 926.
- ↑ Помилка цитування: Неправильний виклик тегу
<ref>: для виносок під назвоюHughes1986не вказано текст - ↑ MacKay, David J. C. (25 September 2003). Information Theory, Inference and Learning Algorithms. Cambridge University Press. ISBN 978-0-521-64298-9.
- ↑ Goodman, Joseph W. (January 2005). Introduction to Fourier Optics. Roberts and Company Publishers. с. 491. ISBN 978-0-9747077-2-3.
- ↑ Marks II, Robert J (8 January 2009). Handbook of Fourier Analysis & Its Applications. Oxford University Press. с. 687. ISBN 978-0-19-804430-7.
- ↑ Anderson S.J., Mullen K.T. and Hess R.F. (1991). Human peripheral spatial resolution for achromatic and chromatic stimuli: limits imposed by optical and retinal factors. The Journal of Physiology. 442 (1): 47—64. doi:10.1113/jphysiol.1991.sp018781. ISSN 0022-3751.
- ↑ а б Williams David R. and Coletta Nancy J. (1987). Cone spacing and the visual resolution limit. Journal of the Optical Society of America A. 4 (8): 1514. doi:10.1364/JOSAA.4.001514. ISSN 1084-7529.
- ↑ Yellott John I. , Wandell Brian A. and Tom N. Cornsweet (1984). The Beginnings of Visual Perception: The Retinal Image and its Initial Encoding.. У Brookhart John Mills and Mountcastle Vernon B. (ред.). Handbook of Physiology: A Critical, Comprehensive Presentation of Physiological Knowledge and Concepts. American Physiological Society. с. 257—316. ISBN 978-0-683-01108-1.
- ↑ Petersen Daniel P. and Middleton David (1962). Sampling and reconstruction of wave-number-limited functions in N-dimensional Euclidean spaces. Information and Control. 5 (4): 279—323. doi:10.1016/S0019-9958(62)90633-2. ISSN 0019-9958.
- ↑ Packer O and Williams DR (11 July 2003). Chapter 2. Light, the Retinal Image, and Photoreceptors. У Shevell S.K. (ред.). The Science of Color (вид. 2). Elsevier. с. 41—102. ISBN 978-0-08-052322-4.
- ↑ Field David J. (1987). Relations between the statistics of natural images and the response properties of cortical cells. Journal of the Optical Society of America A. 4 (12): 2379. doi:10.1364/JOSAA.4.002379. ISSN 1084-7529.
- ↑ Boreman, Glenn D. (2001). Modulation Transfer Function in Optical and Electro-optical Systems. SPIE Press. с. 110. ISBN 978-0-8194-4143-0.
- ↑ а б Yellott J. I. (1982). Spectral analysis of spatial sampling by photoreceptors: Topological disorder prevents aliasing. Vision Research. 22 (9): 1205—1210. doi:10.1016/0042-6989(82)90086-4. ISSN 0042-6989.
- ↑ Campbell F. W. and Gubisch R. W. (1966). Optical quality of the human eye. The Journal of Physiology. 186 (3): 558—578. doi:10.1113/jphysiol.1966.sp008056. ISSN 0022-3751.
- ↑ Gubisch R. W. (1967). Optical Performance of the Human Eye. Journal of the Optical Society of America. 57 (3): 407. doi:10.1364/JOSA.57.000407. ISSN 0030-3941.
- ↑ Jennings J.A.M. and Charman W.N. (1981). Off-axis image quality in the human eye. Vision Research. 21 (4): 445—455. doi:10.1016/0042-6989(81)90091-2. ISSN 0042-6989.
- ↑ Galvin Susan J. and Williams David R. (1992). No aliasing at edges in normal viewing. Vision Research. 32 (12): 2251—2259. doi:10.1016/0042-6989(92)90089-2. ISSN 0042-6989.
- ↑ Huck, F. O., Fales, C. L., Park, S. K., Samms, R. W. and Self, M. O. (December 1983). Information theory analysis of sensor-array imaging systems for computer vision. У Oosterlinck André (ред.). Applications of digital image processing: April 19-22, 1983, Geneva, Switzerland. International Society for Optical Engineering. с. 82—99. ISBN 978-0-89252-432-7.
- ↑ Thibos L. N. (1987). Calculation of the influence of lateral chromatic aberration on image quality across the visual field. Journal of the Optical Society of America A. 4 (8): 1673. doi:10.1364/JOSAA.4.001673. ISSN 1084-7529.
- ↑ Yellott John I. (1984). Image sampling properties of photoreceptors: A reply to Miller and Bernard. Vision Research. 24 (3): 281—282. doi:10.1016/0042-6989(84)90132-9. ISSN 0042-6989.
- ↑ Snyder A., Bossomaier T. and Hughes A. (1986). Optical image quality and the cone mosaic. Science. 231 (4737): 499—501. doi:10.1126/science.3941914. ISSN 0036-8075.
- ↑ Ruderman Daniel L. and Bialek William (1992). Seeing Beyond the Nyquist Limit. Neural Computation. 4 (5): 682—690. doi:10.1162/neco.1992.4.5.682. ISSN 0899-7667.
- ↑ Williams D.R. (1985). Aliasing in human foveal vision. Vision Research. 25 (2): 195—205. doi:10.1016/0042-6989(85)90113-0. ISSN 0042-6989.
Див. також
| |||||||||||||||||||||||||||||||||||||||||||



