Магній у біології
| Ця стаття може містити помилки перекладу з іншої мови. (березень 2023) |

Магній є важливим елементом біологічних систем та зазвичай зустрічається у вигляді іона Mg2+. Належить до групи мікроелементів[1][2][3][4] і присутній у всіх клітинах усіх організмів. Наприклад, аденозинтрифосфат (АТФ), основне джерело енергії в клітинах, стає біологічно активним після утворення зв'язку з іоном магнію, тому АТФ часто насправді є комлексмо магній-АТФ[5]. Магній важливий для стабільності всіх поліфосфатних сполук у клітинах, у тому числі пов'язаних з синтезом ДНК і РНК.

Магній є коферментом для понад 300 ферментів, зокрема для всіх ферментів, що розщеплюють або синтезують АТФ, а також тих, які використовують інші нуклеотиди для синтезу ДНК і РНК[6].
У рослин магній входить до складу пігменту хлорофілу, і таким чином є необхідним для фотосинтезу.
Біохімія[ред. | ред. код]
Mg2+ є четвертим за поширеністю (молярною концентрацією) іоном металу в клітинах і найбільш поширеним вільним двовалентним катіоном — як наслідок, він глибоко і невід'ємно вплетений у клітинний метаболізм. Дійсно, Mg2+-залежні ферменти наявні практично в кожному метаболічному шляху, часто спостерігається специфічне зв'язування Mg2+ з біологічними мембранами, Mg2+ також використовується як сигнальна речовина, а також значна частина біохімії нуклеїнових кислот потребує Mg2+, включаючи всі реакції з вивільнення енергії з АТФ[7][8][9]. У нуклеотидах трифосфатна частина сполуки незмінно стабілізується зв'язуванням з Mg2+ у всіх ферментативних процесах.
У фотосинтезуючих організмах Mg2+ виконує додаткову життєво важливу роль, як координуючий іон у молекулі хлорофілу. Цю роль виявив Річард Вілштеттер, який отримав Нобелівську премію з хімії 1915 року за очищення та структуру зв'язування хлорофілу з вуглецем.
Ферменти[ред. | ред. код]
Хімія іона Mg2+ щодо ферментів демонструє повний спектр незвичайної хімічної реакції цього іона для виконання ряду функцій[7][10][11][12] Mg2+ взаємодіє з субстратами, ферментами, а іноді і з обома (Mg2+ є частиною активного центру). Загалом, Mg2+ взаємодіє з субстратами через координацію внутрішньої сфери, стабілізуючи аніони або реакційноздатні проміжні продукти, також включаючи формування зв'язків з АТФ та активацію молекули для нуклеофільної атаки. Mg2+ зв'язується, використовуючи координацію внутрішньої або зовнішньої сфери, або змінюючи конформацію ферменту, або беручи участь у хімічному процесі каталітичної реакції для взаємодії з ферментами та іншими білками. Оскільки Mg2+ рідко повністю зневоднюється під час зв'язування ліганду, це може бути молекула води, пов'язана з Mg2+, яка є важливою, а не сам іон. Кислотність Mg2+ за Льюїсом (p K a 11,4) використовується для забезпечення реакцій як гідролізу, так і конденсації (найпоширенішими є гідроліз ефіру фосфатної кислоти та перенесення фосфорилу), які в іншому випадку вимагали б значень pH, які значно відрізняються від фізіологічних.
Нуклеїнові кислоти[ред. | ред. код]
Нуклеїнові кислоти мають важливий діапазон взаємодій з Mg2+. Зв'язування Mg2+ з ДНК і РНК стабілізує структуру; це можна спостерігати у підвищеній температурі плавлення (T m) дволанцюгової ДНК у присутності Mg2+[7]. Крім того, рибосоми містять велику кількість Mg2+, і забезпечена стабілізація є важливою для комплексоутворення цього рибопротеїну[13]/ Велика кількість ферментів, які беруть участь у біохімії нуклеїнових кислот, зв'язують Mg2+ для активності, використовуючи іон як для активації, так і для каталізу. Нарешті, автокаталіз багатьох рибозимів (ферментів, що містять лише РНК) залежить від Mg2+ (наприклад, дріжджові мітохондріальні інтрони II групи самосплайсуються).[14]
Іони магнію мають вирішальне значення для підтримки позиційної цілісності тісно згрупованих фосфатних груп. Ці кластери з'являються в численних і чітких частинах клітинного ядра та цитоплазми. Наприклад, гексагідратовані іони Mg2+ зв'язуються в глибині молекули ДНК та у зовнішньому отворі дуплексів нуклеїнових кислот А-форми.[15]
АТФ (аденозинтрифосфат), основне джерело енергії в клітинах, з'єднується з іоном магнію для своєї біологічної активності. Те, що називається АТФ, часто насправді є Mg-АТФ[5].
Клітинні мембрани та стінки[ред. | ред. код]
Біологічні клітинні мембрани та клітинні стінки є поліаніоними поверхнями, що важливо для транспорту іонів, тому що різні мембрани переважно зв'язують різні іони.[7] Як Mg2+, так і Ca2+ регулярно стабілізують мембрани шляхом зшивання карбоксилованих і фосфорильованих головних груп ліпідів. Проте було також показано, що оболонкова мембрана E. coli зв'язує Na+, K+, Mn2+ і Fe3+. Транспортування іонів залежить як від градієнта концентрації іонів, так і від електричного потенціалу (ΔΨ) через мембрану, на який впливатиме заряд на поверхні мембрани. Наприклад, специфічне зв'язування Mg2+ з оболонкою хлоропласта прихводить до втрати ефективності фотосинтезу через блокування поглинання K+ і подальше підкислення строми хлоропласту.[16]
Білки[ред. | ред. код]
Іон Mg2+ має тенденцію формувати лише слабкі зв'язки з білками (K a ≤ 105,[7] що використовується клітиною для вмикання та вимикання ферментативної активності змінами локальної концентрації Mg2+. Хоча концентрація вільного цитоплазматичного Mg2+ становить близько 1 ммоль/л, загальний вміст Mg2+ в клітинах тварин становить 30 ммоль/л,[17] а в рослинах вміст у ентодермальних клітинах листя становив 100 ммоль/л (Stelzer et al., 1990), значна частина якого буферизована у компартментах для зберігання. Цитоплазматична концентрація вільного Mg2+ буферизується шляхом зв'язування з хелаторами (наприклад, АТФ), але також, що більш важливо, буферизується зберіганням Mg2+ у внутрішньоклітинних компартментах. Транспортування Mg2+ між внутрішньоклітинними компартментами може бути основною частиною регуляції активності ферменту. Взаємодія Mg2+ з білками також важлива для транспортування іонів через біологічні мембрани.
Взаємодія з марганцем[ред. | ред. код]
У біологічних системах лише марганець (Mn2+) здатний легко замінити Mg2+, але тільки в деяких ситуаціях. Mn2+ дуже подібний до Mg2+ за хімічними властивостями, зокрема, комплексоутворення внутрішньої та зовнішньої оболонки. Mn2+ ефективно зв'язує АТФ і дозволяє гідролізувати енергетичну молекулу більшістю АТФаз. Mn2+ також може замінити Mg2+ як активуючий іон для ряду Mg2+-залежних ферментів, хоча деяка активність ферменту зазвичай втрачається.[7] Іноді такі ферментні переваги щодо металу відрізняються серед близькоспоріднених видів: наприклад, фермент зворотної транскриптази лентивірусів, таких як ВІЛ, SIV та FIV, зазвичай залежить від Mg2+, тоді як аналогічний фермент для інших ретровірусів віддає перевагу Mn2+.
Функція[ред. | ред. код]
Баланс магнію життєво необхідний для нормальної роботи всіх організмів. Водночас магній є відносно поширеним іоном у земній корі та мантії та має високу біодоступність у гідросфері. Ця доступність у поєднанні з корисною та дуже незвичайною хімією, можливо, призвела до його використання в еволюції як іона для передачі сигналів, активації ферментів і каталізу. Однак незвичайна природа іонного магнію також призвела до серйозних проблем у використанні іона в біологічних системах. Біологічні мембрани непроникні для магнію (та інших іонів), тому транспортні білки повинні сприяти надходженню магнію в клітини та внутрішньоклітинні органели та з них.
У тварин різні типи клітин підтримують різну концентрацію магнію.[18][19][20][21] Схоже так само і у рослин[22][23]. Це свідчить, що різні типи клітин регулюють надходження і відтік магнію різними способами на основі їх унікальних метаболічних потреб. Внутрішньоклітинні та системні концентрації вільного магнію повинні делікатно підтримуватися за допомогою комбінованих буферних процесів (зв'язування іонів з білками та іншими молекулами) і глушіння (транспортування іонів до накопичувального або позаклітинного простору).[24]
Магній дуже важливий для функціонування клітин. Дефіцит таких поживних речовин викликає захворювання організму. В одноклітинних організмах, як бактерії та дріжджі, низький рівень магнію викликає значне зниження швидкості росту. У штамів бактерій, з відключеним транспортом магнію, нормальні показники зберігаються лише за умови впливу дуже високих зовнішніх концентрацій іонів магнію.[25][26] У дріжджів мітохондріальний дефіцит магнію також призводить до порушення життєдіяльності.[27] У людей зустрічається також ряд генетично обумовлених розладів гіпомагніємії.[28][29][30][31]
Тварини[ред. | ред. код]
У жуйних тварин, особливо вразливих до наявності магнію в пасовищних травах, проявляється стан відомий як «трав'яна тетанія». Гіпомагніємія визначається втратою рівноваги через м'язову слабкість.[32]
Нервова система[ред. | ред. код]
Магній впливає на розслаблення м'язів шляхом прямої дії на клітинні мембрани. Іони Mg2+ закривають певні типи кальцієвих каналів, які проводять позитивно заряджені іони кальцію в нейрони. У разі надлишку магнію блокується більше каналів і знижується активність нервових клітин.[33][34]
Рослини[ред. | ред. код]
У рослин магній визнано важливим сигнальним іоном, який активує та опосередковує багато біохімічних реакцій. Найкращим прикладом цього є, можливо, регуляція фіксації вуглецю в хлоропластах у циклі Кальвіна[9][16]. Рослини з дефіцитом магнію демонструють стресову реакцію. Першими ознаками як дефіциту магнію, так і його надмірного впливу на рослини є зниження швидкості фотосинтезу. Це пояснюється центральним положенням іона Mg2+ в молекулі хлорофілу. Пізнішими наслідками дефіциту магнію для рослин є значне зниження росту та репродуктивної життєздатності.[4] Магній також може бути токсичним для рослин, хоча це зазвичай спостерігається лише в умовах посухи[35][36].

У тварин дефіцит магнію (гіпомагніємія) спостерігається за умов низької доступності магнію в навколишньому середовищі.
Харчові потреби та взаємодії[ред. | ред. код]
Mg2+ необхідний для росту рослин і присутній у вищих рослинах у кількостях порядку 80 мкмоль/г−1 сухої ваги[4]. Кількість Mg2+ різна в різних частинах рослини і залежить від стану харчування. Під час достатнього надходження надлишок Mg2+ накопичується в судинних клітинах (Stelzer et al., 1990;[23], а під час голоду Mg2+ перерозподіляється у багатьох частинах організму рослини від старих до нових листків.[4][37]
Mg2+ потрапляє в рослину через коріння. Взаємодія з іншими катіонами в ризосфері може мати значний вплив на поглинання іона (Kurvits and Kirkby, 1980;[38]). Структура клітинних стінок кореня є високопроникною для води та іонів, і, отже, поглинання іонів клітинами кореня може відбуватися будь-де від кореневих волосків до клітин, розташованих майже в центрі кореня (обмежено тільки Каспарською смугою). Стінки та мембрани рослинних клітин несуть велику кількість негативних зарядів, і взаємодія катіонів з цими зарядами є ключовою для поглинання катіонів клітинами коренів та забезпечує локальний концентруючий ефект.[39] Mg2+ відносно слабко зв'язується з цими зарядами і може бути витіснений іншими катіонами, що перешкоджає поглинанню та викликає дефіцит у рослині.
В окремих рослинних клітинах потреби в Mg2+ здебільшого такі ж, як і для всього клітинного життя; Mg2+ використовується для стабілізації мембран, життєво важливий для використання АТФ, бере активну участь у біохімії нуклеїнових кислот і є кофактором для багатьох ферментів (включаючи рибосоми). Крім того, Mg2+ є координуючим іоном у молекулі хлорофілу. Саме внутрішньоклітинна компартменталізація Mg2+ у рослинних клітинах призводить до додаткової складності. Відомо про чотири компартменти рослинної клітини, які взаємодіють з Mg2+. Спочатку Mg2+ потрапляє в цитоплазму клітини (за допомогою ще неідентифікованої системи), але концентрації вільного Mg2+ у цьому відділі суворо регулюються на відносно низьких рівнях (~2 ммоль/л), тому будь-який надлишок Mg2+ або швидко експортується, або зберігається у другому внутрішньоклітинному відділі, вакуолі.[40] Потреба в Mg2+ в мітохондріях була продемонстрована на дріжджах,[41] і дуже ймовірно, що те ж саме буде стосуватися і рослин. Хлоропластам також потрібна значна кількість внутрішнього Mg2+ і низька концентрація цитоплазматичного Mg2+.[42][43] Крім того, ймовірно, що інші субклітинні органели (наприклад, комплекс Гольджі, ендоплазматична ретикулум тощо) також потребують Mg2+.
Розподіл іонів магнію в рослині[ред. | ред. код]
Потрапляючи в цитоплазматичний простір клітин кореня, Mg2+ разом з іншими катіонами, ймовірно, транспортується радіально в осьовий циліндр (стелу) та судинну тканину,[44] Далі з клітин, що оточують ксилему, іони вивільняються або закачуються в ксилему і переносяться по рослині. Так як Mg2+ є дуже рухливим як у ксилемі, так і у флоемі,[45] іони транспортуватимуться до верхньої частини рослини та назад у безперервному циклі поповнення. Отже, поглинання та вивільнення з судинних клітин є, ймовірно, ключовою частиною гомеостазу Mg2+ всієї рослини. На рисунку 1 показано, як мало процесів було пов'язано з їхніми молекулярними механізмами (лише вакуольне поглинання було пов'язано з транспортним білком AtMHX).
На діаграмі показано схему рослини та передбачувані процеси транспорту Mg2+ у корені та листі, де Mg2+ завантажується та вивантажується з судинних тканин.[4] Mg2+ потрапляє в простір клітинної стінки кореня (1) і взаємодіє з негативними зарядами, пов'язаними з клітинними стінками та мембранами. Mg2+ може відразу потрапляти в клітини (симпластичний шлях) або може потрапити аж до Каспарієвої смуги (4) перед поглинанням клітинами (апопластичний шлях; 2). Концентрація Mg2+ у клітинах кореня, ймовірно, буферизується зберіганням у вакуолях кореневих клітин (3). Водночас клітини кінчика кореня не містять вакуолей. Потрапляючи в цитоплазму клітини кореня, Mg2+ рухається до центру кореня за допомогою плазмодесми, де він завантажується в ксилему (5) для транспортування до верхніх частин рослини. Коли Mg2+ досягає листя, він вивантажується з ксилеми в клітини (6) і знову буферизується у вакуолях (7). Невідомо, чи відбувається цикл Mg2+ у флоемі через загальні клітини листка (8) чи безпосередньо з ксилеми у флоему через клітини-переносники (9). Mg2+ може повернутися до коренів у соку флоеми.
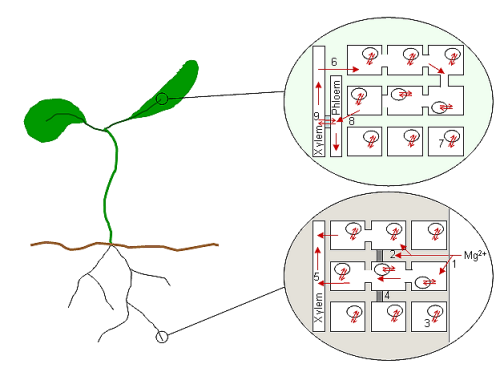
Коли іон Mg2+ поглинається клітиною для метаболічних процесів, зазвичай вважається, що іон залишається в цій клітині доти, доки клітина активна.[4] У судинних клітинах це не завжди так; якщо Mg2+ багато, то він зберігається у вакуолі та не бере участі в повсякденних метаболічних процесах клітини (Stelzer et al., 1990), вивільняється за потреби. Але для більшості клітин саме смерть через старіння або пошкодження вивільняє Mg2+ та багато інших іонних компонентів, переробляючи їх у здорові частини рослини. Крім того, коли Mg2+ у навколишньому середовищі у дефіциті деякі види здатні мобілізувати Mg2+ зі старих тканин.[37] Ці процеси охоплюють вивільнення Mg2+ із зв'язаного та накопиченого станів і його транспортування назад у судинну тканину, де він може бути розподілений до решти частин рослини. Під час росту та розвитку Mg2+ також ремобілізується в рослині, коли змінюються відносини джерела та стоку.[4]
Гомеостаз Mg2+ в окремих рослинних клітинах підтримується процесами у плазматичній мембрані та мембрані вакуолі (див. рис. 2). Основною рушійною силою для переміщення іонів у клітинах рослин є ΔpH[46]. H+-АТФази перекачують іони H+ проти їх градієнта концентрації, щоб підтримувати різницю рН, яка може бути використана для транспорту інших іонів і молекул. Іони Н+ викачуються з цитоплазми в позаклітинний простір або у вакуоль. Надходження Mg2+ у клітину може відбуватися одним із двох шляхів: через канали, що використовують ΔΨ (негативний внутрішній) через цю мембрану, або через симпорт з іонами H+. Для транспортування іонів Mg2+ у вакуоль потрібен антипортовий транспортер Mg2+/H+ (наприклад, AtMHX). Активність Н+-АТФаз залежить від Mg2+ (зв'язаного з АТФ), тому Mg2+ необхідний для підтримки власного гомеостазу.
Наведено схему рослинної клітини з чотирма основними компартментами, які точно взаємодіють з Mg2+. H+-АТФази підтримують постійний ΔpH через плазматичну мембрану та мембрану вакуолі. Mg2+ транспортується у вакуоль за допомогою енергії ΔpH (у A. thaliana AtMHX). Для транспортування Mg2+ у клітину може використовуватися або негативний ΔΨ, або ΔpH. Для транспортування Mg2+ в мітохондрії, ймовірно, використовується ΔΨ, як і в мітохондріях дріжджів, і ймовірно, що хлоропласти приймають Mg2+ за подібною системою. Механізм і молекулярна основа вивільнення Mg2+ з вакуолей і з клітини невідомі. Подібним чином регульовані світлом зміни концентрації Mg2+ у хлоропластах не повністю вивчені, але потребують транспортування іонів H+ через тилакоїдну мембрану.

Магній, хлоропласти і фотосинтез[ред. | ред. код]
Mg2+ є комплексоутворювачем у молекулі хлорофілу, і в рослинах, де іон міститься у великій кількості, близько 6 % загального Mg2+ зв'язано з хлорофілом.[4][47][48] Накопичування тилакоїдів стабілізується Mg2+ і є важливим для ефективності фотосинтезу, щоб відбувалися фазові переходи.[49]
Mg2+, ймовірно, поглинається хлоропластами переважно під час індукованого світлом розвитку від пропластиди до хлоропласта або етіопласту до хлоропласта. У цей час для синтезу хлорофілу та біогенезу стеків тилакоїдної мембрани абсолютно необхідний двовалентний катіон.[50][51]
Інформація щодо здатності Mg2+ переходити в хлоропласти та виходити з них після цієї початкової фази розвитку суперечлива. Deshaies та співав. (1984) виявили, що Mg2+ дійсно переміщувався в ізольовані хлоропласти молодих рослин гороху,[52] але Гупта і Берковіц (1989) не змогли відтворити результат, використовуючи старі хлоропласти шпинату[53]. Deshaies та стівав. заявили у своїй статті, що старі хлоропласти гороху показали менш значні зміни у вмісті Mg 2+, ніж ті, які використовувалися для формування їхніх висновків. Відносна частка незрілих хлоропластів, присутніх у препаратах, може пояснити ці спостереження.
Метаболічний стан хлоропласту значно змінюється вночі та вдень. Протягом дня хлоропласт активно збирає енергію світла і перетворює її в хімічну. Активація залучених метаболічних шляхів відбувається внаслідок змін хімічної природи строми після дії світла. H+ викачується зі строми (як у цитоплазму, так і в просвіт), що призводить до лужного pH.[54][55] Mg2+ (разом з K+) вивільняється з просвіту в строму в процесі електронейтралізації, щоб збалансувати потік H+.[56][57][58][59] Нарешті, тіолові групи ферментів зменшуються через зміну окисно-відновного стану строми.[60] Прикладами ферментів, що активуються у відповідь на ці зміни, є фруктозо-1,6-бісфосфатаза, седохептулозобісфосфатаза та рибулозо-1,5-бісфосфаткарбоксилаза[4][11]. Протягом темного періоду, якби ці ферменти були активними, відбувався б марнотратний цикл продуктів і субстратів.
Можна виділити два основні класи ферментів, які взаємодіють з Mg2+ у стромі під час світлової фази.[11] По-перше, ферменти гліколітичного шляху найчастіше взаємодіють з двома атомами Mg2+. Перший атом є алостеричним модулятором активності ферментів, тоді як другий є частиною активного центру і бере безпосередню участь у каталітичній реакції. Другий клас ферментів включає ті, де Mg2+ утворює комплекс з нуклеотидними ди- і трифосфатами (АДФ і АТФ), а хімічна зміна включає перенесення фосфорилу. Mg2+ також може відігравати роль підтримки структури в цих ферментах (наприклад, енолазі).
Магнієвий стрес[ред. | ред. код]
Реакції організму рослин на стрес можна спостерігати у рослин, які забезпечені недостатньо або надлишково Mg2+. Першими ознаками стресу Mg2+ у рослин як через голодування, так і через токсичність є пригнічення швидкості фотосинтезу, припускають, що через тісні зв'язки між Mg2+ і хлоропластами/хлорофілом. У сосен ще до видимої появи жовтизни і некротичних плям фотосинтетична ефективність хвої помітно падає.[37] Повідомляється, що за дефіциту Mg2+ вторинні ефекти включають нерухомість вуглеводів, припинення транскрипції РНК і синтезу білка.[61] Однак через рухливість Mg2+ всередині рослини фенотип дефіциту може бути присутнім лише в старих частинах рослини. Наприклад, у Pinus radiata, що страждають від дефіциту Mg2+, однією з найперших ідентифікаційних ознак є хлороз хвої на нижніх гілках дерева. Це пояснюють тим, що Mg2+ було відновлено з цих тканин і переміщено до зростаючої (зеленої) хвої вище на дереві.[37]
Дефіцит Mg2+ може бути спричинений нестачею іона в середовищі (ґрунті), але частіше виникає через пригнічення його поглинання.[4] Mg2+ досить слабко зв'язується з негативно зарядженими групами в клітинних стінках коренів, тому надлишок інших катіонів, таких як K+, NH4+, Ca2+ і Mn2+, може перешкоджати поглинанню (Kurvits and Kirkby, 1980;[38]). У кислих ґрунтах Al3+ є особливо сильним інгібітором поглинання Mg2+.[62][63] Пригнічення поглинання Al3+ і Mn2+ є сильнішим, ніж це можна пояснити простим витісненням, отже можливо, що ці іони безпосередньо зв'язуються з системою поглинання Mg2+.[4] У бактерій і дріжджів таке зв'язування Mn2+ вже спостерігалося. Реакція на стрес у рослини розвивається, коли клітинні процеси припиняються через нестачу Mg2+ (наприклад, підтримка ΔpH через плазматичні та вакуольні мембрани). У рослинах, які страждають від голоду Mg2+ в умовах слабкого освітлення, відсоток Mg2+, зв'язаного з хлорофілом, становить 50 %[64]. Імовірно, цей дисбаланс негативно впливає на інші клітинні процеси.
Складніше розвивається токсичний стрес Mg2+. Коли Mg2+ присутні у великій кількості, рослини зазвичай поглинають іон і зберігають його (Stelzer et al., 1990). Однак, якщо це супроводжується посухою, концентрація іонів у клітині може різко зрости. Високі цитоплазматичні концентрації Mg2+ блокують канал K+ у внутрішній мембрані оболонки хлоропласта та перешкоджають видаленню іонів H+ зі строми хлоропласта. Це призводить до підкислення строми, далі деактивації ключових ферментів фіксації вуглецю та призводить до утворення вільних радикалів кисню в хлоропласті, що викликає окисне ушкодження[65].
Транспорт магнію[ред. | ред. код]
Хімічні та біохімічні властивості Mg2+ створюють значну проблему для клітинної системи під час транспортування іонів через біологічні мембрани. Догма транспорту іонів стверджує, що транспортер розпізнає іон, а потім поступово видаляє гідратаційну воду, видаляючи більшу частину або всю воду в окремих порах перед тим, як вивільнити іон на дальній стороні мембрани[66]. Завдяки властивостям Mg2+, великій зміні об'єму від гідратованого до неочищеного іона, високій енергії гідратації та дуже низькій швидкості обміну лігандів у внутрішній координаційній сфері, ці кроки, ймовірно, є складнішими, ніж для більшості інших іонів. На сьогоднішній день було показано, що лише білок ZntA Paramecium є каналом Mg2+.[67] Механізми транспорту Mg2+ білками, що залишилися, починають розкриватися з першою тривимірною структурою транспортного комплексу Mg2+, яка була розкрита в 2004 році.[68]
Гідратна оболонка іона Mg2+ має дуже міцно зв'язану внутрішню оболонку з шести молекул води та відносно міцно зв'язану другу оболонку, що містить 12–14 молекул води (Markham et al., 2002). Таким чином, передбачається, що для розпізнавання іона Mg2+ потрібен певний механізм для початкової взаємодії з гідратною оболонкою Mg2+ з подальшим прямим розпізнаванням/зв'язуванням іона з білком.[69] Завдяки потужності внутрішньосферного комплексоутворення між Mg2+ і будь-яким лігандом численні одночасні взаємодії з транспортним білком на цьому рівні можуть значно затримувати іон у транспортній порі клітини. Отже, можливо, що велика частина гідратної води утримується під час транспортування, що дозволяє слабшу (але все ще специфічну) координацію зовнішньої сфери.
Незважаючи на механічні труднощі, Mg2+ повинен транспортуватися через мембрани, і вже описано велику кількість потоків Mg2+ через мембрани з різних систем.[70] Однак лише невелика кількість транспортерів Mg2+ зараз охарактеризована на молекулярному рівні.
Блокада лігандних іонних каналів[ред. | ред. код]
Іони магнію (Mg2+) у клітинній біології зазвичай майже у всьому протилежні іонам Ca2+, оскільки вони також є двовалентними, але мають більшу електронегативність і, тому, посилено тягнуть молекули води, перешкоджаючи проходженню через канал (навіть якщо сам магній менший). Таким чином, іони Mg2+ блокують канали Ca2+, такі як (канали NMDA), та впливають на канали щілинних контактів, утворюючи електричні синапси.
Медичне значення[ред. | ред. код]
Недостатнє споживання магнію часто викликає м'язові спазми та пов'язане з серцево-судинними захворюваннями, діабетом, високим кров'яним тиском, тривожними розладами, мігренню, остеопорозом та інфарктом мозку[71][72]. Проте гострий дефіцит (див. гіпомагніємія) зустрічається рідко і частіше пов'язаний з побічною дією ліків (наприклад, хронічне вживання алкоголю або діуретиків), ніж з низьким споживанням з їжею. Але також може виникнути у людей, які тривалий час знаходяться на внутрішньовенному харучаванні
Головним симптомом надмірного перорального споживання магнію є діарея. Добавки на основі хелатів амінокислот (таких як гліцинат, лізинат тощо) набагато краще переносяться травною системою та не мають побічних ефектів попередніх форм сполук, тоді як дієтичні добавки з пролонгованим вивільненням запобігають виникненню діареї. Нирки у дорослих людей досить ефективно виводять надлишок магнію, тому пероральне отруєння магнієм у дорослих із нормальною функцією нирок трапляється дуже рідко. Діти грудного віку, навіть здорові, гірше здатні виводити надлишок магнію, тому їм не слід давати магнієві добавки, окрім як за наглядом лікаря.
Надмірний вплив магнію є токсичним для окремих клітин, хоча експериментально це не показано. Гіпермагніємія, надлишок магнію в крові, зазвичай спричинена втратою функції нирок. Здорові тварини швидко виводять надлишок магнію з сечею та калом.[73] Наявність магнію у сечі називається магнезурією. Характерні концентрації магнію в модельних організмах: у E. coli 30-100 мМ (зв'язаний), 0,01-1 мМ (вільний), у дріжжах, що діляться, 50 мМ, у клітинах ссавців 10 мМ (зв'язаний), 0,5 мМ (вільний) і в плазмі крові 1 мМ.[74]
Фармацевтичні препарати з магнієм використовують для лікування таких станів, як дефіцит магнію або гіпомагніємія, а також еклампсія[75].Такі препарати зазвичай містять сульфат або хлорид магнію для парентерального застосування. Магній засвоюється організмом із прийнятною ефективністю (від 30 % до 40 %) з будь-якої розчинної солі магнію, такої як хлорид або цитрат. Магній так само засвоюється з солей Епсома, хоча сульфат у цих солях посилює їх проносний ефект у більших дозах. Всмоктування магнію з нерозчинних оксидів і гідроксидів (магнезіального молока) є нестабільним і менш ефективним через залежність від нейтралізації та розчинення солі кислотою шлунку, що може бути (і зазвичай не є) повним..
Використання магнію оротату як допоміжну терапію у пацієнтів під час лікування тяжкої застійної серцевої недостатності збільшує рівень виживання та покращує клінічні симптоми та якість життя пацієнтів.[76]
Гіпертонія[ред. | ред. код]
Внутрішньовенне введення сульфату магнію використовується для лікування прееклампсії[77]. Мета-аналіз 22 клінічних випробувань із діапазонами доз від 120 до 973 мг/добу (крім гіпертензії через вагітність) і середньою дозою 410 мг, показав, що добавки магнію мали невеликий, але статистично значущий ефект, знижуючи систолічний артеріальний тиск на 3–4 мм рт. ст., а діастолічний артеріальний тиск на 2–3 мм рт. ст. Ефект був більшим за дози більше 370 мг/добу[78].
Цукровий діабет і толерантність до глюкози[ред. | ред. код]
Більше споживання магнію з їжею пов'язане зі зниженням захворюваності на цукровий діабет.[79] У людей з цукровим діабетом або з високим ризиком його виникнення добавки магнію знижують рівень глюкози натщесерце.[80]
Важливість у зв'язуванні ліків[ред. | ред. код]
У жовтні 2001 року в Nature опублікували результати дослідження[81] основ структурної взаємодії між клінічно значущими антибіотиками та рибосомою 50S. Після проведення рентгенівської кристалографії з високою роздільною здатністю було встановлено формування зв'язків антибіотиків лише з 23S рРНК субодиниці рибосоми, а з білковою частиною субодиниці взаємодії не було. Ці результати показали «важливість передбачуваних іонів Mg2+ для зв'язування деяких ліків».
Дієтичні рекомендації[ред. | ред. код]
У 1997 році Інститут медицини США оновив орієнтовні середні потреби (EAR) і рекомендовані дієтичні норми (RDA) для магнію. У випадку коли немає достатньої інформації для встановлення EAR та RDA використовують оцінку під назвою «адекватне споживання» (AI). Поточні EAR для магнію для жінок і чоловіків віком від 31 року становлять 265 мг/день і 350 мг/добу відповідно. RDA — 320 і 420 мг/добу. RDA вищі, ніж EAR для визначення суми, які покриватимуть людей із потребами, вищими за середні. RDA для вагітних становить від 350 до 400 мг/добу залежно від віку жінки, а під час лактації коливається від 310 до 360 мг/добу з тієї ж причини. Для дітей віком від 1 до 13 років RDA збільшується з віком від 65 до 200 мг/добу. Інститут медицини США для безпеки також встановлює допустимі верхні рівні споживання (UL) для вітамінів і мінералів, якщо є достатні докази. Для магнію UL встановлено на 350 мг/добу. UL є специфічним для магнію як дієтичної добавки, тому що одноразовий надмірний прийом магнію може спричинити діарею. UL не поширюється на магній у продуктах харчування. Разом EAR, RDA та ULs називаються дієтичними стандартними дозами споживання[82].
| Вік | Чоловік | Жінка | Вагітність | лактація |
|---|---|---|---|---|
| Від народження до 6 міс | 30 мг* | 30 мг* | ||
| 7–12 місяців | 75 мг* | 75 мг* | ||
| 1–3 роки | 80 мг | 80 мг | ||
| 4–8 років | 130 мг | 130 мг | ||
| 9–13 років | 240 мг | 240 мг | ||
| 14–18 років | 410 мг | 360 мг | 400 мг | 360 мг |
| 19–30 років | 400 мг | 310 мг | 350 мг | 310 мг |
| 31-50 років | 420 мг | 320 мг | 360 мг | 320 мг |
| 51+ років | 420 мг | 320 мг |
* = Достатнє споживання
Європейське агентство з безпеки харчових продуктів (EFSA) називає сукупний набір інформації дієтичними референтними значеннями, у якому популяційне референтне споживання (PRI) використовують замість RDA, а середню потребу замість EAR. AI і UL визначаються аналогічно Сполученим Штатам. Для жінок і чоловіків віком від 18 років AI встановлено на рівні 300 і 350 мг/добу відповідно. AI для вагітності та лактації також 300 мг/добу. Для дітей віком 1–17 років AI збільшується з віком від 170 до 250 мг/добу. Ці показники AI нижчі, ніж RDA США[84]. Європейське агентство з безпеки харчових продуктів розглянуло те саме питання про безпеку та встановило UL на рівні 250 мг/день — нижче значення в США[85]. UL магнію унікальний тим, що він нижчий, ніж деякі RDA. Це стосується лише прийому фармакологічного засобу або дієтичної добавки і не включає споживання з їжею та водою.
Магній у їжі[ред. | ред. код]

Зелені овочі, такі як шпинат, забезпечують надходження магнію завдяки великому вмісту молекул хлорофілу, які містять цей іон. Горіхи (особливо бразильські горіхи, кеш'ю та мигдаль), насіння (наприклад, гарбузове), чорний шоколад, смажені соєві боби, висівки та деякі цільнозернові крупи також є хорошими джерелами магнію[86].
Хоча багато харчових продуктів містять магній, зазвичай він міститься в низьких кількостях. Як і з більшістю поживних речовин, добову потребу в магнії складно задовольнити однією порцією будь-якої окремої їжі. Вживання різноманітних фруктів, овочів і злаків допоможе забезпечити достатнє споживання магнію.
Через легкорозчинність магнію у воді, рафінована їжа, яка обробляється, вариться у воді та сушиться, є поганим джерелом поживних речовин. Так, цільнозерновий хліб містить вдвічі більше магнію, порівняно з білим хлібом, оскільки багаті магнієм зародки та висівки видаляються під час помола пшеничного борошна. Таблиця харчових джерел магнію пропонує багато дієтичних джерел магнію.
«Жорстка» вода також може забезпечити магній, але у «м'якій» воді магнію вже менше. Дієтичні дослідження не оцінюють споживання магнію з води, що може призвести до недооцінки загального споживання магнію та його мінливості.
Надмірне вживання магнію може ускладнити засвоєння кальцію організмом. Нестача магнію може призвести до гіпомагніємії, як описано вище, з нерегулярним серцебиттям, високим кров'яним тиском (ознака у людей, але не у деяких піддослідних тварин, таких як гризуни), безсоння та м'язові спазми (фасцикуляції). Однак, як зазначалося, симптоми низького вмісту магнію внаслідок лише харчового дефіциту трапляється рідко.
Нижче перераховано деякі продукти харчування та кількість магнію в них[87] (склянка ~236 мл):
- Насіння гарбуза без лушпиння (1⁄4 склянки) = 303 мг
- Насіння чіа (1/4 склянки) = 162 мг
- Борошно гречане (1⁄2 склянки) = 151 мг
- Бразильські горіхи (1⁄4 склянки) = 125 мг
- Вівсяні висівки, сирі (1⁄2 склянки) = 110 мг
- Какао-порошок (1⁄4 склянки) = 107 мг
- Палтус (85 г) = 103 мг
- Мигдаль (1⁄4 склянки) = 99 мг
- Кеш'ю (1⁄4 склянки) = 89 мг
- Цільнозернове борошно (1⁄2 склянки) = 83 мг
- Шпинат, варений (1⁄2 склянки) = 79 мг
- Мангольд, варений (1⁄2 склянки) = 75 мг
- Шоколад , 70 % какао (28 г) = 73 мг
- Твердий тофу (1⁄2 склянки) = 73 мг
- Чорна квасоля, варена (1⁄2 склянки) = 60 мг
- Кіноа, варена (1⁄2 склянки) = 59 мг
- Арахісове масло (2 столові ложки) = 50 мг
- Волоські горіхи (1⁄4 склянки) = 46 мг
- Насіння соняшнику, очищені (1⁄4 склянки) = 41 мг
- Нут, варений (1⁄2 склянки) = 39 мг
- Кале, варена (1⁄2 склянки) = 37 мг
- Сочевиця, варена (1⁄2 склянки) = 36 мг
- Вівсяна каша, варена (1⁄2 склянки) = 32 мг
- Рибний соус (1 столова ложка) = 32 мг
- Молоко, знежирене (28 г) = 27 мг
- Кава , еспресо (28 г) = 24 мг
- Цільнозерновий хліб (1 скибочка) = 23 мг
Маркування[ред. | ред. код]
У США на продуктах харчування та дієтичних добавок кількість у порції виражається у відсотках від добової норми (%DV). Для магнію 100 % добової норми становило 400 мг, але станом на 27 травня 2016 року змінили до 420 мг для узгодження з RDA.[88][89] Таблиця старих і нових добових норм для дорослих наведена в Рекомендованій добовій нормі споживання.
Вимірювання магнію в біологічних зразках[ред. | ред. код]
За допомогою радіоактивних ізотопів[ред. | ред. код]
Використання радіоактивних індикаторних елементів у дослідженнях поглинання іонів дозволяє розрахувати km, Ki та Vmax і визначити початкову зміну вмісту іонів у клітинах. Ізотоп 28Mg розпадається через випромінювання бета- або гамма-частинок високої енергії, які можна виміряти за допомогою сцинтиляційного лічильника. Однак період напіврозпаду 28Mg, найбільш стабільного з радіоактивних ізотопів магнію, становить лише 21 годину. Це сильно обмежує експерименти з нуклідом. Крім того, з 1990 року жодне підприємство регулярно не виробляло 28Mg, а ціна за мКі тепер прогнозується близько 30 тис. доларів США.[69] Хімічна природа Mg2+ дуже близька до кількох інших катіонів.[90] Тому Co2+, Mn2+ і Ni2+ успішно використовувалися для імітації властивостей Mg2+ у деяких ферментативних реакціях, а радіоактивні форми цих елементів — в дослідженнях транспорту катіонів. Складність використання заміщення іонів металів у вивченні функції ферменту полягає у складності встановити зв'язок між активністю ферменту із заміщенням іона порівняно з вихідним.[90]
За люмінесцентними індикаторами[ред. | ред. код]
Ряд хелаторів двовалентних катіонів мають різні спектри флуоресценції у зв'язаному і незв'язаному станах.[91] Хелатори Ca2+ добре відомі, мають високу спорідненість з катіоном і низьку перешкоду з боку інших іонів. Хелатори Mg2+ відстають, і основний флуоресцентний барвник для Mg2+ (mag-fura 2[92]) насправді має вищу спорідненість до Ca2+.[93] Це обмежує застосування цього барвника тими типами клітин, де рівень Ca2+ у стані спокою становить < 1мкМ і не змінюється залежно від експериментальних умов, за яких потрібно вимірювати Mg2+. Нещодавно Otten та співав. (2001) описали роботу над новим класом сполук, які можуть виявитися більш корисними, маючи значно кращу спорідненість зв'язування з Mg2+.[94] Використання флуоресцентних барвників обмежується вимірюванням вільного Mg2+. Якщо концентрація іонів буферизується клітиною шляхом хелатування або видалення до субклітинних компартментів, виміряна швидкість поглинання дасть лише мінімальні значення km і Vmax.
За електрофізіологією[ред. | ред. код]
По-перше, іоноспецифічні мікроелектроди можна використовувати для вимірювання внутрішньої концентрації вільних іонів клітин і органел. Основними перевагами є зчитування з клітин протягом відносно тривалих періодів часу, і що, на відміну від барвників, до клітин додається дуже невелика додаткова іонна буферна ємність.[95]
По-друге, техніка двоелектродного фіксатора напруги дозволяє безпосередньо вимірювати потік іонів через мембрану клітини.[96] Мембрану тримають під електричним потенціалом і вимірюють струм у відповідь. Усі іони, що проходять через мембрану, беруть участь у виміряному струмі.
По-третє, техніка фіксації напруги використовує ізольовані ділянки природної або штучної мембрани майже так само, як і фіксація напруги, але без вторинних ефектів клітинної системи. За ідеальних умов провідність окремих каналів можна визначити кількісно. Ця методологія дає найбільш пряме вимірювання дії іонних каналів.[96]
Методом абсорбційної спектроскопії[ред. | ред. код]
Полум'яна атомно-абсорбційна спектроскопія (AAS) визначає загальний вміст магнію в біологічному зразку.[91] Проте цей спосіб руйнівний, а біологічні зразки повинні бути розбиті в концентрованих кислотах, щоб уникнути засмічення тонкого розпилювача. Окрім цього, єдиним обмеженням є те, що зразки мають бути об'ємом приблизно 2 мл і в діапазоні концентрацій 0,1–0,4 мкмоль/л для оптимальної точності. Оскільки ця методика не може відрізнити Mg2+, який уже присутній у клітині, і той, що поглинається під час експерименту, можна кількісно визначити лише вміст, який не поглинається.
Плазма з індуктивним зв'язком (ICP) з використанням модифікацій мас-спектрометрії (MS) або атомно-емісійної спектроскопії (AES) також дозволяє визначити загальний вміст іонів у біологічних зразках.[97] Ці методи більш чутливі, ніж полум'яна ААС, і здатні вимірювати кількість кількох іонів одночасно. Однак вони також значно дорожчі.
Дивитися також[ред. | ред. код]
- Біологія і фармакологія хімічних елементів
- Дефіцит магнію (сільське господарство)
- Дефіцит магнію (гіпомагніемія) в організмі
- Остеопороз
- Іонні канали
Примітки[ред. | ред. код]
- ↑ Magnesium (In Biological Systems). Van Nostrand's Scientific Encyclopedia. John Wiley & Sons, Inc. 2006. doi:10.1002/0471743984.vse4741. ISBN 978-0471743989.
- ↑ Leroy, J. (1926). Necessite du magnesium pour la croissance de la souris. Comptes Rendus des Séances de la Société de Biologie. 94: 431—433.
- ↑ Lusk, J.E.; Williams, R.J.P.; Kennedy, E.P. (1968). Magnesium and the growth of Escherichia coli. Journal of Biological Chemistry. 243 (10): 2618—2624. doi:10.1016/S0021-9258(18)93417-4. PMID 4968384.
- ↑ а б в г д е ж и к л м Marschner, H. (1995). Mineral Nutrition in Higher Plants. San Diego: Academic Press. ISBN 978-0-12-473542-2.
- ↑ а б Definition: magnesium from Online Medical Dictionary. 25 грудня 2007. Архів оригіналу за 25 грудня 2007. Процитовано 17 січня 2018.
- ↑ Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride (англ.). Washington, DC: National Academy Press. 1997. с. 190—191.
- ↑ а б в г д е Cowan, J. A. (1995). J.A. Cowan (ред.). Introduction to the biological chemistry of magnesium. New York: VCH.
- ↑ Romani, A. M. P.; Maguire, M. E. (2002). Hormonal regulation of Mg2+ transport and homeostasis in eukaryotic cells. BioMetals. 15 (3): 271—283. doi:10.1023/A:1016082900838. PMID 12206393.
- ↑ а б Shaul, O. (2002). Magnesium transport and function in plants: the tip of the iceberg. BioMetals. 15 (3): 309—323. doi:10.1023/A:1016091118585. PMID 12206396.
- ↑ Black, C. B.; Cowan, J.A. (1995). Magnesium-dependent enzymes in nucleic acid biochemistry. The Biological Chemistry of Magnesium. New York: VCH.
- ↑ а б в Black, C.B.; Cowan, J. A. (1995). Magnesium-dependent enzymes in general metabolism. The Biological Chemistry of Magnesium. New York: VCH.
- ↑ Cowan, J. A. (2002). Structural and catalytic chemistry of magnesium-dependent enzymes. BioMetals. 15 (3): 225—235. doi:10.1023/A:1016022730880. PMID 12206389.
- ↑ Sperazza, J. M.; Spremulli, L. L. (1983). Quantitation of cation binding to wheat germ ribosomes: influences on subunit association equilibria and ribosome activity. Nucleic Acids Research. 11 (9): 2665—2679. doi:10.1093/nar/11.9.2665. PMC 325916. PMID 6856472.
- ↑ Smith, R. L.; Thompson, L.J.; Maguire, M. E. (1995). Cloning and characterization of MgtE, a putative new class of Mg2+ transporter from Bacillus firmus OF4. Journal of Bacteriology. 177 (5): 1233—1238. doi:10.1128/jb.177.5.1233-1238.1995. PMC 176728. PMID 7868596.
- ↑ Robinson, Howard; Gao, Yi-Gui; Sanishvili, Ruslan; Joachimiak, Andrzej; Wang, Andrew H.-J. (15 квітня 2000). Hexahydrated magnesium ions bind in the deep major groove and at the outer mouth of A-form nucleic acid duplexes. Nucleic Acids Research. 28 (8): 1760—1766. doi:10.1093/nar/28.8.1760. PMC 102818. PMID 10734195.
- ↑ а б Berkowitz, G. A.; Wu, W. (1993). Magnesium, potassium flux and photosynthesis. Magnesium Research. 6 (3): 257—265. PMID 8292500.
- ↑ Ebel, H.; Gunther, T. (1980). Magnesium metabolism: a review. Journal of Clinical Chemistry and Clinical Biochemistry. 18 (5): 257—270. doi:10.1515/cclm.1980.18.5.257. PMID 7000968.
- ↑ Valberg, L. S.; Holt, J.M.; Paulson, E.; Szivek, J. (1965). Spectrochemical Analysis of Sodium, Potassium, Calcium, Magnesium, Copper, and Zinc in Normal Human Erythrocytes. Journal of Clinical Investigation. 44 (3): 379—389. doi:10.1172/JCI105151. PMC 292488. PMID 14271298.
- ↑ Seiler, R. H.; Ramirez, O.; Brest, A. N.; Moyer, J. H. (1966). Serum and erythrocytic magnesium levels in congestive heart failure: effect of hydrochlorothiazide. American Journal of Cardiology. 17 (6): 786—791. doi:10.1016/0002-9149(66)90372-9.
- ↑ Walser, M. (1967). Magnesium metabolism. Ergebnisse der Physiologie Biologischen Chemie und Experimentellen Pharmakologie. 59: 185—296. doi:10.1007/BF02269144. PMID 4865748.
- ↑ Iyengar, G.V.; Kollmer, W. E.; Bowen, H. J. M. (1978). The Elemental Composition of Human Tissues and Body Fluids. Weinheim, New York: Verlag Chemie. ISBN 978-0-89573-003-9.
- ↑ Stelzer, R.; Lehmann, H.; Krammer, D.; Luttge, U. (1990). X-Ray microprobe analysis of vacuoles of spruce needle mesophyll, endodermis and transfusion parenchyma cells at different seasons of the year. Botanica Acta. 103 (4): 415—423. doi:10.1111/j.1438-8677.1990.tb00183.x.
- ↑ а б Shaul, O.; Hilgemann, D. W.; de-Almeida-Engler, J.; Van, M.M.; Inze, D.; Galili, G. (1999). Cloning and characterization of a novel Mg(2+)/H(+) exchanger. EMBO Journal. 18 (14): 3973—3980. doi:10.1093/emboj/18.14.3973. PMC 1171473. PMID 10406802.
- ↑ Thomas, R.C.; Coles, J. A.; Deitmer, J. W. (1991). Homeostatic muffling. Nature. 350 (6319): 564. Bibcode:1991Natur.350R.564T. doi:10.1038/350564b0. PMID 2017256.
- ↑ Hmiel, S. P.; Snavely, M. D.; Florer, J. B.; Maguire, M. E.; Miller, C. G. (1989). Magnesium transport in Salmonella typhimurium: genetic characterization and cloning of three magnesium transport loci. Journal of Bacteriology. 171 (9): 4742—4751. doi:10.1128/jb.171.9.4742-4751.1989. PMC 210275. PMID 2548998.
- ↑ MacDiarmid, C.W.; Gardner, R. C. (1998). Overexpression of the Saccharomyces cerevisiae magnesium transport system confers resistance to aluminum ion. J. Biol. Chem. 273 (3): 1727—1732. doi:10.1074/jbc.273.3.1727. PMID 9430719.
- ↑ Wiesenberger, G.; Waldherr, M.; Schweyen, R. J. (1992). The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo. J. Biol. Chem. 267 (10): 6963—6969. doi:10.1016/S0021-9258(19)50522-1. PMID 1551905.
- ↑ Paunier, L.; Radde, I. C.; Kooh, S.W.; Conen, P.E.; Fraser, D. (1968). Primary hypomagnesemia with secondary hypocalcemia in an infant. Pediatrics. 41 (2): 385—402. PMID 5637791.
- ↑ Weber S, Hoffmann K, Jeck N, Saar K, Boeswald M, Kuwertz-Broeking E, Meij II, Knoers NV, Cochat P, Suláková T, Bonzel KE, Soergel M, Manz F, Schaerer K, Seyberth HW, Reis A, Konrad M (2000). Familial hypomagnesaemia with hypercalciuria and nephrocalcinosis maps to chromosome 3q27 and is associated with mutations in the PCLN-1 gene. European Journal of Human Genetics. 8 (6): 414—422. doi:10.1038/sj.ejhg.5200475. PMID 10878661.
- ↑ Weber S, Schneider L, Peters M, Misselwitz J, Rönnefarth G, Böswald M, Bonzel KE, Seeman T, Suláková T, Kuwertz-Bröking E, Gregoric A, Palcoux JB, Tasic V, Manz F, Schärer K, Seyberth HW, Konrad M (2001). Novel paracellin-1 mutations in 25 families with familial hypomagnesemia with hypercalciuria and nephrocalcinosis. Journal of the American Society of Nephrology. 12 (9): 1872—1881. doi:10.1681/ASN.V1291872. PMID 11518780.
- ↑ Chubanov V, Waldegger S, Mederos y Schnitzler M, Vitzthum H, Sassen MC, Seyberth HW, Konrad M, Gudermann T (2004). Disruption of TRPM6/TRPM7 complex formation by a mutation in the TRPM6 gene causes hypomagnesemia with secondary hypocalcemia. Proceedings of the National Academy of Sciences of the United States of America. 101 (9): 2894—2899. Bibcode:2004PNAS..101.2894C. doi:10.1073/pnas.0305252101. PMC 365716. PMID 14976260.
- ↑ Grunes, D. L.; Stout, P. R.; Brownwell, J.R. (1970). Grass tetany of ruminants. Advances in Agronomy. Т. 22. с. 332—374. doi:10.1016/S0065-2113(08)60272-2. ISBN 978-0-12-000722-6.
- ↑ Slutsky, I.; Sadeghpour, S.; Li, B.; Liu, G. (2004). Enhancement of Synaptic Plasticity through Chronically Reduced Ca2+ Flux during Uncorrelated Activity. Neuron. 44 (5): 835—49. doi:10.1016/j.neuron.2004.11.013. PMID 15572114.Full Text [Архівовано 2022-12-20 у Wayback Machine.]
- ↑ Slutsky, I.; Abumaria, N.; Wu, L. J.; Huang, C.; Zhang, L.; Li, B.; Zhao, X.; Govindarajan, A.; Zhao, M. G. (2010). Enhancement of Learning and Memory by Elevating Brain Magnesium. Neuron. 65 (2): 165—77. doi:10.1016/j.neuron.2009.12.026. PMID 20152124.Full Text [Архівовано 2022-01-20 у Wayback Machine.]
- ↑ Kaiser, W. M. (1987). Effects of water deficit on photosynthetic capacity. Physiologia Plantarum. 71: 142—149. doi:10.1111/j.1399-3054.1987.tb04631.x.
- ↑ Rao, I. M.; Sharp, R. E.; Boyer, J.S. (1987). Leaf Phosphate Status, Photosynthesis, and Carbon Partitioning in Sugar Beet: III. Diurnal Changes in Carbon Partitioning and Carbon Export. Plant Physiology. 92 (1): 29—36. doi:10.1104/pp.92.1.29. PMC 1062243. PMID 16667261.
- ↑ а б в г Laing, W.; Greer, D.; Sun, O.; Beets, P.; Lowe, A.; Payn, T. (2000). Physiological impacts of Mg deficiency in Pinus radiata: growth and photosynthesis. New Phytol. 146: 47—57. doi:10.1046/j.1469-8137.2000.00616.x.
- ↑ а б Heenan, D.P.; Campbell, L.C. (1981). Influence of potassium and manganese on growth and uptake of magnesium by soybeans (Glycine max (L.) Merr. cv Bragg. Plant Soil. 61 (3): 447—456. doi:10.1007/BF02182025.
- ↑ Hope, A. B.; Stevens, P. G. (1952). Electrical potential differences in bean roots on their relation to salt uptake. Australian Journal of Scientific Research, Series B. 5: 335—343.
- ↑ Section 8.5.2 in Marschner, 1995
- ↑ Bui, D.M.; Gregan, J.; Jarosch, E.; Ragnini, A.; Schweyen, R. J. (1999). The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane. Journal of Biological Chemistry. 274 (29): 20438—20443. doi:10.1074/jbc.274.29.20438. PMID 10400670.
- ↑ Demmig, B.; Gimmler, H. (1979). Effect of divalent cations on cation fluxes across the chloroplast envelope and on photosynthesis of intact chloroplasts. Zeitschrift für Naturforschung. 24C (3–4): 233—241. doi:10.1515/znc-1979-3-413.
- ↑ Huber, S.C.; Maury, W. J. (1980). Effects of Magnesium on Intact Chloroplasts: I. EVIDENCE FOR ACTIVATION OF (SODIUM) POTASSIUM/PROTON EXCHANGE ACROSS THE CHLOROPLAST ENVELOPE. Plant Physiology. 65 (2): 350—354. doi:10.1104/pp.65.2.350. PMC 440325. PMID 16661188.
- ↑ Section 2.7 in Marschner, 1995
- ↑ Section 3.3 in Marschner, 1995
- ↑ Section 2.4 in Marschner, 1995
- ↑ Scott, B. J.; Robson, A. D. (1990). Distribution of magnesium in subterranean clover (Trifolium subterranean L.) in relation to supply. Australian Journal of Agricultural Research. 41 (3): 499—510. doi:10.1071/AR9900499.
- ↑ Scott, B. J.; Robson, A. D. (1990b). Changes in the content and form of magnesium in the first trifoliate leaf of subterranean clover under altered or constant root supply. Australian Journal of Agricultural Research. 41 (3): 511—519. doi:10.1071/AR9900511.
- ↑ Fork, D.C. (1986). The control by state transitions of the distribution of excitation energy in photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology. 37: 335—361. doi:10.1146/annurev.arplant.37.1.335.
- ↑ Gregory, R. P. F. (1989). Structure and function of the photosynthesising cell. New York: John Wiley and Sons.
- ↑ Lu YK, Chen YR, Yang CM, Ifuku K (1995). Influence of Fe- and Mg-deficiency on the thylakoid membranes of a chlorophyll-deficient ch5 mutant of Arabidopsis thaliana. Botanical Bulletin of Academia Sinica. 36.
- ↑ Deshaies, R. J.; Fish, L. E.; Jagendorf, A. T. (1984). Permeability of Chloroplast Envelopes to Mg2+: Effects on Protein Synthesis. Plant Physiology. 74 (4): 956—961. doi:10.1104/pp.74.4.956. PMC 1066800. PMID 16663541.
- ↑ Gupta, A. S.; Berkowitz, G. A. (1989). Development and Use of Chlorotetracycline Fluorescence as a Measurement Assay of Chloroplast Envelope-Bound Mg2+. Plant Physiology. 89 (3): 753—761. doi:10.1104/pp.89.3.753. PMC 1055918. PMID 16666617.
- ↑ Heldt, H.W.; Werdan, K.; Milovancev, M.; Geller, G. (1973). Alkalization of the chloroplast stroma caused by light-dependent proton flux into the thylakoid space. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 314 (2): 224—241. doi:10.1016/0005-2728(73)90137-0. PMID 4747067.
- ↑ Hind, G.; Nakatani, H. Y.; Izawa, S. (1974). Light-Dependent Redistribution of Ions in Suspensions of Chloroplast Thylakoid Membranes. Proceedings of the National Academy of Sciences of the United States of America. 71 (4): 1484—1488. Bibcode:1974PNAS...71.1484H. doi:10.1073/pnas.71.4.1484. PMC 388254. PMID 4524652.
- ↑ Bulychev, A. A.; Vredenberg, W. J. (1976). Effect of ionophores A-23187 and nigericin on the light induced redistribution of magnesium potassium and hydrogen ions across the thylakoid membrane. Biochimica et Biophysica Acta. 449 (1): 48—58. doi:10.1016/0005-2728(76)90006-2. PMC 8333438. PMID 10009.
- ↑ Krause, G. H. (1977). Light-induced movement of magnesium ions in intact chloroplasts. Spectroscopic determination with Eriochrome Blue SE. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 460 (3): 500—510. doi:10.1016/0005-2728(77)90088-3. PMID 880298.
- ↑ Portis, A. R. (1981). Evidence of a Low Stromal Mg2+ Concentration in Intact Chloroplasts in the Dark: I. STUDIES WITH THE IONOPHORE A23187. Plant Physiology. 67 (5): 985—989. doi:10.1104/pp.67.5.985. PMC 425814. PMID 16661806.
- ↑ Ishijima, S.; Uchibori, A.; Takagi, H.; Maki, R.; Ohnishi, M. (2003). Light-induced increase in free Mg2+ concentration in spinach chloroplasts: Measurement of free Mg2+ by using a fluorescent probe and intensity of stromal alkalinization. Archives of Biochemistry and Biophysics. 412 (1): 126—132. doi:10.1016/S0003-9861(03)00038-9. PMID 12646275.
- ↑ Sharkey, T. D. (1998). Photosynthetic carbon reduction. Photosynthesis: A Comprehensive Treatise. Cambridge: Cambridge University Press: 111—122.
- ↑ Section 8.5.6 of Marschner, 1995
- ↑ Rengel, Z.; Robinson, D. L. (1989). Competitive Al3+ Inhibition of Net Mg2+ Uptake by Intact Lolium multiflorum Roots : I. Kinetics. Plant Physiology. 91 (4): 1407—1413. doi:10.1104/pp.91.4.1407. PMC 1062198. PMID 16667193.
- ↑ Marschner, H. (1991). Y. Waisel (ред.). Root-induced changes in the availability of micronutrients in the rhizosphere. New York: Marcel Dekker.
- ↑ Dorenstouter, H.; Pieters, G.A.; Findenegg, G. R. (1985). Distribution of magnesium between chloroplhyll and other photosynthetic functions in magnesium deficient 'sun' and 'shade' leaves of poplar. Journal of Plant Nutrition. 8 (12): 1088—1101. doi:10.1080/01904168509363409.
- ↑ Wu, W.; Peters, J.; Berkowitz, G.A. (1991). Surface Charge-Mediated Effects of Mg2+ on K+ Flux across the Chloroplast Envelope Are Associated with Regulation of Stromal pH and Photosynthesis. Plant Physiology. 97 (2): 580—587. doi:10.1104/pp.97.2.580. PMC 1081046. PMID 16668438.
- ↑ Hille, 1992. Chapter 11
- ↑ Haynes, W. J.; Kung, C.; Saimi, Y.; Preston, R. R. (2002). An exchanger-like protein underlies the large Mg2+ current in Paramecium. PNAS. 99 (24): 15717—15722. Bibcode:2002PNAS...9915717H. doi:10.1073/pnas.242603999. PMC 137782. PMID 12422021.
- ↑ Warren, M. A.; Kucharski, L. M.; Veenstra, A.; Shi, L.; Grulich, P. F.; Maguire, M. E. (2004). The CorA Mg2+ Transporter Is a Homotetramer. Journal of Bacteriology. 186 (14): 4605—4612. doi:10.1128/JB.186.14.4605-4612.2004. PMC 438605. PMID 15231793.
- ↑ а б Maguire, M.E.; Cowan, J. A. (2002). Magnesium chemistry and biochemistry. BioMetals. 15 (3): 203—210. doi:10.1023/A:1016058229972. PMID 12206387.
- ↑ Gardner, R. C. (2003). Genes for magnesium transport. Current Opinion in Plant Biology. 6 (3): 263—267. doi:10.1016/S1369-5266(03)00032-3. PMID 12753976.
- ↑ Romani, Andrea, M.P. (2013). Chapter 3. Magnesium in Health and Disease. У Astrid Sigel (ред.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Т. 13. Springer. с. 49—79. doi:10.1007/978-94-007-7500-8_3. ISBN 978-94-007-7499-5. PMID 24470089.
- ↑ Larsson S. C.; Virtanen M. J.; Mars M. та ін. (March 2008). Magnesium, calcium, potassium, and sodium intakes and risk of stroke in male smokers. Arch. Intern. Med. 168 (5): 459—65. doi:10.1001/archinte.168.5.459. PMID 18332289.
- ↑ Harrison's Principles of Internal Medicine, Online Edition
- ↑ Milo, Ron; Philips, Rob. Cell Biology by the Numbers: What are the concentrations of different ions in cells?. book.bionumbers.org. Процитовано 23 березня 2017.
- ↑ Euser, A. G.; Cipolla, M. J. (2009). Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review. Stroke. 40 (4): 1169—1175. doi:10.1161/STROKEAHA.108.527788. PMC 2663594. PMID 19211496.
- ↑ Stepura OB, Martynow AI (February 2008). Magnesium orotate in severe congestive heart failure (MACH). Int. J. Cardiol. 131 (2): 293—5. doi:10.1016/j.ijcard.2007.11.022. PMID 18281113.
- ↑ Duley L, Gülmezoglu AM, Henderson-Smart DJ, Chou D (2010). Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev. 2010 (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ↑ Kass L, Weekes J, Carpenter L (2012). Effect of magnesium supplementation on blood pressure: a meta-analysis. Eur J Clin Nutr. 66 (4): 411—8. doi:10.1038/ejcn.2012.4. PMID 22318649.
- ↑ Fang X, Han H, Li M, Liang C, Fan Z, Aaseth J, He J, Montgomery S, Cao Y (2016). Dose-Response Relationship between Dietary Magnesium Intake and Risk of Type 2 Diabetes Mellitus: A Systematic Review and Meta-Regression Analysis of Prospective Cohort Studies. Nutrients. 8 (11): 739. doi:10.3390/nu8110739. PMC 5133122. PMID 27869762.
- ↑ Veronese N, Watutantrige-Fernando S, Luchini C, Solmi M, Sartore G, Sergi G, Manzato E, Barbagallo M, Maggi S, Stubbs B (2016). Effect of magnesium supplementation on glucose metabolism in people with or at risk of diabetes: a systematic review and meta-analysis of double-blind randomized controlled trials. Eur J Clin Nutr. 70 (12): 1354—1359. doi:10.1038/ejcn.2016.154. PMID 27530471.
{{cite journal}}:|hdl-access=вимагає|hdl=(довідка) - ↑ Schlünzen, Frank; Zarivach, Raz; Harms, Jörg; Bashan, Anat; Tocilj, Ante; Albrecht, Renate; Yonath, Ada; Franceschi, François (2001). Structural basis for the interaction of antibiotics with the peptidyl transferase centre in eubacteria. Nature. 413 (6858): 814—21. Bibcode:2001Natur.413..814S. doi:10.1038/35101544. PMID 11677599.
- ↑ «Magnesium», pp.190-249 in «Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride». National Academy Press. 1997.
- ↑ Magnesium. National Institutes of Health, Office of Dietary Supplements. Updated: September 26, 2018
- ↑ Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies (PDF). 2017.
- ↑ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ↑ Top 10 Foods Highest in Magnesium + Printable One Page Sheet. HealthAliciousNess. Процитовано 17 січня 2018.
- ↑ SELF Nutrition Data - Food Facts, Information & Calorie Calculator. nutritiondata.self.com.
- ↑ Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982 (PDF).
- ↑ Daily Value Reference of the Dietary Supplement Label Database (DSLD). Dietary Supplement Label Database (DSLD). Архів оригіналу за 7 квітня 2020. Процитовано 16 травня 2020.
- ↑ а б Tevelev, A.; Cowan, J. A. (1995). J.A. Cowan (ред.). Metal substitution as a probe of the biological chemistry of magnesium ion. New York: VCH.
- ↑ а б Drakenberg, T. (1995). J. A. Cowan (ред.). Physical methods for studying the biological chemistry of magnesium. New York: VCH.
- ↑ Raju, B.; Murphy, E.; Levy, L. A.; Hall, R. D.; London, R. E. (1989). A fluorescent indicator for measuring cytosolic free magnesium. Am J Physiol Cell Physiol. 256 (3 Pt 1): C540—548. doi:10.1152/ajpcell.1989.256.3.C540. PMID 2923192.
- ↑ Grubbs, R. D. (2002). Intracellular magnesium and magnesium buffering. BioMetals. 15 (3): 251—259. doi:10.1023/A:1016026831789. PMID 12206391.
- ↑ Otten, P.A.; London, R.E.; Levy, L. A. (2001). 4-Oxo-4H-quinolizine-3-carboxylic acids as Mg2+ selective, fluorescent indicators. Bioconjugate Chemistry. 12 (2): 203—212. doi:10.1021/bc000087d. PMID 11312681.
- ↑ Gunzel, D.; Schlue, W.-R. (2002). Determination of [Mg2+]i - an update on the use of Mg2+-selective electrodes. BioMetals. 15 (3): 237—249. doi:10.1023/A:1016074714951. PMID 12206390.
- ↑ а б Hille, B. (1992). 2. Ionic channels of excitable membranes. Sunderland: Sinauer Associates Inc. ISBN 978-0-87893-322-8.
- ↑ See Chapters 5 and 6 in Dean, J.R. (1997). Atomic Absorption and Plasma Spectroscopy. Chichester: John Wiley & Sons. ISBN 978-0-471-97255-6. for descriptions of the methodology as applied to analytical chemistry.
Список літератури[ред. | ред. код]
- Romani, Andrea M.P. (2013). Chapter 4 Magnesium Homeostasis in Mammalian Cells. У Banci, Lucia (ред.). Metallomics and the Cell. Metal Ions in Life Sciences. Т. 12. Springer. с. 69—118. doi:10.1007/978-94-007-5561-1_4. ISBN 978-94-007-5560-4. ISSN 1559-0836. PMID 23595671. electronic-book ISBN 978-94-007-5561-1 electronic-ISSN 1868-0402
- Findling, R. L.; Maxwell, K; Scotese-Wojtila, L; Huang, J; Yamashita, T; Wiznitzer, M (1997). High-dose pyridoxine and magnesium administration in children with autistic disorder: an absence of salutary effects in a double-blind, placebo-controlled study. J Autism Dev Disord. 27 (4): 467—478. doi:10.1023/A:1025861522935. PMID 9261669.
- Green, V.; Pituch, K.; Itchon, J.; Choi, A.; O'Reilly, M.; Sigafoos, J. (2006). Internet Survey of Treatments Used by Parents of Children with Autism. Research in Developmental Disabilities. 27 (1): 70—84. doi:10.1016/j.ridd.2004.12.002. PMID 15919178.
- Lelord, G.; Muh, JP; Barthelemy, C; Martineau, J; Garreau, B; Callaway, E (1981). Effects of pyridoxine and magnesium on autistic symptoms--initial observations. J Autism Dev Disord. 11 (2): 219—230. doi:10.1007/BF01531686. PMID 6765503.
- Martineau, J. та ін. (1985). Vitamin B6, magnesium, and combined B6-Mg: therapeutic effects in childhood autism." Biol. Psychiatry. 20 (5): 467—478. doi:10.1016/0006-3223(85)90019-8. PMID 3886023.
- Tolbert, L.; Haigler, T; Waits, MM; Dennis, T (1993). Brief report: lack of response in an autistic population to a low dose clinical trial of pyridoxine plus magnesium. J Autism Dev Disord. 23 (1): 193—199. doi:10.1007/BF01066428. PMID 8463199.
- Mousain-Bosc, M.; Roche, M; Polge, A; Pradal-Prat, D; Rapin, J; Bali, JP (Mar 2006). Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. I. Attention deficit hyperactivity disorders. Magnes. Res. 19 (1): 46—52. PMID 16846100.
- Mousain-Bosc, M.; Roche, M; Polge, A; Pradal-Prat, D; Rapin, J; Bali, JP (Mar 2006). Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. II. Pervasive developmental disorder-autism. Magnes. Res. 19 (1): 53—62. PMID 16846101.
Посилання[ред. | ред. код]
- Дефіцит магнію
- Список продуктів, багатих на магній
- Веб-сайт про магній — містить повні тексти статей і розділи підручників провідних авторитетів у галузі магнію Мілдред Сіліг, Жана Дурлака, Бертона М. Алтури та Белли Т. Алтури. Посилання на понад 300 статей про магній і дефіцит магнію.
- Дієтичне довідкове споживання
- Пороги одужання — опис досліджень щодо добавок магнію та інших методів лікування аутизму