Спирти
| Спирти | |
 | |
 | |
| Спряжена основа | alkoxide iond |
|---|---|
| Нотація SMARTS | [$([#6][OX2H1]);!$([#6]=O);!$([#6]=S);!$([#6]=[Se])] |
| Точка кипіння | 97,2 °C |
| | |

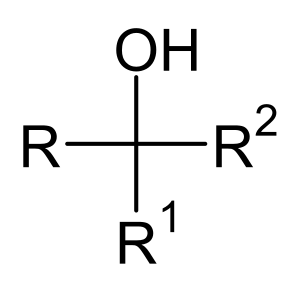
Спирти (від лат. spiritus — дух; застар. алкоголі, від араб. الكحول аль-кухуль — порошок) — органічні сполуки, що містять одну чи більше гідроксильних груп (−OH), безпосередньо зв'язаних із насиченим (у стані sp³-гібридизації) атомом Карбону. Спирти можна розглядати як похідні води (H−O−H), в яких один атом Гідрогену заміщений на органічну функціональну групу: R−O−H.
У номенклатурі ІЮПАК для сполук, у яких гідроксильна група зв'язана з ненасиченим (sp²-гібридним) атомом Карбону, рекомендуються назви «еноли» (гідроксил зв'язаний із вінільним C=C-зв'язком) і «феноли» (гідроксил зв'язаний із бензеновим або іншим ароматичним циклом).
Спирти є великим і різноманітним класом сполук: вони досить поширені в природі й часто виконують важливі функції в живих організмах. Спирти є важливими сполуками з погляду органічного синтезу, не тільки будучи цікавими як цільові продукти, але і як проміжні речовини, що мають низку унікальних хімічних властивостей. Окрім цього, спирти є важливими промисловими продуктами і зазнають широкого застосування як у промисловості, так і в буденному вжитку.
Слово алкого́ль походить від араб. الكحل (al-kuḥl) — «порошкоподібна сурма». Поняття бере початок від алхімічної методики відновлення хімічних сполук до «порошку», що був, як передбачалось, чистою есенцією речовини. Подібним способом, і етиловий спирт є есенцією вина, від чого пішла його назва. В українську мову слово прийшло через нім. Alkohol, нід. alkohol або порт., ісп. alcohol. Однак в українській мові термін зберігся у вигляді архаїзму, очевидно, й омонім слова «алкоголь» у значенні «дрібний порошок».
Слово спирт з'явилось в українській мові за часів входження до складу Російської імперії (період правління Петра I) через англійське слово spirit, яке, своєю чергою, пішло від латинського spīritus — «дихання, дух, душа».
Етиловий спирт, точніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається, що не менш, ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду.
Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році.

У Європі етиловий спирт був отриманий із продуктів бродіння в 11—12 столітті в Італії.
На територію сучасної Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувало великокнязівському дворові.
У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним паливом для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році німецько-російським хіміком Т. Є. Ловіцем.
1842 року німецький хімік Якоб Генріх Вільгельм Шиль (1813—1889) відкрив, що спирти утворюють гомологічний ряд, відрізняючись на деяку постійну величину. Щоправда, він помилився описавши її як C2H2. Через два роки, інший хімік Шарль Жерар встановив правильне гомологічне співвідношення CH2 і передбачив формулу і властивості невідомого в ті роки пропілового спирту.
У 1850 році англійський хімік Александер Вільямсон, досліджуючи реакцію алкоголятів з етилйодидом, встановив, що етиловий спирт є похідним від води з одним зміщеним Гідрогеном, експериментально підтвердив формулу C2H5OH.
Вперше синтез етанолу дією сірчаної кислоти на етилен здійснив у 1854 році французький хімік Марселен Бертло.
Перше дослідження метилового спирту було проведено в 1834 році французькими хіміками Жаном-Батистом Дюма і Еженом Пеліго; вони назвали його «метиловим або деревним спиртом», оскільки він був виявлений в продуктах сухої перегонки деревини. Синтез метанолу з метилхлориду здійснив французький хімік Марселен Бертло в 1857 році. Ним же вперше був відкритий в 1855 році ізопропіловий спирт, синтезований дією на пропен водної сірчаної кислоти.
Вперше третинний спирт (трет-бутанол, 2-метил-пропан-2-ол) синтезував в 1863 році відомий російський вчений А. М. Бутлеров, поклавши початок цілої серії експериментів у цьому напрямку.
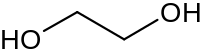
Представник двоатомних спиртів — етиленгліколь — вперше був синтезований французьким хіміком А. Вюрцом в 1856 році. Триатомний спирт — гліцерин — був виявлений у природних жирах ще в 1783 році шведським хіміком Карлом Шеєле, однак його склад був відкритий тільки в 1836 році, а синтез здійснено з ацетону в 1873 році Шарлем Фріделем.
Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним, коли дві — двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні.
Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю -CH2-.
Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол і т. д.
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал. В таблиці наведений гомологічний ряд насичених одноатомних спиртів.
Нижчі спирти (з малою кількістю атомів Карбону в молекулі) при звичайній температурі є леткими рідинами, а вищі, починаючи з C15H31—OH, — тверді речовини. Нижчі спирти з водою зміщуються у всіх співвідношеннях. З підвищенням молекулярної маси розчинність спиртів зменшується. Усі спирти легші від води. В міру збільшення молекулярної маси температура кипіння спиртів підвищується.
| Вуглеводень, від якого походить спирт | Формула вуглеводню | Брутто-формула | Назва спирту | Формула спирту | Брутто-формула | Тпл | Ткип | Розчинність у воді, г/л |
|---|---|---|---|---|---|---|---|---|
| Метан | СН4 | СН4 | Метиловий спирт (метанол) | СН3-ОН | СН4О | −97,8 | 64,7[1] | ∞ |
| Етан | СН3-СН3 | С2Н6 | Етиловий спирт (етанол) | СН3-СН2-OH | С2Н6O | −114,1 | 78,3[1] | ∞ |
| Пропан | СН3-СН2-СН3 | С3Н8 | Пропіловий спирт (пропанол) | СН3-(СН2)2-OH | С3Н8O | −126,2 | 97,2[1] | ∞ |
| Бутан | СН3-(СН2)2-СН3 | С4Н10 | Бутиловий спирт (бутанол) | СН3-(СН2)3-OH | С4Н10O | −89,3 | 117,3[1] | 79 |
| Пентан | СН3-(СН2)3-СН3 | С5Н12 | Аміловий спирт (пентанол) | СН3-(СН2)4-OH | С5Н12O | −78,2 | 138[2] | 23 |
| Гексан | СН3-(СН2)4-СН3 | С6Н14 | Гексиловий спирт (гексанол) | СН3-(СН2)5-OH | С6Н14O | −48,6 | 157,5[3] | 6 |
| Гептан | СН3-(СН2)5-СН3 | С7Н16 | Гептиловий спирт (гептанол) | СН3-(СН2)6-OH | С7Н16O | −34,0 | 176[4] | 2 |
| Октан | СН3-(СН2)6-СН3 | С8Н18 | Октиловий спирт (октанол) | СН3-(СН2)7-OH | С8Н18O | −14,9 | 194,5[3] | 0,5 |
| Нонан | СН3-(СН2)7-СН3 | С9Н20 | Ноніловий спирт (нонанол) | СН3-(СН2)8-OH | С9Н20O | −6 [5] | 214–216[6] | ~0 |
| Декан | СН3-(СН2)8-СН3 | С10Н22 | Дециловий спирт (деканол) | СН3-(СН2)9-ОН | С10Н22O | 7 [7] | 228[4] | ~0 |
Низькомолекулярні одноатомні спирти в природі у вільному стані трапляються в незначних кількостях, це переважно метанол і етанол. Високомолекулярний аліфатичний одноатомний спирт холестерол є важливим складником клітинних мембран. Також одноатомними спиртами є такі відомі природні речовини як речовини як ментол, лимонна кислота, гормон тестостерон, амінокислоти серин, треонін і тирозин. До природних багатоатомних спиртів належать усі вуглеводи, зокрема глюкоза, фруктоза, сахароза, а також їх похідні включаючи нуклеотиди. Окислення багатоатомних спиртів (зокрема гліколіз) є основним джерелом енергії для клітини. Крім того в природі дуже поширені похідні спиртів, насамперед етери та естери, зокрема майже всі ліпіди є естерами гліцеролу. Природні похідні спиртів в окремих випадках застосовуються як промислові сировинні джерела їх добування, наприклад метанол — з лігнін деревини, високомолекулярні спирти — з восків тощо.
Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами. Наприклад:
- 2C2H5—OH + 2Na → 2C2H5—ONa + H2 ↑.
Інші атоми Гідрогену, котрі зв'язані безпосередньо з Карбоном, у реакцію не вступають. На прикладі цих реакцій науковці вперше зустрілись з явищем впливу одних атомів на інші в молекулі. Суть цього впливу можна показати на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:
Гідроксильний атом Гідрогену займає в молекулі особливе положення. На відміну від інших атомів Гідрогену, він не безпосередньо зв'язаний з атомом Карбону, а через Оксиген. Атом Оксигену, як активніший елемент більше, ніж Карбон, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом Гідрогену слабкіше зв'язаний в молекулі, ніж інші атоми Гідрогену, і є більш «рухливим», тому порівняно легко витісняється атомом металу. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми Гідрогену значно тісніше зв'язані з Оксигеном, ніж у молекулах кислот. Тому спирти набагато слабше дисоціюють у воді.[8].

У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється бромоетан:
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
При слабшому нагріванні (близько 140 °С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома Гідрогену спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100 °C) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
Аміловий спирт C5H11OH — одноатомний насичений спирт.
При повному окисненні спиртів утворюються вуглекислий газ та вода.
2C2H5OH + 6O2 → 4CO2 + 6H2O
В органічній хімії одним з прикладів реакцій окиснення є окиснення за Сверном, в результаті якого утворюється альдегід або кетон.
Фізичні властивості: За агрегатним станом нижчі гомологи одноатомних насичених спиртів, наприклад спирти нормальної будови, що містять до 11 атомів Карбону у ланцюгу, за звичайних умов є рідкими. Вищі гомологи є твердими речовинами. Прості аліфатичні спирти — безбарвні рідини.
Спирти мають набагато вищі температури кипіння, ніж відповідні алкани через водневі зв'язки, що виникають між гідроксильними групами. Температури кипіння вторинних та третинних спиртів нижча, ніж первинних, бо радикали заважають утворенню водневих зв'язків.
Запах: Метанол, етанол та н-пропанол мають «класичний» запах спирту. Запах бутанолу зумовлює запах самогону. Аміловий та вищі спирти мають набагато сильніший, дещо солодкуватий запах, що найсильніший в октанолу.
| Назва | Інші назви | Формула | Температура кипіння, °С | Температура плавлення, °С | Густина, г/см3 при 20°С |
|---|---|---|---|---|---|
| Метиловий спирт | Метанол | CH3OH | 64,7 | -97,78 | 0,791 |
| Етиловий спирт | Етанол | C2H5OH | 78,3 | -114,65 | 0,790 |
| н-Пропіловий спирт | Пронан-1-ол | C3H7OH | 97,2 | -124,10 | 0,804 |
| Ізопропіловий спирт | Пропан-2-ол, ізопропанол | CH3CH(CH3)OH | 82,5 | -87,95 | 0,786 |
| н-Бутиловий спирт | Бутан-1-ол | C4H9OH | 117,8 | -88,64 | 0,808 |
| Ізобутиловий спирт | 2-Метилпропан-1-ол | (СН3)2СНСН2ОН | 108,0 | -101,97 | 0,802 |
| втор-Бутиловий спирт | Бутан-2-ол | СН3СН2СН(ОН)СН3 | 99,5 | -114,70 | 0,806 |
| трет-Бутиловий спирт | 2-Метилпропан-2-ол | СН3СН2СН(ОН)СН3 | 82,9 | 25,82 | 0,765(40 °C) |
| н-Аміловий спирт | Пентан-1-ол | C5H11OH | 138,0 | -77,59 | 0,813 |
| н-Гексиловий спирт | Гексан-1-ол | C6H13OH | 157,1 | -47,40 | 0,822 |
| н-Гептиловий спирт | Гептан-1-ол | C7H15OH | 176,3 | -32,80 | 0,824 |
| н-Октиловий спирт | Октан-1-ол | C8H17OH | 195,1 | -16,30 | 0,823 |
Хімічні властивості:
- Горіння (C2H5OH + 3O2 → 2CO2 + 3H2O)
- Взаємодіють з лужними металами (C2H5OH + 2Na → 2C2H5ONa + H2)
- Взаємодіють з галогеноводнями (C2H5OH + HBr →t→ C2H5Br + H2O)
- Внутрішньомолекулярна дегідратація (C2H5OH →t, h2so4 →H2C=(зв'язок)СH2 + H2O)
- Міжмолекулярна дегідратація (C2H5–OH + HO–C2H5 →t, h2so4→ C2H5–O–C2H5 + H2O)
Одним з найважливіших методів виробництва спиртів є гідратація олефінів, в ході якої виробляють етиловий, ізопропіловий, ізобутіловий та інші спирти. Метиловий спирт отримують гідруванням окису вуглецю (з'єднання СО і водню в умовах високих тисків і температур у присутності каталізатора). Вищі спирти утворюються при гідруванні вищих жирних кислот і їх ефірів, альдегідів та ін.
Сфери використання спиртів численні та різноманітні, особливо враховуючи широкий спектр сполук, що належать до цього класу. Разом з тим, з промислової точки зору, тільки невелика низка спиртів вносить помітний внесок у глобальну світову економіку.
В TOP 50 за 2002 рік сполук, що випускаються хімічною промисловістю США, зі спиртів входять тільки метанол (14-е місце) та етиленгліколь (29-е місце).[9] У наступні 50 найважливіших хімічних сполук, за даними 1999 року, включені ізопропіловий спирт, н-бутиловий спирт, синтетичний етанол, пропіленгліколь, діетиленгліколь, 2-етилгексанол, 1,4-бутандіол, сорбітол і гліцерин.[9]
У світі найбільше значення з спиртів мають метиловий, етиловий, пропіловий, ізопропіловий спирт, а також бутилові, амілові і вищі жирні спирти. З циклічних і ароматичних спиртів: циклогексанол, 2-етилгексанол, фенілетиловий і бензиловий спирти; з гліколів і поліолів: етиленгліколь, пропіленгліколь, діетиленгліколь, гліцерин, пентаеритрит.
Найбільш великотоннажними напрямками використання спиртів є (в довільному порядку):
- проміжні продукти для основного органічного синтезу;
- застосування як палива;
- виробництво розчинників;
- виробництво синтетичних миючих засобів, парфумерії та косметики;
- використання в харчовій і фармацевтичній промисловості.
Для паливних цілей наразі використовуються в промислових об'ємах три спирти: метанол, етанол і бутанол, що пов'язано насамперед з їх комерційною доступністю та можливістю масового виробництва з рослинної сировини (крім метанолу). При цьому можливе використання спиртів у вигляді пального в чистому вигляді, а також у вигляді різних сумішей з бензином або дизельним паливом[10], а також як добавок (до 10 %) з метою підвищення октанового числа і зниження токсичності відпрацьованих газів.[11][12] Також окремим напрямом є використання метанолу для переетерифікації жирів у виробництві біодизеля.[13]
Найпоширенішим паливним спиртом є етанол. За оцінками експертів, на 2009 рік 80-90 % всього виробленого у світі етилового спирту було використано саме в цих цілях і склало 73,9 млрд літрів (≈ 58 млн тонн).[14]
Основні причини, які дали поштовх активному вивченню спиртів як альтернативного палива, це[15]:
- зростання цін на нафту і природний газ, а також вичерпність цих ресурсів в найближчому майбутньому;
- спирти володіють високими експлуатаційними характеристиками, а продукти згоряння містять менше шкідливих речовин;
- спирти можуть виготовлятися біохімічним методом з відходів харчової, деревообробної та целюлозно-паперової промисловості, тим самим вирішуючи одночасно проблему утилізації.
Разом з тим, масове використання вищевказаних спиртів як моторного палива, крім суто економічних причин, має низку вад:
- метанол і етанол мають порівняно з бензином меншу енергоефективність і, відповідно, забезпечують більші витрати;
- низькі температури кипіння спиртів можуть бути причиною утворення парових пробок, що може істотно ускладнити роботу двигуна;
- гігроскопічність спиртів, а також їх розчинність у воді може призвести до різкого зниження потужності при потраплянні вологи в паливну систему;
- спирти мають істотно більш високі корозійні характеристики порівняно з вуглеводнями;
- відносно висока прихована теплота згоряння метанолу та етанолу може бути причиною проблеми при змішуванні цих спиртів з повітрям і подальшого транспортування через впускний колектор двигуна.
- ↑ а б в г Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 312.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, S. 120, ISBN 3-7776-0485-2.
- ↑ а б Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, S. 124, ISBN 3-7776-0485-2.
- ↑ а б Hans Rudolf Christensen: Grundlagen der organischen Chemie, Verlag Sauerländer Aarau, 1. Auflage, 1970, S. 166.
- ↑ Шаблон:GESTIS.
- ↑ Технічний лист 1-Nonanol отримано з Merck, 1. November 2010.
- ↑ Шаблон:GESTIS.
- ↑ Evans D. A. Evans pKa Table (PDF). Архів оригіналу (PDF) за 15 березня 2013. Процитовано 14 березня 2013. [Архівовано 2013-10-02 у Wayback Machine.]
- ↑ а б Chenier Ph. J. Survey of Industrial Chemistry. — Third Edition. — New York : Kluwer Academic / Plenum Publishers, 2002. — С. 17-18. — ISBN 0-306-47246-5.
- ↑ Использование этилового спирта в качестве компонента автомобильного бензина. Анализ нормативной документации. Законы и практика. Аналитический портал химической промышленности Newchemistry.ru. Архів оригіналу за 21 серпня 2011. Процитовано 12 вересня 2010. (рос.)
- ↑ Карпов С. А., Кунашев Л. Х., Царев А. В., Капустин В. М. Применение алифатических спиртов в качестве экологически чистых добавок в автомобильные бензины // Нефтегазовое дело. — 2006. — № 2. Архівовано з джерела 23 вересня 2010. Процитовано 2012-02-20. [Архівовано 2010-09-23 у Wayback Machine.]
- ↑ Использование спиртов как добавок к нефтяным топливам. Альтернативные топлива, энергетика. Аналитический портал химической промышленности Newchemistry.ru. Архів оригіналу за 21 серпня 2011. Процитовано 12 вересня 2010.
- ↑ Биодизель. Российская Национальная Биотопливная Ассоциация. Архів оригіналу за 21 серпня 2010. Процитовано 12 вересня 2010. [Архівовано 2010-08-21 у Wayback Machine.]
- ↑ Global ethanol production to reach 85.9 billion litres in 2010: Global Renewable Fuels Alliance releases 2010 biofuels production forecast. Press Release. Global Renewable Fuels Alliance. 21 березня 2010. Архів оригіналу за 2 лютого 2012. Процитовано 25 травня 2010. [Архівовано 2012-11-24 у Wayback Machine.]
- ↑ Карпов С. А. Актуальные аспекты применения топливного этанола в России и США // Нефтегазовое дело. — 2006. — № 2. Архівовано з джерела 15 липня 2007. Процитовано 2012-02-20. [Архівовано 2007-07-15 у Wayback Machine.]
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0. (С.?)
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — С. ?.
- Органічна хімія: Підруч. для студ. вищ. навч. закл. / Л. Д. Бобрівник, В. М. Руденко, Г. О. Лезенко. — К.; Ірпіль: ВТФ «Перун», 2005. — 544 с. — ISBN 966-569-132-5 (С.?)
- Органічна хімія / Ю. О. Ластухін, С. А. Воронов. — Львів: Центр Європи, 2001. — 864 с. (С.?)
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — С. 132, 137—139, 202, 490. — 560 с. — ISBN 978-966-382-113-9.
- Фармакологія: підручник (ВНЗ І—ІІІ р. а.) / І. В. Нековаль, Т. В. Казанюк. — 7-е вид., переробл. і допов. — «Медицина», 2016. — 552 с. — ISBN 978-617-505-507-6 (С.?)
- СПИРТИ [Архівовано 3 серпня 2016 у Wayback Machine.] //Фармацевтична енциклопедія




