Європій
Європій (англ. europium, нім. Europium n) — хімічний елемент. Символ Eu, ат. н. 63, ат.м. 151,96. Належить до лантаноїдів. Сріблясто-білий метал. Хімічно активний. Компонент люмінофорів. Входить як ізоморфна домішка в кристалічну ґратку мінералів монациту, лопариту, евксеніту, фергусоніту.
Історія[ред. | ред. код]
У 1879 французький хімік Поль Еміль Лекок де Буабодран заявив про відкриття нового елементу, самарію. Проте, складний спектр самарію вказував на наявність у ньому домішків інших невідомих елементів.
Першим зафіксував специфічну червону спектральну лінію європію довжиною 609 нм Вільям Крукс у 1885 році, проте тоді не було ясно, що вона належить саме новому елементу[1].
У 1886 році швейцарський хімік Жан Шарль Галісард Маріньяк виділив з самарію гадоліній, що пояснив частину незрозумілих спектральних ліній, але не всі[2]. Пізніше того ж року Ежен Анатоль Демарсе заявив про виділення оксиду ще одного елементу, проте його дослід не вдалося повторити[3].
У 1892 році Буабодран також заявив про відкриття нового елементу, проте ця заява була зроблена лише за спектральними данними — елемент не було відділено від самарію[3].
Нарешті, у 1896 році, через 10 років після своєї першої спроби, Демарсе зміг виділити оксид нового елементу, а у 1901 році отримав порівняно чистий зразок, і показав, що саме з ним пов'язані аномальні спектральні лінії, які спостерігали Крукс і Буабодран, а також встановив його приблизну атомну масу (151)[4].
Назву елемент отримав на честь континенту Європа. Можливо, Демарсе таким чином хотів відповісти на популярну в останні десятиліття 19 століття тенденцію називати елементи на честь окремих країн — германій, галій, полоній[5].
Поширення та отримання[ред. | ред. код]

Європій є порівняно розповсюдженим елементом земної кори — його частка (1,8 г/т) у кілька сотень разів вища за частку золота[6], проте, як і інші лантаноїди, він є розсіяним елементом, а тому не скупчується у родовищах.
Європій може заміщати кальцій і стронцій, тому деякі мінерали кальцію і стронцію мають підвищений вміст європію. Проте, для комерційного видобутку така концентрація є занизькою[2].
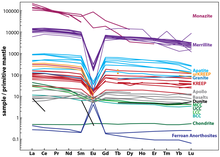
Зазвичай, всі лантаноїди в усіх мінералах присутні разом, і їх пропорція також зберігається (важчі лантаноїди мають меншу концентрацію). Проте, через те, що хімічні властивості європію трохи відрізняються від решти лантаноїдів, він не підкоряється цій закономірності. Це явище носить назву європієвої аномалії[en]. При описі мінералів, у яких концентрація європію значно менша за очікувану, кажуть про негативну європієву аномалію, а для тих, у яких концентрація вища — про позитивну європієву аномалію[7].
Добувають європій разом з іншими рідкоземельними металами з мінералів монациту, бастнезиту і ксенотиму. У найбагатших рудах вміст європію сягає 1%, проте більш типовим є значення 0,05% (за вагою)[8].
Більша частина покладів цих мінералів знаходиться у Китаї, Бразилії, В'єтнамі та Росії, проте, оскільки китайські руди є значно багатшими, їх переробка є більш вигідною, починаючи з 90-х років Китай є основним постачальником рідкоземельних металів, у тому числі і європію[9][3].
При переробці руди завжди отримується суміш лантаноїдів. Розділення лантаноїдів є складним багатостадійним процесом, проте європій може бути відділений порівняно легко, через те, що він може бути переведений у двовалентний стан.
Металевий європій отримують відновленням Eu2O3 у вакуумі лантаном або вуглецем, а також електролізом розплаву EuCl3[2].
У 2010 році було видобуто близько 270 тон європію (у перерахунку на чистий метал)[10].
Хімічні властивості[ред. | ред. код]
Європій найактивніший серед рідкісноземельних елементів. Його реакційна здатність порівнюється з кальцієм. Європій досить швидко, а при нагріванні активно реагує з киснем повітря з утворенням європій (ІІІ) оксиду:
Повільно реагує з водою, однак реакція пришвидшується при нагріванні з утворенням гідроксиду:
Європій реагує з галогенами:
(сіль білого кольору)
(сіль жовтого кольору)
(сіль зеленого кольору)
Європій реагує з розведеними кислотами з утворенням Eu(III) іону який забарвлює розчин у рожевий колір (існує як аквакомплекс)
Європій один з небагатьох рідкісноземельних металів, що може проявляти ступінь окиснення +2.
Ізотопи[ред. | ред. код]
Природній європій складається з двох різних ізотопів. З них 1 стабільний, а ще 1 має надзвичайно довгий період розпаду.
| Масове число | Частка у природному європії | Період напіврозпаду |
|---|---|---|
| 151 | 47,81 % | >= 1,7×1018 років |
| 153 | 52,19 % | ∞ |
Загалом відомо 43 ізотопи європію з масовими числами від 130 до 165, 8 з яких — метастабільні. З нестабільних ізотопів, що не зустрічаються в природі, найбільші періоди напіврозпаду мають Eu150 (36,9 років) і Eu152 (13,5 років)[11].
Застосування[ред. | ред. код]
Люмінофори[ред. | ред. код]



Європій має яскраву емісійну лінію червоного кольору (довжина хвилі 610 нм). Ця лінія відповідає переходу електрону на четвертому f-рівні. Цей рівень електронів екранований s- і p-електронами п'ятої орбіталі, тому хімічні зв'язки дуже слабко впливають на частоту світла, що випромінюється при цьому переході. Інші лінії виникають лише у деяких хімічних сполуках, наприклад, синя лінія випромінюється лише у двовалентному стані[1].
У кольорових дисплеях кожен піксель складається з трьох субпікселів червоного, синього і зеленого кольору. У телевізорах з кінескопом і плазмових дисплеях світіння забезпечується трьома люмінофорами відповідних кольорів, що випромінюють світло після опромінення їх пучком швидких електронів. У 60-х роках виявилося, що для створення червоного кольору ідеально підходить люмінофор на основі європію у комплексі з ванадатом ітрію. Виробництво кольорових телевізорів було найбільшим споживачем європію до початку 21 століття, коли кінескопи були витіснені рідкокристалічними дисплеями[3].
Зараз люмінофори на основі європію використовуються у дисплеях підвищеної яскравості. Також ведуться розробки органічних світлодіодів на основі європію[3].
Одним зі ступенів захисту банкнот євро є малюнок, нанесений сполукою європію, що світиться помаранчево-червоним світлом при опроміненні ультрафіолетом[1].
Метод флуоресціюючих антитіл, що використовується для виявлення у пацієнта специфічних антигенів використовує антитіла, мічені люмінофором, з подальшим візуальним дослідженням світіння тестованого зразка. У якості люмінофору часто використовуються сполуки європію[12].
Легований європієм борат або фтороборат стронцію використовується як робоче тіло у лампах чорного світла (ультрафіолетові лампи, що майже не випромінюють у видимому діапазоні) з довжиною хвилі 368-371 нм[13].
Європієві мітки використовують для боротьби з контрафактною продукцією[3].
Існують потенційні використання європію у сільському господарстві — пластик, легований двовалентним європієм і міддю ефективно перетворює ультрафіолетове світло у видиме, що пришвидшує ріст рослин під ним[1]. Схожа методика використовується для підвищення ККД фотоелементів[3].
Інше[ред. | ред. код]
Пластики, леговані європієм використовуються у лазерній техніці. Один з найефективніших поглиначів нейтронів у ядерній техніці[14].
Примітки[ред. | ред. код]
- ↑ а б в г Europium in the limelight [Архівовано 3 вересня 2021 у Wayback Machine.](англ.)
- ↑ а б в Emsley, 2011, с. 171.
- ↑ а б в г д е ж Европий: факты и фактики [Архівовано 11 липня 2020 у Wayback Machine.](рос.)
- ↑ On the phosphorescent spectra of Sδ and Europium [Архівовано 11 липня 2020 у Wayback Machine.](англ.)
- ↑ Научные сказки периодической таблицы. Занимательная история химических элементов от мышьяка до цинка [Архівовано 11 липня 2020 у Wayback Machine.](рос.)
- ↑ Abundance in Earth's Crust of the elements [Архівовано 12 липня 2020 у Wayback Machine.](англ.)
- ↑ Systematics and the Properties of the Lanthanides(англ.)
- ↑ Materials Handbook: A Concise Desktop Reference [Архівовано 14 липня 2020 у Wayback Machine.](англ.)
- ↑ RARE EARTHS [Архівовано 16 липня 2020 у Wayback Machine.](англ.)
- ↑ Europium [Архівовано 21 березня 2020 у Wayback Machine.](англ.)
- ↑ Isotopes of the Element Europium [Архівовано 17 вересня 2017 у Wayback Machine.](англ.)
- ↑ [https://www.abcam.com/en-ua/technical-resources/guides/fluorescence-guide/time-resolved-fluorescence Introduction to time-resolved fluorescence (TRF) ] [Архівовано 14 липня 2020 у Wayback Machine.](англ.)
- ↑ Principles of Colour and Appearance Measurement [Архівовано 12 липня 2020 у Wayback Machine.](англ.)
- ↑ Europium. Архів оригіналу за 19 червня 2020. Процитовано 12 липня 2020.
Література[ред. | ред. код]
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк:"Вебер", 2008. — 758 с. ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- John Emsley. Nature's Building Blocks: An A-Z Guide to the Elements. — Oxford University Press, 2011. — 699 с. — ISBN 9780199605637.
Посилання[ред. | ред. код]
https://www.webelements.com/europium/chemistry.html [Архівовано 1 травня 2009 у Wayback Machine.]






![{\displaystyle {\ce {[Eu(OH2)9]^3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b384332690247900dcff150e254fc925df275480)
![{\displaystyle {\ce {2Eu + 3H2SO4 + 18H2O -> 2 [Eu(OH2)9]^3+ + 3SO4^2- + 3H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/51a66ded771bd74b3fe97a1880a5470daf58b4f4)