Уран (хімічний елемент)

Ура́н (лат. Uranium), U — радіоактивний хімічний елемент III групи періодичної системи Менделєєва, належить до сімейства актиноїдів, атомний номер 92, атомна маса 238,029; сріблясто-білий метал.
Загальна характеристика[ред. | ред. код]
Природний уран складається з суміші трьох ізотопів:
- 238U — 99,2739 %, період напіврозпаду Т1/2 = 4,51·109 років.
- 235U — 0,7024 %, Т1/2 = 7,13·108 років.
- 234U — 0,0057 %, Т1/2 = 2,48·105 років.
З 11 штучних радіоактивних ізотопів з масовими числами від 227 до 240 найбільш довгоживучий — 233U (Т1/2 = 1,62·105 років); він утворюється в процесі нейтронного опромінювання торію. 238U і 235U є родоначальниками двох радіоактивних рядів.
Усі ізотопи урану радіоактивні з великими періодами напіврозпаду.
Проста речовина — уран. Сріблясто-білий метал. Густина — 19,07; tплав = 1132 °C, tкип = 3818 °C.
Хімічно надзвичайно активний. Реагує з більшістю неметалів. На повітрі повільно окиснюється, у порошкоподібному стані пірофорний і горить яскравим полум'ям. З киснем утворює діоксид UO2, триоксид UO3 і велику кількість проміжних сполук, з яких найбільше значення має U3O8. Уран реагує з водою, легко розчиняється в соляній і азотній кислотах, повільно — в сірчаній, ортофосфорній і флуорводневій кислотах. З лугами не взаємодіє, при нагріванні реагує з галогенами, азотом, фосфором, утворюючи важливі для технології його виробництва сполуки: тетрафлуорид (UF4), гексафлуорид (UF6) і моносульфід (US, ядерне паливо). З металами утворює сплави різних типів. Для 6-валентного урану характерне утворення іонів уранілу UO22+, який має підвищену здатність до комплексоутворення; найважливіші для технології карбонатні, сульфатні, флуоридні, фосфатні та ін. комплекси.
Механічні властивості урану залежать від його чистоти, від режимів механічної й термічної обробки.
Історія[ред. | ред. код]
Ще в прадавні часи (I ст. до н. е.) природний оксид урану використовувався для виготовлення жовтої глазурі для кераміки. Перша важлива дата в історії дослідження урану — 1789 рік, коли німецький натурфілософ і хімік Мартін Генріх Клапрот відновив добуту з саксонської смоляної руди золотисто-жовту «землю» до чорної металоподібної речовини. На честь найбільш далекої з відомих тоді планет (відкритої Гершелем вісьмома роками раніше) Клапрот, вважаючи нову речовину елементом, назвав його ураном. Тільки 1841 року французький хімік Ежен Мелькіор Пеліго довів, що, попри характерний металевий блиск, уран Клапрота — не елемент, а оксид UO2. 1840 року Пеліго вдалося отримати справжній уран — важкий метал сіро-сталевого кольору і визначити його атомну масу.
Походження назви[ред. | ред. код]
Названий на честь планети Уран, відкритої незадовго до самого елемента; планета, в свою чергу, названа іменем давньоримського бога небес Урана.
Хімічні властивості[ред. | ред. код]
На повітрі уран повільно окиснюється з утворенням на поверхні плівки двоокису, який не оберігає метал від подальшого окиснення. У порошкоподібному стані уран — пірофорний — горить яскравим полум'ям. З киснем утворює двоокис UO2, триокис UOЗ і велику кількість проміжних оксидів, найважливіший з яких U3О8. Ці проміжні оксиди за властивостями близькі до UO2 і UOЗ.
У природі уран найчастіше зустрічається у вигляді оксиду U3O8, який легко розчиняється в суміші карбонату та гідрокарбонату натрію, чим користуються для відокремлення від супутніх домішок:
Існує багато інших оксидів урану, найважливіший для використання в атомній енергетиці — UO2[джерело?].
UF6 — летка речовина, застосовується в технології збагачення урану.
Уран і його сполуки радіаційно- та хімічно токсичні. Гранично допустима доза (ПДД) при професійному опромінюванні 5 — бер на рік.
Розповсюдження[ред. | ред. код]
Середній вміст урану в земній корі становить 2,6·10−4 % (мас). За О. П. Виноградовим середній вміст урану в ультраосновних породах становить 3·10−7 %, в основних — 5·10−5 %, у середніх — 1,8·10−4 %, у кислих — 3,5·10−4 % і в осадових — 3,2·10−4 %.
У природі відомо понад 150 уранових і урановмісних мінералів. Найбільше практичне значення має уранініт (настуран, «уранова смолка») UO2 (92 % U) і його аморфний різновид — уранова чернь (до 60 %) — суміш оксидів урану зі змінним співвідношенням чотири- й шестивалентного урану. Різні типи руд, що розробляються, містять також:
- бранерит (U, Ca, Th, Y) [(Ti, Fe)2O6] (28—44 %)
- давидит (Fe, U)TiO3 (20 %)
- ураноторит (Th, Fe, U)SiO4·n H2O (до 17 %)
- уранофан CaH2· [UO2(SiO4)2]·5 Н2О (67 %)
- коффініт U(SiO4)1-х·(ОН)4х (68 %)
- отеніт Ca[UО2·РО4]2·(10—12 %) H2O (60 %)
- торберніт Cu[UО2·РО4]2 ·(8—12 %) H2O (61 %)
- цейнерит Cu[UО2·AsO4]2 ·10 H2O (56 %)
- карнотит K2[(UО22)V2O8]·3 H2O (64 %),
а також уранові слюдки, тіямуніт, лібігіт тощо. Важливе значення мають також титанати урану, силікати, танталоніобати, фосфати, ванадати тощо. природні урановмісні мінерали.
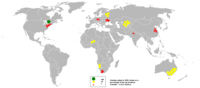
Найбільшим постачальником палива для діючих у світі ядерних реакторів є Канада. У басейні річки Атабаска на півночі провінції Саскачеван видобувається близько 11600 тонн, або близько 30 % світового виробництва. На другому місці за обсягами видобутку — Австралія, за нею йдуть США і Південна Африка[джерело?].
У 2005 році світовий обсяг видобутку урану досяг приблизно 39,3 тисячі тонн, збільшившись від 2003 року на 10 %. Це становить більше половини максимальної світової потреби в урані[джерело?].
Запаси порівняно дешевого урану на планеті дорівнюють приблизно 4 млн т, і вони можуть бути вичерпані, як і нафта, за 25—30 років[джерело?].
Природний уран[ред. | ред. код]
Уран, що трапляється в природі, має атомну масу близько 238 і складається переважно з ізотопу 238U (99,3 %), також він містить невелику кількість 235U (близько 0,7 %) та незначну кількість 234U. Уранові руди добувають в уранових рудниках (шахтах) і на гірничозбагачувальних комбінатах із них отримують концентрат. Найчастіше це тверда суміш оксидів урану (U3О8). Після висушування речовина зазвичай має жовтуватий колір (залежно від вмісту домішок), її називають «жовтим кеком» (англ. Yellow Cake). Жовтий кек доставляють із комбінатів до спеціалізованих переробних заводів для афінажу, збагачення та виготовлення ядерного палива[1].
Уран є одним із найважливіших для життя хімічних елементів, оскільки температура Землі підтримується завдяки енергії розпаду урану всередині Землі[сумнівно ][2][неавторитетне джерело][3][відсутнє в джерелі].
Отримання[ред. | ред. код]
Уран одержують з уранових руд, що містять 0,05—0,5 % U.
Найперша стадія уранового виробництва — концентрування. Породу подрібнюють і змішують з водою. Важкі компоненти суспензії осідають швидше. Якщо порода містить первинні мінерали урану, то вони осідають швидко: це важкі мінерали. Вторинні мінерали урану легші, в цьому випадку раніше осідає важка порожня порода. (Втім, далеко не завжди вона справді порожня; в ній може бути багато корисних елементів, зокрема, й уран). Наступна стадія — вилуговування концентратів, переведення урану в розчин. Застосовують кислотне й лужне вилуговування.
Перше — дешевше, оскільки для видобування урану використовують сірчану кислоту. Але якщо у початковій сировині, як, наприклад, в урановій смолці, уран перебуває в чотиривалентному стані, то цей спосіб непридатний: чотиривалентний уран в сірчаній кислоті практично не розчиняється.
У цьому випадку потрібно або вдатися до лужного вилуговування, або попередньо окислювати уран до шестивалентного стану. Не застосовують кислотне вилуговування і в тих випадках, коли урановий концентрат містить доломіт або магнезит, що реагують з сірчаною кислотою. У цих випадках використовують гідроксид натрію. Проблему вилуговування урану з руд вирішує кисневе продування. У нагріту до 150 °C суміш уранової руди з сульфідними мінералами подають потік кисню. При цьому з сірчистих мінералів утворюється сірчана кислота, яка і вимиває уран. На наступному етапі з отриманого розчину потрібно вибірково виділити уран. Сучасні методи — екстракція та іонний обмін — дозволяють вирішити цю проблему.
Однак розчин містить не лише уран, а й інші катіони. Деякі з них за певних умов поводять себе так само, як уран: екстрагуються тими ж органічними розчинниками, осідають на тих же іонообмінних смолах, випадають в осад за тих же умов. Тому для селективного виділення урану доводиться використовувати багато окисно-відновних реакцій, щоб на кожній стадії позбавлятися від того чи іншого небажаного супутника. На сучасних іонообмінних смолах уран виділяється дуже селективно. Методи іонного обміну та екстракції добрі ще й тим, що дозволяють досить повно видобувати уран з бідних розчинів (вміст урану — десяті частки граму на літр).
Після цих операцій уран переводять у твердий стан — в один з оксидів або в тетрафторид UF4. Але цей уран ще треба очистити від невеликих домішок елементів з великим перерізом захоплення теплових нейтронів — бору, кадмію, гафнію. Їх вміст у кінцевому продукті не повинен перевищувати стотисячних і мільйонних часток відсотка. Для видалення цих домішок технічно чисту сполуку урану розчиняють в азотній кислоті. При цьому утворюється уранілнітрат UO2(NO3)2, який при екстракції трибутил-фосфатом і деякими іншими речовинами додатково очищається до потрібних кондицій. Потім цю речовину кристалізують (або осаджують пероксид UO4·2Н2О) і починають обережно прожарювати. У результаті цієї операції утворюється оксид урану UO3, який відновлюють воднем до UO2. На діоксид урану UO2 при температурі від 430 до 600 °C діють сухим фтористим воднем для отримання тетрафториду UF4. З цієї сполуки відновлюють металевий уран за допомогою кальцію або магнію з виходом урану у вигляді зливків масою до 1,5 т. Зливки рафінуються у вакуумних печах.
В 2023 році міжнародна дослідницька група під керівництвом Австралії, до якої входила основна група вчених ANSTO, виявила, що існує простий та ефективний метод, який дозволяє видобувати уран з морської води. Дослідження з даного питання, яке було опубліковане в журналі Energy Advances, може допомогти у розробці нових матеріалів, високоселективних по відношенню до урану, а саме головне, досить ефективних та економічно вигідних[4].
Збагачення[ред. | ред. код]
Застосування[ред. | ред. код]
Металевий уран або його сполуки використовуються в основному як ядерне паливо в ядерних реакторах. Природна або низькозбагачена суміш ізотопів урану (3—5 % 235U) використовується у стаціонарних реакторах атомних електростанцій, продукт високого ступеня збагачення (20—40 % 235U) — в ядерних силових установках або в реакторах, що працюють на швидких нейтронах. Майже чистий 235U (понад 90 %) використовується в ядерній зброї. 238U служить джерелом вторинного ядерного пального — плутонію.
Наприкінці першого десятиріччя XXI ст. світова атомна енергія, яку виробляють понад 30 країн, має добрі перспективи — планується її широкомасштабний розвиток, зокрема побудова від 300 до 600 нових атомних реакторів вже до 2025 р.[джерело?]
У Франції понад 75 % електроенергії виробляється на АЕС, у США — 20 %, в Англії і Бельгії — близько 60 %, Фінляндії — 27 %.[джерело?] В Україні частка АЕС у виробленні електроенергії у 2010 році становила 47,4 %[джерело?]. У США працює понад 100 АЕС.
Ціни[ред. | ред. код]
Ціни на уран у січні 2024 року продовжили зростання і перевищили $92 за фунт, сягнувши максимуму з кінця 2007 року. [5]
У літературі[ред. | ред. код]
У романі українського письменника Макса Кідрука «Жорстоке небо» в 21 главі згадується про один із ізотопів U-239, щоб дати порівняння про нестабільність настрою одного з персонажів: «Його тато був ще тим диваком, нестабільним, наче уран-239, холериком, затятим мисливцем, чиї перепади настрою могли порівнятись лише зі зміною погоди в південних широтах».
Див. також[ред. | ред. код]
Джерела[ред. | ред. код]
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Гірничий енциклопедичний словник : у 3 т / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2001—2004.
- Любич О. Й., Пчелінцев В. О. Фізичні основи металургії кольорових і рідкоземельних металів: Навч. посібник. — Суми: Вид-во СумДУ, 2009 ISBN 978-966-657-255-7 с.212 — 214
| Ця стаття містить перелік посилань, але походження тверджень у ній залишається незрозумілим через практично повну відсутність внутрішньотекстових джерел-виносок. (вересень 2016) |
|
- ↑ Фонд Yellow Cake: Ціни на уран стабільні, але COVID-19 може спричинити коливання. 27.10.2020
- ↑ ??. Біогеохімічний цикл урану. Vuzlit - архив студенческих работ. Процитовано 16 березня 2023.
{{cite web}}: Проігноровано|chapter=(довідка) - ↑ С.А. Вижва, І.І. Онищук, О.П. Черняєв. (2012). Ядерна геофізика (PDF) (Підручник). Київський національний університет імені Тараса Шевченка.
- ↑ Вчені пропонують простий метод вилучення урану з морської води. 12.10.2023
- ↑ Ціни на уран зросли до максимуму за 16 років. minfin.com.ua (укр.). Процитовано 18 січня 2024.
![{\displaystyle \mathrm {2U_{3}O_{8}+12Na_{2}CO_{3}+O_{2}\longrightarrow 6Na_{4}[UO_{2}(CO_{3})_{3}]+6NaOH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdbb2c56f194527c9038194679c90375f254c9be)
