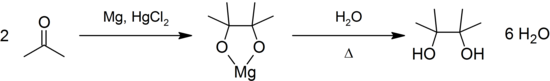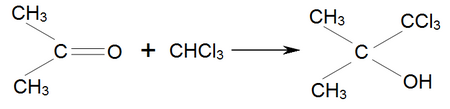Ацетон
| Ацетон | |
|---|---|

| |
 |
 |
 |
|
| Назва за IUPAC | пропанон |
| Інші назви | диметилкетон, 2-пропанон, пропан-2-он |
| Ідентифікатори | |
| Номер CAS | 67-64-1 |
| PubChem | 180 |
| Номер EINECS | 200-662-2 |
| Номер EC | 200-662-2 |
| KEGG | D02311 |
| Назва MeSH | Acetone |
| ChEBI | CHEBI:15347 |
| RTECS | AL3150000 |
| SMILES | CC(C)=O |
| InChI | 1S/C3H6O/c1-3(2)4/h1-2H3 |
| Номер Бельштейна | 635680 |
| Номер Гмеліна | 1466 |
| Властивості | |
| Молекулярна формула | С3Н6O |
| Молярна маса | 58,079 г/моль |
| Молекулярна маса | 58 а. о. м. |
| Зовнішній вигляд | Летка безбарвна рідина |
| Запах | Характерний |
| Густина | 0,79705 г/см³ (15 °C) |
| Тпл | −94,9 °C |
| Ткип | 56,5 °C |
| Тиск насиченої пари | 179,63 мм рт. ст. (при 20 °С) |
| Кислотність (pKa) | 24,2 |
| Основність (pKb) | -10,2 |
| Діелектрична проникність (ε) | 21,4 |
| Показник заломлення (nD) | 1,35998 |
| В'язкість | 0,36 мПа·с (при 10 °С) |
| Дипольний момент | 2,80 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
-248,4 кДж/моль (рід.) -217,1 кДж/моль (газ)[1] |
| Ст. ентальпія згоряння ΔcH 298 |
-1787 кДж/моль (рід.)[2] |
| Ст. ентропія S 298 |
199,8 Дж/(моль·K) (рід.) 295,3 Дж/(моль·K) (газ)[1] |
| Теплоємність, c p |
126,3 Дж/(кмоль·К) (рід.) 74,5 Дж/(моль·K) (газ)[1] |
| Небезпеки | |
| ГДК (Україна) | 200 мг/м3 |
| ЛД50 | 3000 мг/кг (миші, орально) |
| Індекс ЄС | 606-001-00-8 |
| Класифікація ЄС | |
| NFPA 704 | |
| Температура спалаху | −17 °C |
| Температура самозаймання | 500 °C |
| Вибухові границі | 2,15%-13,00% |
| Пов'язані речовини | |
| Пов'язані речовини | Бутанон, Ізопропіловий спирт |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ацето́н, пропано́н (від лат. acetum — оцет) — найпростіша сполука гомологічного ряду аліфатичних кетонів. Формула (CH3)2CO.
Безбарвна летка рідина з характерним запахом. Необмежено змішується з водою та полярними органічними розчинниками, також в обмежених пропорціях змішується з неполярними розчинниками.
Ацетон є цінним промисловим розчинником і завдяки невеликій токсичності він отримав широке застосування у виробництві лаків, вибухових речовин, лікарських засобів. Він є вихідною сировиною в численних хімічних синтезах. В лабораторній практиці його застосовують як полярний апротонний розчинник, для приготування охолоджувальних сумішей разом із сухим льодом і аміаком, ацетон є дуже корисним для миття хімічного посуду.
Ацетон є одним з продуктів метаболізму у живих організмах, зокрема, у людини. Він є одним із компонентів так званих ацетонових тіл, яких в крові здорової людини міститься вкрай мало, однак при патологічних станах (тривале голодування, важке фізичне навантаження, важка форма цукрового діабету) їх концентрація може значно підвищуватися і досягати 20 ммоль/л (кетонемія)[3].
В Україні ацетон, відповідно до Постанови Кабінету Міністрів від 5 грудня 2012 р. N 1129 «Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів», є прекурсором, стосовно якого встановлюються заходи контролю. Крім того таким же заходам контролю підлягають речовини, що містять не менш як 50% ацетону[4].

Ацетон — один з найважливіших кетонів. Його вперше у 1595 році виявив німецький хімік Андреас Лібавій при сухій перегонці ацетату свинцю. Але лише в 1832 році Жан-Батист Дюма і Юстус фон Лібіх точно визначили його природу і склад. До 1914 року ацетон отримували майже виключно через коксування деревини, але підвищений попит на нього під час першої світової війни дуже швидко призвів до створення нових методів виробництва.
Найстаріший метод промислового виробництва ацетону полягав у сухій перегонці ацетату кальцію, який утворюється при нейтралізації вапном деревного оцту, який утворюється при коксуванні деревини[5]. Зараз цей метод вже не застосовується, оскільки ацетон в цьому випадку містить занадто багато домішок, а вихідний матеріал дефіцитний.
Відомі також способи одержання ацетону бактеріальним розщепленням вуглеводів (крохмалю, цукрів, меляси), причому як побічні продукти утворюються бутиловий або етиловий спирт[6][7][8]. Ацетон і бутиловий спирт одержують в мольному співвідношенні від 2:1 до 3:1.
У Німеччині був розроблений технологічний процес виробництва ацетону на основі оцтової кислоти[9]. При 400 °С через контакти з церію пропускали оцтову кислоту:
Такий ацетон вирізняється особливою чистотою.
Ацетон також виробляють з ацетилену прямим синтезом:
Ацетилен вступає у взаємодію з водяною парою при 450 °С в присутності каталізаторів (зокрема оксиду цинку або композиту Fe2O3-ZnO)[10][11][12][13].
Одним із головних методів одержання ацетону є дегідрогенізація ізопропілового спирту[14][15][16]:
Дегідрогенізація протікає при 350—400 °С в присутності таких каталізаторів, як сплав залізо-мідь-цинк[17], оксид цинку або оксид цинку з 4,5% карбонату натрію[18], мідь, свинець та інші[19][20]. Внаслідок ендотермічного характеру реакції процес ведуть в трубчастому реакторі, вузькі довгі трубки якого обігріваються димовими газами. Продуктивність процесу зростає при підвищенні тиску (близько 2,7—3,4 атмосфери).
Активність каталізатора поступово знижується через відкладення на його поверхні сажі і смолистих речовин. Регенерація каталізатора полягає у випалюванні вуглецевих відкладень киснем, розбавленим інертними газами.
Останнім часом все частіше ацетон одержують через окиснення ізопропілового спирту повітрям. При цьому також утворюється перекис водню:
Цей метод відіграє певну роль при виробництві гліцерину за відсутності хлору. Як каталізатор при проведенні процесу застосовують срібло, мідь, нікель, платину та інші.
В цьому процесі повітря, насичене парами ізопропілового спирту, пропускається над тонким шаром каталізатора при температурі 400–650 °C. Продукти реакції швидко охолоджують, і конденсат після нейтралізації невеликих кількостей оцтової кислоти дистилюють. Виділений технічний ацетон ректифікують, а непрореагований ізопропіловий спирт повертають на окиснення.
Реакція окиснення ізопропілового спирту сильно екзотермічна і її важко контролювати. Тому рекомендується в одній реакції об'єднувати і окиснення, і дегідрогенізацію, для того щоб сумарний тепловий ефект наближався до нуля.
Розроблена і впроваджена в промисловості технологія прямого синтезу ацетальдегіду з етилену[21][22][23]
може також слугувати для безпосереднього одержання ацетону з пропілену. У цьому випадку пропілен (або багата пропіленом суміш газів) під дією розчину каталізатору PdCl2 і CuCl2 в хлоридній кислоті перетворюється на ацетон. Відновлений каталізатор знову окислюється повітрям. При цьому протікають такі реакції:
Вихід становить 92—94% при 90—120 °С і тиску 9—12 кгс/см². Як побічні продукти утворюються 0,5—1,5% пропіонового альдегіду (пропаналю) і ~2% моно- і дихлороацетонів. Припускають, що реакція йде через комплекс [PdCl2(OH)C3H6]-, який у присутності води гідролітично розщеплюється на ацетон, паладій і хлоридну кислоту[24]. Агентами повторного окислення будуть CuCl2 або FeCl3, а також суміші обох сполук[25].
Реакцію можна проводити при кімнатній температурі, але підвищені температури прискорюють процес. У більшості випадків рН розчину становить від 3 до 4. Тиск також сприятливо впливає на хід реакції. Зазвичай працюють з дуже розведеним розчином PdCl2 (частково разом з ацетатом міді)[26]. Використання концентрованого розчину PdCl2 прискорює реакцію.
Модифіковані каталізатори акролеїну застосовуються і при прямому окисненні пропілену в ацетон. Каталізатори на основі MoO3 або Bi2O3 у присутності H3PO4 або H3BO3 при 375 °С дають поряд з ацетальдегідом, оцтовою кислотою, формальдегідом, етилацетатом і акролеїном також і ацетон[27], причому позитивного впливу надає додавання срібла[28]. Можна використовувати фосфоромолібдат бісмуту на Al2O3 та фосфоромолібденову кислоту на SiO2 (260 °С, 1 с)[29].
Цей спосіб також є одним з основних промислових способів одержання ацетону, він на 40% дешевший від методу одержання ацетону з ізопропілового спирту. Вихідними продуктами служать бензен і пропілен.
Алкілування бензену пропіленом здійснюють у присутності каталізатору хлориду алюмінію при температурі 50 °С. Як каталізатори використовували також концентровану сульфатну кислоту, фтороводень, флуорид бору та інші.
Окиснення кумолу проводиться киснем повітря при 4—5 атмосферах і 110—120 °С, при цьому утворюється гідропероксид кумолу.
Гідропероксид кумолу при температурі 30—60 °С в присутності приблизно 0,1% сульфатної кислоти розкладається на фенол і ацетон:

Ацетон можна добути каталітичним розкладом парів оцтової кислоти при підвищеній температурі (400—450 °С). Каталізатори — карбонат кальцію або барію, оксиди кальцію, алюмінію, торію, урану, цинку, солі марганцю та інші.
Можливе утворення ацетону при каталітичному окисненні пропану киснем повітря при температурі 400 °C:
Ацетон має типові хімічні властивості кетонів. Він важко окиснюється, каталітично відновлюється до ізопропілового спирту, реагує по карбонільній групі з нуклеофілами та по α-позиції.
При відновленні ацетону лужними реагентами і особливо амальгамами магнію або цинку відбувається конденсація і відновлення, що завершуються утворенням пінакону:
Ацетон окиснює вторинні спирти в кетони за присутності трет-бутилату або ізопропілату алюмінію (реакція Опенауера[en])
При використанні великого надлишку ацетону реакція зсувається вправо.
Під дією перекису водню на ацетон в кислому середовищі утворюється перекис ацетону.
Хромовий ангідрид окиснює ацетон до вуглекислого газу та води. Ацетон реагує з аміаком і воднем у присутності нікелю або міді, утворюючи аміни:
Зазвичай реакція проходить при температурі 125—175 °С і тиску 5—10 атмосфер.
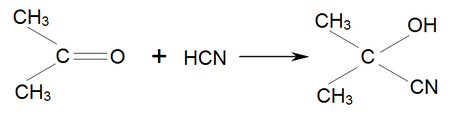
Однією із найважливіших реакцій ацетону є приєднання до нього синильної кислоти, в результаті чого утворюється ацетонціангідрин:
Аналогічно ацетон приєднує хлороформ, утворюючи хлоретон, який застосовується як антисептик:
При конденсації з ацетиленом ацетон утворює диметилкарбінол, який легко перетворюється в ізопрен:
Також взаємодіє з діазометаном. При цьому до ацетону приєднується CH2, та утворюється метилетилкетон. Спочатку діазометан приєднується до молекули, атом оксигену набуває негативного заряду, атом нітрогену — позитивного. Потім азот відщеплюється, і одна з метильних груп периєднується до CH2:
Як і в інших аліфатичних кетонах, в ацетоні протони на вуглеці сусідньому з карбонільною групою доволі кислі й відносно легко вступають в реакції заміщення як в кислому так і в лужному середовищі. При дії на ацетон металічного натрію або аміду натрію утворюється ацетоннатрій — натрієвий алкоголят ізопропенілового спирту:
В присутності лугів ацетон легко реагує з галоїдами з утворенням хлороформу, йодоформу і бромоформу:
Ця реакція протікає через проміжне утворення трихлорацетону.
Реакції в кислому середовищі проходять по іншому механізму. Спочатку протонується карбонільна група, потім відривається протон в α-позиції з утворенням нейтрального енолу який легко всутає в реакції приєднання.
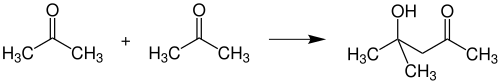
Реакції приєднання по карбонільній групі чи по α-позиції, що призводять до утворення нових С-С зв'язків називають реакціями конденсації. Оскільки в ацетоні присутні активна карбонільна група і дві активні метильні групи в α-позиціях, він здатен вступати в різноманітні реакції конденсації. При альдольній конденсації відбувається утворення діацетонового спирту, який застосовують як розчинник:
При кротоновій конденсації послідовно утворюються оксид мезитилу, а потім форон. Оксид мезитилу застосовують для зниження леткості розчинників для лакофарбових покриттів.
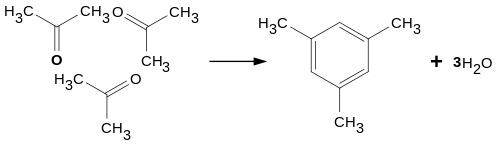
При конденсації трьох молекул ацетону під дією концентрованої сульфатної або хлоридної кислоти утворюється симетричний триметилбензол (мезитилен):
При конденсації ацетону з формальдегідом у присутності невеликих кількостей лугів утворюється ацетоспирт, який при дії йоду або кислот при нагріванні легко відщеплює воду, переходячи в метилвінілкетон:
При конденсації оцтовоетилового естеру з ацетоном отримують ацетилацетон:
При піролізі ацетону (500—700 °С) над глиноземом або на розпеченому електричним струмом платиновому дроті в спеціальному приладі — кетенній лампі, утворюється найпростіший кетен — етенон:
Ацетон також вступає з аміаком в реакцію Манніха з утворенням 2,2',6,6'-тетраметилпіперидону-4 з прийнятними виходами.

Ацетон — дуже добрий розчинник жирів, олив, багатьох смол, нітролаків, сургучу, каніфолі. Ацетон також розчиняє ацетилен, целулоїд, нітро- та ацетилцелюлозу. Каучук, пек та мастикові смоли не розчиняються в ацетоні.
Завдяки своїй малій токсичності, добрій розчинній здатності ацетон дуже широко застосовується на підприємствах хімічної чистки.
При конденсації ацетону в лужному середовищі можна отримати різноманітні продукти[30]. При температурі 10—20 °С в метанольному розчині ацетон димеризується у присутності невеликих кількостей лугу в діацетоновий спирт, з якого одержують гексиленгліколь, оксид мезитилу, метилізобутилкарбінол, метилізобутилкетон, метиловий естер гексиленгліколю. Гексиленгліколь додається переважно до палива. Оксид мезитилу здатен вступати в різні реакції приєднання, наприклад з метанолом в присутності невеликих кількостей лугу. Метилізобутилкетон — дуже важливий розчинник. Метилізобутилкетон і метилізобутилкарбінол є дуже добрими розчинниками для полівінілхлориду, співполімерів вінілхлориду, похідних целюлози, хлорованого каучуку та інших речовин. У більшості випадків за розчинними здібностями вони перевершують естери.

При каталітичній конденсації ацетону в присутності основ при 200 °С поряд з так званими ізоциклітонами утворюється ізофорон, який також є основою для різноманітних синтезів. Сам ізофорон займає виняткове становище як розчинник вінілових лаків. Він надає лакам гарячої сушки блиску і міцності. При обережному гідруванні з ізофорону одержують 3,3,5-триметилциклогексанон, який застосовується на одержання перекисів і служить розчинником. 3,3,5-триметилциклогексанол, який утворюється в результаті повної гідрогенізації ізофорону, є важливим компонентом спеціальних пластифікаторів, особливо у взаємодії з довголанцюговими аліфатичними моно- і дикарбоновими кислотами. Але ще більше значення надають продукту його окиснення нітратною кислотою — α, α, γ-триметиладипіновій кислоті. Цю кислоту етерефікують в спеціальні пластифікатори і перетворюють через диметиловий естер у 2,2,4-триметилгександіол-1, 6 шляхом енергійної гідрогенізації. Крім того, кислоту можна перетворити гідрогенізацією динітрилу в 2,2,4-триметилгексаметилендіамін.
Інший шлях одержання діаміну з ізофорону полягає в дії на нього синильної кислоти та утворенні нітрилу ізофорону — 3,3,5-триметил-5-ціаноциклогексанону, який при спеціальних умовах можна відновити в 1-амінометил-1,3,3-триметил-5-аміноциклогексан (ізофорондіамін). Діаміни легко перевести в діізоціанати і далі використовувати як затверджувачі епоксидних смол. Особливо велика їх роль для виготовлення прозорих поліамідів. Поліаміди застосовуються для виготовлення смол, зв'язних компонентів лаків, клеїв, високоякісних пластмас.
Також в органічному синтезі з ацетону добувають кетен, ізопрен тощо.
Наркотик, послідовно вражає всі відділи центральної нервової системи. При вдиханні протягом тривалого часу накопичується в організмі. Токсичний ефект залежить не тільки від концентрації, а й від часу дії. Повільне виділення з організму збільшує можливості хронічного отруєння. Пригнічує деякі мітохондріальні (окиснювальні) ферменти[31].
При гострому отруєнні у білих мишей бокове положення після 2-годинної експозиції настає при 30—40 мг/л[32]; смерть — при 150 мг/л. У білих щурів бокове положення при 2-годинному впливі 30 мг/л. Концентрації до 10 мг/л не здійснюють впливу навіть через 8 годин. Перші ознаки отруєння встановлені при 25 мг/л через 1,5—3 години. При 50 мг/л рефлекси зникають через 2—2,5 години. У морських свинок і кроликів бокове положення наступало при 2-годинному впливі 72 мг/л. Мінімальні концентрації, що змінюють безумовнорефлекторну діяльність кроликів, 1,25—2,5 мг/л. У мишей, щурів, морських свинок і кроликів концентрації ацетону, що викликали бокове положення, приводили до збільшення вмісту ацетону, ацетооцтової і особливо β-оксимасляної кислоти в крові та сечі[32]. У кішок вдихання 8—10 мг/л протягом 5 годин викликає лише подразнення слизових оболонок носа і очей, сонливість. У собак при 5—6 мг/л і експозиції 7 годин умовні рефлекси не змінюються.
При дослідженнях хронічного отруєння білим щурам давали вдихати 0,00053 мг/л ацетону безперервно протягом 45 діб або 0,2 мг/л щодня по 8 годин. В результаті не було виявлено істотних ознак отруєння[33]. Вплив 0,019 мг/л по 4 години на день протягом 3 тижнів не змінило умовнорефлекторної діяльності[34]. Тварини витримували дію ацетону протягом 9 днів при концентрації в крові 100 мг% і не проявляли жодних ознак отруєння, якщо не враховувати деякої сонливості. При 250 мг% ацетону в крові — слабкість і розлад координації рухів. У мишей і кроликів при щоденних 4-годинних отруєннях концентрацією 8 мг/л протягом більше 3 місяців розвивалося підвищення чутливості до ацетону з погіршенням загального стану. За іншими даними, навпаки, при вдиханні протягом 40 хвилин 1—2 рази на тиждень зростаючих з 1 до 4 мг/л концентрацій спостерігалося «звикання»[35][36]. Вміст ацетону в крові «звиклих» тварин при одній і тій же концентрації його в повітрі був нижчим, ніж у тих, які вперше його вдихали[37]. У кішок повторне отруєння 3—5 мг/л — викликало лише подразнення слизових оболонок.
Поріг сприйняття запаху становить 0,0011 мг/л, поріг дії, що спричиняє виникнення електрокортикального умовного рефлексу, 0,44 мг/л[33]. При вдиханні 1,2 мг/л протягом 3—5 хвилин відбувається подразнення слизових оболонок очей, носа і горла, а вдихання 0,01 мг/л протягом 6 годин підвищувало активність холінестерази крові та коефіцієнт використання кисню. Збільшення вмісту в крові кетонових тіл відбувалося і при впливі 0,001 мг/л; в сечі вміст кетонових тіл не змінювався[38].
У випадку гострого отруєння, у потерпілого вміст ацетону в крові на другий день досягав 18 мг% (норма 1—2 мг%). Ацетон був виявлений також і в сечі; через деякий час в сечі виявляли невелику кількість білка, лейкоцити і еритроцити. Рівень цукру в крові в день отруєння досягав 142 мг%[39].

При одночасному вмісті в повітрі 2,3—3 мг/л ацетону і бутанону відзначені випадки непритомності у робітниць. При застосуванні як розчинника ацетону разом з бутаноном описане отруєння кількох робітників (нездужання, сльозотеча, нетривала непритомність, що супроводжувалася судомами, головний біль). Масове гостре захворювання очей у робітників взуттєвої фабрики (світлобоязнь, сльозотеча, кон'юнктивіти і навіть розлад зору) було викликано ацетонистим спиртом і залежало, очевидно, не стільки від ацетону, скільки від метилового і алілового спиртів. Аналогічні захворювання пояснювалися забрудненням ацетону ацетальдегідом.
За спостереженнями в ході досліджень хронічних отруєнь при концентрації 0,1—0,12 мг/л ацетону у робітників не спостерігалося жодних ознак отруєння, хоча в сечі він постійно визначався; при 0,5-1 мг/л ацетон в крові не визначався протягом тижня. Концентрація 5 мг/л в повітрі при щоденному впливі викликала виникнення в крові до 40 мг% ацетону. При наявності ~0,6 мг/л ацетону в повітрі (у присутності бутилацетату та етилового спирту) відзначалися ознаки отруєння. Спостерігалися зміни з боку верхніх дихальних шляхів, частіше у формі атрофічних катарів, анемія, зсув вліво лейкоцитарної формули, зниження апетиту. У деяких робітників у сироватці крові було виявлено зниження рівня альбумінів і підвищення рівня α-, β- і γ-глобулінів, а також загальних ліпідва, без інших симптомів інтоксикації.
При зануренні вуха кролика в ацетон на 3 години або при нанесенні чистого ацетону на вистрижену шкіру живота на 6 годин місцевої дії майже непомітно. При накладенні компресів з ацетону виявлені зміни в периферичній нервовій системі, найбільш чутливими виявляються мозкові нервові волокна.
Компреси з ацетону, накладені людині на плече на добу, викликали незначне почервоніння, яке незабаром зникало. У робітників на ділянках шкіри, на які протягом робочого дня діяв ацетон, зменшувався pH і кількість холестерину, пригнічувалась функція сальних залоз[40].
Рідкий ацетон може всмоктуватися через шкіру. Ацетон з'являється в крові відразу після початку вдихання, його концентрація поступово наростає до встановлення динамічної рівноваги. Вміст у тканинах становить такий ряд: головний мозок → селезінка → печінка → підшлункова залоза → нирки → легені → м'язи → серце. Мічений вуглець, що входить в молекулу ацетону, виявлений у складі глікогену, сечі, холестерину, жирних і амінокислот. Ацетон метаболізується повніше при вдиханні невисоких концентрацій. З повітрям, що видихається, виділяється незмінений ацетон, а при його окисненні утворюється . Ацетон виділяється також через нирки і шкіру[41].
Ацетон, ацетооцтова і бетаоксимасляна кислота, об'єднуються під загальною назвою ацетонові тіла. Це продукти неповного окислення жирів і частково білків, тісно пов'язані між собою.
За нормального стану організму ацетонові тіла в загальному аналізі сечі відсутні. Слід зазначити, що за добу з сечею таки виділяється незначна кількість цих сполук, проте такі концентрації не можуть бути визначені звичайними методами, що застосовуються в лабораторіях. Тому прийнято вважати, що в нормі в сечі ацетонових тіл немає.
Ацетонові тіла виявляються в загальному аналізі сечі при порушенні обміну вуглеводів і жирів. Таке порушення супроводжується збільшенням кількості ацетонових тіл в тканинах в крові (кетонемія). Вміст у сечі ацетонових тіл називається кетонурією.
За нормальних умов організм черпає енергію в основному з глюкози. Глюкоза накопичується в організмі, в першу чергу в печінці, у вигляді глікогену. Глікоген утворює енергетичний резерв, який можна швидко мобілізувати при необхідності компенсації раптової недостачі глюкози.
При фізичних і емоційних навантаженнях, при хворобах з підвищеною температурою та інших підвищених витратах енергії запаси глікогену вичерпуються, організм починає отримувати енергію із запасів жиру. При розпаді жиру утворюються ацетонові тіла, які виводяться з сечею. Якщо з ацетоновими тілами в загальному аналізі сечі виявляється глюкоза, то це ознака цукрового діабету. Також ацетонові тіла в загальному аналізі сечі з'являються внаслідок зневоднення організму, при різкому схудненні, гарячці, голодуванні, важких отруєннях із сильною блювотою і проносом.
- ↑ а б в CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- ↑ Howard, William L. Acetone // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — P. 93. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- ↑ Березов Т. Т., Коровкин Б. Ф., Биологическая химия: Учебник / Под. ред. акад. АМН СССР С. С. Дебова.— 2-е изд., перераб. и доп.— М.: Медицина,— 1990.— 528 с. ISBN 5-225-01515-8 (рос.)
- ↑ Постанова Кабінету міністрів України №770 від 6 травня 2000 року «Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів». Архів оригіналу за 11 грудня 2016. Процитовано 26 травня 2022.
- ↑ Ullmann, Enzyklopadie der technischen Chemie, München, Bd. 1, 1951, S. 106. (нім.)
- ↑ Патент США 1329214, 1920. (англ.)
- ↑ J. H. Northrop et al., Industrial & Engineering Chemistry, 11, 723 (1919). (англ.)
- ↑ W. H. Peterson et al., Industrial & Engineering Chemistry, 13, 757 (1921). (англ.)
- ↑ Німецький патент 298851, 1916. (нім.)
- ↑ Англійський патент 299048, 1928. (англ.)
- ↑ Англійський патент 313897, 1928. (англ.)
- ↑ Англійський патент 330350, 1929. (англ.)
- ↑ Англійський патент 472093, 1936. (англ.)
- ↑ Англійський патент 173539, 1920. (англ.)
- ↑ Патент США 1365035, 1918. (англ.)
- ↑ Патент США 1497817, 1918. (англ.)
- ↑ Патент США 1952702, 1933. (англ.)
- ↑ Патент США 1895516, 1933. (англ.)
- ↑ Патент США 1895528, 1933. (англ.)
- ↑ Патент США 1895529, 1933. (англ.)
- ↑ J. Smidt et. al., Angewandte Chemie, 71, 176–182 (1959). (нім.)
- ↑ W. Hafner et al., Chemische Berichte, 95, 1575–1581 (1962). (нім.)
- ↑ J. Smidt, H. Krekeler, Erdol und Kohle, 16, (6-1), 560–563 (1963). (нім.)
- ↑ J. Smidt, Chemistry & Industry, 1962, 54—61. (англ.)
- ↑ Англійський патент 884962, 1961. (англ.)
- ↑ Англійський патент 878777, 1961. (англ.)
- ↑ Бельгійський патент 620834, 1963. (фр.)
- ↑ Французький патент 1397639, 1965. (фр.)
- ↑ Італійський патент 640465, 1962. (італ.)
- ↑ К. Schmitt, Chemische Industrie, 18, № 4, 204–210 (1966). (нім.)
- ↑ Clark H., Powis G. Biochemical Pharmacology, 1974, v. 23. № 5, p. 1015–1019. (англ.)
- ↑ а б Линючева Л. А. и др. Фармакология и токсикология, 1969, № 4, с. 465–467. (рос.)
- ↑ а б Фельдман Ю. Г. В кн.: Предельно допустимые концентрации атмосферных загрязнений. Вып. 6. М., 1962, с. 109–127. (рос.)
- ↑ Batting К., Grandjen Е. Archives of Environmental Health, 1964, v. 9. № 6, p. 745–749. (англ.)
- ↑ Кулинченко В. П. В кн.: Конференция молодых научных работников. Тезисы докладов. Институтт гигиены труда и проф. заболев. АМН СССР, 1964, с. 30—31. (рос.)
- ↑ Олюпин И. В., Проблемы гигиены труда и проф. заболев. Вып. I. Иркутск, 1964, с, 12—19;: 20—31. (рос.)
- ↑ Добрынина В. В. В кн.: Материалы II конференции молодых научных работников. Лен. ин-та гиг. труда и проф. заболев. Л. 1968, с. 46-49. (рос.)
- ↑ Михайлов В. И., Пилипюк З. И. Гигиена труда, 1968, № 1, с. 57—60. (рос.)
- ↑ Ross D. S. The Annals of Occupational Hygiene [Архівовано 10 червня 2005 у Wayback Machine.], 1973, v. 16, № 1, p. 73—75. (англ.)
- ↑ Рогайлин В. И. Гигиена труда, 1966, № 2, с. 23—25. (рос.)
- ↑ Eagle J., American Industrial Hygiene Association Journal, 1973, v. 34, № 12, p. 533–539. (англ.)
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Ленинград : Химия, 1976. — Т. 1. — С. 529-533. — 49000 прим. (рос.)
- Шейхет Ф. И. Материаловедение химикатов, красителей и моющих средств. — Москва : Легкая индустрия, 1969. — С. 62-71. — 18000 прим. (рос.)
- Химическая энциклопедия / Под. ред. Кнунянц И. Л. — Москва : Советская энциклопедия, 1988. — Т. 1. (рос.)
- Теддер Дж., Нехватал А., Джубб А. Промышленная органическая химия. — Москва : Мир, 1977. — 704 с. (рос.)
- Ацетон [Архівовано 10 березня 2016 у Wayback Machine.] Фармацевтична енциклопедія
- Запах ацетону з рота. Архів оригіналу за 20 червня 2013.
- Ацетон. Школа доктора Комаровського. Архів оригіналу за 20 червня 2013.
- Ацетон буває різним. Архів оригіналу за 20 червня 2013.
| Ця стаття належить до добрих статей української Вікіпедії. |