Вуглеводи
Вуглево́ди — органічні сполуки, що складаються з карбону, оксигену й гідрогену та за хімічною природою є полігідроксиальдегідами або кетонами (тобто мають кілька гідроксильних груп й одну карбонільну), або перетворюються на них шляхом гідролізу. Більшість вуглеводів мають емпіричну формулу Cn(H2O)m, звідки й походить їхня назва («вуглець» + «вода»). Деякі похідні вуглеводів можуть також містити нітроген, сульфур, фосфор тощо.
Вуглеводи є складовою частиною клітин усіх живих організмів й одним із чотирьох найбільших класів біомолекул разом із білками, ліпідами й нуклеїновими кислотами.
Загальний опис
Вуглеводи — полігідроксиальдегіди або полігідроксикетони, або ж молекули, які можуть гідролізуватися до них. Загальний термін включає моносахариди, олігосахариди й полісахариди. Більшість із них має загальну формулу Cn(H2O)m.
| 1. Як вуглеводи впливають на наше здоров'я // Канал «Цікава наука» на YouTube, 20 лютого 2020. | |
Моносахариди називають простими цукрами, їхні молекули складаються із однієї полігідроксиальдегідної або кетонної одиниці, що містить переважно від 3 до 9 атомів карбону. Найпоширенішим у природі моносахаридом є глюкоза.
Прості цукри можуть об'єднуватись у короткі ланцюжки, найчастіше по два (дисахариди), за допомогою глікозидних зв'язків формуючи таким чином олігосахариди. Типовий приклад дисахариду — сахароза (буряковий або тростинний цукор). Олігосахариди з трьома й більше мономерними ланками у клітинах зазвичай не існують самостійно, а входять до складу сполук з невуглеводними речовинами. Низькомолекулярні вуглеводи (тобто моно- й олігосахариди) об'єднують під назвою цукри, більшість індивідуальних сполук цієї групи мають назви із закінченням «-оза».
Полісахариди — це полімери 20 і більше моносахаридних одиниць, інколи до кількох тисяч, вони можуть бути лінійними (як целюлоза) або розгалуженими (як глікоген).
Більше половини органічного вуглецю на Землі існує у формі вуглеводів, вони є найпоширенішими органічними сполуками на нашій планеті. Щороку фотосинтезуючі організми перетворюють 100 мільярдів[1] тонн вуглекислого газу і води у целюлозу та інші речовини. У рослинах вуглеводи становлять до 80 % сухої речовини, в організмі людини і тварини — до 2 %[2]. Для більшості гетеротрофів окиснення вуглеводів є центральним шляхом отримання енергії клітинами, так у дієті середньостатистичної людини першочерговим джерелом енергії є крохмаль і цукри. Багато полісахаридів виконують структурну роль — входять до складу клітинних стінок рослин, бактерій і грибів, сполучної тканини тварин. Інші вуглеводні полімери беруть участь у змащенні суглобів, забезпеченні розпізнавання і адгезії між клітинами. Вони також можуть входити до більших комплексів разом із білками чи ліпідами, так званих глікокон'югатів. Два моносахариди пентози — рибоза і дезоксирибоза — є структурними компонентами нуклеїнових кислот.
Моносахариди
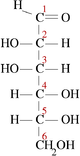
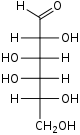
Моносахариди або монози — найпростіші вуглеводи, вони не піддаються гідролізу. Це безбарвні кристалічні сполуки, добре розчинні у воді, але нерозчинні у неполярних розчинниках, переважно солодкі на смак. Типова будова молекули моносахариду така: нерозгалужений карбоновий скелет, що містить від 3 до 9 атомів, до одного з яких подвійним зв'язком приєднано атом оксигену, формуючи карбонільну групу, до решти атомів скелету приєднано одинарними зв'язками гідроксильні групи. Якщо карбонільна група розташована на кінці молекули — сполука є альдозою, а якщо посередині — кетозою. Найпростіші моносахариди — це тріози (містять три атоми карбону): гліцеральдегід (альдотріоза) і дигідроксиацетон (кетотріоза). Прості цукри із 4-ма атомами карбону називаються тетрозами, з 5-ма — пентозами, 6-ма — гексозами, 7-ма — гептозами і так далі. Найпоширеніші у природі гексози, до цієї групи належить глюкоза (альдогексоза) і фруктоза (кетогексоза)[3].
Стереоізомерія моносахаридів

Усі моносахариди, крім дигідроксиацетону, містять хіральні атоми карбону, тобто такі, до яких приєднано 4 різні замісники, через це можливе утворення стереоізомерів, кількість яких рівна 2n, де n — кількість хіральних атомів. Так, для гліцеральдегіду існує два таких ізомери (21), що є точними дзеркальними відображеннями одне одного (енантіомерами) — d-гілцеральдегід і l-гліцеральдегід. Альдогексози мають 4 хіральні центри, і, відповідно, 16 стереозомерів. У восьми з них положення гідроксильної групи біля найдальшого від альдегідної групи атома карбону відповідає такому у d-гліцеральдегіду, вони є d-ізомерами, решта 8 — l-ізомерами. Більшість гексоз живих організмів належать до d-ряду. Моносахариди, що відрізняються положенням гідроксильної групи тільки біля одного атома карбону, називаються епімерами, наприклад глюкоза й галактоза (відмінність біля C4)[3].
Хімічні властивості
Циклізація
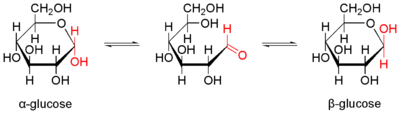
Оскільки моносахариди містять карбонільну й спиртові групи, а вони здатні взаємодіяти між собою, то можливі внутрішньомолекулярні реакції, коли це просторово допустимо, а саме в альдотетроз та всіх моносахаридів із кількістю атомів карбону більшою 4-ох. При цьому формується ковалентний зв'язок між Карбоном карбонільної групи й Оксигеном однієї з гідроксильних груп, молекула стає циклічною, а згаданий атом карбону — асиметричним (хіральним). Через це можливе існування двох стереоізомерів — α і β, у першому новоутворена (напівацетальна чи напівкетальна або глікозидна) гідроксильна група розміщена з протилежного боку до групи -CH2OH біля С5, у другому — з одного боку. Оскільки α- і β-ізомери відрізняються лише розташуванням глікозидного гідроксилу, їх називають аномерами[3].
Якщо внаслідок циклізації утворюється 6-членний цикл, то сполука називатиметься піранозою (нагадує піранове кільце), якщо 5-членне — фуранозою (нагадує фуранове кільце). Для альдогексоз піранозна форма значно стабільніша, ніж фуранозна, кетогексози і альдотетрози ж можуть формувати тільки 5-членні кільця[4].
У кристалічному стані моносахариди перебувають у циклічній конфігурації, наприклад глюкоза — у формі α-глюкопіранози[4]. У розчині α- й β-аномери можуть вільно перетворюватися один на один (через лінійну форму). Наприклад, після розчинення у воді α-d-глюкози з часом встановлюється динамічна рівновага: розчин містить близько третини α-аномеру, двох третин β-аномеру й дуже незначні кількості лінійної й двох фуранозних форм. У процесі встановлення рівноваги змінюється кут обертання розчином площини поляризації світла, що позначають терміном мутаротація. Ізомерні форми сполук, які здатні перетворюватися одна на одну, називають таутомерами[3].
Відновні властивості
Карбонільна група моносахаридів може легко вступати у взаємодію з окисниками, перетворюючись при цьому в карбоксильну. Наприклад, глюкоза та інші прості цукри відновлюють іон Cu2+, продуктами реакції є альдонова кислота, що згодом перетворюється у суміш різних карбонових кислот. Ця взаємодія лежить в основі кількісного методу визначення відновних цукрів з реактивом Фелінга, що тривалий час використовувався для виявлення глюкози у сечі під час діагностики цукрового діабету[3]. Альдози, на відміну від кетоз, також вступають в реакцію з реактивом Толленса, відновлюючи іони Ag+ з утворенням так званого «срібного дзеркала»[5].
Алкілювання й ацилювання
Гідроксильні групи моносахаридів можуть брати участь в реакціях алкілювання зі спиртами, найактивніше вступає в такі взаємодії глікозидний гідроксил. При алкілюванні останнього утворюються сполуки O-глікозиди, невуглеводна частина яких називається агліконом[4]. Можливе також утворення N-глікозидів, у реакціях з амінами, у цьому випадку аглікон з'єднаний із вуглеводним циклом через атом Нітрогену. Типовим прикладом N-глікозидів є нуклеозиди — сполуки рибози і азотистої основи[6].
Моносахариди (й інші вуглеводи) також можуть вступати в реакції ацилювання з органічними й неорганічними кислотами, продуктами яких є естери. Особливо важливе значення у природі мають фосфати простих цукрів, такі як глюкозо-6-фосфат[4].
Різноманітність і значення моносахаридів
Серед альдоз тільки d-глюкоза часто зустрічається в природі у вільному стані. Її можна знайти у виноградному соку, багатьох фруктах, а також у крові тварин. В організмі людини окиснення глюкози є джерелом енергії для роботи нервової системи, а також великою мірою — для м'язових скорочень. Глюкоза є продуктом гідролізу полісахаридів крохмалю, глікогену й целюлози (під дією ферментів або мінеральних кислот). Інші важливі речовини цього класу — d-гліцеральдегід, d-рибоза, d-маноза і d-галактоза — переважно входять до складу більших молекул. Серед кетоз у природі найчастіше зустрічаються дигідроксиацетон, d-фруктоза, d-рибулоза і d-ксилулоза[7].
Похідні простих цукрів

Крім найпростіших цукрів у природі поширені їх похідні, у яких гідроксильні або карбонільні групи окиснені або заміщені на інші функціональні групи. Наприклад, при окисненні альдегідної групи альдоз утворюються альдонові кислоти, такі як глюконова кислота (похідна глюкози). Продуктом окиснення гідроксильної групи до карбоксильної на протилежному кінці молекули є уронові кислоти, наприклад глюкуронова і галактуронова[3]. Як альдонові, так і уронові кислоти мають виражену схильність до внутрішньої естерифікації з утворенням 5- або 6-членних лактонів. Наприклад, аскорбінова кислота (вітамін C) є γ-лактоном, що синтезується рослинами і більшістю тварин з моносахаридів (глюкози, манози чи галактози)[5].
Альдози й кетози можуть бути відновлені за м'яких умов з утворенням багатоатомних спиртів, таких як рибітол, інозитол, гліцерол і ксилітол[8].
Поширені в природі фосфоцукри, вони є проміжними продуктами синтезу й розщеплення більшості моносахаридів. Фосфорилювання відбувається щоб активувати цукри для наступних хімічних реакцій, а також щоб затримати їх всередині клітини, оскільки плазматичні мембрани переважно не мають переносників для фосфорильованих форм[3].
В аміноцукрів на аміногрупу заміщується одна з гідроксильних, найчастіше біля C2, як у глюкозаміну, галактозаміну й манозаміну. Майже завжди ця аміногрупа конденсується із оцтовою кислотою, як у N-ацетилглюкозаміну. Остання сполука входить до складу багатьох структурних полісахаридів, наприклад, у клітинній стінці бактерій. N-ацетилнейрамінова кислота є 9-карбоновим кислотним похідним N-ацетилманозаміну і є компонентом деяких гліколіпідів і глікопротеїнів у тварин[3].
Ще одна група похідних моносахаридів — дезоксицукри, в яких одну з гідроксильних груп заміщено на атом Гідрогену. Найпоширеніша сполука цього класу — β-2-d-дезоксирибоза, що входить до складу ДНК. l-фукоза і l-рамноза є похідними l-галактози і l-манози відповідно. Перша з них знайдена в гліколіпідах і глікопротеїнах, друга — в рослинних полісахаридах[3].
Олігосахариди

Моносахариди можуть вступати один з одним у реакцію конденсації, що відбувається між глікозидним гідроксилом однієї молекули і якоюсь (глікозидною, чи ні) -OH групою іншого. При цьому формується O-глікозидний зв'язок. Олігосахариди містять від 2 до 19 моносахаридних ланок. Найпоширеніші з них — дисахариди.
Глікозидний зв'язок легко піддається гідролізу в кислотному, але не в лужному, середовищі. При цьому олігосахариди розпадаються на складові моносахариди[9].
Залежно від здатності відновлювати слабкі окисники, такі як Cu2+, оксиди деяких металів, олігосахариди поділяються на редукуючі (відновлюючі) і нередукуючі (невідновлюючі). Для проявлення відновлювальних властивостей вуглевод повинен мати хоча б одну напівацетальну (чи напівкетальну) гідроксильну групу і, відповідно, можливість переходу у лінійну форму. Через це олігосахариди, що утворюються внаслідок реакції між глікозидним гідроксилом одного моносахариду і неглікозидним — іншого, мають так званий редукуючий кінець (той, на якому розташований глікозидний гідроксил) і можуть проявляти відновні властивості. До редукуючих дисахаридів належать мальтоза і лактоза[9]. Наприклад, реакція окиснення мальтози:
З іншого боку, в утворенні нередукуючих цукрів задіяні гілкозидні гідроксили обидвох моносахаридів, формується O-глікозидний зв'язок між двома атомами C-1. Такі сполуки не можуть переходити в лінійну форму й виявляти відновні властивості, прикладом є сахароза[9].
Номенклатура олігосахаридів

Для більшості розповсюджених олігосахаридів використовуються тривіальні назви, як-от сахароза, лактоза, мальтоза. Існують також правила найменування цих сполук, які однозначно відображають їхню хімічну природу і особливо корисні у випадку більшої кількості мономерних ланок. Для редукуючих олігосахаридів назва починається із нередукуючого кінця, для залишку моносахариду вказується конфігурація глікозидного гідроксилу (α чи β) і тип кільця за допомогою додавання «-піранозил» або «-фуранозил». Далі в дужках через стрілочку записуються номери атомів карбону, сполучених глікозидним зв'язком, після цього називається наступний моносахаридний залишок і так далі. Наприклад, мальтоза: α-d-глюкопіранозил-(1→4)-d-глюкопіраноза. Оскільки більшість природних цукрів належать до d-ряду і в гексоз значно переважає піранозна форма, для скороченого запису використовують абревіатури з трьох букв, наприклад, лактоза: Гал-(β1→4)-Глк (теж, що і β-d-галактопіранозил-(1→4)-d-глюкопіраноза). У записах назв нередукючих цукрів використовують двосторонню стрілочку: Глк(α1↔β2)Фру (теж, що і α-d-глюкопіранозил-β-d-фруктофуранозид), порядок зазначення моносахаридних залишків не має значення[9].
Дисахариди
Дисахариди — вуглеводи, які при нагріванні з водою в присутності мінеральних кислот чи під дією ферментів піддаються гідролізу, розкладаються на дві молекули моносахаридів.
Буряковий та тростинний цукор (сахароза), С12Н22О11 — найважливіший із дисахаридів. Його добувають із цукрового буряку (в ньому знаходиться до 28 % сахарози від сухої речовини) або із цукрової тростини. Він є також у соках берези, клену й деяких фруктах. Сахароза — цінний харчовий продукт. Під час гідролізу вона розпадається з утворенням молекули глюкози й молекули фруктози. Мальтоза — це солодовий цукор, він складається з двох залишків глюкози. Дисахариди мають солодкий присмак. Вони, як і моносахариди, добре розчинні у воді.
Полісахариди
Полісахариди — це вуглеводи, які багато в чому відрізняються від моносахаридів і дисахаридів, не мають солодкого смаку і майже не розчинні у воді. Вони являють собою складні високомолекулярні сполуки, які під каталітичним впливом кислот чи ферментів піддаються гідролізу з утворенням простіших поліцукридів, потім дицукридів, і, зрештою, багато (сотні і тисячі) молекул моноцукридів. Важливі представники поліцукридів — крохмаль і целюлоза. Їх молекули побудовані з ланок -С6Н10О5-, є залишками шестичленних циклічних форм молекул глюкози, що втратили молекулу води, тому склад крохмалю й целюлози виражається однією формулою (С6Н10О5)X. Різниця у властивостях цих поліцукридів обумовлена просторовою ізомерією моноцукридних молекул: крохмаль побудований із ланок α-форми глюкози, а целюлоза — β-форми.
Крохмаль (С6Н10О5)x — білий порошок (під мікроскопом — зернистий), нерозчинний у холодній воді; у гарячій воді набухає, утворює колоїдний розчин (крохмальний клейстер); з розчином йоду дає синє забарвлення. Молекули крохмалю неоднорідні за розмірами. Крохмаль утворюється в результаті фотосинтезу в листі рослин, відкладається «про запас» у бульбах, кореневищах, зернах. У шлунковому тракті людини й тварин крохмаль піддається гідролізу й перетворюється на глюкозу, яка засвоюється організмом.
У техніці перетворення крохмалю на глюкозу (процес оцукрювання) відбувається шляхом кип'ятіння його впродовж декількох годин із розбавленою сірчаною кислотою (каталітичний вплив сірчаної кислоти на оцукрювання крохмалю було відкрито 1811 року російським дослідником К. С. Кирхгофом). Щоб з утвореного розчину вилучити сірчану кислоту до нього додають крейду, з якою сірчана кислота утворює нерозчинний сульфат кальцію. Останній відфільтровують і розчин випарюють. Утворюється густа солодка маса — крохмальна патока, що крім глюкози містить значну кількість інших продуктів гідролізу крохмалю. Патока використовується для приготування кондитерських виробів і для різноманітних технічних цілей. Якщо потрібно отримати чисту глюкозу, то крохмаль кип'ятять довше, так досягається повніше перетворення його на глюкозу. Отриманий після нейтралізації й фільтрування розчин згущують, поки з нього не почнуть випадати кристали глюкози. При нагріванні сухого крохмалю до 200—250°С відбувається часткове розкладання його й утворюється суміш простіших ніж крохмаль, полісахаридів, які називають декстрином. Декстрин використовується для оздоблення тканин і приготування клею. Перетворенням крохмалю на декстрин пояснюється утворення скоринки на випеченому хлібі, а також блиск накрохмаленої білизни.
Целюлоза чи клітковина (С6Н10О5)X — волокниста речовина, головна складова частина оболонки рослинних клітин. Величина Х у молекулах целюлози становить приблизно 3000, але може досягати від 6000 до 12000. Найчистіша природна целюлоза — бавовняне волокно — складається з 85—90 % целюлози. У деревині хвойних приблизно 50 % целюлози (до складу деревини поряд із целюлозою входять її супутники, серед них важливим є лігнін — природний полімер, побудований із декількох ароматичних кисневовмісних сполук ряду бензолу, і геміцелюлози — спорідненого целюлозі поліцукриду). Целюлоза не розчиняється у воді, діетиловому ефірі й етиловому спирті. Вона не розщеплюється під дією розбавлених кислот, стійка до дії лугів і слабких окисників.
Значення целюлози дуже велике, досить зазначити, що велика кількість бавовняного волокна йде на виробництво бавовняно-паперових тканин. Із целюлози виробляють папір і картон, а шляхом хімічної переробки — низку різноманітних продуктів: штучне волокно, пластичні маси, лаки, бездимний порох, етиловий спирт.
При обробці на холоді концентрованою сірчаною кислотою целюлоза розчиняється в ній, утворюючи в'язкий розчин. Якщо цей розчин вилити в надлишок води, виділяється білий пластичний продукт, так званий амілоїд, що є частково гідролізованою целюлозою. Він схожий із крохмалем за реакцією з йодом (синє забарвлення; целюлоза не дає цієї реакції). Якщо непроклеєний папір опустити на короткий час у концентровану сірчану кислоту і потім терміново промити, то амілоїд, що утвориться, склеїть волокна паперу, роблячи його щільнішим та міцнішим. Так виготовляється пергаментний папір. При тривалій дії на целюлозу концентрованих розчинів мінеральних кислот із підігрівом вона піддається гідролізу, кінцевим продуктом якого є глюкоза.
Вивчення вуглеводів
Вивчення структури і функцій високомолекулярних вуглеводів дещо відставало у порівнянні із дослідженням білків і нуклеїнових кислот із кількох причин. По-перше, сполуки цього класу переважно гетерогенні як за розміром, так і за складом, що ускладнює хімічні і фізичні характеристики. По-друге, оскільки структура складних вуглеводів не закодована безпосередньо генетично, а утворюється внаслідок серії ферментативних реакцій, генетичний аналіз у цьому випадку значно складніший і менш інформативний, ніж, наприклад, при дослідженні білків. Крім того, оскільки полісахариди переважно виконують пасивні ролі в клітинах, важко розробити надійні методи дослідження їхньої біологічної активності[10].
Хімія вуглеводів
Хімія вуглеводів - велика та економічно важлива галузь органічної хімії. Деякі з основних органічних реакцій, в яких беруть учать вуглеводи:
Див. також
- Всмоктування вуглеводів
- Ліпополісахариди
- Олігосахариди
- Біопластик
- Ферментація
- Глікобіологія
- Гліколіпіди
- Макромолекула
- Пентозофосфатний шлях
- Фотосинтез
Примітки
- ↑ Nelson et al, 2008, с. 235.
- ↑ а б Ластухін та ін, 2006.
- ↑ а б в г д е ж и к Nelson et al, 2008, с. 239—341.
- ↑ а б в г Ластухін, 2005.
- ↑ а б Voet et al, 2011, с. 364.
- ↑ Berg et al, 2007, с. 309.
- ↑ Voet et al, 2011, с. 361.
- ↑ Voet et al, 2011, с. 365.
- ↑ а б в г Nelson et al, 2008, с. 243—344.
- ↑ Voet et al, 2011, с. 359.
Джерела
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 221—225. ISBN 978-0470-57095-1.
- Ластухін Ю.О., Воронов С.А. (2006). Органічна хімія. Львів: Центр Європи. с. 864. ISBN 966-7022-19-6.
- Ластухін О.Ю. (2005). Хімія природних органічних сполук. Львів: Національний університет «Львівська політехніка», «Інтелект-Захід». с. 560. ISBN 966-7597-47-4.
- Полумбрик М. О. Вуглеводи в харчових продуктах і здоров'я людини. — К.: Академперіодика, 2011.