Селениста кислота
| Селениста кислота[1] | |
|---|---|
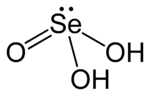 Структурна формула
| |
 Кульково-стрижнева модель
| |
 Селениста кислота на годинниковому склі
| |
| Назва за IUPAC | Селенова(IV) кислота |
| Інші назви | Селенітна кислота |
| Ідентифікатори | |
| Номер CAS | 7783-00-8 |
| PubChem | 1091 |
| Номер EINECS | 231-974-7 |
| DrugBank | DB11127 |
| KEGG | D05814 |
| Назва MeSH | D01.810.900 |
| ChEBI | 26642 |
| RTECS | VS7175000 |
| SMILES | O[Se+]([O-])O |
| InChI | 1/H2O3Se/c1-4(2)3/h(H2,1,2,3) |
| Номер Гмеліна | 25856 |
| Властивості | |
| Молекулярна формула | H2O3Se |
| Молярна маса | 128,97 г/моль |
| Зовнішній вигляд | білі гігроскопічні кристали |
| Густина | 3.0 г/см3 |
| Тпл | розкладається при 70 °C |
| Розчинність (вода) | дуже розчинна |
| Розчинність | розчинна в етанолі |
| Кислотність (pKa) | pKa1 = 2.46 pKa2 = 7.3[2] |
| Фармакологія | |
| Шляхи введення | Внутрішньовенна ін'єкція |
| Небезпеки | |
| ГГС піктограми |   
|
| ГГС формулювання небезпек | 301, 331, 373, 410 |
| ГГС запобіжних заходів | 260, 261, 264, 270, 271, 273, 301+310, 304+340, 311, 314, 321, 330, 391, 403+233, 405, 501 |
| Пов'язані речовини | |
| Інші аніони | Селенова кислота Селенід водню |
| Інші катіони | Селеніт натрію |
| Пов'язані речовини | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Селениста кислота (або селенітна кислота) — хімічна сполука з формулою H2SeO3. Структурно її більш точно описує формула O=Se(OH)2. Це основна оксокислота селену; іншою є селенова кислота.
Утворення і властивості[ред. | ред. код]
Селениста кислота аналогічна сірчистій кислоті, але її легше відокремити. Селениста кислота легко утворюється при додаванні до води діоксиду селену. Будучи кристалічною твердою речовиною, сполуку можна розглядати як пірамідальні молекули, які з'єднані між собою водневими зв'язками.
У розчині це дипротонова кислота:[3]
- H2SeO3 ⇌ H+ + HSeO−3 (pKa = 2.62)
- HSeO−3 ⇌ H+ + SeO2−3 (pKa = 8.32)
За своєю природою вона помірно окиснюється, але кінетично повільно. В 1 М H+:
- H2SeO3 + 4 H+ + 4 e− ⇌ Se + 3 H2O (E
o= +0.74 V)
В 1 М OH−:
- SeO2−3 + 4 e− + 3 H2O ⇌ Se + 6 OH− (E
o= −0.37 V)
Селениста кислота є гігроскопічною.[4][5]
Використання[ред. | ред. код]
Основне застосування — захист і зміна кольору сталі, особливо сталевих частин вогнепальної зброї.[6] Так званий процес холодного воронування використовує селенисту кислоту, нітрат міді (II) і азотну кислоту для зміни кольору сталі зі сріблясто-сірого на синьо-сірий або чорний. В альтернативних процедурах замість них використовується мідний купорос і ортофосфорна кислота. Цей процес утворює покриття із селеніду міді та істотно відрізняється від інших процесів воронування, які генерують чорний оксид заліза. Деякі старі леза для гоління також виготовляли з вороненої сталі.[6]
Інше застосування селенистої кислоти – це хімічне затемнення та патинування міді, латуні та бронзи, що забезпечує насичений темно-коричневий колір, який можна додатково посилити механічним стиранням.
Використовується в органічному синтезі як окиснювач для синтезу 1,2-дикарбонільних сполук, наприклад, у лабораторному отриманні гліоксалю (етан-1,2-діону) з ацетальдегіду.[7]
Селениста кислота є ключовим компонентом реагенту Мекке, який використовується для перевірки на наркотики.[8][9]
Медичне застосування[ред. | ред. код]
Селениста кислота може постачати мікроелемент, який люди вказують як джерело селену.[10][11]
Вплив на здоров'я[ред. | ред. код]
Як і багато інших сполук селену, селениста кислота є дуже токсичною у надмірних кількостях, і споживання будь-якої значної кількості селенової кислоти зазвичай призводить до летального результату, однак вона є схваленим харчовим джерелом у належних кількостях. Симптоми отруєння селеном можуть виникнути через кілька годин після впливу кислоти, і можуть включати ступор, нудоту, важку гіпотензію та смерть.
Список літератури[ред. | ред. код]
- ↑ Lide DR (1998). Handbook of Chemistry and Physics (вид. 87). Boca Raton, Florida: CRC Press. с. 4–81. ISBN 0-8493-0594-2.
- ↑ Ka and pKa for Polyprotic Acids [Архівовано 2019-11-18 у Wayback Machine.]. ucdsb.on.ca
- ↑ Inorganic Chemistry. San Diego: Academic Press. 2001. ISBN 0-12-352651-5.
- ↑ CRC Handbook of Chemistry and Physics (вид. 76th). Boca Raton, FL: CRC Press Inc. 1995. с. 4—82.
- ↑ Selenious acid. PubChem. Процитовано 17 січня 2020.
- ↑ а б SELENIUM (PIM483). 28 червня 1990. Процитовано 29 грудня 2010.
- ↑ "Glyoxal Bisulfite", Organic Syntheses, Collected Volume 3, p.438 (1955).
- ↑ Colour Test Reagents-Kits for Preliminary Identification of Drugs of Abuse (PDF). National Institute of Justice. 1 липня 2000. Процитовано 26 січня 2012.
- ↑ Material Safety Data Sheet - Product Name: Reagent for Special Opiates (PDF). Sirchie Finger Print Laboratories, Inc. 12 травня 2006. Архів оригіналу (PDF) за 18 жовтня 2006.
- ↑ Selenious acid injection, solution. DailyMed. 1 травня 2020. Процитовано 22 жовтня 2020.
- ↑ Drug Approval Package: Selenious Acid Injection. U.S. Food and Drug Administration (FDA). Процитовано 22 жовтня 2020.
Зовнішні посилання[ред. | ред. код]
- Selenious acid. Drug Information Portal. U.S. National Library of Medicine.



