Вірус імунодефіциту людини: відмінності між версіями
| [перевірена версія] | [перевірена версія] |
Pvladko (обговорення | внесок) м →Лікування: оформлення |
Доповнення перекладом з російської Вікіпедії Мітка: потенційно неавторитетне джерело |
||
| Рядок 26: | Рядок 26: | ||
=== Походження === |
=== Походження === |
||
[[Файл:HIV-budding-Color.jpg|right|thumbnail|300px| Штучне забарвлення [[Скануючий електронний мікроскоп|скануючим електронним мікроскопом]] ВІЛ-1, в зеленому, з відділенням дочірньої клітини від вирощених [[лімфоцити|лімфоцитів]].]] |
[[Файл:HIV-budding-Color.jpg|right|thumbnail|300px| Штучне забарвлення [[Скануючий електронний мікроскоп|скануючим електронним мікроскопом]] ВІЛ-1, в зеленому, з відділенням дочірньої клітини від вирощених [[лімфоцити|лімфоцитів]].]] |
||
Вважають, що обидва типи вірусу імунодефіциту людини ВІЛ-1 і ВІЛ-2 виникли в [[Західна Африка|Західній]] і [[Центральна Африка|Центральній Африці]] південніше Сахари і передалися від [[Мавпи|мавп]] до людей (це процес називається [[зооноз]]ом). ВІЛ-1 виник на півдні [[Камерун]]у внаслідок еволюцію [[Ендемія|ендемічного]] вірусу імунодефіциту мавп SIV-cpz, який заражає диких шимпанзе (підвиду ''[[шимпанзе звичайний|Pan troglodytes troglodytes]]'')<ref name="pmid9989410">{{cite journal |author=Gao F, Bailes E, Robertson DL, ''et al.'' |title=Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes |journal=Nature |volume=397 |issue=6718|pages=436–41 |year=1999 |month=February |pmid=9989410 |doi=10.1038/17130 |url=|bibcode = 1999Natur.397..436G }}</ref><ref name=Keele>{{cite journal | author=Keele, B. F., van Heuverswyn, F., Li, Y. Y., Bailes, E., Takehisa, J., Santiago, M. L., Bibollet-Ruche, F., Chen, Y., Wain, L. V., Liegois, F., Loul, S., Mpoudi Ngole, E., Bienvenue, Y., Delaporte, E., Brookfield, J. F. Y., Sharp, P. M., Shaw, G. M., Peeters, M., and Hahn, B. H. | title=Chimpanzee Reservoirs of Pandemic and Nonpandemic HIV-1 | journal=Science | date=28 July 2006| volume=313 | issue=5786 | pages=523–6 | doi = 10.1126/science.1126531 | pmc=2442710 | pmid=16728595|bibcode = 2006Sci...313..523K }}</ref>. |
|||
ВІЛ, як вважають, виник у [[Мавпи|мавп]] у тропічній Африці і був переданий людям у кінці 19 або на початку 20-го століття.<ref name=Salemi>{{cite journal |last1=Salemi |first1=M. |title=Dating the common ancestor of SIVcpz and HIV-1 group M and the origin of HIV-1 subtypes by using a new method to uncover clock-like molecular evolution |journal=The FASEB Journal |pages=276–78 |year=2000 |doi=10.1096/fj.00-0449fje |pmid=11156935 |volume=15 |issue=2 |last2=Strimmer |first2=K |last3=Hall |first3=WW |last4=Duffy |first4=M |last5=Delaporte |first5=E |last6=Mboup |first6=S |last7=Peeters |first7=M |last8=Vandamme |first8=AM}}</ref><ref name=Korber>{{cite journal |last1=Korber |first1=B. |last2=Muldoon |first2=M |last3=Theiler |first3=J |last4=Gao |first4=F |last5=Gupta |first5=R |last6=Lapedes |first6=A |last7=Hahn |first7=BH |last8=Wolinsky |first8=S |last9=Bhattacharya |first9=T |title=Timing the Ancestor of the HIV-1 Pandemic Strains |journal=Science |volume=288 |issue=5472 |pages=1789–96 |year=2000 |pmid=10846155 |doi=10.1126/science.288.5472.1789|bibcode = 2000Sci...288.1789K }}</ref><ref name="pmid18833279">{{cite journal |author=Worobey M, Gemmel M, Teuwen DE, ''et al.'' |title=Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960|journal=Nature |volume=455 |issue=7213 |pages=661–4 |year=2008 |month=October |pmid=18833279|doi=10.1038/nature07390 |url=|bibcode = 2008Natur.455..661W }}</ref> Перша наукова стаття, яка визнала особливості опортуністичних (умовно-патогенних) інфекцій, що ілюструють СНІД, була опублікована в 1981 році.<ref name=MMWR2>{{cite web|url=http://www.cdc.gov/MMWR/preview/mmwrhtml/00043494.htm|title=Pneumocystis Pneumonia – Los Angeles|work=|accessdate=2008-05-05|archiveurl=https://www.webcitation.org/67yHfzGkG?url=http://www.cdc.gov/MMWR/preview/mmwrhtml/00043494.htm|archivedate=2012-05-27|deadurl=no}}</ref> |
|||
ВІЛ-2 виник на території [[Західна Африка|Західної Африки]] (від південного [[Сенегалу]] до заходу [[Кот-д'Івуар]]у) внаслідок еволюції вірусу імунодефіциту мавп SIV-smm, який заражає темно-коричневих мангабеїв (''[[Cercocebus atys]]'') і [[Вузьконосі|вузьконосих мавп]].<ref name=Reeves>{{cite journal | author=Reeves, J. D. and Doms, R. W | title=Human Immunodeficiency Virus Type 2 | journal=J. Gen. Virol. | year=2002 | pages=1253–1265 | volume=83 | issue=Pt 6 | pmid= 12029140 | doi=10.1099/vir.0.18253-0}}</ref> Проте деякі [[широконосі мавпи]], такі як нічні мавпи є стійкими до ВІЛ-1, можливо, через геномне злиття двох вірусних генів стійкості.<ref name=Goodier>{{cite journal | author=Goodier, J., and Kazazian, H. | title=Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites | journal=Cell | year=2008 | pages=23–35 | volume=135 | issue=1 | doi = 10.1016/j.cell.2008.09.022 | pmid=18854152}}</ref> ВІЛ-1, як вважають, перестрибнув видовий бар'єр, принаймні тричі, і породив три групи вірусів: M, N і О.<ref name=Sharp2001>{{cite journal |last1=Sharp |first1=P. M. |last2=Bailes |first2=E. |last3=Chaudhuri |first3=R. R. |last4=Rodenburg |first4=C. M. |last5=Santiago |first5=M. O. |last6=Hahn |first6=B. H. |title=The origins of acquired immune deficiency syndrome viruses: where and when? |journal=Philosophical Transactions of the Royal Society B: Biological Sciences |volume=356 |pages=867–76 |year=2001 |doi=10.1098/rstb.2001.0863 |pmid=11405934 |pmc=1088480 |url=http://www.aidsorigins.com/pdfs/rs/sharp.pdf |issue=1410 |archiveurl=https://web.archive.org/web/20071025023136/http://www.aidsorigins.com/pdfs/rs/sharp.pdf |archivedate=2007-10-25 |accessdate=2012-02-04 |deadurl=yes }}</ref> |
|||
Існує доказ того, що |
Існує доказ того, що мисливці на диких тварин (мавп) або постачальники м'яса в Західній і Центральній Африці заражаються вірусом імунодефіциту мавп, причому ймовірність зараження [[Кореляція і залежність|корелює]] з частотою взаємодії з мавпами і їх м'ясом.<ref name=Kalish2005>{{cite journal |author=Kalish ML, Wolfe ND, Ndongmo CD, McNicholl J, Robbins KE, ''et al.'' |title=Central African hunters exposed to simian immunodeficiency virus |journal=Emerg Infect Dis |volume=11 |issue=12 |pages=1928–30 |year=2005 |pmid=16485481}}</ref> Однак це слабкий вірус і зазвичай його пригнічує імунна системою людини протягом тижня після зараження. Вважають, що потрібно кілька передач вірусу від людини до людини в швидкій послідовності, щоб вірусу вистачило часу мутувати у ВІЛ.<ref name=Marx2001>{{cite journal |author=Marx PA, Alcabes PG, Drucker E |title=Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa |volume=356 |issue=1410 |pages=911–20 |year=2001 |pmid=11405938 |journal=Philos Trans R Soc Lond B Biol Sci |pmc=1088484 |doi=10.1098/rstb.2001.0867 |url=http://rstb.royalsocietypublishing.org/content/356/1410/911.full.pdf}}</ref>. Хоча передавання вірусу імунодефіциту мавп від людини до людини відбувається рідко, певні соціальні чинники можуть суттєво впливати на частоту заражень. Припускають, що умови для поширення вірусу були несприятливі в Африці до XX століття. Зіставлення періодів прискореної еволюції ВІЛ з соціо-економічними змінами дозволяє робити припущення про природу чинників, що прискорили поширення ВІО і ВІЛ. |
||
Генетичні дослідження показують, що останній спільний предок ВІЛ-1 групи М існував близько 1910 року<ref name=Worobey2008>{{cite journal |last1=Worobey |first1=Michael |last2=Gemmel |first2=Marlea |last3=Teuwen |first3=Dirk E. |last4=Haselkorn |first4=Tamara |last5=Kunstman |first5=Kevin |last6=Bunce |first6=Michael |last7=Muyembe |first7=Jean-Jacques |last8=Kabongo |first8=Jean-Marie M. |last9=Kalengayi |first9=Raphaël M. |title=Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960 |journal=Nature |volume=455 |issue=7213 |pages=661–4 |year=2008 |pmid=18833279 |doi=10.1038/nature07390 |url=http://nsm1.nsm.iup.edu/luciano/VWS%20STUFF/Unit%206%202010/VWS%202010%20DRC60.pdf |bibcode=2008Natur.455..661W |accessdate=4 лютий 2012 |archiveurl=https://web.archive.org/web/20120113060138/http://nsm1.nsm.iup.edu/luciano/VWS%20STUFF/Unit%206%202010/VWS%202010%20DRC60.pdf |archivedate=13 січень 2012 |deadurl=yes }}</ref>. Прихильники цієї дати пов'язують поширення ВІЛ з розвитком [[колоніалізм]]у і зростанням великих колоніальних африканських міст. Ці чинники призвели до соціальних змін у суспільстві, як-от збільшення частоти безладних статевих зв'язків, поширення [[Проституція|проституції]] та [[Хвороби, що передаються статевим шляхом|захворювань, що передаються статевим шляхом]] (ЗПСШ)<ref name=Sousa2010>{{cite journal |last1=Sousa |first1=João Dinis de |last2=Müller |first2=Viktor |last3=Lemey |first3=Philippe |last4=Vandamme |first4=Anne-Mieke |last5=Vandamme |first5=Anne-Mieke |title=High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains |journal=PLoS ONE |volume=5 |issue=4 |pages=e9936 |year=2010 |pmid=20376191 |pmc=2848574 |doi=10.1371/journal.pone.0009936|url=http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0009936 |editor1-last=Martin |editor1-first=Darren P.}}</ref>. ЗПСШ, наприклад, [[сифіліс]], можуть супроводжуватися генітальними виразками. Дослідження показують, що ймовірність передачі ВІЛ під час вагінального статевого акту, досить низька за звичайних умов, може збільшитись у десятки, якщо не сотні разів, коли один з партнерів потерпає від генітальних виразок. Про ступінь поширеності ЗПСШ у колоніальних містах на початку 1900-х можна судити з таких цифр: 1928 року щонайменше 45 % мешканок східного Леопольдвіля (нині — [[Кіншаса]], ранній центр поширення ВІЛ групи М) були повіями, а 1933 року близько 15 % усіх мешканців цього ж міста були заражені однією з форм сифілісу. Ретроспективний аналіз показав, що початок епідемії ВІЛ-інфекції в Кіншасі збігся з піком епідемії генітальних виразок у середині 1930-х років<ref name=Sousa2010 />. |
|||
Згідно з альтернативним поглядом, основним чинником, що сприяв адаптації ВІЛ до людей і його поширенню, була небезпечна медична практика в Африці в роки після [[Друга світова війна|Другої світової війни]], як-от використання нестерильних багаторазових шприців під час масових [[Вакцини|вакцинацій]], ін'єкції [[Антибіотики|антибіотиків]] і протималярійних засобів<ref name=Marx2001 /><ref name=Chitnis2000>{{cite journal |last1=Chitnis |first1=Amit |last2=Rawls |first2=Diana |last3=Moore |first3=Jim |title=Origin of HIV Type 1 in Colonial French Equatorial Africa? |journal=AIDS Research and Human Retroviruses |volume=16 |issue=1 |pages=5–8 |year=2000 |pmid=10628811 |doi=10.1089/088922200309548}}</ref><ref name=McNeil>{{cite news |author=[[Donald G. McNeil, Jr.]] |coauthors= |title=Precursor to H.I.V. Was in Monkeys for Millennia |url=http://www.nytimes.com/2010/09/17/health/17aids.html?_r=1&src=me&ref=general |quote=Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. ... suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.|work=[[New York Times]] |date=September 16, 2010 |accessdate=2010-09-17 }}</ref>. |
|||
Під час ретроаналізу зразків крові, взятих після Другої світової війни, зафіксовано найбільш ранній документальний випадок наявності ВІЛ в організмі людини, кров у якої взяли 1959 року<ref name=Zhu>{{cite journal|author=Zhu, T., Korber, B. T., Nahmias, A. J., Hooper, E., Sharp, P. M. and Ho, D. D.|title=An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic|journal=Nature|year=1998|pages=594–7|volume=391|issue=6667|pmid=9468138|doi=10.1038/35400 |url=http://www.nature.com/nature/journal/v391/n6667/full/391594a0.html|bibcode = 1998Natur.391..594Z }}</ref> Вірус, можливо, був присутній в Сполучених Штатах уже в 1966 році<ref>{{cite news | last = Kolata | first = Gina | title = Boy's 1969 Death Suggests AIDS Invaded U.S. Several Times | publisher = [[The New York Times]] | date = 28 October 1987 | url = http://query.nytimes.com/gst/fullpage.html?res=9B0DEFD6173AF93BA15753C1A961948260&sec=health&pagewanted=all | accessdate = 11 February 2009}}</ref>, але переважну більшість випадків зараження ВІЛ, ідентифікованих за межами тропічної Африки, можна простежити до однієї невстановленої особи, яка заразилась ВІЛ на [[Гаїті]], а потім перенесла цю інфекцію в США близько 1969 року<ref name="Thomas_Gilbert">{{cite web|url=http://statistics.arizona.edu/courses/EEB320-2007/honors/HIV.pdf|title=The emergence of HIV/AIDS in the Americas and beyond|deadurl=yes|archiveurl=https://web.archive.org/web/20120328094817/http://statistics.arizona.edu/courses/EEB320-2007/honors/HIV.pdf|archivedate=2012-03-28|accessdate=2012-02-04}}</ref>. |
|||
Порівняно нещодавно виникла ще одна гіпотеза, автором якої є Е. Хупеору{{Джерело}}: вірус з‘явився на початку 50-х років минулого сторіччя, як наслідок помилки науковців, які працювали над створенням вакцини від поліомієліту. Помилка була в тому, що для виробництва вакцини використовувалися клітини печінки шимпанзе, які, ймовірно, містили вірус, аналогічний ВІЛ. Одним з найвагоміших аргументів на користь гіпотези є той факт, що вакцину тестували саме в тих районах Африки, де на сьогодні найвищий рівень інфікування вірусом імунодефіциту. |
|||
=== Відкриття === |
=== Відкриття === |
||
Взимку 1981 року до госпіталю [[Нью-Йоркський університет|Нью-Йоркського університету]] поступило декілька молодих чоловіків, близько 30 років, з незнайомою формою [[саркома Капоші|саркоми Капоші]]. В той час це захворювання |
Взимку 1981 року до госпіталю [[Нью-Йоркський університет|Нью-Йоркського університету]] поступило декілька молодих чоловіків, близько 30 років, з незнайомою формою [[саркома Капоші|саркоми Капоші]]. В той час це захворювання траплялося досить рідко: всього 1-2 випадки на 10 мільйонів населення, переважно в людей похилого віку. Саркома мала злоякісний перебіг: пухлини поширювалися по всьому тілу, виявлялися на слизових оболонках, не піддавалися лікуванню й швидко призводили до смерті. |
||
Навесні 1981 року в Лос-Анджелесі з'явилася ще одна категорія незвичайних хворих — зі злоякісною формою [[пневмоцистна пневмонія|пневмоцистної пневмонії]]. У 3-х з них пневмоцистне запалення легень супроводжувалося [[кандидоз]]ом. |
Навесні 1981 року в Лос-Анджелесі з'явилася ще одна категорія незвичайних хворих — зі злоякісною формою [[пневмоцистна пневмонія|пневмоцистної пневмонії]]. У 3-х з них пневмоцистне запалення легень супроводжувалося [[кандидоз]]ом. |
||
Влітку 1981 р. у Центр контролю за захворюваннями США в Атланті надійшла інформація вже про 111 пацієнтів з подібним захворюванням. Майже усі вони виникли у чоловіків молодого віку і усі ці особи були [[гомосексуальність|гомосексуалами]]. |
Влітку 1981 р. у Центр контролю за захворюваннями США в Атланті надійшла інформація вже про 111 пацієнтів з подібним захворюванням. Майже усі вони виникли у чоловіків молодого віку і усі ці особи були [[гомосексуальність|гомосексуалами]]. |
||
Висока смертність спонукала організувати обов'язковий облік, спостереження й вивчення усіх випадків нової хвороби. |
Висока смертність спонукала організувати обов'язковий облік, спостереження й вивчення усіх випадків нової хвороби. |
||
Появу цих захворювань у молодих людей, що не належать до відповідних груп ризику, спостерігали вперше. Потім виявили такі ж симптоми серед [[Наркоманія|наркоспоживачів]], хворих на [[Гемофілія|гемофілію A]]<ref>{{Стаття|видання=MMWR Morb. Mortal. Wkly. Rep.|номер=27|сторінки=365—367|мова=en|тип=journal|місяць=7|рік=1982}}</ref>, і [[Гаїті|гаїтян]]<ref>{{Стаття|видання=MMWR Morb. Mortal. Wkly. Rep.|номер=26|сторінки=353—354|мова=en|тип=journal|місяць=7|рік=1982}}</ref><ref name="pmid16873641">{{Стаття|видання=Science|номер=5786|сторінки=470—473|мова=en|тип=journal|автор=Cohen J.|рік=2006}}</ref>. Найбільш значущим було виявлення зниження співвідношення [[CD4|CD4<sup>+</sup>]]/[[CD8|CD8<sup>+</sup>]]-клітин внаслідок відносного і/або абсолютного зменшення кількості CD4<sup>+</sup>-лімфоцитів у поєднанні зі збільшенням кількості CD8<sup>+</sup>-лімфоцитів<ref name="MMWR1982a">{{Стаття|видання=MMWR Morb Mortal Wkly Rep.|номер=19|сторінки=249—251|accessdate=2011-08-31|мова=en|тип=journal|автор=Centers for Disease Control (CDC)|рік=1982}}</ref><ref name="Barre">{{Стаття|видання=Science|номер=4599|сторінки=868—871|bibcode=1983Sci...220..868B|мова=en|тип=journal|автор=Barré-Sinoussi F., Chermann J.C., Rey F., Nugeyre M.T., Chamaret S., Gruest J., Dauguet C., Axler-Blin C., Vézinet-Brun F., Rouzioux C., Rozenbaum W., Montagnier L;|рік=1983}}</ref>. |
|||
Літо 1981 року прийнято вважати початком глобальної епідемії СНІДу. Ретроспективний аналіз сироваток, що зберігалися в Національному Центрі контролю за інфекційними захворюваннями в [[США]], показав, що перші випадки СНІД людини відносяться до 50-х років ХХ сторіччя, захворювання виникло в Африці, а потім поширилося на території інших країн. |
Літо 1981 року прийнято вважати початком глобальної епідемії СНІДу. Ретроспективний аналіз сироваток, що зберігалися в Національному Центрі контролю за інфекційними захворюваннями в [[США]], показав, що перші випадки СНІД людини відносяться до 50-х років ХХ сторіччя, захворювання виникло в Африці, а потім поширилося на території інших країн. |
||
Основою раніше невідомого захворювання було різке ослаблення [[імунітет]]у. У липні 1982 року для позначення цього стану запропоновано термін [[СНІД|синдром набутого імунного дефіциту]] (СНІД, AIDS)<ref>{{Cite web|url=http://www.avert.org/his81_86.htm|title=The history of AIDS 1981—1986|publisher=AVERT|language=en|accessdate=2014-07-21}}</ref>. У вересні 1982 року СНІДу дали повноцінне визначення як [[Нозологія|нозологічній]] формі на підставі спостереження низки опортуністичних інфекцій у чотирьох груп пацієнтів, зазначених вище<ref name="av1986">{{Cite web|url=http://www.avert.org/history-aids-1986.htm|title=History of AIDS Up to 1986|publisher=AVERT|language=en|accessdate=2014-07-21}}</ref><ref>{{Cite pmid|6815471}}</ref>. |
|||
== Епідемія ВІЛ/СНІДу == |
|||
У період з 1981 по 1984 рік вийшло кілька робіт, що пов'язували ймовірність розвитку СНІДу з [[Анальний секс|анальним сексом]] або з впливом [[наркотик]]ів<ref>{{Cite pmid|6272109}}</ref><ref>{{Cite pmid|6272112}}</ref><ref>{{Cite pmid|6121088}}</ref><ref>{{Cite pmid|6603806}}</ref><ref>{{Cite pmid|6143974}}</ref><ref>{{Cite pmid|6150466}}</ref>. Паралельно йшли роботи над гіпотезою про можливу інфекційну природу СНІДу. |
|||
Вірус імунодефіциту людини незалежно відкрили 1983 року в двох лабораторіях: у [[Інститут Пастера|Інституті Пастера]] у [[Франція|Франції]] під керівництвом [[Люк Монтаньє|Люка Монтаньє]] і в [[Національний інститут раку (США)|Національному інституті раку]] в [[Сполучені Штати Америки|США]] під керівництвом [[Галло, Роберт|Роберта Галло]]. Результати досліджень, у яких із тканин пацієнтів з [[Медична семіотика|симптомами]] СНІДу вперше вдалося виділити новий [[Ретровіруси|ретровірус]], опубліковано 20 травня 1983 року в журналі [[Science]]<ref name="Barre-Sinoussi et al">{{Cite pmid|6189183}}</ref><ref name="Gallo">{{Cite pmid|6601823}}</ref>. У цих же роботах виділений з хворих на Снід вірус був вперше успішно розмножили у культивованих Т-лімфоцитах. Французька група дослідників показала, що серологічно цей вірус відрізняється від HTLV-I, і назвала його LAV («вірус, асоційований з [[Лімфаденіт|лімфаденопатією]]<nowiki/>»), а американська група назвала його HTLV-III, помилково віднісши до групи [[Human T-lymphotropic virus|HTLV-вірусів]]. Дослідники висунули припущення, що вірус може викликати синдром набутого імунного дефіциту<ref name="av1986">{{Cite web|url=http://www.avert.org/history-aids-1986.htm|title=History of AIDS Up to 1986|publisher=AVERT|language=en|accessdate=2014-07-21}}</ref>. |
|||
1986 року виявлено, що віруси, відкриті 1983-го французькими та американськими дослідниками, генетично ідентичні. Початкові назви вірусів скасовано і запропоновано одну спільну назву — вірус імунодефіциту людини<ref>{{Cite pmid|3010128}}</ref>. 2008 року [[Люк Монтаньє]] і [[Франсуаза Барре-Сінуссі|Франсуаза Барр-Сінуссі]] удостоєні [[Список лауреатів Нобелівської премії з фізіології або медицини|Нобелівської премії в області фізіології або медицини]] «за відкриття вірусу імунодефіциту людини»<ref>{{Cite web|url=http://www.nobelprize.org/nobel_prizes/medicine/laureates/2008/press.html|title=The Nobel Prize in Physiology or Medicine 2008 Press Release|quote=Harald zur Hausen, Françoise Barré-Sinoussi, Luc Montagnier|language=en|accessdate=2014-07-21}}</ref>. |
|||
== ВІЛ-інфекція == |
|||
=== Інфікування === |
|||
Вірус може передаватися через прямий контакт пошкодженої або непошкодженій [[Слизова оболонка|слизової оболонки]] або пошкодженої [[Шкіра|шкіри]] здорової людини з біологічними рідинами зараженої людини: [[Кров|кров'ю]], [[Передеякулят|передсіменною рідиною]] (виділяється протягом всього статевого акту), [[Сперма|спермою]], секретом [[Піхва жінки|піхви]], [[Грудне молоко|грудним молоком]]. Вірус може передаватись під час незахищеного [[Анальний секс|анального]], [[Вагінальний секс|вагінального]] або [[Оральний секс|орального]] сексу<ref name="Levy">{{Книга|автор=Levy J.A.|видавництво=USA: American Society for Microbiology|рік=2007|isbn=978-1-55581-393-2}}</ref><ref>{{Cite pmid|9833850}}</ref>. |
|||
Інтактна, неушкоджена шкіра є ефективним бар'єром для інфекції, тому що в шкірі відсутні клітини, які можуть бути заражені ВІЛ. Для успішного інфікування потрібен прямий контакт з кровоносною системою або з мембранами клітин слизових оболонок. Під час статевого акту слизові оболонки статевих органів і прямої кишки часто зазнають незначних пошкоджень, через які вірус може потрапляти в кров. Такі пошкодження частіше виникають за наявності захворювань, що передаються статевим шляхом, наприклад, у разі герпесу. Тому особливо небезпечною формою статевого акту для партнера, що приймає, є незахищений анальний секс, бо за цієї форми виникає найбільша кількість дрібних і великих пошкоджень<ref>{{Cite pmid|21309617}}</ref><ref>{{Cite web|url=http://www.aidsmap.com/Route-and-susceptibility-mucous-membranes-and-target-cells/page/1324028/|title=From exposure to infection: The biology of HIV transmission|language=en|last=James Wilton|accessdate=2014-09-10|archiveurl=https://web.archive.org/web/20140910195457/http://www.aidsmap.com/Route-and-susceptibility-mucous-membranes-and-target-cells/page/1324028/|archivedate=2014-09-10|deadlink=yes}}</ref>. З іншого боку, зараження можливе і в разі непошкодженої слизової оболонки, оскільки слизова оболонка містить значну кількість дендритних клітин (зокрема, клітин Лангерганса), які можуть відігравати роль «носіїв» вірусних частинок у лімфатичні вузли. |
|||
З більшою ймовірністю вірус передається внаслідок використання заражених голок та шприців (особливо споживачами ін'єкційних наркотиків), а також під час [[переливання крові]] (якщо медичний персонал порушив встановлені процедури перевірки донорської крові)<ref name="bartlett2008">{{Книга|автор=Jpnh G Bartlett.|видавництво=Медицинская школа Университета Джонса Хопкинса|рік=2008|сторінок=138}}</ref>. Також вірус може передатись від матірі до дитини під час [[Вагітність у тварин|вагітності]], [[Пологи|пологів]] (зараження через кров матері)<ref>{{Cite pmid|11981365}}</ref><ref>{{Cite web|url=http://aidsinfo.nih.gov/ContentFiles/PerinatalGL.pdf|title=Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States|date=2006-10-12|publisher=AIDSinfo.nih.gov|language=en|accessdate=2014-07-21}}</ref> та під час [[Грудне вигодовування|грудного вигодовування]] (причому і від зараженої матері до здорової дитини через грудне молоко, і від зараженої дитини до здорової матері внаслідок покусування грудей під час годування)<ref>{{Книга|автор=Всемирная организация здравоохранения|рік=2007|isbn=9789241596596}}</ref>. |
|||
Вірус не передається повітряно-крапельним шляхом, побутовим шляхом, стикаючись з непошкодженою шкірою, через укуси більшості кровосисних [[Комахи|комах]]<ref>{{Cite pmid|12062985}}Цитата: «<u>Most bloodsucking insects are not capable of transmitting HIV</u> because they inject saliva and ingest blood through different routes»</ref> (виняток мухи-жигалки), [[сльози]] і [[Слина|слину]] (через те, що концентрація [[Віріон|віріонів]] ВІЛ у цих рідинах нижча за [[Інфікуються доза|інфікувальну дозу]], а також завдяки тому, що слина — агресивне середовище, руйнує своїми [[Ферменти|ферментами]] [[Віріон|віріони]] ВІЛ)<ref name="Saliva">{{Cite web|url=https://www.cdc.gov/HIV/pubs/facts/transmission.htm|title=HIV Transmission|last=CDC|language=en|accessdate=2014-07-21|archiveurl=https://web.archive.org/web/20050204141148/http://www.cdc.gov/HIV/pubs/facts/transmission.htm|archivedate=2005-02-04}} {{Cite web|url=http://www.hivlawandpolicy.org/sites/www.hivlawandpolicy.org/files/CDC%2C%20HIV%20and%20its%20transmission.pdf|title=HIV and Its Transmission|last=Centers for Disease Control and Prevention|publisher=The Center for HIV Law and Policy|language=en|description=Разоблачение мифов о передаче ВИЧ бытовым путём, при поцелуях, укусах, через слюну, слёзы и др.|accessdate=2014-07-21}} {{Cite web|url=http://aids.gov/hiv-aids-basics/hiv-aids-101/how-you-get-hiv-aids/|title=HOW DO YOU GET HIV OR AIDS?|last=aids.gov|publisher=U.S. Department of Health & Human Services|language=en|accessdate=2014-07-21}} {{Cite pmid|9989543}}</ref>. |
|||
=== Хвороба === |
|||
[[Файл:Hiv-timecourse_copy_rus.png|міні|400x400пкс|Динаміка кількості CD4<sup>+</sup>-лімфоцитів та копій РНК вірусу за період від моменту інфікування до термінальної стадії<ref>Приведено согласно Figure 1, опубликованной в {{Стаття|видання=New England Journal of Medicine|номер=5|сторінки=327—335|мова=en|тип=journal|автор=Pantaleo, G et al.|число=4|місяць=2|рік=1993}}, также доступнка Figure 4 в {{Cite web|title=The relationship between the human immunodeficiency virus and the acquired immunodeficiency syndrome|publisher=US National Institute of Allergy and Infectious Diseases|language=en|accessdate=2009-11-03|url=http://www3.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/relationshipHIVAIDS.htm|deadlink=404|archiveurl=https://web.archive.org/web/20091130070900/http://www3.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/relationshipHIVAIDS.htm|archivedate=2009-11-30}} Дополнительная информация опубликована в {{Стаття|видання=Science|номер=510|сторінки=1749—1754|мова=en|тип=journal|автор=Piutak, M et al.|число=19|місяць=3|рік=1993}}</ref> кількість CD4+лімфоцитів в 1 мкл крові кількість копій РНК вірусу в 1 мл плазми крові]] |
|||
У перебігу хвороби виділяють три стадії: гостру інфекцію, латентний період і термінальну стадію ([[СНІД]]) (див. ілюстрацію). У ході розвитку [[ВІЛ-інфекція|ВІЛ-інфекції]] у однієї й тієї ж людини внаслідок [[Мутація|мутацій]] виникають нові [[Штам|штами]] вірусу, які різняться за швидкістю відтворення та здатністю інфікувати<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref><ref name="Alimonti">{{Стаття|title=Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS.|видання={{Нп3|Journal of General Virology}}|сторінки=1649—1661|номер=7|мова=en|тип=journal|автор=Alimonti J.B., Ball T.B., Fowke K.R.|рік=2003|видавництво={{Нп3|Microbiology Society}}}}</ref>. Розмножившись, вірусні частинки вивільняються з уражених клітин і впроваджуються в нові — цикл розвитку повторюється. Інфіковані вірусом [[Т-хелпери]] поступово гинуть через руйнування вірусом, [[Апоптоз|апоптозу]] або знищення [[Цитотоксичні Т-лімфоцити|Т-кілерами]]. У процесі розвитку ВІЛ-інфекції кількість Т-хелперів (CD4<sup>+</sup>-клітин) знижується настільки, що організм вже не може протистояти збудників [[Опортуністична інфекція|опортуністичних інфекцій]], які безпечні або мало небезпечні для здорових людей з нормально функціонуючої [[Імунна система|імунної системою]]. На термінальній стадії (СНІД) ослаблений організм вражають [[Бактеріальні інфекції|бактеріальні]], [[Мікоз|грибкові]], [[Вірусні захворювання|вірусні]] і [[Протозойні хвороби|протозойні інфекції]], а також [[Пухлина|пухлини]]<ref name="Holmes">{{Стаття|title=Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa|видання=Clin. Infect. Dis.|сторінки=656‐662|номер=5|мова=en|тип=journal|автор=Holmes C.B., Losina E., Walensky R.P., Yazdanpanah Y., Freedberg K.A.|рік=2003}}</ref><ref name="Guss">{{Стаття|title=The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1|видання=J. Emerg. Med.|сторінки=375—384|номер=3|мова=en|тип=journal|автор=Guss D.A.|рік=1994}}</ref><ref name="Guss2">{{Стаття|title=The acquired immune deficiency syndrome: an overview for the emergency physician, Part 2|видання=J. Emerg. Med.|сторінки=491—497|номер=4|мова=en|тип=journal|автор=Guss D.A.|рік=1994}}</ref>. У відсутність антиретровірусної терапії смерть пацієнта настає не в результаті розмноження вірусу в CD4<sup>+</sup>-клітинах, а з причини розвитку опортуністичних захворювань (вторинних по відношенню до ВІЛ-інфекції). |
|||
=== Епідеміологія === |
|||
[[Файл:HIV Epidem.png|міні|праворуч|300пкс|Ураженість ВІЛом дорослого населення віком від 15 до 49 р. по країнах станом на [[2008]]]] |
[[Файл:HIV Epidem.png|міні|праворуч|300пкс|Ураженість ВІЛом дорослого населення віком від 15 до 49 р. по країнах станом на [[2008]]]] |
||
{{оновити|розділ|дата=лютий 2018}} |
{{оновити|розділ|дата=лютий 2018}} |
||
| Рядок 70: | Рядок 93: | ||
Серед світових антилідерів за зростанням відносного показника нових захворювань у 2005—2015 роках опинилися також Єгипет, Пакистан, Кенія, Філіппіни, Мексика та Камбоджа. Загалом кількість нових інфікувань за 10 років в середньому падала лише на 0,7 відсотка на рік порівняно із річним спадом на 2,7 відсотка у 1997—2005 роках. Дослідники занепокоєні, що через це світові зусилля з подолання епідемії ВІЛ/СНІДу до 2030 року можуть зійти нанівець. |
Серед світових антилідерів за зростанням відносного показника нових захворювань у 2005—2015 роках опинилися також Єгипет, Пакистан, Кенія, Філіппіни, Мексика та Камбоджа. Загалом кількість нових інфікувань за 10 років в середньому падала лише на 0,7 відсотка на рік порівняно із річним спадом на 2,7 відсотка у 1997—2005 роках. Дослідники занепокоєні, що через це світові зусилля з подолання епідемії ВІЛ/СНІДу до 2030 року можуть зійти нанівець. |
||
За даними на 2011 рік, у світі за весь час на [[ВІЛ-інфекція|ВІЛ-інфекцію]] захворіли 60 мільйонів осіб, з них: 25 мільйонів померли, а 35 мільйонів живуть з ВІЛ-інфекцією<ref>{{Cite web|url=http://ria.ru/press_video/20111130/502694336.html|title=Борьба со СПИД в России: как остановить болезнь?|last=|date=2011-11-30|publisher=РИА Новости|accessdate=2013-06-16|language=ru|archiveurl=https://www.webcitation.org/6HPmSydu1?url=http://ria.ru/press_video/20111130/502694336.html|archivedate=2013-06-16}}</ref>. Понад дві третини з них мешкають в [[Африка|Африці]] на південь від пустелі [[Сахара]]<ref name="autogenerated4">{{Cite web|url=http://www.unaids.org/en/media/unaids/contentassets/documents/unaidspublication/2011/JC2216_WorldAIDSday_report_2011_en.pdf|title=UNAIDS World AIDS Day Report 2011|last=|date=2011|publisher=UNAIDS World AIDS|accessdate=2013-06-16|language=en|archiveurl=https://www.webcitation.org/6HPmXpInY?url=http://www.unaids.org/en/media/unaids/contentassets/documents/unaidspublication/2011/JC2216_WorldAIDSday_report_2011_en.pdf|archivedate=2013-06-16}}</ref>. [[Епідемія]] почалася тут наприкінці 1970-х — на початку 1980-х років. Потім епідемія перекинулася в [[Сполучені Штати Америки|США]], [[Західна Європа|Західну Європу]] та країни [[Південна Африка|Південної Африки]]. Сьогодні, за винятком країн Африки, найшвидше вірус поширюється в [[Центральна Азія|Центральній Азії]] та [[Східна Європа|Східній Європі]] (зокрема в Росії). [[Епідемія|Епідемічна]] ситуація в цих регіонах стримувалася до кінця 1990-х, потім з [[1999]] по [[2002|2002 роки]] кількість інфікованих майже потроїлася — здебільшого за рахунок ін'єкційних наркоманів. Значно нижче середнього ВІЛ-інфекція поширена в [[Східна Азія|Східній Азії]], [[Північна Африка|Північній Африці]] і на [[Близький Схід|Близькому Сході]]. У масштабі планети епідемічна ситуація стабілізувалася, кількість нових випадків ВІЛ-інфекції знизилася з 3,5 мільйонів 1997 року до 2,7 мільйонів 2007 року. |
|||
== Будова вірусу == |
|||
Головна стаття: [[будова ВІЛ]] |
|||
=== Діагностика === |
|||
[[Файл:HI-virion.jpg|міні|ліворуч|200пкс|Структура віріону ВІЛ-1: 1 — [[РНК]]-геном; 2 — нуклеокапсид; 3 — [[капсид]]; 4 — білковий матрикс; 5 — мембрана (частина клітинної); 6 — gp120 — [[глікопротеїн]], що зв'язується з рецептором клітини; 7 — gp41 — трансмембранний глікопротеїн, відповідальний за злиття мембран; 8 — інтеграза (вклинення ДНК-копії геному вірусу в клітинний геном); 9 — [[зворотна транскриптаза]] (стимулює генерацію ДНК-копії вірусної РНК); 10 — Vif, Vpr (сприяє інфектуванню клітин не здатних до поділу), Nef и p7 (захищає РНК, відповідає за розпізнавання вірусної РНК на стадії зборки нового вірусу); 11 — [[протеаза]]]] |
|||
Аналіз крові дозволяє виявити [[антитіла]] до [[Білки|білків]] вірусу ([[Імуноферментний аналіз (ELISA)|ІФА]]), реакцію антитіл на білки вірусу ([[вестерн-блот]]), [[РНК]] вірусу ([[ВІД-ПЛР|ЗТ-ПЛР]])<ref>{{Cite web|url=http://hivtest.cdc.gov/faq.aspx#tests|title=National HIV and STD Testing Resources|publisher=Centers for Disease Control and Prevention|language=en|accessdate=2014-07-21}}</ref>. Визначення [[Вірусне навантаження|вірусного навантаження]] (підрахунок кількості копій РНК вірусу в мілілітрі [[Плазма крові|плазми крові]]) дозволяє судити про стадію захворювання та ефективність лікування<ref>{{Cite web|url=http://www.aids.gov/hiv-aids-basics/just-diagnosed-with-hiv-aids/understand-your-test-results/viral-load/|title=Just Diagnosed with HIV AIDS: Understand Your Test Results: Viral Load|last=aids.gov|publisher=U.S. Department of Health & Human Services|language=en|accessdate=2014-07-21}}</ref><ref>{{Cite web|url=http://www.webmd.com/hiv-aids/human-immunodeficiency-virus-hiv-test|title=Human Immunodeficiency Virus (HIV) Test|last=WebMD Medical Reference from Healthwise|publisher=Healthwise|language=en|accessdate=2014-07-21}}</ref>. |
|||
Обов'язкова перевірка [[Донорська здача крові|донорської крові]] в розвинених країнах значною мірою скоротила можливість передачі вірусу через неї. Тестування на ВІЛ вагітних жінок дозволяє своєчасно розпочати вживання ліків і народити здорову дитину. |
|||
[[Віріон]] має сферичну форму діаметром приблизно 120 нм. Всередині міститься яйцевидна капсида, в якій розміщено 2 копії вірусної РНК (по 9700 основ). Всього вірус кодує 14 протеїнів. |
|||
Існує думка, що примусове тестування населення безперспективне з погляду стримування епідемії<ref>{{Cite web|url=http://xn--b1am9b.xn--p1ai/test_na_vich.html|title=ВИЧ.рф тест на ВИЧ|language=ru|accessdate=2014-09-12}}</ref> і порушує [[права людини]]<ref>{{Cite web|url=http://www.who.int/mediacentre/factsheets/fs360/ru/|title=ВИЧ/СПИД: Тестирование и консультирование|language=ru|accessdate=2014-09-12}}</ref>. У Росії проведення тесту без згоди людини є незаконним<ref>{{Cite web|url=http://www.rg.ru/1993/08/19/osnovy-zdorovya-dok.html|title=Федеральный закон от 22 июля 1993 г. № 5487-1 "Основы законодательства Российской Федерации об охране здоровья граждан" 0|publisher=Российская газета|accessdate=2014-07-21}}</ref>, однак існують ситуації, в яких надання результатів тестування на ВІЛ є обов'язковим, але не насильницьким (донорство, працевлаштування медичних працівників, для іноземних громадян, які отримують дозвіл на перебування в РФ, в місцях позбавлення волі за наявності клінічних показань)<ref>{{Cite web|url=http://www.aids.ru/law/law_05.shtml|title=Тест на ВИЧ с точки зрения права|publisher=Николай Недзельский|accessdate=2014-07-21}}</ref>. |
|||
== Генетична мінливість та різноманітність == |
|||
[[Файл:HIV-SIV-phylogenetic-tree.svg|міні|праворуч|200пкс|Підтипи ВІЛ та споріднених вірусів довжина ліній пропорційна ступеню генетичної відмінності]] |
|||
=== Лікування === |
|||
Висока мінливість вірусу <small>(0,003 %/на нуклеїнову основу/цикл реплікації)</small> ВІЛ є однією з причин, що сильно ускладнюють розробку [[ретровіруси|антиретровірусних]] ліків. |
|||
Один з підвидів навіть виділяють як окремий вірус (HIV-2) на противагу «класичному» HIV-1. |
|||
[[Файл:HIV life cycle.gif|міні|ліворуч|200пкс|Життєвий цикл вірусу ВІЛ-1. Цифрами позначено: 1)Злииття вірусної та клітинної мембран; 2) Зворотна транскрипція (вірусної [[РНК]] в [[ДНК]]) під дією RT([[Зворотна транскриптаза]]); 3)проходження утвореної вірусної ДНК в [[ядро клітини]] та інтеграція в клітинний [[геном]] (каталізується Інтегразою (IN); 4)[[Транскрипція (біологія)|транскрипція]] з утворенням спочатку укороченних РНК, що кодують білки вірусу (spliced RNA), а на пізніших стадіях й повномірної вірусної РНК; 5) [[Трансляція (біологія)|трансляція]] вірусних білків [[рибосома|рибосомним]] механізмом клітини; 6) Організація нового віріону на мембрані, розпізнавання вірусної РНК NC доменом поліпротеїну GAG та відбрунькування молодого віріону; 7)формування (maturation) повноцінного віріону (розщеплення GAG [[протеаза|протеазою]] (PR), формування капсиди]] |
|||
== Життєвий цикл вірусу == |
|||
Після потрапляння в організм людини ВІЛ проникає в клітини-мішені — Т-лімфоцити (CD4), які виконують регуляторну роль в імунній відповіді. Крім цього, ВІЛ здатний проникати в інші клітини, що обумовлює залучення в патологічний процес різних органів і систем. Геном ВІЛ, включений до геному клітини-господаря, носить назву «провірусу». ВІЛ має високу активність, продукуючи 1010 вірусних часток щодня. Якщо пацієнт отримує недостатньо ефективну антиретровірусну терапію формуються варіанти вірусу, стійкі до препаратів. При «природному перебігу» ВІЛ інфекції виявляється висока швидкість утворення і руйнування лімфоцитів — 109 клітин в день. У цій «гонці на виживання» вірус з часом перемагає, вражаючи клітини імунної системи. Їх загибель призводить до формування імунодефіциту, який проявляється розвитком симптомів, пов'язаних як з ВІЛ-інфекцією так і з вторинними захворюваннями інфекційного та неінфекційного ґенезу. |
|||
{{Розширити розділ|дата=лютий 2013}} |
|||
== Лікування == |
|||
{{ external media | align = right | width = 350px |
{{ external media | align = right | width = 350px |
||
| video1 = 1. [https://www.youtube.com/watch?v=ugK0a_O0KrU Наскільки близько ми до звільнення від ВІЛ-інфекції] // Канал «Цікава наука» на [[YouTube]], 26 лютого 2020. |
| video1 = 1. [https://www.youtube.com/watch?v=ugK0a_O0KrU Наскільки близько ми до звільнення від ВІЛ-інфекції] // Канал «Цікава наука» на [[YouTube]], 26 лютого 2020. |
||
}} |
}} |
||
З-поміж 35 мільйонів осіб, що живуть з ВІЛ-інфекцією, частина залишається в живих завдяки антиретровірусній терапії. За відсутності [[Високоактивна антиретровірусна терапія|антиретровірусної терапії]] ВІЛ-інфекції, смерть настає в середньому через 9-11 років після зараження<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref><ref name="autogenerated9">{{Cite web|last=[[Joint United Nations Programme on HIV/AIDS|UNAIDS]], [[World Health Organization|WHO]]|language=en|date=2007-12|title=2007 AIDS epidemic update|url=http://data.unaids.org/pub/EPISlides/2007/2007_epiupdate_en.pdf|page=10|accessdate=2008-03-12|format=PDF}}</ref>. Якщо проводити [[Високоактивна антиретровірусна терапія|антиретровірусну терапію]] тривалість життя пацієнта зростає до 70-80 років<ref name="autogenerated14">{{Cite web|url=http://www.aidsmap.com/page/2816991/|title=aidsmap. Ожидаемая продолжительность жизни для некоторых групп ВИЧ-инфицированных лиц в США теперь значительно превосходит её средний показатель|accessdate=2015-01-26|archiveurl=https://web.archive.org/web/20150307094902/http://www.aidsmap.com/page/2816991/|archivedate=2015-03-07|deadlink=yes}}</ref><ref name="autogenerated15">[http://arvt.ru/news/2014-01-29-life-expectancy.html Антиретровирусная терапия online. Продолжительность жизни людей с ВИЧ, получающих АРВТ в развитых странах]</ref><ref name="autogenerated16">[https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3867319/ US National Library of Medicine National Institutes of Health. Closing the Gap: Increases in Life Expectancy among Treated HIV-Positive Individuals in the United States and Canada]</ref>. Антиретровірусні препарати заважають ВІЛ розмножуватися в клітинах імунної системи людини, блокуючи проходження [[Віріон|віріонів]] у клітини й порушуючи на різних етапах процес збирання нових віріонів. Своєчасно розпочате лікування антиретровірусними препаратами в сотні разів знижує ризик розвитку СНІДу та подальшої смерті<ref>{{Cite pmid|18476292}}</ref><ref>{{Cite pmid|8813039}}</ref><ref>{{Cite pmid|16054937}}</ref>. Антиретровірусні препарати у частини пацієнтів викликають побічні ефекти, в деяких випадках навіть вимагають змінити схему лікування (набір ліків). |
|||
На сьогодні використовуються препарати базовані на близько 25 діючих речовинах (препаратів набагато більше, оскільки для покращення ефекту застосовують суміші 2 та більше активних речовин). Більшість діючих речовин блокують зворотну транскриптазу вірусу. |
|||
Терапію призначають у разі зниження імунітету та/або високого [[Вірусне навантаження|вірусного навантаження]]. Якщо кількість CD4<sup>+</sup>-лімфоцитів велика й вірусне навантаження низьке, терапію не призначають. Після призначення терапії ліки потрібно вживати щодня в один і той же час і довічно, що створює незручності для пацієнтів. Крім того, слід враховувати високу вартість місячного курсу ліків. 2014 року необхідні ліки отримувала менш як половина з 9,5 млн осіб, що потребують противірусної терапії<ref>{{Cite web|url=http://www.avert.org/starting-monitoring-switching-hiv-treatment.htm|title=Starting, Monitoring & Switching HIV Treatment|publisher=AVERT|language=en|accessdate=2014-07-21}}</ref>. |
|||
Також ''усі вагітні жінки'' з ВІЛ-інфекцією повинні починати негайну [[Високоактивна антиретровірусна терапія|ВААРТ]], щоб запобігти передаванню ВІЛ плоду<ref name="guidelines_ART">{{Cite web|url=http://aidsinfo.nih.gov/contentfiles/lvguidelines/adultandadolescentgl.pdf|title=Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents|last=AIDSinfo|publisher=NIH|language=en|accessdate=2014-08-13}}</ref>. |
|||
Згідно з рекомендаціями [[Всесвітня організація охорони здоров'я|ВООЗ]], ВААРТ слід негайно починати всім ВІЛ-інфікованим ''дітям до півтора років''<ref>{{Cite web|url=http://www.who.int/hiv/pub/guidelines/arv2013/download/en/|title=Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection|last=World Health Organization|language=en|accessdate=2014-08-13}}</ref>. Початок терапії у дітей, які набули ВІЛ від матері, впродовж 3 місяців після пологів знижує смертність на 75 %<ref name="gapreport">{{Cite web|url=http://www.unaids.org/en/resources/campaigns/2014/2014gapreport/gapreport/|title=Gap report|last=UNAIDS|language=en|accessdate=2014-08-13}}</ref>. За відсутності лікування третина ВІЛ-інфікованих дітей помирає протягом першого року життя і 50 % - протягом другого року. Якщо діагностика ВІЛ неможлива, лікування слід починати у віці 9 місяців, або раніше, у разі з'яви симптомів<ref name="hivtreatchilden">{{Cite web|url=http://www.avert.org/hiv-treatment-children.htm|title=HIV treatment children|last=AVERT|language=en|accessdate=2014-08-13}}</ref>. |
|||
Станом на лютий 2016 року було оголошено, що групі німецьких вчених вдалося повністю видалити тип ВІЛ-1 з живих клітин. Випробування проводили на клітинах людини, вживлених піддослідним мишам. Випробування на людях повинні проводити найближчим часом<ref>{{Стаття|видання=[[Nature Biotechnology]]|мова=en|тип=journal|автор=Janet Karpinski, Ilona Hauber, Jan Chemnitz et al.|рік=2016|видавництво=[[Nature Publishing Group]]}}</ref><ref>[http://hi-news.ru/research-development/nemeckim-uchyonym-udalos-pobedit-virus-immunodeficita-cheloveka.html Немецким учёным удалось победить вирус иммунодефицита человека] Новости высоких технологий{{проверено|01|03|2016}}</ref><ref>{{Cite web|url=http://www.nature.com/nbt/journal/vaop/ncurrent/full/nbt.3467.html|title=Directed evolution of a recombinase that excises the provirus of most HIV-1 primary isolates with high specificity|last=Janet Karpinski, Ilona Hauber, Jan Chemnitz ''et al.''|date=2016-02-22|website=|publisher=Nature Biotechnology|accessdate=2016-03-01|language=en|archiveurl=https://web.archive.org/web/20160224021813/http://www.nature.com/nbt/journal/vaop/ncurrent/full/nbt.3467.html|archivedate=2016-02-24}}</ref>. |
|||
2018 року [[FDA|Адміністрація з контролю над продуктами і ліками]] (FDA) схвалила ібалізумаб (ibalizumab-uiyk) для застосування в терапії пацієнтів з мультирезистентним ВІЛ-1. Препарат являє собою [[Моноклональні антитіла|моноклональне антитіло]], що зв'язується з [[CD4]] рецепторами [[T-лімфоцити|T-клітин]] та пригнічує процес проходження вірусу в клітину людини. Ібалізумаб можна застосовувати в терапії з іншими антиретровірусними препаратами. За результатами клінічних досліджень за участю 40 пацієнтів, які раніше лікувались більш ніж 10 різними антиретровірусними агентами, вірусне навантаження знизилось у більшості випробовуваних через один тиждень після введення першої дози препарату. Через 24 тижні терапії вірусологічної супресії досягнуто в 43 % учасників клінічних випробувань<ref>[http://www.remedium.ru/news/detail.php?ID=73691 В США одобрен препарат для лечения ВИЧ с новым механизмом действия]</ref>. |
|||
ВІЛ 2019 року вносили в список десяти основних проблем охорони здоров'я, які потребують особливої уваги [[Всесвітня організація охорони здоров'я|ВООЗ]]<ref>{{Cite web|language=ru|title=Десять проблем здравоохранения, над которыми ВОЗ будет работать в 2019 году|url=http://web.archive.org/web/20190419101223/https://www.who.int/ru/emergencies/ten-threats-to-global-health-in-2019|website=ВОЗ|date=2019|accessdate=2019-03-29}}</ref>. |
|||
== Профілактика == |
|||
Більшість діючих речовин блокують зворотну транскриптазу вірусу. |
|||
=== Профілактика === |
|||
За оцінками, 2,1 мільйона підлітків жили з ВІЛ у 2016 році, переважно з більшості країн Африканського регіону за данними ВООЗ. Хоча загальна кількість смертей, пов’язаних із ВІЛ, зменшується з моменту піку 2006 року, за оцінками, це не стосується підлітків. Це відображає той факт, що більшість сучасних підлітків народилися до того, як профілактика передачі ВІЛ від матері до дитини антиретровірусною терапією набула широкого поширення. Однак значна частина ВІЛ-позитивних підлітків не знає про свій статус, і багато хто з тих, хто знає про свій статус, не отримують ефективного, тривалого антиретровірусного лікування. |
За оцінками, 2,1 мільйона підлітків жили з ВІЛ у 2016 році, переважно з більшості країн Африканського регіону за данними ВООЗ. Хоча загальна кількість смертей, пов’язаних із ВІЛ, зменшується з моменту піку 2006 року, за оцінками, це не стосується підлітків. Це відображає той факт, що більшість сучасних підлітків народилися до того, як профілактика передачі ВІЛ від матері до дитини антиретровірусною терапією набула широкого поширення. Однак значна частина ВІЛ-позитивних підлітків не знає про свій статус, і багато хто з тих, хто знає про свій статус, не отримують ефективного, тривалого антиретровірусного лікування. |
||
| Рядок 110: | Рядок 135: | ||
=== Стійкість до ліків === |
=== Стійкість до ліків === |
||
ВІЛ має велику здатність мутувати. Наприклад, відомо більше 20 мутацій (підвидів) протеїну NC (p7). Більшість таких вірусів менш шкідливі (патогенні), ніж вихідний й розмножуються повільніше. З іншого боку, вони можуть мати вищу стійкість проти певного медикаменту. Під час лікування певним препаратом існує етап, коли більшість «старого» типу вірусу загинула, а «мутант» все ще не викорінений. Переривання лікування на цій стадії призводить до [[Резистентність (імунітет)|резистентності]] й пацієнт виявляється ураженим формою вірусу стійкою до даного препарату. Найпоширенішою є мутація кількох амінокислот зворотної транскриптази, що приводить до стійкості до одного з перших препаратів-блокаторів зворотної транскрипції вірусу. |
ВІЛ має велику здатність мутувати. Наприклад, відомо більше 20 мутацій (підвидів) протеїну NC (p7). Більшість таких вірусів менш шкідливі (патогенні), ніж вихідний й розмножуються повільніше. З іншого боку, вони можуть мати вищу стійкість проти певного медикаменту. Під час лікування певним препаратом існує етап, коли більшість «старого» типу вірусу загинула, а «мутант» все ще не викорінений. Переривання лікування на цій стадії призводить до [[Резистентність (імунітет)|резистентності]] й пацієнт виявляється ураженим формою вірусу стійкою до даного препарату. Найпоширенішою є мутація кількох амінокислот зворотної транскриптази, що приводить до стійкості до одного з перших препаратів-блокаторів зворотної транскрипції вірусу. |
||
== Класифікація == |
|||
[[Файл:HIV-SIV-phylogenetic-tree.svg|міні|праворуч|200пкс|Підтипи ВІЛ та споріднених вірусів довжина ліній пропорційна ступеню генетичної відмінності]] |
|||
Висока мінливість вірусу <small>(0,003 %/на нуклеїнову основу/цикл реплікації)</small> ВІЛ є однією з причин, що сильно ускладнюють розробку [[ретровіруси|антиретровірусних]] ліків. |
|||
Вірус імунодефіциту людини належить до родини [[Ретровіруси|ретровірусів]] (''Retroviridae''), роду [[Lentivirus|лентивірусів]] (''Lentivirus''). Назва ''Lentivirus'' походить від латинського слова ''lente'' — повільний. Така назва віддзеркалює одну з особливостей вірусів цієї групи, а саме — повільну і неоднакову швидкість розвитку інфекційного процесу в макроорганізмі. Для лентивірусів також характерний тривалий [[інкубаційний період]]<ref name="KurthBannert">{{Книга|автор=Kurth, R; Bannert, N|рік=2010|видавництво=Caister Academic Press|isbn=978-1-904455-55-4}}</ref>. |
|||
Для вірусу імунодефіциту людини характерна висока частота [[Мутація|генетичних змін]], що виникають у процесі [[самовідтворення]]. Частота виникнення помилок у ВІЛ становить 10<sup>-3</sup> — 10<sup>-4</sup> помилок на [[геном]] на цикл [[Реплікація ДНК|реплікації]], що на кілька порядків перевищує аналогічну величину в [[Еукаріоти|еукаріотів]]. Розмір геному ВІЛ становить приблизно 10<sup>4</sup> [[Нуклеотиди|нуклеотидів]]. З цього випливає, що практично кожен дочірній геном хоча б на один нуклеотид відрізняється від свого попередника. У сучасній класифікації розрізняють два основні види ВІЛ — ВІЛ-1 і ВІЛ-2. Ці віруси ймовірно виникли внаслідок незалежної передачі людям [[SIV]] (вірусу імунодефіциту мавп) [[шимпанзе]] і [[Cercocebus|мангабеїв]] відповідно<ref name="Nyamweya">{{Cite pmid|23444290}}</ref>. |
|||
І ВІЛ-1 і ВІЛ-2 здатні викликати серйозний імунодефіцит, однак клінічний перебіг хвороби дещо різниться. Відомо, що ВІЛ-2 менш [[Патогенність|патогенний]] і передається з меншою ймовірністю, ніж ВІЛ-1. Ймовірно, це пов'язано з тим, що для інфекції ВІЛ-2 характерне менше [[Вірусне навантаження|число вірусних частинок на мілілітр крові]]. Відзначено, що інфекція ВІЛ-2 забезпечує носієві деякий незначний захист від зараження ВІЛ-1. Проте описано випадки подвійної інфекції, причому зараження може відбуватися в будь-якому порядку. Інфекція ВІЛ-2 рідше спричиняє розвиток СНІДу. Є відомості про дещо більшу частоту розвитку [[Саркома Капоші|саркоми Капоші]], [[Кандидоз|кандидозу]] ротової порожнини та хронічної [[Гарячка|лихоманки]] при ВІЛ-1/СНІД. При ВІЛ-2/СНІД частіше розвивається [[енцефаліт]], або хронічна бактеріальна [[діарея]], серйозні [[Цитомегаловірус|цитомегаловірусні]] інфекції і [[холангіт]]<ref name="Nyamweya">{{Cite pmid|23444290}}</ref>. До роду ''[[Lentivirus]]'' також відносять види, що спричиняють схожі захворювання в мавп, кішок, коней, овець і т. д.<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref><ref>{{Стаття|видання=Arch. Virol.|сторінки=1—13|мова=en|тип=journal|автор=Gelderblom H.R., Ozel M., Pauli G.|рік=1989}}</ref><ref>{{Cite web|url=http://ictvonline.org/virusTaxonomy.asp?taxnode_id=20133261|title=Lentivirus|publisher=International Committee on Taxonomy of Viruses (ICTV)|language=en|description=Virus Taxonomy: 2013 Release|accessdate=2014-07-21|archiveurl=https://web.archive.org/web/20140729210613/http://ictvonline.org/virusTaxonomy.asp?taxnode_id=20133261|archivedate=2014-07-29|deadlink=yes}}</ref>. |
|||
=== ВІЛ-1 === |
|||
ВІЛ-1 описаний 1983 року і є найбільш поширеним і патогенним видом ВІЛ<ref name="bartlett">{{Книга|автор=Джон Бартлетт|частина=Типы и подтипы ВИЧ|посилання частина=http://www.eurasiahealth.org/attaches/82168/MMHIV10_2.pdf|рік=2009}} [https://www.webcitation.org/6A3qODrr7?url=http://www.eurasiahealth.org/attaches/82168/MMHIV10_2.pdf Архив]</ref>. Глобальна епідемія [[ВІЛ-інфекція|ВІЛ-інфекції]] головним чином обумовлена поширенням ВІЛ-1. У переважній більшості випадків, якщо не зазначено інше, під ВІЛ мають на увазі ВІЛ-1<ref>{{Cite web|url=http://www.avert.org/hiv-types.htm|title=HIV Strains: Types, Groups and Subtypes|publisher=AVERT|language=en|accessdate=2014-07-21}}</ref>. |
|||
Вид ВІЛ-1 поділяють на головну групу М і кілька побічних груп. Вважають, що групи M, N, O, P утворилися внаслідок незалежних випадків передачі SIV від мавпи до людини, і подальшої мутації вірусу до ВІЛ<ref>{{Cite pmid|22229120}}</ref>. |
|||
* Віруси '''групи М''' ({{lang-en|main}} — основна) є причиною понад 90 % випадків ВІЛ-інфекції. Групу М поділяють на кілька [[Клада|клад]], званих підтипами, що їх також позначають літерами: |
|||
** підтип A масово поширений, наприклад, у [[Західна Африка|Західній Африці]] та Росії<ref name="pmid15332265">{{Стаття|видання=J. Med. Virol.|номер=2|сторінки=191—196|мова=en|тип=journal|автор=Bobkov A.F., Kazennova E.V., Selimova L.M., et al.|місяць=10|рік=2004}}</ref>; |
|||
** підтип B домінує в [[Європа|Європі]], [[Північна Америка|Північній Америці]], [[Південна Америка|Південній Америці]], [[Японія|Японії]], [[Таїланд|Таїланді]], [[Австралія|Австралії]]<ref name="Goudsmit">Goudsmit, Jaap. Viral Sex; The Nature of AIDS. Oxford University Press. New York, New York, 1997. Pg. 51-58. Retrieved May 25, 2008.</ref>; |
|||
** підтип C переважає у [[Південна Африка|Південній]] і [[Східна Африка|Східній Африці]], [[Індія|Індії]], [[Непал|Непалі]], деяких частинах [[китайці|Китаю]]; |
|||
** підтип D виявлений тільки в [[Східна Африка|Східній]] і [[Центральна Африка|Центральній Африці]]; |
|||
** підтип E не виявлений у нерекомбинантному вигляді, лише спільно з підтипом А як CRF01_AE в [[Південносхідна Азія|Південно-Східній Азії]]; |
|||
** підтип F виявлений у [[Центральна Африка|Центральній Африці]], [[Південна Америка|Південній Америці]] та [[Східна Європа|Східній Європі]]<ref name="Avert">[http://www.avert.org/hivtypes.htm] Introduction to HIV types, groups and subtypes. March 3, 2008. Retrieved May 25, 2008.</ref>; |
|||
** підтип G і рекомбінантна форма CRF02_AG виявлені в [[Африка|Африці]] і [[Центральна Європа|Центральній Європі]]; |
|||
** підтип H виявлений тільки в [[Центральна Африка|Центральній Африці]]; |
|||
** підтип I запропоновано для опису штаму-продукту множинної рекомбінації CRF04_cpx декількох підтипів<ref>{{Cite pmid|11172098}}</ref>; |
|||
** підтип J поширений в [[Північна Африка|Північній]], [[Центральна Африка|Центральній]] і [[Західна Африка|Західній]] Африці і [[Список країн Карибського басейну|країнах Карибського басейну]]<ref name="pmid717053344">{{Стаття|видання=AIDS|номер=16|сторінки=W13—23|мова=en|тип=journal|автор=Hemelaar J., Gouws E., Ghys P.D., Osmanov S.|місяць=3|рік=2006}}</ref>; |
|||
** підтип K виявлений тільки в [[Демократична Республіка Конго|Конго]] і [[Камерун|Камеруні]]. |
|||
* '''Група O''' ({{lang-en|outlier}} — несхожий) виявлена у [[Центральна Африка|Центральній Африці]] і [[Західна Африка|Західній]] Африці. Найбільш поширена в Камеруні, де 1997 року понад 2 % пацієнтів були заражені вірусом групи<ref name="pmid9084797">{{Стаття|видання=AIDS|номер=4|сторінки=493—498|мова=en|тип=journal|автор=Peeters M., Gueye A., Mboup S., Bibollet-Ruche F., Ekaza E., Mulanga C., Ouedrago R., Gandji R., Mpele P., Dibanga G., Koumare B., Saidou M., Esu-Williams E., Lombart J.P., Badombena W., Luo N., Vanden Haesevelde M., Delaporte E.|місяць=3|рік=1997}}</ref> (близько 100 000 осіб, за даними на 2013 рік)<ref>Mourez T, Simon F, Plantier JC. Non-M variants of human immunodeficiency virus type 1. Clin Microbiol Rev. 2013 Jul;26(3):448-61</ref>. Віруси цієї групи не визначалися ранніми версіями тест-систем на ВІЛ-1; сучасні тести визначають віруси і групи '''O''', і групи N<ref>{{Cite web|url=http://www.avert.org/hiv-types.htm|title=HIV Strains: Types, Groups and Subtypes|last=AVERT.org|language=en|accessdate=2014-07-24}}</ref>. |
|||
* '''Група N''' ({{lang-en|non-M}}, {{Lang-en2|non-O}} — ні M, ні O) позначає штами не М і не '''O''', описана 1998 року і виявлена тільки в Камеруні. Від 2006 року виявлено лише 10 заражень вірусами групи N<ref name="doi10.1089/aid.2006.22.83">{{Стаття|видання=AIDS Research and Human Retroviruses|номер=1|сторінки=83—92|мова=en|тип=journal|автор=Julie Yamaguchi, Ruthie Coffey, Ana Vallari, Charlotte Ngansop, Dora Mbanya, Nicaise Ndembi, Lazare Kaptué, Lutz G. Gürtler, Pierre Bodelle, Gerald Schochetman, Sushil G. Devare, Catherine A. Brennan|місяць=1|рік=2006}}</ref>. |
|||
* '''Група P''' — 2009 року визначено нуклеотидну послідовність РНК ВІЛ, значною мірою схожу з вірусом імунодефіциту мавп, описаним у [[Горила|горил]] (SIVgor), але не із SIV, характерним для шимпанзе (SIVcpz). Вірус виділено зі зразків, отриманих від жінки камерунського походження, що проживає у [[Франція|Франції]]<ref name="pmid19648927">{{Стаття|видання=Nature Medicine|номер=8|сторінки=871—872|мова=en|тип=journal|автор=Plantier J.C., Leoz M., Dickerson J.E., De Oliveira F., Cordonnier F., Lemée V., Damond F., Robertson D.L., Simon F.|місяць=8|рік=2009}}</ref><ref name="CBC news HIV P">{{Цитата:Новини|url=http://www.cbc.ca/health/story/2009/08/03/hiv-africa.html|date=2009-08-03|accessdate=2009-08-03|title=New HIV strain discovered|work=[[Associated Press]]|publisher=[[CBC News]]|archiveurl=https://web.archive.org/web/20090805173954/http://www.cbc.ca/health/story/2009/08/03/hiv-africa.html|archivedate=2009-08-05}}</ref><ref name="millennia">{{Цитата:Новини|last=[[Donald G. McNeil, Jr.]]|coauthors=|title=Precursor to H.I.V. Was in Monkeys for Millennia|url=https://www.nytimes.com/2010/09/17/health/17aids.html?_r=1&src=me&ref=general|quote=But P appears to have crossed over from a gorilla; it was discovered only last year, and in only one woman, who was from Cameroon, where lowland gorillas are hunted for meat.|work=[[New York Times]]|date=2010-09-16|accessdate=2010-09-17}}</ref>. |
|||
=== ВІЛ-2 === |
|||
ВІЛ-2 ідентифіковано 1986 року<ref>{{Cite pmid|2425430}}</ref>, генетично дуже близький до T-лімфотропного вірусу SIVsmm мангабеїв, і меншою мірою до вірусу ВІЛ-1. Геноми ВІЛ-1 і ВІЛ-2 мають [[Гомологія (біологія)|гомологію]] консервативних генів gag і pol близько 60 %, і до 45 % генів білків оболонки<ref>{{Cite pmid|3031510}}</ref>. Станом на 2010 рік описано 8 груп ВІЛ-2, лише групи A і B є епідемічними. Віруси групи А поширені в [[Західна Африка|Західній Африці]], [[Ангола|Анголі]], [[Мозамбік|Мозамбіку]], [[Бразилія|Бразилії]], [[Індія|Індії]] і мало поширені в [[Сполучені Штати Америки|США]] і [[Європа|Європі]]<ref>{{Cite pmid|21796096}} За 12 лет с 1988 по 2010 в США зарегистрированы лишь 242 случая ВИЧ-инфекции</ref><ref>{{Cite web|url=http://aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-arv-guidelines/24/hiv-2-infection|title=Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents|publisher=U.S. Department of Health and Human Services|language=en|accessdate=2014-07-21|quote=Инфекция ВИЧ-2 эндемична в Западной Африке и имеет лишь ограниченное распространение за пределами этой зоны.}}</ref>. Віруси групи поширені В в [[Західна Африка|Західній Африці]]<ref name="Santiago2005">{{Стаття|видання=Journal of Virology|номер=19|сторінки=12515—12527|мова=en|тип=journal|автор=Santiago, M. L.; Range, F.; Keele, B. F.; Li, Y.; Bailes, E.; Bibollet-Ruche, F.; Fruteau, C.; Noe, R.; Peeters, M.|рік=2005}}</ref><ref name="Marx2001">{{Стаття|сторінки=911—920|видання=Philos Trans R Soc Lond B Biol Sci|номер=1410|мова=en|тип=journal|автор=Marx P.A., Alcabes P.G., Drucker E.|рік=2001}}</ref>. |
|||
== Будова вірусу == |
|||
Головна стаття: [[будова ВІЛ]] |
|||
== Будова віріона == |
|||
{{Main|Будова ВІЛ}} |
|||
[[Файл:HI-virion.jpg|міні|ліворуч|200пкс|Структура віріону ВІЛ-1: 1 — [[РНК]]-геном; 2 — нуклеокапсид; 3 — [[капсид]]; 4 — білковий матрикс; 5 — мембрана (частина клітинної); 6 — gp120 — [[глікопротеїн]], що зв'язується з рецептором клітини; 7 — gp41 — трансмембранний глікопротеїн, відповідальний за злиття мембран; 8 — інтеграза (вклинення ДНК-копії геному вірусу в клітинний геном); 9 — [[зворотна транскриптаза]] (стимулює генерацію ДНК-копії вірусної РНК); 10 — Vif, Vpr (сприяє інфектуванню клітин не здатних до поділу), Nef и p7 (захищає РНК, відповідає за розпізнавання вірусної РНК на стадії зборки нового вірусу); 11 — [[протеаза]]]] |
|||
[[Віріон|Віріони]] ВІЛ сферичну форму діаметром приблизно 120 [[Нанометр|нм]]<ref name="McGovern">{{Стаття|видання=[[Journal of Medical Chemistry]]|номер=8|сторінки=1712—1722|мова=en|тип=journal|автор=McGovern S.L., Caselli E., Grigorieff N., Shoichet B.K.|рік=2002}}</ref>. Це приблизно в 60 разів менше за діаметр [[Еритроцити|еритроцита]]<ref name="Microbiology3">Compared with overview in: {{Книга|автор=Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C.|видавництво=Lippincott Williams & Wilkins|місце=Hagerstown, MD|рік=2007|pages=|isbn=0-7817-8215-5|chapterurl=}} Page 3</ref>. До складу зрілих віріонів входить кілька тисяч білкових молекул різних типів. |
|||
[[Капсид]] зрілого віріона, що складається з приблизно 2000 молекул білка р24, має форму усіченого [[Конус|конуса]]<ref name="compendia">{{Книга|автор=Los Alamos National Laboratory|рік=2008}}</ref>. |
|||
Всередині капсиду розташований білково-нуклеїновий комплекс: дві нитки вірусної [[РНК]], міцно пов'язані з білком нуклеокапсиду '''p7''', [[ферменти]] ([[зворотна транскриптаза]], [[протеаза]], [[інтеграза]])<ref name="compendia">{{Книга|автор=Los Alamos National Laboratory|рік=2008}}</ref>. З капсидом також асоційовані білки '''Nef''' і '''Vif''' (7-20 молекул Vif на віріон). Всередині віріона (і, найімовірніше, за межами капсиду) виявлений білок '''Vpr'''<ref name="Levy">{{Книга|автор=Levy J.A.|видавництво=USA: American Society for Microbiology|рік=2007|isbn=978-1-55581-393-2}}</ref>{{Rp|8-11}}. Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) пов'язані близько 200 копій клітинного ферменту пептидилпролілізомерази A[en] (циклофілін А), необхідного для складання віріона<ref name="Structural_biology">{{Cite pmid|9878383}}</ref>. |
|||
Капсид оточений оболонкою, утвореною з приблизно 2000 молекул матриксного білка '''p17'''<ref name="compendia">{{Книга|автор=Los Alamos National Laboratory|рік=2008}}</ref>. Матриксна оболонка, в свою чергу, оточена двошаровою [[Ліпіди|ліпідною]] мембраною, що є [[Вірусна оболонка|зовнішньою оболонкою вірусу]]. Її утворюють молекули [[Фосфоліпіди|фосфоліпідів]], захоплені вірусом під час його відбрунькування від клітини, в якій він сформувався<ref>{{Cite pmid|8091422}}</ref>. В ліпідну мембрану вбудовані 72 [[Глікопротеїни|глікопротеїнові]] комплекси Env, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну '''gp41''' <nowiki>(TM)</nowiki>, що слугує «якорем» комплексу, і трьома молекулами поверхневого глікопротеїну '''gp120''' (SU)<ref name="Structural_biology">{{Cite pmid|9878383}}</ref>. З допомогою білка gp120 вірус приєднується до рецептора CD4 і корецептора, що розташовані на поверхні [[T-лімфоцити|Т-лімфоцитів]] людини. [[Стехіометричне рівняння|Стехіометричне співвідношення]] p24:gp120 у віріона становить 60-100:1<ref name="Levy">{{Книга|автор=Levy J.A.|видавництво=USA: American Society for Microbiology|рік=2007|isbn=978-1-55581-393-2}}</ref>{{Rp|11}}. Під час формування зовнішньої оболонки вірусу також відбувається захоплення деякої кількості мембранних білків клітини, зокрема [[Людський лейкоцитарний антиген|людських лейкоцитарних антигенів]] (HLA) класів I і II і молекул [[Адгезія|адгезії]]<ref name="rhv1993">{{Cite pmid|8312057}}</ref>. |
|||
Білки віріона інтенсивно вивчають, оскільки вони є мішенями розроблюваних ліків і [[вакцини]] проти ВІЛ. |
|||
'''Функції важливих структурних білків ВІЛ-1'''<ref name="compendia">{{Книга|автор=Los Alamos National Laboratory|рік=2008}}</ref><ref name="rhv1993">{{Cite pmid|8312057}}</ref> |
|||
{| class="wikitable" |
|||
!Скорочення |
|||
!Опис |
|||
!Функції |
|||
|- |
|||
|'''gp41 (TM, transmembrane)''' |
|||
|Трансмембранний глікопротеїн масою 41 кДа |
|||
|Розташований у зовнішньому шарі ліпідної мембрани, відіграє роль «якоря», що утримує молекули білка gp120 |
|||
|- |
|||
|'''gp120 (SU, surface)''' |
|||
|Глікопротеїн масою 120 кДа |
|||
|Зовнішній білок віріона. Нековалентно пов'язаний з трансмембранним білком gp41. З однією молекулою gp41 пов'язані 3-5 молекул gp120. Здатний зв'язувати рецептор CD4. Відіграє важливу роль у процесі проходження вірусу в клітину. |
|||
|- |
|||
|'''p24 (CA, capsid)''' |
|||
|Білок масою 24 кДа |
|||
|Утворює капсид вірусу |
|||
|- |
|||
|'''p17 (MA, matrix)''' |
|||
|Матриксний білок масою 17 кДа |
|||
|Близько двох тисяч молекул цього білка утворюють шар завтовшки 5-7 нм, розташований між зовнішньою оболонкою і капсидом вірусу. |
|||
|- |
|||
|'''p7 (NC, nucleocapsid)''' |
|||
|Нуклеокапсидный білок масою 7 кДа |
|||
|Входить до складу капсиду вірусу. Утворює комплекс з вірусної РНК. |
|||
|} |
|||
== Геном і кодовані білки == |
|||
[[Файл:Геном-ВИЧ.png|міні|450x450пкс|Геном ВІЛ-1<ref name="compendia">{{Книга|автор=Los Alamos National Laboratory|рік=2008}}</ref>]] |
|||
Генетичний матеріал ВІЛ представлений двома копіями позитивно-смислової (+)[[РНК]]<ref name="Structural_biology">{{Cite pmid|9878383}}</ref>. [[Геном]] ВІЛ-1 завдовжки 9000 [[Нуклеотиди|нуклеотидів]]. Кінці геному представлені [[Довгі кінцеві повтори|довгими кінцевими повторами]] ({{lang-en|long terminal repeat}}, LTR), які керують продукуванням нових вірусів і можуть активуватися і білками вірусу, і білками інфікованої клітини. |
|||
9 [[Ген|генів]] ВІЛ-1 кодують, принаймні, 15 білків<ref>{{Cite pmid|12835701}}</ref>. Ген ''pol'' кодує ферменти: [[Зворотна транскриптаза|зворотну транскриптазу]] (RT), [[Інтеграза|інтегразу]] (IN) і [[Протеаза ВІЛ-1|протеазу]] (PR). Ген ''gag'' кодує поліпротеїн Gag/p55, що його вірусна протеаза розщеплює до структурних білків '''p6''', '''p7''', '''p17''', '''p24'''. Ген ''env'' кодує білок '''gp160''', що його клітинна ендопротеаза [[FURIN|фурин розщеплює]] на структурні білки '''gp41''' і '''gp120'''<ref name="Levy">{{Книга|автор=Levy J.A.|видавництво=USA: American Society for Microbiology|рік=2007|isbn=978-1-55581-393-2}}</ref>{{Rp|8-12}}. Інші шість генів — ''tat'', ''rev'', ''nef'', ''vif'', ''vpr'', ''vpu'' (''vpx'' у ВІЛ-2) — кодують білки, що відповідають за здатність ВІЛ-1 інфікувати клітини і виробляти нові копії вірусу. Реплікація ВІЛ-1 ''[[in vitro]]'' можлива без генів ''nef'', ''vif'', ''vpr'', ''vpu'', однак їх продукти необхідні для повноцінної інфекції ''[[in vivo]]''<ref name="guatelli">{{Cite pmid|20012522}}</ref><ref name="Nomaguchi M. 2008">{{Cite pmid|18672082}}</ref><ref>{{Cite pmid|18541215}}</ref>. |
|||
==== Gag ==== |
|||
Поліпротеін-попередник Gag/p55 синтезується з повнорозмірною геномною РНК (яка в цьому разі слугує [[Матрична рибонуклеїнова кислота|мРНК]]) у процесі стандартної [[кеп]]-залежної [[Трансляція (біологія)|трансляції]], але можлива й [[IRES]]-залежна трансляція. Попередники функціональних білків розташовуються у складі поліпротеїну Gag/p55 в такому порядку: p17...p24...p2...p7...p1...p6<ref name="Levy">{{Книга|автор=Levy J.A.|видавництво=USA: American Society for Microbiology|рік=2007|isbn=978-1-55581-393-2}}</ref>{{Rp|8}} (р1 і р2 — з'єднувальні [[пептиди]]; інші продукти розщеплення Gag/p55 описано вище). Нерозщеплений протеазою Gag/p55 містить три основні [[Білковий домен|домени]]: домен мембранної локалізації (М, membrane targeting), домен взаємодії (I, interaction) і «пізній» домен (L, late). Домен М, розташований всередині області p17/МА, міристилюється (приєднуються залишки [[Міристинова кислота|міристинової кислоти]]) і направляє Gag/p55 до плазматичної мембрани. Домен I, що розташований всередині області p7<sup>NC</sup> (NC, nucleocapsid), відповідає за міжмолекулярні взаємодії окремих мономерів Gag/p55. Домен L, також локалізований в області p7<sup>NC</sup>, опосередковує відбрунькування віріонів від плазматичної мембрани; в цьому процесі бере участь також р6 область поліпротеїну Gag/p55{{Rp|8}}<ref>{{Cite pmid|18599104}}</ref>. |
|||
==== Vpu ==== |
|||
Двома важливими функціями білка Vpu є: 1) [[Протеоліз|руйнування]] клітинного рецептора CD4 в [[Ендоплазматичний ретикулум|ендоплазматичному ретикулумі]] шляхом залучення [[Убіквітин-лігаза|убіквітинлігазних]] комплексів і 2) стимуляція виділення дочірніх віріонів з клітини шляхом інактивації [[Інтерферони|інтерферон]]-індукованого трансмембранного білка [[BST2|CD317]]/BST-2, що дістав також назву «tetherin» за його здатність пригнічувати виділення новоутворених дочірніх віріонів, утримуючи їх на поверхні клітини<ref name="guatelli">{{Cite pmid|20012522}}</ref><ref name="Nomaguchi M. 2008">{{Cite pmid|18672082}}</ref><ref name="Neil S.J. 2008">{{Cite pmid|18200009}}</ref><ref name="Van Damme N. 2008">{{Cite pmid|18342597}}</ref><ref name="autogenerated1">{{Cite pmid|21176220}}</ref><ref name="autogenerated2">{{Cite pmid|20201792}}</ref>. |
|||
==== Vpr ==== |
|||
Білок Vpr потрібний для реплікації вірусу в неподільних клітинах, зокрема, [[Макрофаги|макрофагах]]. Цей білок, поряд з іншими клітинними та вірусними білками, активує транскрипцію з використанням довгих кінцевих повторів геному ВІЛ як промоторів. Білок Vpr відіграє важливу роль у перенесенні вірусної ДНК в [[Клітинне ядро|ядро]] і викликає затримку [[Мітоз|поділу]] клітини в [[G2-фаза|періоді G2]]<ref name="Votteler, J 2008">Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525</ref>. |
|||
==== Vif ==== |
|||
Білок Vif відіграє важливу роль у підтримці реплікації вірусу. Vif індукує убіквітинілювання і деградацію клітинного антивірусного білка APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, синтезованій у процесі зворотної транскрипції. Штами, позбавлені Vif, не реплікуються в [[Т-хелпери|CD4<sup>+</sup>-лімфоцитах]], деяких лініях T-лімфоцитів і макрофагах. Ці штами здатні проникати в клітини-мішені й починати [[Зворотна транскрипція|зворотну транскрипцію]], проте синтез вірусної ДНК залишається незавершеним<ref name="Votteler, J 2008">Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525</ref>. |
|||
==== Nef ==== |
|||
Білок Nef виконує кілька функцій. Він пригнічує експресію молекул CD4 і HLA класів I і II на поверхні інфікованих клітин, чим дозволяє вірусу уникати атаки [[Цитотоксичні Т-лімфоцити|цитотоксичних T-лімфоцитів]] і розпізнавання CD4<sup>+</sup>-лімфоцитами. Білок Nef може також пригнічувати активацію T-лімфоцитів, пов'язуючи різні білки-компоненти систем [[Сигнальна трансдукція|внутрішньоклітинного передавання сигналу]]<ref name="Votteler, J 2008">Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525</ref>. |
|||
В інфікованих вірусом імунодефіциту [[Макака резус|макак-резусів]] активна реплікація вірусу і розвиток хвороби можливі лише коли ген ''nef'' інтактний. [[Делеція (біологія)|Делеції]] гена ''nef'' виявлено в штамах ВІЛ, виділених у групи австралійців з тривалим непрогресивним перебігом інфекції<ref>{{Cite pmid|11044102}}</ref>. Однак у частини з них з часом з'явилися ознаки прогресування інфекції, зокрема, знизилась кількість CD4<sup>+</sup>-лімфоцитів. Отже, хоча делеції гена ''nef'' і можуть сповільнювати реплікацію вірусу, це не гарантує повної неможливості прогресування захворювання<ref>{{Cite pmid|17888184}}</ref>. |
|||
==== Tat і Rev ==== |
|||
Регуляторні білки Tat (''т''ранс-''а''к''т''иватор) і Rev накопичуються в ядрі клітини і пов'язують певні ділянки вірусної РНК. Білок Tat має молекулярну масу близько 14-15 кДа, пов'язує вторинну структуру геномної РНК поблизу [[5'-нетрансльована ділянка|5'-нетрансльованої області]]<ref name="Votteler, J 2008">Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525</ref><ref name="Montagnier, Luc 1999">Montagnier, Luc. (1999) Human Immunodeficiency Viruses (Retroviridae). Encyclopedia of Virology (2nd Ed.) 763—774</ref>, активує зворотну транскрипцію геномної РНК ВІЛ, синтез вірусних мРНК, необхідний для реплікації вірусу майже у всіх [[Культура клітин|культурах клітин]], регулює вихід віріонів із заражених клітин, потребує клітинного [[Кофактор|кофактору]] — [[Циклін|цикліну]] T1. Білок Rev регулює експресію білків віріона, пов'язує мРНК гена ''env'' в області RRE ({{lang-en|Rev response element}}) [[Інтрон|інтрона]], що розділяє [[Екзон|екзони]] генів Tat і Rev. |
|||
Білки Tat і Rev стимулюють транскрипцію провірусної ДНК і [[транспорт РНК]] з ядра в цитоплазму, а також потрібні для [[Трансляція (біологія)|трансляції]]. Білок Rev забезпечує також [[Ядерна пора|транспорт компонентів вірусу]] з ядра і переключення синтезу регуляторних білків вірусу на синтез структурних<ref name="Votteler, J 2008">Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525</ref>. |
|||
== Життєвий цикл вірусу == |
|||
[[Файл:HIV life cycle.gif|міні|ліворуч|200пкс|Життєвий цикл вірусу ВІЛ-1. Цифрами позначено: 1)Злииття вірусної та клітинної мембран; 2) Зворотна транскрипція (вірусної [[РНК]] в [[ДНК]]) під дією RT([[Зворотна транскриптаза]]); 3)проходження утвореної вірусної ДНК в [[ядро клітини]] та інтеграція в клітинний [[геном]] (каталізується Інтегразою (IN); 4)[[Транскрипція (біологія)|транскрипція]] з утворенням спочатку укороченних РНК, що кодують білки вірусу (spliced RNA), а на пізніших стадіях й повномірної вірусної РНК; 5) [[Трансляція (біологія)|трансляція]] вірусних білків [[рибосома|рибосомним]] механізмом клітини; 6) Організація нового віріону на мембрані, розпізнавання вірусної РНК NC доменом поліпротеїну GAG та відбрунькування молодого віріону; 7)формування (maturation) повноцінного віріону (розщеплення GAG [[протеаза|протеазою]] (PR), формування капсиди]] |
|||
Після потрапляння в організм людини ВІЛ проникає в клітини-мішені — Т-лімфоцити (CD4), які виконують регуляторну роль в імунній відповіді. Крім цього, ВІЛ здатний проникати в інші клітини, що обумовлює залучення в патологічний процес різних органів і систем. Геном ВІЛ, включений до геному клітини-господаря, носить назву «провірусу». ВІЛ має високу активність, продукуючи 1010 вірусних часток щодня. Якщо пацієнт отримує недостатньо ефективну антиретровірусну терапію формуються варіанти вірусу, стійкі до препаратів. При «природному перебігу» ВІЛ інфекції виявляється висока швидкість утворення і руйнування лімфоцитів — 109 клітин в день. У цій «гонці на виживання» вірус з часом перемагає, вражаючи клітини імунної системи. Їх загибель призводить до формування імунодефіциту, який проявляється розвитком симптомів, пов'язаних як з ВІЛ-інфекцією так і з вторинними захворюваннями інфекційного та неінфекційного ґенезу. |
|||
=== До проникнення в клітину-мішень === |
|||
Потрапивши на поверхню та всередину [[Організм|організму]], [[Віріон|віріони]] ВІЛ опиняються в різних за агресивністю біологічних рідинах. [[Слина]] та [[шлунковий сік]] містять [[ферменти]], що більшою мірою руйнують [[Віріон|віріони]] ВІЛ, ніж інші біологічні рідини (це не стосується немовлят перших місяців життя, у яких ще не виробляються відповідні [[Травні ферменти|ферменти травлення]], тому немовлята можуть заразитись через грудне молоко). Віріони ВІЛ проходять у [[Серцево-судинна система|кровоносну]] і [[Лімфатична система|лімфатичну систему]] організму і переміщуються по організму в потоці [[Кров|крові]] і [[Лімфа|лімфи]]. Опинившись поруч з [[CD4]]-клітиною, віріони ВІЛ приєднуються до рецептора [[CD4]] на її плазматичній мембрані<ref name="ncbi.hiv">{{Cite web|url=http://www.math.umt.edu/bardsley/courses/495/Projects/HIV/PerelsonEtAl1996.pdf|title=HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time|publisher=Science. 1996 Mar 15;271(5255):1582-6.|language=en|accessdate=2014-08-23|archiveurl=https://web.archive.org/web/20160305014116/http://www.math.umt.edu/bardsley/courses/495/Projects/HIV/PerelsonEtAl1996.pdf|archivedate=2016-03-05|deadlink=yes}} [https://www.ncbi.nlm.nih.gov/pubmed/8599114 PMID 8599114]</ref>. |
|||
=== Проходження в клітину і зворотна транскрипція === |
|||
{| align="right" cellpadding="5" style="text-align:center" |
|||
|'''Механізм злиття віріона ВІЛ <br /><br /><br /><br />і плазматичної мембрани <br /><br /><br /><br /> Т-лімфоцита людини'''<br /><br /><br /><br /> |
|||
[[Файл:HIV_Membrane_fusion_panel_rus_1.png|центр|міні|220x220пкс|1. Взаємодія вірусного білка gp120 з клітинним рецептором CD4 (зазначено червоною стрілкою)]] |
|||
[[Файл:HIV_Membrane_fusion_panel_rus_2.png|центр|міні|220x220пкс|2. [[Конформаційна ізомерія|Конформаційні]] зміни вірусного білка gp120 забезпечують зв'язування з клітинним рецептором [[CCR5]] (зазначено червоною стрілкою)]] |
|||
[[Файл:HIV_Membrane_fusion_panel_rus_3.png|центр|міні|220x220пкс|3. Кінцеві ділянки вірусного білка gp41 проходять у [[Клітинна мембрана|плазматичну мембрану]] клітини (зазначено червоною стрілкою)]] |
|||
[[Файл:HIV_Membrane_fusion_panel_rus_4.png|центр|міні|220x220пкс|4. Вірусний білок gp41 зазнає значних [[Конформаційна ізомерія|конформаційних]] змін (зазначено червоною стрілкою), що призводить до зближення і злиття мембран віріона і клітини]] |
|||
|} |
|||
Вірусний глікопротеїн gp120 міцно пов'язує рецептор CD4. Внаслідок такої взаємодії gp120 зазнає [[Конформаційна ізомерія|конформаційних]] зміни, які дозволяють йому зв'язувати молекулу [[Корецептор|корецептора]] [[CXCR4]] або [[CCR5]] (експресованих на поверхні Т-лімфоцитів, макрофагів, дендритних клітин мікроглії)<ref name="autogenerated5">{{Cite pmid|15647694}}</ref><ref name="autogenerated11">{{Cite pmid|10922058}}</ref>. Залежно від здатності зв'язувати ці [[Корецептор|корецептори]], ВІЛ класифікують на R5-тропні (пов'язують тільки корецептор CCR5), X4-тропні (пов'язують тільки корецептор CXCR4) і R5X4-тропні (можуть взаємодіяти з обома корецепторами) варіанти. При зараженні здебільшого передаються R5-тропні і R5X4-тропні варіанти<ref>Wilen CB, Tilton JC, Doms RW. HIV: cell binding and entry. Cold Spring Harb Perspect Med. 2012 Aug 1;2(8)</ref>. Препарати, що блокують [[Корецептор|корецептори]], можуть протидіяти ВІЛ<ref name="autogenerated8">{{Cite web|url=http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/howhiv.aspx|title=Информация о ВИЧ на сайте NIAID|language=en|accessdate=2014-08-07}}</ref>. |
|||
Після описаних подій вірусний білок gp41 проходить у [[Клітинна мембрана|мембрану клітини]] і зазнає значних [[Конформаційна ізомерія|конформаційних]] змін, внаслідок яких [[Клітинна мембрана|мембрана клітини]] і мембрана [[Віріон|віріона]] ВІЛ зближуються одна з одною й потім зливаються. Вірусний білок gp41 дуже важливий для злиття мембран, тому його розглядають як мішень для розробки противірусних препаратів. |
|||
Після злиття мембран вміст віріона проходить всередину клітини. Всередині клітини вірусна РНК вивільняється з капсиду. Потім під дією [[Зворотна транскриптаза|зворотної транскриптази]] відбувається [[зворотна транскрипція]] — процес синтезу ДНК на підставі інформації в одноланцюговій геномній РНК вірусу<ref name="autogenerated10">[http://obi.img.ras.ru/Humbio/immunology/imm-gal/0005fba9.htm Размножение вируса иммунодефицита человека в клетке]</ref>. Більша частина лікарських препаратів, затверджених для застосування при ВІЛ-інфекції, спрямована на порушення роботи [[Зворотна транскриптаза|зворотної транскриптази]]<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref>. |
|||
=== Транспорт вірусної ДНК в ядро та інтеграція в геном === |
|||
Після завершення зворотної транскрипції в CD4<sup>+</sup>-лімфоциті вірусний геном представлений невбудованою ДНК. Для вбудування вірусної ДНК в геном клітини-господаря і для утворення нових вірусів '''потрібна''' [[T-лімфоцити|активація T-лімфоцитів]]. Активація CD4<sup>+</sup>-лімфоцитів відбувається коли вони контактують з [[Антігенпредставляющіе клітини|антигенпредставленими клітинами]] в лімфоїдній тканині. Наявність вірусів на поверхні фолікулярних дендритних клітин і присутність прозапальних [[Цитокіни|цитокінів]] ([[Інтерлейкін-1|ІЛ-1]], [[Інтерлейкін-6|ІЛ-6]] і [[Фактор некрозу пухлини|ФНОа]]) сприяють розмноженню ВІЛ в інфікованих клітинах. Саме тому лімфоїдна тканина є найсприятливішим середовищем для реплікації ВІЛ. |
|||
Синтезована вірусна ДНК транспортується всередину ядра клітини в складі пре-інтеграційного комплексу, до якого також належать білки ВІЛ p17/MA, Nef та інтеграза<ref>Levy J.A. HIV and the pathogenesis of AIDS. — p. 110, 111, 160, 161 — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2</ref>. Далі вірусна ДНК вбудовується в [[Хромосома|хромосому]] активованого T-лімфоцита під дією [[Інтеграза|інтегрази]]. Кілька препаратів, що інгібують інтегрази, широко застосовують у сучасній комплексній антиретровірусній терапії. Вірусна ДНК, що вбудувалась у хромосому клітини, називається [[Провірус|'''''провірусом''''']]<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref>. |
|||
=== Транскрипція, сплайсинг, транспорт РНК з ядра в цитоплазму і трансляція === |
|||
В ядрі клітинна [[РНК-полімераза]] синтезує попередник вірусних [[Матрична рибонуклеїнова кислота|інформаційних РНК]] (мРНК), довжина якого дорівнює довжині геномної РНК ВІЛ-1. Цей попередник мРНК піддається [[Кеп|5'-кінцевому кепуванню]] і [[Поліаденілування|3'-кінцевому поліаденілюванню]]. Крім того, попередник мРНК піддається [[Сплайсинг|сплайсингу]], внаслідок якого утворюються понад 40 різних мРНК, що їх можна поділити на 3 класи<ref name="pmid22355797">{{Cite pmid|22355797}}</ref>: |
|||
# несплайсована РНК завдовжки близько 9.3 [[Пара основ|kb]] — далі використовується як мРНК для синтезу білків Gag і Gag-Pol, а також як геномна РНК; |
|||
# неповністю сплайсовані РНК завбільшки близько 4 kb — використовуються як мРНК для синтезу білків Vif, Vpr, Tat, Vpu і Env; |
|||
# повністю сплайсовані РНК завбільшки близько 2 kb — використовуються як мРНК для синтезу білків Vpr, Tat, Rev і Nef. |
|||
На ранній стадії експресії генів, за відсутність білка Rev, несплайсована і неповністю сплайсовані РНК ВІЛ-1 нестабільні й швидко руйнуються в ядрі. Водночас повністю сплайсовані мРНК ВІЛ-1 є стабільними і транспортуються з ядра в цитоплазму<ref name="pmid22355797">{{Cite pmid|22355797}}</ref>. В цитоплазмі за допомогою [[Рибосома|рибосом]] відбувається процес [[Трансляція (біологія)|трансляції]] — [[Біосинтез білків|біосинтез білка]] з [[Амінокислоти|амінокислот]] за заданою матрицею на основі [[Генетична інформація|генетичної інформації]], що міститься в мРНК. Синтезований в цитоплазмі білок Rev транспортується в ядро, де зв'язується з областю RRE несплайсованої й неповністю сплайсованих РНК, що стабілізує ці РНК. Крім того, Rev взаємодіє з клітинним білком [[XPO1|CRM1]] ([[XPO1|експортин]] 1), і ця взаємодія стимулює транспорт несплайсованої й неповністю сплайсованих РНК з ядра в цитоплазму, де відбувається синтез закодованих у них білків. |
|||
=== Збирання й відбрунькування віріонів === |
|||
Геномна РНК вірусу, а також вірусні білки транспортуються до місць збирання віріонів — до мембрани. Віріони спочатку формуються з поліпротеїнів-попередників структурних білків і ферментів і на цій стадії не є інфекційними. Під час дозрівання вірусної частинки вірусна протеаза розщеплює білки-попередники до функціональних компонентів<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref>. Кілька схвалених противірусних препаратів інгібують роботу протеази і перешкоджають формуванню зрілих віріонів. |
|||
Нові вірусні частинки відбрунькувуються від поверхні клітини, захоплюючи частину її мембрани, і виходять у кров'яне русло, а клітина хазяїна, що несе рецептор CD4, гине<ref name="autogenerated12">{{Cite pmid|8599114}}</ref>. Нещодавні дослідження показали, що процес відбруньковування віріонів може бути більш складним, ніж вважали раніше. Так було виявлено, що завдяки взаємодії білка Gag з компонентами клітини віріони накопичуються в особливих внутрішньоклітинних [[Везикула|мультивезикулярных]] тільцях, які зазвичай слугують для експорту білків. Таким чином вірусні частинки вивільняються з клітини, експлуатуючи її власну систему транспорту макромолекул<ref name="NIAID">[http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/relationshipHIVAIDS.aspx NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome]</ref>. |
|||
=== Поширення організмом === |
|||
[[Віріон]] ВІЛ, що тільки-но виділився з зараженого лімфоцита у [[Плазма крові|плазмі крові]] живе в середньому близько 8 годин<ref name="ncbi.hiv">{{Cite web|url=http://www.math.umt.edu/bardsley/courses/495/Projects/HIV/PerelsonEtAl1996.pdf|title=HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time|publisher=Science. 1996 Mar 15;271(5255):1582-6.|language=en|accessdate=2014-08-23|archiveurl=https://web.archive.org/web/20160305014116/http://www.math.umt.edu/bardsley/courses/495/Projects/HIV/PerelsonEtAl1996.pdf|archivedate=2016-03-05|deadlink=yes}} [https://www.ncbi.nlm.nih.gov/pubmed/8599114 PMID 8599114]</ref>. Тривалість напівжиття (час, за який гине 50 % віріонів ВІЛ) у [[Плазма крові|плазмі крові]] становить приблизно 6 годин. В інших середовищах тривалість напівжиття віріонів ВІЛ на [[Порядок величини|порядки]] менше. |
|||
Під час гострої фази ВІЛ-інфекції відсутність специфічної [[Імунітет (медицина)|імунної]] відповіді дозволяє вірусу активно реплікуватися й досягати високих концентрацій у крові. Вірус заселяє органи [[Лімфатична система|лімфатичної системи]], CD4<sup>+</sup>-лімфоцити, макрофаги, а також інші клітини: [[Альвеолярний макрофаги|альвеолярні макрофаги]] легень, [[клітини Лангерганса]], [[фолікулярні дендритні клітини]] [[Лімфатичний вузол|лімфатичних вузлів]], клітини [[Олігодендроцит|олігодендроглії]] й [[Астроцит|астроцити]] мозку і епітеліальні клітини кишки<ref name="autogenerated17">[http://uhrn.civicua.org/library/art_ru/hiv.htm ВИЧ-инфекция Под ред. Ю. В. Лобзина, С. С. Козлова, А. Н. Ускова, 2000 год.]</ref><ref>{{Cite pmid|11821899}}</ref>. У лімфоїдній тканині ВІЛ розмножується протягом усього захворювання, вражаючи макрофаги, активовані і спокійні CD4<sup>+</sup>-лімфоцити і фолікулярні дендритні клітини<ref name="autogenerated6">{{Cite pmid|12163303}}</ref><ref>{{Cite pmid|9329969}}</ref>. Кількість клітин, що містять провірусну ДНК, у лімфоїдній тканині в 5-10 разів вища, ніж серед клітин крові, а реплікація ВІЛ в лімфоїдній тканини на 1-2 порядки вища, ніж у крові. Основним клітинним резервуаром ВІЛ є CD4<sup>+</sup>-Т-лімфоцити імунологічної пам'яті<ref>Siliciano RF, Greene WC. «HIV latency». Cold Spring Harb Perspect Med. 2011 Sep;1(1): a007096. doi: 10.1101/cshperspect.a007096</ref>. |
|||
Для активації CD8<sup>+</sup>-лімфоцитів і утворення антиген-специфічних цитотоксичних T-лімфоцитів потрібна [[Презентація антигену|презентація]] пептидного антигену в комплексі з [[Людський лейкоцитарний антиген|людським лейкоцитарним антигеном]] класу I. Дендритні клітини, потрібні для початку первинних антиген-специфічних реакцій, захоплюють антигени, переробляють і переносять їх на свою поверхню, де ці антигени в комплексі з додатковими стимулювальними молекулами активують Т-лімфоцити. Заражені клітини часто не виділяють ''додаткових'' стимулювальних молекул і тому не здатні викликати активацію достатньої кількості B - і T-лімфоцитів, функція яких залежить від дендритних клітин. |
|||
На 2018 рік ВІЛ-інфекція досі залишається невиліковним захворюванням, оскільки геном вірусу інтегрується в хромосоми клітин і може реактивуватися навіть після курсу антиретровірусної терапії. Нині йде пошук безпечних способів редагування геному людини та виключення з нього провірусної ДНК<ref>{{Cite web|url=http://arvt.ru/news/2014-06-22-CRISPR-Cas9-CCR5-delta32.html|title=Генетический ластик для ВИЧ|publisher=Фонд развития межсекторного социального партнёрства|language=ru|accessdate=2014-07-21}}</ref><ref>{{Cite pmid|24927590}}</ref>. 2014 року запропоновано метод видалення геному ВІЛ-1 інфікованих клітин за допомогою [[Cas9|системи CRISPR/Cas9]]. За допомогою цього методу дослідникам вдалося вирізати фрагмент провірусної ДНК, розташований між 5'- і 3'-кінцевими LTR-областями з хромосом заражених клітин у культурі. Крім того, цей метод виявився також ефективним для профілактики зараження неінфікованих клітин. Описаний підхід може привести до розробки способу повного позбавлення від ВІЛ-інфекції<ref>{{Cite pmid|25049410}}</ref><ref>{{Cite web|url=http://www.nkj.ru/news/24712/|title=Клетки человека избавили от ВИЧ|date=2014-07-25|last=Кирилл Стасевич|website=[[Наука и жизнь]]|publisher=nkj.ru|accessdate=2014-07-27|language=ru}}</ref>. |
|||
== Природна стійкість до ВІЛ == |
|||
Описано випадки стійкості людей до ВІЛ. Проникнення вірусу в клітину імунної системи пов'язане з його взаємодією з поверхневим [[Рецептор (білок)|рецептором]], білком [[CCR5]]. [[Делеція (біологія)|Делеція]] (втрата ділянки гена) CCR5-дельта32 призводить до несприйнятливості її носія до ВІЛ. Передбачають, що ця мутація виникла приблизно дві з половиною тисячі років тому і з часом поширилася в [[Європа|Європі]]. Нині до ВІЛ фактично стійкий в середньому один відсоток жителів Європи, 10-15% європейців мають часткову опірність до ВІЛ<ref>{{Cite web|url=http://archive.wired.com/medtech/health/news/2005/01/66198?currentPage=all|title=Genetic HIV Resistance Deciphered|last=Randy Dotinga|publisher=WIRED.com // Condé Nast|language=en|accessdate=2014-07-21}}</ref>. 0,1–0,3% російського населення майже несприйнятливі до ВІЛ<ref>{{Публікація|статья|автор=Кузнецов|автор ім'я=Даниил|тип=журн.|видання=[[Популярная механика]]|рік=2018|номер=9|сторінки=|архів=|архів дата=}}</ref>. Вчені [[Ліверпульський університет|Ліверпульського університету]] пояснюють поширення мутації гена ''CCR5'' тим, що вона посилює опірність до бубонної [[Чума|чуми]]. Епідемія «<nowiki/>[[Чорна смерть|чорної смерті]]<nowiki/>» 1347 року (а в Скандинавії ще й [[1711|1711 року]]) сприяла збільшенню частоти цього генотипу в Європі. |
|||
Мутація в гені [[CCR2]] також зменшує шанс проникнення ВІЛ в клітину і призводить до затримки розвитку СНІДу. Існує невеликий відсоток ВІЛ-позитивних людей (близько 10 %), у яких СНІД не розвивається протягом тривалого часу. Їх називають [[Нонпрогрессор|нонпрогресорами]] (nonprogressors)<ref>{{Cite pmid|19317737}}</ref><ref>{{Cite pmid|12170257}}</ref>. |
|||
Важливий клітинний компонент захисту проти ВІЛ — антивірусний білок APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, яка синтезується під час зворотної транскрипції. APOBEC3G інактивується білком Vif ВІЛ-1, який викликає його убіквітинілювання і деградацію<ref>Sheehy AM, Gaddis NC, Choi JD, Malim MH (2002) Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral Vif protein. Nature. 2002 Aug 8;418 (6898):646-650.</ref>. |
|||
Виявлено, що одним з головних елементів антивірусного захисту людини та інших [[Примати|приматів]] є білок [[TRIM5a]], здатний розпізнавати [[капсид]] вірусних частинок і перешкоджати розмноженню вірусу в клітині. TRIM5a людини і шимпанзе дещо різняться й ефективні проти різних вірусів: цей білок захищає шимпанзе від ВІЛ та споріднених йому вірусів, а людину — від вірусу [[PtERV1]]<ref>{{Стаття|видання=Science|номер=5832|сторінки=1756—1758|мова=en|тип=journal|автор=Kaiser, Shariser|число=22|місяць=6|рік=2007}}</ref>. Мавпи [[Новий світ|Нового Світу]], за винятком [[Мірікіна|мірікіни]], яка має [[Химерні білки|химерний ген]] ''TRIM5-CypA'', стійкості до ВІЛ не мають<ref name="Sayah2004">{{Cite pmid|15243629}}</ref>. |
|||
Інший важливий елемент антивірусного захисту — інтерферон-індукований трансмембранний білок [[BST2|CD317]]/BST-2 ({{lang-en|bone marrow stromal antigen 2}})<ref name="Neil S.J. 2008">{{Cite pmid|18200009}}</ref><ref name="Van Damme N. 2008">{{Cite pmid|18342597}}</ref><ref name="Tokarev A. 2009">{{Cite pmid|19929170}}</ref>. CD317 — трансмембранний білок 2-го типу з незвичайною топологією: він має трансмембранний домен поруч з N-кінцем і глікозилфосфатидилінозитол (GPI) на С-кінці, між якими розташований позаклітинний домен<ref>{{Cite pmid|12956872}}</ref>. Показано, що CD317 безпосередньо взаємодіє зі зрілими дочірніми віріонами, «прив'язуючи» їх до поверхні клітини<ref name="Perez-Caballero D. 2009">{{Cite pmid|19879838}}</ref>. Для пояснення механізму такого «прив'язування» запропоновано кілька альтернативних моделей, які, проте, сходяться в наступному: молекули CD317 формують паралельний гомодимер; один або два гомодимери зв'язуються одночасно з одним виріоном і клітинною мембраною. При цьому з мембраною віріона взаємодіють або обидва мембранні «якорі» (трансмембранний домен і GPI) однієї з молекул CD317, або один з них. Спектр активності CD317 включає, принаймні, чотири сімейства вірусів: ретровіруси, філовіруси, аренавіруси і герпесвіруси. Активність цього клітинного фактора інгібується білками Vpu ВІЛ-1, Env ВІЛ-2 і SIV, Nef SIV, глікопротеїном оболонки вірусу Ебола і білком К5 герпесвірусу саркоми Капоші<ref name="guatelli">{{Cite pmid|20012522}}</ref><ref name="Nomaguchi M. 2008">{{Cite pmid|18672082}}</ref><ref name="autogenerated1">{{Cite pmid|21176220}}</ref><ref name="autogenerated2">{{Cite pmid|20201792}}</ref><ref>{{Cite pmid|20485522}}</ref><ref>{{Cite pmid|20688520}}</ref>. Виявлено кофактор білка CD317 — клітинний білок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — [[Убіквітин-лігаза|Е3-убіквітинлігаза класу RING]]. BCA2 посилює інтерналізацію віріонів ВІЛ-1, «прив'язаних» білком CD317 до поверхні клітини, в CD63<sup>+</sup> внутрішньоклітинні везикули з їхнім подальшим руйнуванням у [[Лізосома|лізосомах]]<ref>{{Cite pmid|20019814}}</ref>. |
|||
== Редагування геному людини == |
|||
У січні 2019 року [[Уряд Китайської Народної Республіки|влада Китаю]] підтвердила народження в [[Шеньчжень|Шеньчжені]] [[Лулу і Нана|перших у світі]] генетично модифікованих людей, у яких відредагували ген [[CCR5]], відповідальний за взаємодію з ВІЛ, а також почала розслідування щодо біолога [[Хе Цзянькуй|Хе Цзянькуя]]. Передбачають, що генно-модифіковані діти не можуть захворіти на ВІЛ. |
|||
== Міфи == |
== Міфи == |
||
| Рядок 119: | Рядок 315: | ||
== Див. також == |
== Див. також == |
||
* [[ВІЛ серед ЧСЧ та транс-людей в Україні]] |
* [[ВІЛ серед ЧСЧ та транс-людей в Україні]] |
||
* [[Тімоті Рей Браун]] («Берлінський пацієнт») — перша людина, яка вилікувалась від ВІЛ/СНІДу. |
|||
* [[Роберт Рейфорд]] («пацієнт зіро») — перша зареєстрована жертва ВІЛ/СНІДу в Північній Америці. |
|||
* [[Арвід Ное]] — перша зареєстрована жертва ВІЛ/СНІДу в Європі. |
|||
* [[Грете Раск]] — одна з перших жертв ВІЛ/СНІДу в Європі. |
|||
* [[Гаетан Дюга]] — канадський бортпровідник, що зробив значний внесок у поширення вірусу в Північній Америці. Раніше його помилково ідентифікували як «нульового пацієнта». |
|||
== Примітки == |
== Примітки == |
||
| Рядок 148: | Рядок 349: | ||
|archivedate = |
|archivedate = |
||
}} |
}} |
||
* {{Книга|автор=Bushman F.D., Nabel G.J., Swanstrom R. (Editors)|частина=|оригінал=|видання=|місце=Cold Spring Harbor, New York, USA|видавництво=Cold Spring Harbor Laboratory Press|рік=2012|сторінки=|сторінок=572|isbn=978-193611340-8}} |
|||
* {{Книга|автор=Levy J.A.|частина=|оригінал=|видання=Third edition|місце=|видавництво=ASM Press|рік=2007|сторінок=644|isbn=978-1-55581-393-2|ref=Levy J.A.}} |
|||
* {{Книга|автор=Pancino G., Silvestri G., Fowke K. (Editors)|частина=|оригінал=|видання=|місце=UK-USA-Canada|видавництво=Academic Press|рік=2012|сторінки=|сторінок=345|isbn=978-0-12-387715-4}} |
|||
* {{Книга|автор=Pepin J.|частина=|оригінал=|видання=|місце=New York, USA|видавництво=Cambridge University Press|рік=2011|сторінки=|сторінок=293|isbn=978-0-52118637-7}} |
|||
* {{Книга|автор=Prasad V.R., Kalpana G.V. (Editors)|частина=|оригінал=|видання=|місце=|видавництво=Humana Press|рік=2009|сторінки=|сторінок=457|isbn=978-1-58829-859-1}} |
|||
* {{Книга|автор=Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors)|частина=|оригінал=|видання=|місце=|видавництво=Jones and Bartlett Learning|рік=2012|сторінки=|сторінок=248|isbn=978-1-4496-5092-6}} |
|||
* {{Книга|автор=Spearman P., Freed E.O. (Editors)|частина=|оригінал=|видання=|місце=|видавництво=Springer|рік=2009|сторінки=|сторінок=204|isbn=978-3-642-02174-9}} |
|||
* {{Книга|автор=Weeks B.B., Alcamo I.E.|частина=|оригінал=|видання=|місце=USA - Canada - UK|видавництво=Jones and Bartlett Publishers|рік=2010|сторінки=|сторінок=360|isbn=978-0-7637-6324-4}} |
|||
== Посилання == |
== Посилання == |
||
| Рядок 154: | Рядок 363: | ||
*[https://gettest.com.ua/najbezgluzdishi-legendi-pro-vil-v-yaki-soromno-viriti/ Найбезглуздіші легенди про ВІЛ, в які соромно вірити] |
*[https://gettest.com.ua/najbezgluzdishi-legendi-pro-vil-v-yaki-soromno-viriti/ Найбезглуздіші легенди про ВІЛ, в які соромно вірити] |
||
*[[ВІЛ-інфекція в Україні]] |
*[[ВІЛ-інфекція в Україні]] |
||
*[http://www.unaids.org/ru/ ЮНЭЙДС объединенная программа ООН по ВИЧ/СПИДУ] {{ref-ru}} |
|||
* [http://www.ifp.kiev.ua/doc/people/vil-pop/vil-pop1.htm Популярно про ВІЛ-інфекцію] |
* [http://www.ifp.kiev.ua/doc/people/vil-pop/vil-pop1.htm Популярно про ВІЛ-інфекцію] |
||
* [http://m-l.com.ua/?aid=725 Питання діагностики та терапії ВІЛ-інфекції/СНІД] |
* [http://m-l.com.ua/?aid=725 Питання діагностики та терапії ВІЛ-інфекції/СНІД] |
||
| Рядок 160: | Рядок 368: | ||
* [http://panatseyko.antiaids.org/ep04.html Доктор Панацейко та його поради], анімаційний проект фонду [[Франчук Олена Леонідівна|Олени Франчук]] «[[АнтиСНІД]]» |
* [http://panatseyko.antiaids.org/ep04.html Доктор Панацейко та його поради], анімаційний проект фонду [[Франчук Олена Леонідівна|Олени Франчук]] «[[АнтиСНІД]]» |
||
{{ЗПСШ}} |
{{ЗПСШ}} |
||
{{Virus-stub}} |
|||
{{бібліоінформація}} |
{{бібліоінформація}} |
||
[[Категорія:РНК-вмісні віруси]] |
[[Категорія:РНК-вмісні віруси]] |
||
Версія за 11:03, 4 квітня 2020
| Ця стаття містить правописні, лексичні, граматичні, стилістичні або інші мовні помилки, які треба виправити. (лютий 2018) |
| Вірус імунодефіциту людини | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 Стилізоване зображення ВІЛ
| ||||||||||
| Класифікація вірусів | ||||||||||
| ||||||||||
Посилання
| ||||||||||
|
Ві́рус імунодефіци́ту люди́ни або ВІЛ (англ. Human Immunodeficiency Virus, HIV) — вірус імунодефіциту, що призводить до захворювання людини на ВІЛ-інфекцію/СНІД. ВІЛ схильний до стрімких мутацій. Передається через прямий контакт слизових оболонок або крові з рідиною тілесного походження, яка містить ВІЛ, як то кров, сперма, піхвові виділення, передсемінна рідина і грудне молоко. У ході ВІЛ-інфекції в однієї людини формуються все нові штами вірусу, що є мутованими, абсолютно різні за швидкістю відтворення і здатні ініціювати і нищити ті або інші типи клітин.
Геном вірусу складається з двох копій молекули РНК — ВІЛ є ретровірусом.
Історичні відомості
Походження

Вважають, що обидва типи вірусу імунодефіциту людини ВІЛ-1 і ВІЛ-2 виникли в Західній і Центральній Африці південніше Сахари і передалися від мавп до людей (це процес називається зоонозом). ВІЛ-1 виник на півдні Камеруну внаслідок еволюцію ендемічного вірусу імунодефіциту мавп SIV-cpz, який заражає диких шимпанзе (підвиду Pan troglodytes troglodytes)[1][2].
ВІЛ-2 виник на території Західної Африки (від південного Сенегалу до заходу Кот-д'Івуару) внаслідок еволюції вірусу імунодефіциту мавп SIV-smm, який заражає темно-коричневих мангабеїв (Cercocebus atys) і вузьконосих мавп.[3] Проте деякі широконосі мавпи, такі як нічні мавпи є стійкими до ВІЛ-1, можливо, через геномне злиття двох вірусних генів стійкості.[4] ВІЛ-1, як вважають, перестрибнув видовий бар'єр, принаймні тричі, і породив три групи вірусів: M, N і О.[5]
Існує доказ того, що мисливці на диких тварин (мавп) або постачальники м'яса в Західній і Центральній Африці заражаються вірусом імунодефіциту мавп, причому ймовірність зараження корелює з частотою взаємодії з мавпами і їх м'ясом.[6] Однак це слабкий вірус і зазвичай його пригнічує імунна системою людини протягом тижня після зараження. Вважають, що потрібно кілька передач вірусу від людини до людини в швидкій послідовності, щоб вірусу вистачило часу мутувати у ВІЛ.[7]. Хоча передавання вірусу імунодефіциту мавп від людини до людини відбувається рідко, певні соціальні чинники можуть суттєво впливати на частоту заражень. Припускають, що умови для поширення вірусу були несприятливі в Африці до XX століття. Зіставлення періодів прискореної еволюції ВІЛ з соціо-економічними змінами дозволяє робити припущення про природу чинників, що прискорили поширення ВІО і ВІЛ.
Генетичні дослідження показують, що останній спільний предок ВІЛ-1 групи М існував близько 1910 року[8]. Прихильники цієї дати пов'язують поширення ВІЛ з розвитком колоніалізму і зростанням великих колоніальних африканських міст. Ці чинники призвели до соціальних змін у суспільстві, як-от збільшення частоти безладних статевих зв'язків, поширення проституції та захворювань, що передаються статевим шляхом (ЗПСШ)[9]. ЗПСШ, наприклад, сифіліс, можуть супроводжуватися генітальними виразками. Дослідження показують, що ймовірність передачі ВІЛ під час вагінального статевого акту, досить низька за звичайних умов, може збільшитись у десятки, якщо не сотні разів, коли один з партнерів потерпає від генітальних виразок. Про ступінь поширеності ЗПСШ у колоніальних містах на початку 1900-х можна судити з таких цифр: 1928 року щонайменше 45 % мешканок східного Леопольдвіля (нині — Кіншаса, ранній центр поширення ВІЛ групи М) були повіями, а 1933 року близько 15 % усіх мешканців цього ж міста були заражені однією з форм сифілісу. Ретроспективний аналіз показав, що початок епідемії ВІЛ-інфекції в Кіншасі збігся з піком епідемії генітальних виразок у середині 1930-х років[9].
Згідно з альтернативним поглядом, основним чинником, що сприяв адаптації ВІЛ до людей і його поширенню, була небезпечна медична практика в Африці в роки після Другої світової війни, як-от використання нестерильних багаторазових шприців під час масових вакцинацій, ін'єкції антибіотиків і протималярійних засобів[7][10][11].
Під час ретроаналізу зразків крові, взятих після Другої світової війни, зафіксовано найбільш ранній документальний випадок наявності ВІЛ в організмі людини, кров у якої взяли 1959 року[12] Вірус, можливо, був присутній в Сполучених Штатах уже в 1966 році[13], але переважну більшість випадків зараження ВІЛ, ідентифікованих за межами тропічної Африки, можна простежити до однієї невстановленої особи, яка заразилась ВІЛ на Гаїті, а потім перенесла цю інфекцію в США близько 1969 року[14].
Відкриття
Взимку 1981 року до госпіталю Нью-Йоркського університету поступило декілька молодих чоловіків, близько 30 років, з незнайомою формою саркоми Капоші. В той час це захворювання траплялося досить рідко: всього 1-2 випадки на 10 мільйонів населення, переважно в людей похилого віку. Саркома мала злоякісний перебіг: пухлини поширювалися по всьому тілу, виявлялися на слизових оболонках, не піддавалися лікуванню й швидко призводили до смерті.
Навесні 1981 року в Лос-Анджелесі з'явилася ще одна категорія незвичайних хворих — зі злоякісною формою пневмоцистної пневмонії. У 3-х з них пневмоцистне запалення легень супроводжувалося кандидозом.
Влітку 1981 р. у Центр контролю за захворюваннями США в Атланті надійшла інформація вже про 111 пацієнтів з подібним захворюванням. Майже усі вони виникли у чоловіків молодого віку і усі ці особи були гомосексуалами. Висока смертність спонукала організувати обов'язковий облік, спостереження й вивчення усіх випадків нової хвороби.
Появу цих захворювань у молодих людей, що не належать до відповідних груп ризику, спостерігали вперше. Потім виявили такі ж симптоми серед наркоспоживачів, хворих на гемофілію A[15], і гаїтян[16][17]. Найбільш значущим було виявлення зниження співвідношення CD4+/CD8+-клітин внаслідок відносного і/або абсолютного зменшення кількості CD4+-лімфоцитів у поєднанні зі збільшенням кількості CD8+-лімфоцитів[18][19].
Літо 1981 року прийнято вважати початком глобальної епідемії СНІДу. Ретроспективний аналіз сироваток, що зберігалися в Національному Центрі контролю за інфекційними захворюваннями в США, показав, що перші випадки СНІД людини відносяться до 50-х років ХХ сторіччя, захворювання виникло в Африці, а потім поширилося на території інших країн.
Основою раніше невідомого захворювання було різке ослаблення імунітету. У липні 1982 року для позначення цього стану запропоновано термін синдром набутого імунного дефіциту (СНІД, AIDS)[20]. У вересні 1982 року СНІДу дали повноцінне визначення як нозологічній формі на підставі спостереження низки опортуністичних інфекцій у чотирьох груп пацієнтів, зазначених вище[21][22].
У період з 1981 по 1984 рік вийшло кілька робіт, що пов'язували ймовірність розвитку СНІДу з анальним сексом або з впливом наркотиків[23][24][25][26][27][28]. Паралельно йшли роботи над гіпотезою про можливу інфекційну природу СНІДу.
Вірус імунодефіциту людини незалежно відкрили 1983 року в двох лабораторіях: у Інституті Пастера у Франції під керівництвом Люка Монтаньє і в Національному інституті раку в США під керівництвом Роберта Галло. Результати досліджень, у яких із тканин пацієнтів з симптомами СНІДу вперше вдалося виділити новий ретровірус, опубліковано 20 травня 1983 року в журналі Science[29][30]. У цих же роботах виділений з хворих на Снід вірус був вперше успішно розмножили у культивованих Т-лімфоцитах. Французька група дослідників показала, що серологічно цей вірус відрізняється від HTLV-I, і назвала його LAV («вірус, асоційований з лімфаденопатією»), а американська група назвала його HTLV-III, помилково віднісши до групи HTLV-вірусів. Дослідники висунули припущення, що вірус може викликати синдром набутого імунного дефіциту[21].
1986 року виявлено, що віруси, відкриті 1983-го французькими та американськими дослідниками, генетично ідентичні. Початкові назви вірусів скасовано і запропоновано одну спільну назву — вірус імунодефіциту людини[31]. 2008 року Люк Монтаньє і Франсуаза Барр-Сінуссі удостоєні Нобелівської премії в області фізіології або медицини «за відкриття вірусу імунодефіциту людини»[32].
ВІЛ-інфекція
Інфікування
Вірус може передаватися через прямий контакт пошкодженої або непошкодженій слизової оболонки або пошкодженої шкіри здорової людини з біологічними рідинами зараженої людини: кров'ю, передсіменною рідиною (виділяється протягом всього статевого акту), спермою, секретом піхви, грудним молоком. Вірус може передаватись під час незахищеного анального, вагінального або орального сексу[33][34].
Інтактна, неушкоджена шкіра є ефективним бар'єром для інфекції, тому що в шкірі відсутні клітини, які можуть бути заражені ВІЛ. Для успішного інфікування потрібен прямий контакт з кровоносною системою або з мембранами клітин слизових оболонок. Під час статевого акту слизові оболонки статевих органів і прямої кишки часто зазнають незначних пошкоджень, через які вірус може потрапляти в кров. Такі пошкодження частіше виникають за наявності захворювань, що передаються статевим шляхом, наприклад, у разі герпесу. Тому особливо небезпечною формою статевого акту для партнера, що приймає, є незахищений анальний секс, бо за цієї форми виникає найбільша кількість дрібних і великих пошкоджень[35][36]. З іншого боку, зараження можливе і в разі непошкодженої слизової оболонки, оскільки слизова оболонка містить значну кількість дендритних клітин (зокрема, клітин Лангерганса), які можуть відігравати роль «носіїв» вірусних частинок у лімфатичні вузли.
З більшою ймовірністю вірус передається внаслідок використання заражених голок та шприців (особливо споживачами ін'єкційних наркотиків), а також під час переливання крові (якщо медичний персонал порушив встановлені процедури перевірки донорської крові)[37]. Також вірус може передатись від матірі до дитини під час вагітності, пологів (зараження через кров матері)[38][39] та під час грудного вигодовування (причому і від зараженої матері до здорової дитини через грудне молоко, і від зараженої дитини до здорової матері внаслідок покусування грудей під час годування)[40].
Вірус не передається повітряно-крапельним шляхом, побутовим шляхом, стикаючись з непошкодженою шкірою, через укуси більшості кровосисних комах[41] (виняток мухи-жигалки), сльози і слину (через те, що концентрація віріонів ВІЛ у цих рідинах нижча за інфікувальну дозу, а також завдяки тому, що слина — агресивне середовище, руйнує своїми ферментами віріони ВІЛ)[42].
Хвороба
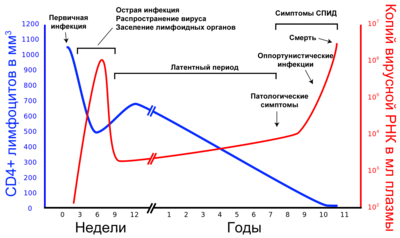
У перебігу хвороби виділяють три стадії: гостру інфекцію, латентний період і термінальну стадію (СНІД) (див. ілюстрацію). У ході розвитку ВІЛ-інфекції у однієї й тієї ж людини внаслідок мутацій виникають нові штами вірусу, які різняться за швидкістю відтворення та здатністю інфікувати[44][45]. Розмножившись, вірусні частинки вивільняються з уражених клітин і впроваджуються в нові — цикл розвитку повторюється. Інфіковані вірусом Т-хелпери поступово гинуть через руйнування вірусом, апоптозу або знищення Т-кілерами. У процесі розвитку ВІЛ-інфекції кількість Т-хелперів (CD4+-клітин) знижується настільки, що організм вже не може протистояти збудників опортуністичних інфекцій, які безпечні або мало небезпечні для здорових людей з нормально функціонуючої імунної системою. На термінальній стадії (СНІД) ослаблений організм вражають бактеріальні, грибкові, вірусні і протозойні інфекції, а також пухлини[46][47][48]. У відсутність антиретровірусної терапії смерть пацієнта настає не в результаті розмноження вірусу в CD4+-клітинах, а з причини розвитку опортуністичних захворювань (вторинних по відношенню до ВІЛ-інфекції).
Епідеміологія

| Інформація в цьому розділі застаріла. (лютий 2018) |
Згідно з доповіддю «Об'єднаної програми ООН по ВІЛ/СНІД» 2008 р.
- Кількість людей, які живуть з ВІЛ/СНІД, у 2008 р.
- Усього — 39,5 мільйона (34,1 — 47,1 мільйона): Дорослих — 37,2 мільйона (32,1 — 44,5 мільйона): Жінок — 17,7 мільйона (15,1 — 20,9 мільйона): Дітей молодших 15 років — 2,3 мільйона (1,7 — 3,5 мільйона)
- Кількість людей, які заразилися ВІЛ у 2008 р.
- Усього — 4,3 мільйона (3,6 — 6,6 мільйона): Дорослих — 3,8 мільйона (3,2 — 5,7 мільйона): Дітей молодших 15 років — 530,000 (410,000 — 660,000)
- Кількість смертей від СНІД у 2008 р.
- Усього — 2,9 мільйона (2,5 — 3,5 мільйона): Дорослих — 2,6 мільйона (2,2 — 3,0 мільйона): Дітей молодших 15 років — 380,000 (290,000 — 500,000)
При цьому, з загальної кількості інфікованих, дві третини (63 % — 24,7 млн.[21,8 — 27,7 млн.]) усіх дорослих та дітей з ВІЛ у світі живуть в країнах Африки на південь від пустелі Сахара, переважно у південній частині Африки. Одна третина (32 %) усіх людей з ВІЛ у світі живе в цьому регіоні, і тут також сталися 34 % усіх смертей від СНІД у 2008 році.
19 липня 2016 року Американський Інститут показників і оцінки здоров'я оприлюднив дослідження щодо інфікування ВІЛ та захворювання на СНІД у 2005—2015 роках, у якому на тлі глобальних успіхів Україна показала невтішну статистику. Показники смертності від захворювання на СНІД, який спричинює ВІЛ, на глобальному рівні скорочується. Про це йдеться у звіті американського Інституту показників і оцінки здоров'я (англ. IHME).
Водночас, зазначається в документі, в окремих країнах за минуле десятиріччя показники нових інфікувань ВІЛ суттєво зросли. Серед країн найбільшу кількість випадків нових інфікувань зафіксували у Росії (57 340) та Україні (13 490)[49].
Серед світових антилідерів за зростанням відносного показника нових захворювань у 2005—2015 роках опинилися також Єгипет, Пакистан, Кенія, Філіппіни, Мексика та Камбоджа. Загалом кількість нових інфікувань за 10 років в середньому падала лише на 0,7 відсотка на рік порівняно із річним спадом на 2,7 відсотка у 1997—2005 роках. Дослідники занепокоєні, що через це світові зусилля з подолання епідемії ВІЛ/СНІДу до 2030 року можуть зійти нанівець.
За даними на 2011 рік, у світі за весь час на ВІЛ-інфекцію захворіли 60 мільйонів осіб, з них: 25 мільйонів померли, а 35 мільйонів живуть з ВІЛ-інфекцією[50]. Понад дві третини з них мешкають в Африці на південь від пустелі Сахара[51]. Епідемія почалася тут наприкінці 1970-х — на початку 1980-х років. Потім епідемія перекинулася в США, Західну Європу та країни Південної Африки. Сьогодні, за винятком країн Африки, найшвидше вірус поширюється в Центральній Азії та Східній Європі (зокрема в Росії). Епідемічна ситуація в цих регіонах стримувалася до кінця 1990-х, потім з 1999 по 2002 роки кількість інфікованих майже потроїлася — здебільшого за рахунок ін'єкційних наркоманів. Значно нижче середнього ВІЛ-інфекція поширена в Східній Азії, Північній Африці і на Близькому Сході. У масштабі планети епідемічна ситуація стабілізувалася, кількість нових випадків ВІЛ-інфекції знизилася з 3,5 мільйонів 1997 року до 2,7 мільйонів 2007 року.
Діагностика
Аналіз крові дозволяє виявити антитіла до білків вірусу (ІФА), реакцію антитіл на білки вірусу (вестерн-блот), РНК вірусу (ЗТ-ПЛР)[52]. Визначення вірусного навантаження (підрахунок кількості копій РНК вірусу в мілілітрі плазми крові) дозволяє судити про стадію захворювання та ефективність лікування[53][54].
Обов'язкова перевірка донорської крові в розвинених країнах значною мірою скоротила можливість передачі вірусу через неї. Тестування на ВІЛ вагітних жінок дозволяє своєчасно розпочати вживання ліків і народити здорову дитину.
Існує думка, що примусове тестування населення безперспективне з погляду стримування епідемії[55] і порушує права людини[56]. У Росії проведення тесту без згоди людини є незаконним[57], однак існують ситуації, в яких надання результатів тестування на ВІЛ є обов'язковим, але не насильницьким (донорство, працевлаштування медичних працівників, для іноземних громадян, які отримують дозвіл на перебування в РФ, в місцях позбавлення волі за наявності клінічних показань)[58].
Лікування
| 1. Наскільки близько ми до звільнення від ВІЛ-інфекції // Канал «Цікава наука» на YouTube, 26 лютого 2020. | |
З-поміж 35 мільйонів осіб, що живуть з ВІЛ-інфекцією, частина залишається в живих завдяки антиретровірусній терапії. За відсутності антиретровірусної терапії ВІЛ-інфекції, смерть настає в середньому через 9-11 років після зараження[44][59]. Якщо проводити антиретровірусну терапію тривалість життя пацієнта зростає до 70-80 років[60][61][62]. Антиретровірусні препарати заважають ВІЛ розмножуватися в клітинах імунної системи людини, блокуючи проходження віріонів у клітини й порушуючи на різних етапах процес збирання нових віріонів. Своєчасно розпочате лікування антиретровірусними препаратами в сотні разів знижує ризик розвитку СНІДу та подальшої смерті[63][64][65]. Антиретровірусні препарати у частини пацієнтів викликають побічні ефекти, в деяких випадках навіть вимагають змінити схему лікування (набір ліків).
Терапію призначають у разі зниження імунітету та/або високого вірусного навантаження. Якщо кількість CD4+-лімфоцитів велика й вірусне навантаження низьке, терапію не призначають. Після призначення терапії ліки потрібно вживати щодня в один і той же час і довічно, що створює незручності для пацієнтів. Крім того, слід враховувати високу вартість місячного курсу ліків. 2014 року необхідні ліки отримувала менш як половина з 9,5 млн осіб, що потребують противірусної терапії[66].
Також усі вагітні жінки з ВІЛ-інфекцією повинні починати негайну ВААРТ, щоб запобігти передаванню ВІЛ плоду[67].
Згідно з рекомендаціями ВООЗ, ВААРТ слід негайно починати всім ВІЛ-інфікованим дітям до півтора років[68]. Початок терапії у дітей, які набули ВІЛ від матері, впродовж 3 місяців після пологів знижує смертність на 75 %[69]. За відсутності лікування третина ВІЛ-інфікованих дітей помирає протягом першого року життя і 50 % - протягом другого року. Якщо діагностика ВІЛ неможлива, лікування слід починати у віці 9 місяців, або раніше, у разі з'яви симптомів[70].
Станом на лютий 2016 року було оголошено, що групі німецьких вчених вдалося повністю видалити тип ВІЛ-1 з живих клітин. Випробування проводили на клітинах людини, вживлених піддослідним мишам. Випробування на людях повинні проводити найближчим часом[71][72][73].
2018 року Адміністрація з контролю над продуктами і ліками (FDA) схвалила ібалізумаб (ibalizumab-uiyk) для застосування в терапії пацієнтів з мультирезистентним ВІЛ-1. Препарат являє собою моноклональне антитіло, що зв'язується з CD4 рецепторами T-клітин та пригнічує процес проходження вірусу в клітину людини. Ібалізумаб можна застосовувати в терапії з іншими антиретровірусними препаратами. За результатами клінічних досліджень за участю 40 пацієнтів, які раніше лікувались більш ніж 10 різними антиретровірусними агентами, вірусне навантаження знизилось у більшості випробовуваних через один тиждень після введення першої дози препарату. Через 24 тижні терапії вірусологічної супресії досягнуто в 43 % учасників клінічних випробувань[74].
ВІЛ 2019 року вносили в список десяти основних проблем охорони здоров'я, які потребують особливої уваги ВООЗ[75].
Більшість діючих речовин блокують зворотну транскриптазу вірусу.
Профілактика
За оцінками, 2,1 мільйона підлітків жили з ВІЛ у 2016 році, переважно з більшості країн Африканського регіону за данними ВООЗ. Хоча загальна кількість смертей, пов’язаних із ВІЛ, зменшується з моменту піку 2006 року, за оцінками, це не стосується підлітків. Це відображає той факт, що більшість сучасних підлітків народилися до того, як профілактика передачі ВІЛ від матері до дитини антиретровірусною терапією набула широкого поширення. Однак значна частина ВІЛ-позитивних підлітків не знає про свій статус, і багато хто з тих, хто знає про свій статус, не отримують ефективного, тривалого антиретровірусного лікування.
Однією з конкретних цілей цілі сталого розвитку в галузі охорони здоров'я (SDG 3) є те, що до 2030 року слід припинити епідемію СНІДу, туберкульозу, малярії та занедбаних тропічних захворювань, гепатитів, захворювань, що передаються водою та інших інфекційних захворювань. Враховуючи високу поширеність ВІЛ у багатьох країнах, для досягнення цієї мети підліткам потрібно буде займати центральне місце для контролю зусиль та сталої профілактики ВІЛ.
Молоді люди повинні знати, як захистити себе від ВІЛ-інфекції та повинні мати засоби для цього:
- можливість отримання презервативів для запобігання передачі вірусу статевим шляхом.
- необхідний кращий доступ до тестування та консультування на ВІЛ та посилення наступних зв’язків із службами лікування ВІЛ для тих, хто отримав ВІЛ-позитивний результат.[76]
Стійкість до ліків
ВІЛ має велику здатність мутувати. Наприклад, відомо більше 20 мутацій (підвидів) протеїну NC (p7). Більшість таких вірусів менш шкідливі (патогенні), ніж вихідний й розмножуються повільніше. З іншого боку, вони можуть мати вищу стійкість проти певного медикаменту. Під час лікування певним препаратом існує етап, коли більшість «старого» типу вірусу загинула, а «мутант» все ще не викорінений. Переривання лікування на цій стадії призводить до резистентності й пацієнт виявляється ураженим формою вірусу стійкою до даного препарату. Найпоширенішою є мутація кількох амінокислот зворотної транскриптази, що приводить до стійкості до одного з перших препаратів-блокаторів зворотної транскрипції вірусу.
Класифікація

Висока мінливість вірусу (0,003 %/на нуклеїнову основу/цикл реплікації) ВІЛ є однією з причин, що сильно ускладнюють розробку антиретровірусних ліків.
Вірус імунодефіциту людини належить до родини ретровірусів (Retroviridae), роду лентивірусів (Lentivirus). Назва Lentivirus походить від латинського слова lente — повільний. Така назва віддзеркалює одну з особливостей вірусів цієї групи, а саме — повільну і неоднакову швидкість розвитку інфекційного процесу в макроорганізмі. Для лентивірусів також характерний тривалий інкубаційний період[77].
Для вірусу імунодефіциту людини характерна висока частота генетичних змін, що виникають у процесі самовідтворення. Частота виникнення помилок у ВІЛ становить 10-3 — 10-4 помилок на геном на цикл реплікації, що на кілька порядків перевищує аналогічну величину в еукаріотів. Розмір геному ВІЛ становить приблизно 104 нуклеотидів. З цього випливає, що практично кожен дочірній геном хоча б на один нуклеотид відрізняється від свого попередника. У сучасній класифікації розрізняють два основні види ВІЛ — ВІЛ-1 і ВІЛ-2. Ці віруси ймовірно виникли внаслідок незалежної передачі людям SIV (вірусу імунодефіциту мавп) шимпанзе і мангабеїв відповідно[78].
І ВІЛ-1 і ВІЛ-2 здатні викликати серйозний імунодефіцит, однак клінічний перебіг хвороби дещо різниться. Відомо, що ВІЛ-2 менш патогенний і передається з меншою ймовірністю, ніж ВІЛ-1. Ймовірно, це пов'язано з тим, що для інфекції ВІЛ-2 характерне менше число вірусних частинок на мілілітр крові. Відзначено, що інфекція ВІЛ-2 забезпечує носієві деякий незначний захист від зараження ВІЛ-1. Проте описано випадки подвійної інфекції, причому зараження може відбуватися в будь-якому порядку. Інфекція ВІЛ-2 рідше спричиняє розвиток СНІДу. Є відомості про дещо більшу частоту розвитку саркоми Капоші, кандидозу ротової порожнини та хронічної лихоманки при ВІЛ-1/СНІД. При ВІЛ-2/СНІД частіше розвивається енцефаліт, або хронічна бактеріальна діарея, серйозні цитомегаловірусні інфекції і холангіт[78]. До роду Lentivirus також відносять види, що спричиняють схожі захворювання в мавп, кішок, коней, овець і т. д.[44][79][80].
ВІЛ-1
ВІЛ-1 описаний 1983 року і є найбільш поширеним і патогенним видом ВІЛ[81]. Глобальна епідемія ВІЛ-інфекції головним чином обумовлена поширенням ВІЛ-1. У переважній більшості випадків, якщо не зазначено інше, під ВІЛ мають на увазі ВІЛ-1[82].
Вид ВІЛ-1 поділяють на головну групу М і кілька побічних груп. Вважають, що групи M, N, O, P утворилися внаслідок незалежних випадків передачі SIV від мавпи до людини, і подальшої мутації вірусу до ВІЛ[83].
- Віруси групи М (англ. main — основна) є причиною понад 90 % випадків ВІЛ-інфекції. Групу М поділяють на кілька клад, званих підтипами, що їх також позначають літерами:
- підтип A масово поширений, наприклад, у Західній Африці та Росії[84];
- підтип B домінує в Європі, Північній Америці, Південній Америці, Японії, Таїланді, Австралії[85];
- підтип C переважає у Південній і Східній Африці, Індії, Непалі, деяких частинах Китаю;
- підтип D виявлений тільки в Східній і Центральній Африці;
- підтип E не виявлений у нерекомбинантному вигляді, лише спільно з підтипом А як CRF01_AE в Південно-Східній Азії;
- підтип F виявлений у Центральній Африці, Південній Америці та Східній Європі[86];
- підтип G і рекомбінантна форма CRF02_AG виявлені в Африці і Центральній Європі;
- підтип H виявлений тільки в Центральній Африці;
- підтип I запропоновано для опису штаму-продукту множинної рекомбінації CRF04_cpx декількох підтипів[87];
- підтип J поширений в Північній, Центральній і Західній Африці і країнах Карибського басейну[88];
- підтип K виявлений тільки в Конго і Камеруні.
- Група O (англ. outlier — несхожий) виявлена у Центральній Африці і Західній Африці. Найбільш поширена в Камеруні, де 1997 року понад 2 % пацієнтів були заражені вірусом групи[89] (близько 100 000 осіб, за даними на 2013 рік)[90]. Віруси цієї групи не визначалися ранніми версіями тест-систем на ВІЛ-1; сучасні тести визначають віруси і групи O, і групи N[91].
- Група N (англ. non-M, non-O — ні M, ні O) позначає штами не М і не O, описана 1998 року і виявлена тільки в Камеруні. Від 2006 року виявлено лише 10 заражень вірусами групи N[92].
- Група P — 2009 року визначено нуклеотидну послідовність РНК ВІЛ, значною мірою схожу з вірусом імунодефіциту мавп, описаним у горил (SIVgor), але не із SIV, характерним для шимпанзе (SIVcpz). Вірус виділено зі зразків, отриманих від жінки камерунського походження, що проживає у Франції[93][94][95].
ВІЛ-2
ВІЛ-2 ідентифіковано 1986 року[96], генетично дуже близький до T-лімфотропного вірусу SIVsmm мангабеїв, і меншою мірою до вірусу ВІЛ-1. Геноми ВІЛ-1 і ВІЛ-2 мають гомологію консервативних генів gag і pol близько 60 %, і до 45 % генів білків оболонки[97]. Станом на 2010 рік описано 8 груп ВІЛ-2, лише групи A і B є епідемічними. Віруси групи А поширені в Західній Африці, Анголі, Мозамбіку, Бразилії, Індії і мало поширені в США і Європі[98][99]. Віруси групи поширені В в Західній Африці[100][7].
Будова вірусу
Головна стаття: будова ВІЛ
Будова віріона

Віріони ВІЛ сферичну форму діаметром приблизно 120 нм[101]. Це приблизно в 60 разів менше за діаметр еритроцита[102]. До складу зрілих віріонів входить кілька тисяч білкових молекул різних типів.
Капсид зрілого віріона, що складається з приблизно 2000 молекул білка р24, має форму усіченого конуса[103].
Всередині капсиду розташований білково-нуклеїновий комплекс: дві нитки вірусної РНК, міцно пов'язані з білком нуклеокапсиду p7, ферменти (зворотна транскриптаза, протеаза, інтеграза)[103]. З капсидом також асоційовані білки Nef і Vif (7-20 молекул Vif на віріон). Всередині віріона (і, найімовірніше, за межами капсиду) виявлений білок Vpr[33]. Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) пов'язані близько 200 копій клітинного ферменту пептидилпролілізомерази A[en] (циклофілін А), необхідного для складання віріона[104].
Капсид оточений оболонкою, утвореною з приблизно 2000 молекул матриксного білка p17[103]. Матриксна оболонка, в свою чергу, оточена двошаровою ліпідною мембраною, що є зовнішньою оболонкою вірусу. Її утворюють молекули фосфоліпідів, захоплені вірусом під час його відбрунькування від клітини, в якій він сформувався[105]. В ліпідну мембрану вбудовані 72 глікопротеїнові комплекси Env, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну gp41 (TM), що слугує «якорем» комплексу, і трьома молекулами поверхневого глікопротеїну gp120 (SU)[104]. З допомогою білка gp120 вірус приєднується до рецептора CD4 і корецептора, що розташовані на поверхні Т-лімфоцитів людини. Стехіометричне співвідношення p24:gp120 у віріона становить 60-100:1[33]. Під час формування зовнішньої оболонки вірусу також відбувається захоплення деякої кількості мембранних білків клітини, зокрема людських лейкоцитарних антигенів (HLA) класів I і II і молекул адгезії[106].
Білки віріона інтенсивно вивчають, оскільки вони є мішенями розроблюваних ліків і вакцини проти ВІЛ.
Функції важливих структурних білків ВІЛ-1[103][106]
| Скорочення | Опис | Функції |
|---|---|---|
| gp41 (TM, transmembrane) | Трансмембранний глікопротеїн масою 41 кДа | Розташований у зовнішньому шарі ліпідної мембрани, відіграє роль «якоря», що утримує молекули білка gp120 |
| gp120 (SU, surface) | Глікопротеїн масою 120 кДа | Зовнішній білок віріона. Нековалентно пов'язаний з трансмембранним білком gp41. З однією молекулою gp41 пов'язані 3-5 молекул gp120. Здатний зв'язувати рецептор CD4. Відіграє важливу роль у процесі проходження вірусу в клітину. |
| p24 (CA, capsid) | Білок масою 24 кДа | Утворює капсид вірусу |
| p17 (MA, matrix) | Матриксний білок масою 17 кДа | Близько двох тисяч молекул цього білка утворюють шар завтовшки 5-7 нм, розташований між зовнішньою оболонкою і капсидом вірусу. |
| p7 (NC, nucleocapsid) | Нуклеокапсидный білок масою 7 кДа | Входить до складу капсиду вірусу. Утворює комплекс з вірусної РНК. |
Геном і кодовані білки
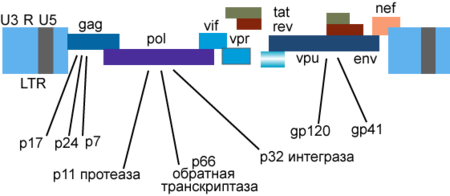
Генетичний матеріал ВІЛ представлений двома копіями позитивно-смислової (+)РНК[104]. Геном ВІЛ-1 завдовжки 9000 нуклеотидів. Кінці геному представлені довгими кінцевими повторами (англ. long terminal repeat, LTR), які керують продукуванням нових вірусів і можуть активуватися і білками вірусу, і білками інфікованої клітини.
9 генів ВІЛ-1 кодують, принаймні, 15 білків[107]. Ген pol кодує ферменти: зворотну транскриптазу (RT), інтегразу (IN) і протеазу (PR). Ген gag кодує поліпротеїн Gag/p55, що його вірусна протеаза розщеплює до структурних білків p6, p7, p17, p24. Ген env кодує білок gp160, що його клітинна ендопротеаза фурин розщеплює на структурні білки gp41 і gp120[33]. Інші шість генів — tat, rev, nef, vif, vpr, vpu (vpx у ВІЛ-2) — кодують білки, що відповідають за здатність ВІЛ-1 інфікувати клітини і виробляти нові копії вірусу. Реплікація ВІЛ-1 in vitro можлива без генів nef, vif, vpr, vpu, однак їх продукти необхідні для повноцінної інфекції in vivo[108][109][110].
Gag
Поліпротеін-попередник Gag/p55 синтезується з повнорозмірною геномною РНК (яка в цьому разі слугує мРНК) у процесі стандартної кеп-залежної трансляції, але можлива й IRES-залежна трансляція. Попередники функціональних білків розташовуються у складі поліпротеїну Gag/p55 в такому порядку: p17...p24...p2...p7...p1...p6[33] (р1 і р2 — з'єднувальні пептиди; інші продукти розщеплення Gag/p55 описано вище). Нерозщеплений протеазою Gag/p55 містить три основні домени: домен мембранної локалізації (М, membrane targeting), домен взаємодії (I, interaction) і «пізній» домен (L, late). Домен М, розташований всередині області p17/МА, міристилюється (приєднуються залишки міристинової кислоти) і направляє Gag/p55 до плазматичної мембрани. Домен I, що розташований всередині області p7NC (NC, nucleocapsid), відповідає за міжмолекулярні взаємодії окремих мономерів Gag/p55. Домен L, також локалізований в області p7NC, опосередковує відбрунькування віріонів від плазматичної мембрани; в цьому процесі бере участь також р6 область поліпротеїну Gag/p55[111].
Vpu
Двома важливими функціями білка Vpu є: 1) руйнування клітинного рецептора CD4 в ендоплазматичному ретикулумі шляхом залучення убіквітинлігазних комплексів і 2) стимуляція виділення дочірніх віріонів з клітини шляхом інактивації інтерферон-індукованого трансмембранного білка CD317/BST-2, що дістав також назву «tetherin» за його здатність пригнічувати виділення новоутворених дочірніх віріонів, утримуючи їх на поверхні клітини[108][109][112][113][114][115].
Vpr
Білок Vpr потрібний для реплікації вірусу в неподільних клітинах, зокрема, макрофагах. Цей білок, поряд з іншими клітинними та вірусними білками, активує транскрипцію з використанням довгих кінцевих повторів геному ВІЛ як промоторів. Білок Vpr відіграє важливу роль у перенесенні вірусної ДНК в ядро і викликає затримку поділу клітини в періоді G2[116].
Vif
Білок Vif відіграє важливу роль у підтримці реплікації вірусу. Vif індукує убіквітинілювання і деградацію клітинного антивірусного білка APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, синтезованій у процесі зворотної транскрипції. Штами, позбавлені Vif, не реплікуються в CD4+-лімфоцитах, деяких лініях T-лімфоцитів і макрофагах. Ці штами здатні проникати в клітини-мішені й починати зворотну транскрипцію, проте синтез вірусної ДНК залишається незавершеним[116].
Nef
Білок Nef виконує кілька функцій. Він пригнічує експресію молекул CD4 і HLA класів I і II на поверхні інфікованих клітин, чим дозволяє вірусу уникати атаки цитотоксичних T-лімфоцитів і розпізнавання CD4+-лімфоцитами. Білок Nef може також пригнічувати активацію T-лімфоцитів, пов'язуючи різні білки-компоненти систем внутрішньоклітинного передавання сигналу[116].
В інфікованих вірусом імунодефіциту макак-резусів активна реплікація вірусу і розвиток хвороби можливі лише коли ген nef інтактний. Делеції гена nef виявлено в штамах ВІЛ, виділених у групи австралійців з тривалим непрогресивним перебігом інфекції[117]. Однак у частини з них з часом з'явилися ознаки прогресування інфекції, зокрема, знизилась кількість CD4+-лімфоцитів. Отже, хоча делеції гена nef і можуть сповільнювати реплікацію вірусу, це не гарантує повної неможливості прогресування захворювання[118].
Tat і Rev
Регуляторні білки Tat (транс-активатор) і Rev накопичуються в ядрі клітини і пов'язують певні ділянки вірусної РНК. Білок Tat має молекулярну масу близько 14-15 кДа, пов'язує вторинну структуру геномної РНК поблизу 5'-нетрансльованої області[116][119], активує зворотну транскрипцію геномної РНК ВІЛ, синтез вірусних мРНК, необхідний для реплікації вірусу майже у всіх культурах клітин, регулює вихід віріонів із заражених клітин, потребує клітинного кофактору — цикліну T1. Білок Rev регулює експресію білків віріона, пов'язує мРНК гена env в області RRE (англ. Rev response element) інтрона, що розділяє екзони генів Tat і Rev.
Білки Tat і Rev стимулюють транскрипцію провірусної ДНК і транспорт РНК з ядра в цитоплазму, а також потрібні для трансляції. Білок Rev забезпечує також транспорт компонентів вірусу з ядра і переключення синтезу регуляторних білків вірусу на синтез структурних[116].
Життєвий цикл вірусу

Після потрапляння в організм людини ВІЛ проникає в клітини-мішені — Т-лімфоцити (CD4), які виконують регуляторну роль в імунній відповіді. Крім цього, ВІЛ здатний проникати в інші клітини, що обумовлює залучення в патологічний процес різних органів і систем. Геном ВІЛ, включений до геному клітини-господаря, носить назву «провірусу». ВІЛ має високу активність, продукуючи 1010 вірусних часток щодня. Якщо пацієнт отримує недостатньо ефективну антиретровірусну терапію формуються варіанти вірусу, стійкі до препаратів. При «природному перебігу» ВІЛ інфекції виявляється висока швидкість утворення і руйнування лімфоцитів — 109 клітин в день. У цій «гонці на виживання» вірус з часом перемагає, вражаючи клітини імунної системи. Їх загибель призводить до формування імунодефіциту, який проявляється розвитком симптомів, пов'язаних як з ВІЛ-інфекцією так і з вторинними захворюваннями інфекційного та неінфекційного ґенезу.
До проникнення в клітину-мішень
Потрапивши на поверхню та всередину організму, віріони ВІЛ опиняються в різних за агресивністю біологічних рідинах. Слина та шлунковий сік містять ферменти, що більшою мірою руйнують віріони ВІЛ, ніж інші біологічні рідини (це не стосується немовлят перших місяців життя, у яких ще не виробляються відповідні ферменти травлення, тому немовлята можуть заразитись через грудне молоко). Віріони ВІЛ проходять у кровоносну і лімфатичну систему організму і переміщуються по організму в потоці крові і лімфи. Опинившись поруч з CD4-клітиною, віріони ВІЛ приєднуються до рецептора CD4 на її плазматичній мембрані[120].
Проходження в клітину і зворотна транскрипція
| Механізм злиття віріона ВІЛ і плазматичної мембрани Т-лімфоцита людини 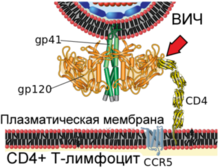   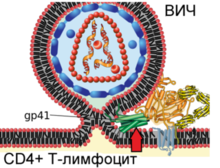 |
Вірусний глікопротеїн gp120 міцно пов'язує рецептор CD4. Внаслідок такої взаємодії gp120 зазнає конформаційних зміни, які дозволяють йому зв'язувати молекулу корецептора CXCR4 або CCR5 (експресованих на поверхні Т-лімфоцитів, макрофагів, дендритних клітин мікроглії)[121][122]. Залежно від здатності зв'язувати ці корецептори, ВІЛ класифікують на R5-тропні (пов'язують тільки корецептор CCR5), X4-тропні (пов'язують тільки корецептор CXCR4) і R5X4-тропні (можуть взаємодіяти з обома корецепторами) варіанти. При зараженні здебільшого передаються R5-тропні і R5X4-тропні варіанти[123]. Препарати, що блокують корецептори, можуть протидіяти ВІЛ[124].
Після описаних подій вірусний білок gp41 проходить у мембрану клітини і зазнає значних конформаційних змін, внаслідок яких мембрана клітини і мембрана віріона ВІЛ зближуються одна з одною й потім зливаються. Вірусний білок gp41 дуже важливий для злиття мембран, тому його розглядають як мішень для розробки противірусних препаратів.
Після злиття мембран вміст віріона проходить всередину клітини. Всередині клітини вірусна РНК вивільняється з капсиду. Потім під дією зворотної транскриптази відбувається зворотна транскрипція — процес синтезу ДНК на підставі інформації в одноланцюговій геномній РНК вірусу[125]. Більша частина лікарських препаратів, затверджених для застосування при ВІЛ-інфекції, спрямована на порушення роботи зворотної транскриптази[44].
Транспорт вірусної ДНК в ядро та інтеграція в геном
Після завершення зворотної транскрипції в CD4+-лімфоциті вірусний геном представлений невбудованою ДНК. Для вбудування вірусної ДНК в геном клітини-господаря і для утворення нових вірусів потрібна активація T-лімфоцитів. Активація CD4+-лімфоцитів відбувається коли вони контактують з антигенпредставленими клітинами в лімфоїдній тканині. Наявність вірусів на поверхні фолікулярних дендритних клітин і присутність прозапальних цитокінів (ІЛ-1, ІЛ-6 і ФНОа) сприяють розмноженню ВІЛ в інфікованих клітинах. Саме тому лімфоїдна тканина є найсприятливішим середовищем для реплікації ВІЛ.
Синтезована вірусна ДНК транспортується всередину ядра клітини в складі пре-інтеграційного комплексу, до якого також належать білки ВІЛ p17/MA, Nef та інтеграза[126]. Далі вірусна ДНК вбудовується в хромосому активованого T-лімфоцита під дією інтегрази. Кілька препаратів, що інгібують інтегрази, широко застосовують у сучасній комплексній антиретровірусній терапії. Вірусна ДНК, що вбудувалась у хромосому клітини, називається провірусом[44].
Транскрипція, сплайсинг, транспорт РНК з ядра в цитоплазму і трансляція
В ядрі клітинна РНК-полімераза синтезує попередник вірусних інформаційних РНК (мРНК), довжина якого дорівнює довжині геномної РНК ВІЛ-1. Цей попередник мРНК піддається 5'-кінцевому кепуванню і 3'-кінцевому поліаденілюванню. Крім того, попередник мРНК піддається сплайсингу, внаслідок якого утворюються понад 40 різних мРНК, що їх можна поділити на 3 класи[127]:
- несплайсована РНК завдовжки близько 9.3 kb — далі використовується як мРНК для синтезу білків Gag і Gag-Pol, а також як геномна РНК;
- неповністю сплайсовані РНК завбільшки близько 4 kb — використовуються як мРНК для синтезу білків Vif, Vpr, Tat, Vpu і Env;
- повністю сплайсовані РНК завбільшки близько 2 kb — використовуються як мРНК для синтезу білків Vpr, Tat, Rev і Nef.
На ранній стадії експресії генів, за відсутність білка Rev, несплайсована і неповністю сплайсовані РНК ВІЛ-1 нестабільні й швидко руйнуються в ядрі. Водночас повністю сплайсовані мРНК ВІЛ-1 є стабільними і транспортуються з ядра в цитоплазму[127]. В цитоплазмі за допомогою рибосом відбувається процес трансляції — біосинтез білка з амінокислот за заданою матрицею на основі генетичної інформації, що міститься в мРНК. Синтезований в цитоплазмі білок Rev транспортується в ядро, де зв'язується з областю RRE несплайсованої й неповністю сплайсованих РНК, що стабілізує ці РНК. Крім того, Rev взаємодіє з клітинним білком CRM1 (експортин 1), і ця взаємодія стимулює транспорт несплайсованої й неповністю сплайсованих РНК з ядра в цитоплазму, де відбувається синтез закодованих у них білків.
Збирання й відбрунькування віріонів
Геномна РНК вірусу, а також вірусні білки транспортуються до місць збирання віріонів — до мембрани. Віріони спочатку формуються з поліпротеїнів-попередників структурних білків і ферментів і на цій стадії не є інфекційними. Під час дозрівання вірусної частинки вірусна протеаза розщеплює білки-попередники до функціональних компонентів[44]. Кілька схвалених противірусних препаратів інгібують роботу протеази і перешкоджають формуванню зрілих віріонів.
Нові вірусні частинки відбрунькувуються від поверхні клітини, захоплюючи частину її мембрани, і виходять у кров'яне русло, а клітина хазяїна, що несе рецептор CD4, гине[128]. Нещодавні дослідження показали, що процес відбруньковування віріонів може бути більш складним, ніж вважали раніше. Так було виявлено, що завдяки взаємодії білка Gag з компонентами клітини віріони накопичуються в особливих внутрішньоклітинних мультивезикулярных тільцях, які зазвичай слугують для експорту білків. Таким чином вірусні частинки вивільняються з клітини, експлуатуючи її власну систему транспорту макромолекул[44].
Поширення організмом
Віріон ВІЛ, що тільки-но виділився з зараженого лімфоцита у плазмі крові живе в середньому близько 8 годин[120]. Тривалість напівжиття (час, за який гине 50 % віріонів ВІЛ) у плазмі крові становить приблизно 6 годин. В інших середовищах тривалість напівжиття віріонів ВІЛ на порядки менше.
Під час гострої фази ВІЛ-інфекції відсутність специфічної імунної відповіді дозволяє вірусу активно реплікуватися й досягати високих концентрацій у крові. Вірус заселяє органи лімфатичної системи, CD4+-лімфоцити, макрофаги, а також інші клітини: альвеолярні макрофаги легень, клітини Лангерганса, фолікулярні дендритні клітини лімфатичних вузлів, клітини олігодендроглії й астроцити мозку і епітеліальні клітини кишки[129][130]. У лімфоїдній тканині ВІЛ розмножується протягом усього захворювання, вражаючи макрофаги, активовані і спокійні CD4+-лімфоцити і фолікулярні дендритні клітини[131][132]. Кількість клітин, що містять провірусну ДНК, у лімфоїдній тканині в 5-10 разів вища, ніж серед клітин крові, а реплікація ВІЛ в лімфоїдній тканини на 1-2 порядки вища, ніж у крові. Основним клітинним резервуаром ВІЛ є CD4+-Т-лімфоцити імунологічної пам'яті[133].
Для активації CD8+-лімфоцитів і утворення антиген-специфічних цитотоксичних T-лімфоцитів потрібна презентація пептидного антигену в комплексі з людським лейкоцитарним антигеном класу I. Дендритні клітини, потрібні для початку первинних антиген-специфічних реакцій, захоплюють антигени, переробляють і переносять їх на свою поверхню, де ці антигени в комплексі з додатковими стимулювальними молекулами активують Т-лімфоцити. Заражені клітини часто не виділяють додаткових стимулювальних молекул і тому не здатні викликати активацію достатньої кількості B - і T-лімфоцитів, функція яких залежить від дендритних клітин.
На 2018 рік ВІЛ-інфекція досі залишається невиліковним захворюванням, оскільки геном вірусу інтегрується в хромосоми клітин і може реактивуватися навіть після курсу антиретровірусної терапії. Нині йде пошук безпечних способів редагування геному людини та виключення з нього провірусної ДНК[134][135]. 2014 року запропоновано метод видалення геному ВІЛ-1 інфікованих клітин за допомогою системи CRISPR/Cas9. За допомогою цього методу дослідникам вдалося вирізати фрагмент провірусної ДНК, розташований між 5'- і 3'-кінцевими LTR-областями з хромосом заражених клітин у культурі. Крім того, цей метод виявився також ефективним для профілактики зараження неінфікованих клітин. Описаний підхід може привести до розробки способу повного позбавлення від ВІЛ-інфекції[136][137].
Природна стійкість до ВІЛ
Описано випадки стійкості людей до ВІЛ. Проникнення вірусу в клітину імунної системи пов'язане з його взаємодією з поверхневим рецептором, білком CCR5. Делеція (втрата ділянки гена) CCR5-дельта32 призводить до несприйнятливості її носія до ВІЛ. Передбачають, що ця мутація виникла приблизно дві з половиною тисячі років тому і з часом поширилася в Європі. Нині до ВІЛ фактично стійкий в середньому один відсоток жителів Європи, 10-15% європейців мають часткову опірність до ВІЛ[138]. 0,1–0,3% російського населення майже несприйнятливі до ВІЛ[139]. Вчені Ліверпульського університету пояснюють поширення мутації гена CCR5 тим, що вона посилює опірність до бубонної чуми. Епідемія «чорної смерті» 1347 року (а в Скандинавії ще й 1711 року) сприяла збільшенню частоти цього генотипу в Європі.
Мутація в гені CCR2 також зменшує шанс проникнення ВІЛ в клітину і призводить до затримки розвитку СНІДу. Існує невеликий відсоток ВІЛ-позитивних людей (близько 10 %), у яких СНІД не розвивається протягом тривалого часу. Їх називають нонпрогресорами (nonprogressors)[140][141].
Важливий клітинний компонент захисту проти ВІЛ — антивірусний білок APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, яка синтезується під час зворотної транскрипції. APOBEC3G інактивується білком Vif ВІЛ-1, який викликає його убіквітинілювання і деградацію[142].
Виявлено, що одним з головних елементів антивірусного захисту людини та інших приматів є білок TRIM5a, здатний розпізнавати капсид вірусних частинок і перешкоджати розмноженню вірусу в клітині. TRIM5a людини і шимпанзе дещо різняться й ефективні проти різних вірусів: цей білок захищає шимпанзе від ВІЛ та споріднених йому вірусів, а людину — від вірусу PtERV1[143]. Мавпи Нового Світу, за винятком мірікіни, яка має химерний ген TRIM5-CypA, стійкості до ВІЛ не мають[144].
Інший важливий елемент антивірусного захисту — інтерферон-індукований трансмембранний білок CD317/BST-2 (англ. bone marrow stromal antigen 2)[112][113][145]. CD317 — трансмембранний білок 2-го типу з незвичайною топологією: він має трансмембранний домен поруч з N-кінцем і глікозилфосфатидилінозитол (GPI) на С-кінці, між якими розташований позаклітинний домен[146]. Показано, що CD317 безпосередньо взаємодіє зі зрілими дочірніми віріонами, «прив'язуючи» їх до поверхні клітини[147]. Для пояснення механізму такого «прив'язування» запропоновано кілька альтернативних моделей, які, проте, сходяться в наступному: молекули CD317 формують паралельний гомодимер; один або два гомодимери зв'язуються одночасно з одним виріоном і клітинною мембраною. При цьому з мембраною віріона взаємодіють або обидва мембранні «якорі» (трансмембранний домен і GPI) однієї з молекул CD317, або один з них. Спектр активності CD317 включає, принаймні, чотири сімейства вірусів: ретровіруси, філовіруси, аренавіруси і герпесвіруси. Активність цього клітинного фактора інгібується білками Vpu ВІЛ-1, Env ВІЛ-2 і SIV, Nef SIV, глікопротеїном оболонки вірусу Ебола і білком К5 герпесвірусу саркоми Капоші[108][109][114][115][148][149]. Виявлено кофактор білка CD317 — клітинний білок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3-убіквітинлігаза класу RING. BCA2 посилює інтерналізацію віріонів ВІЛ-1, «прив'язаних» білком CD317 до поверхні клітини, в CD63+ внутрішньоклітинні везикули з їхнім подальшим руйнуванням у лізосомах[150].
Редагування геному людини
У січні 2019 року влада Китаю підтвердила народження в Шеньчжені перших у світі генетично модифікованих людей, у яких відредагували ген CCR5, відповідальний за взаємодію з ВІЛ, а також почала розслідування щодо біолога Хе Цзянькуя. Передбачають, що генно-модифіковані діти не можуть захворіти на ВІЛ.
Міфи
Існує ненаукова думка, що ВІЛ не існує або не призводить до СНІДу. Її дотримуються навіть деякі вчені, не задіяні у вивченні вірусів. Наявності таких уявлень сприяє довга фаза між зараженням ВІЛ та розвитком СНІДу й те, що в деяких уражених ВІЛ СНІД взагалі не розвивається. Проте факт наявності ВІЛ у хворих на СНІД на сьогодні незаперечний.
Так само блукає міф про штучне походження ВІЛ, правда останній не витримує жодної критики, оскільки є достеменно відома історія віруса, який існує більше 200 років, коли його створити штучно не було можливо.
Див. також
- ВІЛ серед ЧСЧ та транс-людей в Україні
- Тімоті Рей Браун («Берлінський пацієнт») — перша людина, яка вилікувалась від ВІЛ/СНІДу.
- Роберт Рейфорд («пацієнт зіро») — перша зареєстрована жертва ВІЛ/СНІДу в Північній Америці.
- Арвід Ное — перша зареєстрована жертва ВІЛ/СНІДу в Європі.
- Грете Раск — одна з перших жертв ВІЛ/СНІДу в Європі.
- Гаетан Дюга — канадський бортпровідник, що зробив значний внесок у поширення вірусу в Північній Америці. Раніше його помилково ідентифікували як «нульового пацієнта».
Примітки
- ↑ Gao F, Bailes E, Robertson DL та ін. (February 1999). Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes. Nature. 397 (6718): 436—41. Bibcode:1999Natur.397..436G. doi:10.1038/17130. PMID 9989410.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Keele, B. F., van Heuverswyn, F., Li, Y. Y., Bailes, E., Takehisa, J., Santiago, M. L., Bibollet-Ruche, F., Chen, Y., Wain, L. V., Liegois, F., Loul, S., Mpoudi Ngole, E., Bienvenue, Y., Delaporte, E., Brookfield, J. F. Y., Sharp, P. M., Shaw, G. M., Peeters, M., and Hahn, B. H. (28 July 2006). Chimpanzee Reservoirs of Pandemic and Nonpandemic HIV-1. Science. 313 (5786): 523—6. Bibcode:2006Sci...313..523K. doi:10.1126/science.1126531. PMC 2442710. PMID 16728595.
- ↑ Reeves, J. D. and Doms, R. W (2002). Human Immunodeficiency Virus Type 2. J. Gen. Virol. 83 (Pt 6): 1253—1265. doi:10.1099/vir.0.18253-0. PMID 12029140.
- ↑ Goodier, J., and Kazazian, H. (2008). Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites. Cell. 135 (1): 23—35. doi:10.1016/j.cell.2008.09.022. PMID 18854152.
- ↑ Sharp, P. M.; Bailes, E.; Chaudhuri, R. R.; Rodenburg, C. M.; Santiago, M. O.; Hahn, B. H. (2001). The origins of acquired immune deficiency syndrome viruses: where and when? (PDF). Philosophical Transactions of the Royal Society B: Biological Sciences. 356 (1410): 867—76. doi:10.1098/rstb.2001.0863. PMC 1088480. PMID 11405934. Архів оригіналу (PDF) за 25 жовтня 2007. Процитовано 4 лютого 2012.
- ↑ Kalish ML, Wolfe ND, Ndongmo CD, McNicholl J, Robbins KE та ін. (2005). Central African hunters exposed to simian immunodeficiency virus. Emerg Infect Dis. 11 (12): 1928—30. PMID 16485481.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ а б в Marx PA, Alcabes PG, Drucker E (2001). Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa (PDF). Philos Trans R Soc Lond B Biol Sci. 356 (1410): 911—20. doi:10.1098/rstb.2001.0867. PMC 1088484. PMID 11405938. Помилка цитування: Некоректний тег
<ref>; назва «Marx2001» визначена кілька разів з різним вмістом - ↑ Worobey, Michael; Gemmel, Marlea; Teuwen, Dirk E.; Haselkorn, Tamara; Kunstman, Kevin; Bunce, Michael; Muyembe, Jean-Jacques; Kabongo, Jean-Marie M.; Kalengayi, Raphaël M. (2008). Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960 (PDF). Nature. 455 (7213): 661—4. Bibcode:2008Natur.455..661W. doi:10.1038/nature07390. PMID 18833279. Архів оригіналу (PDF) за 13 січень 2012. Процитовано 4 лютий 2012.
- ↑ а б Sousa, João Dinis de; Müller, Viktor; Lemey, Philippe; Vandamme, Anne-Mieke; Vandamme, Anne-Mieke (2010). Martin, Darren P. (ред.). High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains. PLoS ONE. 5 (4): e9936. doi:10.1371/journal.pone.0009936. PMC 2848574. PMID 20376191.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Chitnis, Amit; Rawls, Diana; Moore, Jim (2000). Origin of HIV Type 1 in Colonial French Equatorial Africa?. AIDS Research and Human Retroviruses. 16 (1): 5—8. doi:10.1089/088922200309548. PMID 10628811.
- ↑ Donald G. McNeil, Jr. (16 вересня 2010). Precursor to H.I.V. Was in Monkeys for Millennia. New York Times. Процитовано 17 вересня 2010.
Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. ... suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.
- ↑ Zhu, T., Korber, B. T., Nahmias, A. J., Hooper, E., Sharp, P. M. and Ho, D. D. (1998). An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic. Nature. 391 (6667): 594—7. Bibcode:1998Natur.391..594Z. doi:10.1038/35400. PMID 9468138.
- ↑ Kolata, Gina (28 October 1987). Boy's 1969 Death Suggests AIDS Invaded U.S. Several Times. The New York Times. Процитовано 11 February 2009.
- ↑ The emergence of HIV/AIDS in the Americas and beyond (PDF). Архів оригіналу (PDF) за 28 березня 2012. Процитовано 4 лютого 2012.
- ↑ // MMWR Morb. Mortal. Wkly. Rep. : journal. — 1982. — No. 27 (7). — P. 365—367.
- ↑ // MMWR Morb. Mortal. Wkly. Rep. : journal. — 1982. — No. 26 (7). — P. 353—354.
- ↑ Cohen J. // Science : journal. — 2006. — No. 5786. — P. 470—473.
- ↑ Centers for Disease Control (CDC). // MMWR Morb Mortal Wkly Rep. : journal. — 1982. — No. 19. — P. 249—251. Процитовано 2011-08-31.
- ↑ Barré-Sinoussi F., Chermann J.C., Rey F., Nugeyre M.T., Chamaret S., Gruest J., Dauguet C., Axler-Blin C., Vézinet-Brun F., Rouzioux C., Rozenbaum W., Montagnier L;. // Science : journal. — 1983. — No. 4599. — P. 868—871. — Bibcode:.
- ↑ The history of AIDS 1981—1986 (англ.). AVERT. Процитовано 21 липня 2014.
- ↑ а б History of AIDS Up to 1986 (англ.). AVERT. Процитовано 21 липня 2014.
- ↑ PMID 6815471 (PMID 6815471)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6272109 (PMID 6272109)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6272112 (PMID 6272112)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6121088 (PMID 6121088)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6603806 (PMID 6603806)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6143974 (PMID 6143974)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6150466 (PMID 6150466)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6189183 (PMID 6189183)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 6601823 (PMID 6601823)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 3010128 (PMID 3010128)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ The Nobel Prize in Physiology or Medicine 2008 Press Release (англ.). Процитовано 21 липня 2014.
Harald zur Hausen, Françoise Barré-Sinoussi, Luc Montagnier
- ↑ а б в г д Levy J.A. {{{Заголовок}}}. — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2.
- ↑ PMID 9833850 (PMID 9833850)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 21309617 (PMID 21309617)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ James Wilton. From exposure to infection: The biology of HIV transmission (англ.). Архів оригіналу за 10 вересня 2014. Процитовано 10 вересня 2014.
- ↑ Jpnh G Bartlett. {{{Заголовок}}}. — Медицинская школа Университета Джонса Хопкинса, 2008. — 138 с.
- ↑ PMID 11981365 (PMID 11981365)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States (PDF) (англ.). AIDSinfo.nih.gov. 12 жовтня 2006. Процитовано 21 липня 2014.
- ↑ Всемирная организация здравоохранения. {{{Заголовок}}}. — 2007. — ISBN 9789241596596.
- ↑ PMID 12062985 (PMID 12062985)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.Цитата: «Most bloodsucking insects are not capable of transmitting HIV because they inject saliva and ingest blood through different routes» - ↑ CDC. HIV Transmission (англ.). Архів оригіналу за 4 лютого 2005. Процитовано 21 липня 2014. Centers for Disease Control and Prevention. HIV and Its Transmission (PDF) (англ.). The Center for HIV Law and Policy. Процитовано 21 липня 2014.
{{cite web}}: Проігноровано невідомий параметр|description=(довідка) aids.gov. HOW DO YOU GET HIV OR AIDS? (англ.). U.S. Department of Health & Human Services. Процитовано 21 липня 2014. PMID 9989543 (PMID 9989543)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Приведено согласно Figure 1, опубликованной в Pantaleo, G et al. // New England Journal of Medicine : journal. — 1993. — No. 5. — (2). — P. 327—335., также доступнка Figure 4 в The relationship between the human immunodeficiency virus and the acquired immunodeficiency syndrome (англ.). US National Institute of Allergy and Infectious Diseases. Архів оригіналу за 30 листопада 2009. Процитовано 3 листопада 2009.
{{cite web}}: Недійсний|deadlink=404(довідка) Дополнительная информация опубликована в Piutak, M et al. // Science : journal. — 1993. — No. 510. — (3). — P. 1749—1754. - ↑ а б в г д е ж NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome
- ↑ Alimonti J.B., Ball T.B., Fowke K.R. Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS. // Journal of General Virology[en] : journal. — Microbiology Society[en], 2003. — No. 7. — P. 1649—1661.
- ↑ Holmes C.B., Losina E., Walensky R.P., Yazdanpanah Y., Freedberg K.A. Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa // Clin. Infect. Dis. : journal. — 2003. — No. 5. — P. 656‐662.
- ↑ Guss D.A. The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1 // J. Emerg. Med. : journal. — 1994. — No. 3. — P. 375—384.
- ↑ Guss D.A. The acquired immune deficiency syndrome: an overview for the emergency physician, Part 2 // J. Emerg. Med. : journal. — 1994. — No. 4. — P. 491—497.
- ↑ За статистикою, серед країн Європи найбільшу кількість випадків нових ВІЛ-інфікувань зафіксували у Росії та Україні | Конвіктус Україна. www.convictus.org.ua. Процитовано 5 грудня 2016.[недоступне посилання з червня 2019]
- ↑ Борьба со СПИД в России: как остановить болезнь? (рос.). РИА Новости. 30 листопада 2011. Архів оригіналу за 16 червня 2013. Процитовано 16 червня 2013.
- ↑ UNAIDS World AIDS Day Report 2011 (PDF) (англ.). UNAIDS World AIDS. 2011. Архів оригіналу (PDF) за 16 червня 2013. Процитовано 16 червня 2013.
- ↑ National HIV and STD Testing Resources (англ.). Centers for Disease Control and Prevention. Процитовано 21 липня 2014.
- ↑ aids.gov. Just Diagnosed with HIV AIDS: Understand Your Test Results: Viral Load (англ.). U.S. Department of Health & Human Services. Процитовано 21 липня 2014.
- ↑ WebMD Medical Reference from Healthwise. Human Immunodeficiency Virus (HIV) Test (англ.). Healthwise. Процитовано 21 липня 2014.
- ↑ ВИЧ.рф тест на ВИЧ (рос.). Процитовано 12 вересня 2014.
- ↑ ВИЧ/СПИД: Тестирование и консультирование (рос.). Процитовано 12 вересня 2014.
- ↑ Федеральный закон от 22 июля 1993 г. № 5487-1 "Основы законодательства Российской Федерации об охране здоровья граждан" 0. Российская газета. Процитовано 21 липня 2014.
- ↑ Тест на ВИЧ с точки зрения права. Николай Недзельский. Процитовано 21 липня 2014.
- ↑ UNAIDS, WHO (2007-12). 2007 AIDS epidemic update (PDF) (англ.). с. 10. Процитовано 12 березня 2008.
- ↑ aidsmap. Ожидаемая продолжительность жизни для некоторых групп ВИЧ-инфицированных лиц в США теперь значительно превосходит её средний показатель. Архів оригіналу за 7 березня 2015. Процитовано 26 січня 2015.
- ↑ Антиретровирусная терапия online. Продолжительность жизни людей с ВИЧ, получающих АРВТ в развитых странах
- ↑ US National Library of Medicine National Institutes of Health. Closing the Gap: Increases in Life Expectancy among Treated HIV-Positive Individuals in the United States and Canada
- ↑ PMID 18476292 (PMID 18476292)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 8813039 (PMID 8813039)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 16054937 (PMID 16054937)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Starting, Monitoring & Switching HIV Treatment (англ.). AVERT. Процитовано 21 липня 2014.
- ↑ AIDSinfo. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents (PDF) (англ.). NIH. Процитовано 13 серпня 2014.
- ↑ World Health Organization. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection (англ.). Процитовано 13 серпня 2014.
- ↑ UNAIDS. Gap report (англ.). Процитовано 13 серпня 2014.
- ↑ AVERT. HIV treatment children (англ.). Процитовано 13 серпня 2014.
- ↑ Janet Karpinski, Ilona Hauber, Jan Chemnitz et al. // Nature Biotechnology : journal. — Nature Publishing Group, 2016.
- ↑ Немецким учёным удалось победить вирус иммунодефицита человека Новости высоких технологий(Перевірено 1 березня 2016)
- ↑ Janet Karpinski, Ilona Hauber, Jan Chemnitz та ін. (22 лютого 2016). Directed evolution of a recombinase that excises the provirus of most HIV-1 primary isolates with high specificity (англ.). Nature Biotechnology. Архів оригіналу за 24 лютого 2016. Процитовано 1 березня 2016.
{{cite web}}: Явне використання «та ін.» у:|last=(довідка) - ↑ В США одобрен препарат для лечения ВИЧ с новым механизмом действия
- ↑ Десять проблем здравоохранения, над которыми ВОЗ будет работать в 2019 году. ВОЗ (рос.). 2019. Процитовано 29 березня 2019.
- ↑ Adolescents: health risks and solutions. www.who.int (англ.). Процитовано 22 березня 2020.
- ↑ Kurth, R; Bannert, N. {{{Заголовок}}}. — Caister Academic Press, 2010. — ISBN 978-1-904455-55-4.
- ↑ а б PMID 23444290 (PMID 23444290)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Gelderblom H.R., Ozel M., Pauli G. // Arch. Virol. : journal. — 1989. — P. 1—13.
- ↑ Lentivirus (англ.). International Committee on Taxonomy of Viruses (ICTV). Архів оригіналу за 29 липня 2014. Процитовано 21 липня 2014.
{{cite web}}: Проігноровано невідомий параметр|description=(довідка) - ↑ Джон Бартлетт. Типы и подтипы ВИЧ // {{{Заголовок}}}. — 2009. Архив
- ↑ HIV Strains: Types, Groups and Subtypes (англ.). AVERT. Процитовано 21 липня 2014.
- ↑ PMID 22229120 (PMID 22229120)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Bobkov A.F., Kazennova E.V., Selimova L.M., et al. // J. Med. Virol. : journal. — 2004. — No. 2 (10). — P. 191—196.
- ↑ Goudsmit, Jaap. Viral Sex; The Nature of AIDS. Oxford University Press. New York, New York, 1997. Pg. 51-58. Retrieved May 25, 2008.
- ↑ [1] Introduction to HIV types, groups and subtypes. March 3, 2008. Retrieved May 25, 2008.
- ↑ PMID 11172098 (PMID 11172098)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Hemelaar J., Gouws E., Ghys P.D., Osmanov S. // AIDS : journal. — 2006. — No. 16 (3). — P. W13—23.
- ↑ Peeters M., Gueye A., Mboup S., Bibollet-Ruche F., Ekaza E., Mulanga C., Ouedrago R., Gandji R., Mpele P., Dibanga G., Koumare B., Saidou M., Esu-Williams E., Lombart J.P., Badombena W., Luo N., Vanden Haesevelde M., Delaporte E. // AIDS : journal. — 1997. — No. 4 (3). — P. 493—498.
- ↑ Mourez T, Simon F, Plantier JC. Non-M variants of human immunodeficiency virus type 1. Clin Microbiol Rev. 2013 Jul;26(3):448-61
- ↑ AVERT.org. HIV Strains: Types, Groups and Subtypes (англ.). Процитовано 24 липня 2014.
- ↑ Julie Yamaguchi, Ruthie Coffey, Ana Vallari, Charlotte Ngansop, Dora Mbanya, Nicaise Ndembi, Lazare Kaptué, Lutz G. Gürtler, Pierre Bodelle, Gerald Schochetman, Sushil G. Devare, Catherine A. Brennan. // AIDS Research and Human Retroviruses : journal. — 2006. — No. 1 (1). — P. 83—92.
- ↑ Plantier J.C., Leoz M., Dickerson J.E., De Oliveira F., Cordonnier F., Lemée V., Damond F., Robertson D.L., Simon F. // Nature Medicine : journal. — 2009. — No. 8 (8). — P. 871—872.
- ↑ New HIV strain discovered. Associated Press. CBC News. 3 серпня 2009. Архів оригіналу за 5 серпня 2009. Процитовано 3 серпня 2009.
- ↑ Donald G. McNeil, Jr. (16 вересня 2010). Precursor to H.I.V. Was in Monkeys for Millennia. New York Times. Процитовано 17 вересня 2010.
But P appears to have crossed over from a gorilla; it was discovered only last year, and in only one woman, who was from Cameroon, where lowland gorillas are hunted for meat.
- ↑ PMID 2425430 (PMID 2425430)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 3031510 (PMID 3031510)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 21796096 (PMID 21796096)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. За 12 лет с 1988 по 2010 в США зарегистрированы лишь 242 случая ВИЧ-инфекции - ↑ Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents (англ.). U.S. Department of Health and Human Services. Процитовано 21 липня 2014.
Инфекция ВИЧ-2 эндемична в Западной Африке и имеет лишь ограниченное распространение за пределами этой зоны.
- ↑ Santiago, M. L.; Range, F.; Keele, B. F.; Li, Y.; Bailes, E.; Bibollet-Ruche, F.; Fruteau, C.; Noe, R.; Peeters, M. // Journal of Virology : journal. — 2005. — No. 19. — P. 12515—12527.
- ↑ McGovern S.L., Caselli E., Grigorieff N., Shoichet B.K. // Journal of Medical Chemistry : journal. — 2002. — No. 8. — P. 1712—1722.
- ↑ Compared with overview in: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. {{{Заголовок}}}. — Hagerstown, MD : Lippincott Williams & Wilkins, 2007. — ISBN 0-7817-8215-5. Page 3
- ↑ а б в г д Los Alamos National Laboratory. {{{Заголовок}}}. — 2008.
- ↑ а б в PMID 9878383 (PMID 9878383)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 8091422 (PMID 8091422)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 8312057 (PMID 8312057)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12835701 (PMID 12835701)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в PMID 20012522 (PMID 20012522)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в PMID 18672082 (PMID 18672082)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 18541215 (PMID 18541215)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 18599104 (PMID 18599104)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 18200009 (PMID 18200009)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 18342597 (PMID 18342597)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 21176220 (PMID 21176220)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б PMID 20201792 (PMID 20201792)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ а б в г д Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525
- ↑ PMID 11044102 (PMID 11044102)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 17888184 (PMID 17888184)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Montagnier, Luc. (1999) Human Immunodeficiency Viruses (Retroviridae). Encyclopedia of Virology (2nd Ed.) 763—774
- ↑ а б HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time (PDF) (англ.). Science. 1996 Mar 15;271(5255):1582-6. Архів оригіналу (PDF) за 5 березня 2016. Процитовано 23 серпня 2014. PMID 8599114
- ↑ PMID 15647694 (PMID 15647694)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 10922058 (PMID 10922058)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Wilen CB, Tilton JC, Doms RW. HIV: cell binding and entry. Cold Spring Harb Perspect Med. 2012 Aug 1;2(8)
- ↑ Информация о ВИЧ на сайте NIAID (англ.). Процитовано 7 серпня 2014.
- ↑ Размножение вируса иммунодефицита человека в клетке
- ↑ Levy J.A. HIV and the pathogenesis of AIDS. — p. 110, 111, 160, 161 — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2
- ↑ а б PMID 22355797 (PMID 22355797)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 8599114 (PMID 8599114)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ ВИЧ-инфекция Под ред. Ю. В. Лобзина, С. С. Козлова, А. Н. Ускова, 2000 год.
- ↑ PMID 11821899 (PMID 11821899)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12163303 (PMID 12163303)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 9329969 (PMID 9329969)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Siliciano RF, Greene WC. «HIV latency». Cold Spring Harb Perspect Med. 2011 Sep;1(1): a007096. doi: 10.1101/cshperspect.a007096
- ↑ Генетический ластик для ВИЧ (рос.). Фонд развития межсекторного социального партнёрства. Процитовано 21 липня 2014.
- ↑ PMID 24927590 (PMID 24927590)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 25049410 (PMID 25049410)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Кирилл Стасевич (25 липня 2014). Клетки человека избавили от ВИЧ. Наука и жизнь (рос.). nkj.ru. Процитовано 27 липня 2014.
- ↑ Randy Dotinga. Genetic HIV Resistance Deciphered (англ.). WIRED.com // Condé Nast. Процитовано 21 липня 2014.
- ↑ Кузнецов, Даниил. Помилка: не задано параметр
|назва=в шаблоні {{публікація}}. — Популярная механика. — 2018. — № 9. - ↑ PMID 19317737 (PMID 19317737)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12170257 (PMID 12170257)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ Sheehy AM, Gaddis NC, Choi JD, Malim MH (2002) Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral Vif protein. Nature. 2002 Aug 8;418 (6898):646-650.
- ↑ Kaiser, Shariser. // Science : journal. — 2007. — No. 5832. — (6). — P. 1756—1758.
- ↑ PMID 15243629 (PMID 15243629)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 19929170 (PMID 19929170)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 12956872 (PMID 12956872)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 19879838 (PMID 19879838)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 20485522 (PMID 20485522)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 20688520 (PMID 20688520)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - ↑ PMID 20019814 (PMID 20019814)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.
Література
- Туберкульоз, ВІЛ-інфекція/СНІД. Затверджено Міністерством освіти і науки України як навчальний посібник для студентів вищих навчальних закладів. Рекомендовано Міністеством охорони здоров'я України як навчальний посібник для студентів вищих медичних навчальних закладів III—IV рівнів акредитації / За редакцією члена-кореспондента, професора В. Ф. Москаленка, професора Р. Г. Процюка. — Київ : «Медицина», 2009. — 424 с. — ISBN 978-966-10-0059-8.
- Bushman F.D., Nabel G.J., Swanstrom R. (Editors). {{{Заголовок}}}. — Cold Spring Harbor, New York, USA : Cold Spring Harbor Laboratory Press, 2012. — 572 с. — ISBN 978-193611340-8.
- Levy J.A. {{{Заголовок}}}. — Third edition. — ASM Press, 2007. — 644 с. — ISBN 978-1-55581-393-2.
- Pancino G., Silvestri G., Fowke K. (Editors). {{{Заголовок}}}. — UK-USA-Canada : Academic Press, 2012. — 345 с. — ISBN 978-0-12-387715-4.
- Pepin J. {{{Заголовок}}}. — New York, USA : Cambridge University Press, 2011. — 293 с. — ISBN 978-0-52118637-7.
- Prasad V.R., Kalpana G.V. (Editors). {{{Заголовок}}}. — Humana Press, 2009. — 457 с. — ISBN 978-1-58829-859-1.
- Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors). {{{Заголовок}}}. — Jones and Bartlett Learning, 2012. — 248 с. — ISBN 978-1-4496-5092-6.
- Spearman P., Freed E.O. (Editors). {{{Заголовок}}}. — Springer, 2009. — 204 с. — ISBN 978-3-642-02174-9.
- Weeks B.B., Alcamo I.E. {{{Заголовок}}}. — USA - Canada - UK : Jones and Bartlett Publishers, 2010. — 360 с. — ISBN 978-0-7637-6324-4.
Посилання
- Безкоштовно дізнатися свій ВІЛ статус.
- Найбезглуздіші легенди про ВІЛ, в які соромно вірити
- ВІЛ-інфекція в Україні
- Популярно про ВІЛ-інфекцію
- Питання діагностики та терапії ВІЛ-інфекції/СНІД
- Історія та етіологія ВІЛ-інфекції
- Доктор Панацейко та його поради, анімаційний проект фонду Олени Франчук «АнтиСНІД»
| ||||||||||||||||||||||||||||||||
|
