Малярія
| Малярія | |
|---|---|
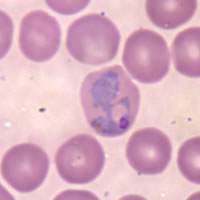 Червоні кров’яні тільця, заражені P. vivax | |
| Спеціальність | інфекційні хвороби, тропічна медицина і паразитологія |
| Симптоми | переміжна гарячка, періодична гарячкаd, гепатомегалія, анемія, спленомегалія, жовтяниця, кома, озноб[1] і гарячка |
| Причини | P. falciparum[2], P. vivax[2], P. malariae[2], Plasmodium ovale[2] і P. knowlesi |
| Метод діагностики | мазок крові[3], оптичний мікроскоп і ПЛР |
| Ведення | протималярійні засоби, антипіретики, внутрішньовенне заміщення рідиниd і симптоматична терапія |
| Препарати | хлорохін[4], прімахінd[4], гідроксихлорохін[4], мефлохін[4], піріметамін[4], примахіну фосфатd[4], сульфадіазин[5], цінхонідинd[6], артезунат / амодіахін, артемізинінd, хінідин, хінін, доксициклін, кліндаміцин і атоваквон |
| Класифікація та зовнішні ресурси | |
| МКХ-10 | B50 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| eMedicine | ped/1357 |
| MeSH | D008288 |
| | |
Малярі́я (англ. malaria від с.в. італ. mala — «погане» та італ. aria — «повітря»; також фр. paludisme, нім. Wechselfieber; застаріле, побутове — болотна хвороба, переміжна гарячка, болотна гарячка, трясця, пропасниця тощо) — інфекційне захворювання, яке спричинюють найпростіші з роду плазмодіїв (Plasmodium, зокрема 80—90 % випадків смерті припадає на тропічну малярію, яку породжує Plasmodium falciparum). Передається людині зазвичай при укусах комарів роду Anopheles (так званих «малярійних комарів»). Перебіг хвороби супроводжується гарячкою, ознобом, потінням, спленомегалією (збільшенням розмірів селезінки), гепатомегалією (збільшенням розмірів печінки) і часто анемією, характеризується хронічним перебігом із можливістю рецидивів.
Значення і актуальність[ред. | ред. код]

Малярія завжди була і є однією з найнебезпечніших хвороб людини. Вона приводила до занепаду великі країни, знищувала народи, вирішувала результати війн. До відомих жертв, які найімовірніше померли від малярії, належать: єгипетський фараон Тутанхамон, Александр Македонський, Аларіх I (король готів), Аттіла (король гунів), Чингісхан, святий Августин, принаймні 5 римських пап, італійський поет Данте Аліг'єрі, імператор Священної Римської імперії Карл V, Христофор Колумб, Олівер Кромвель, лорд Байрон, український ентомолог Д. В. Знойко та багато інших[7].
Факти щодо малярії:
- У 2022 році майже половина населення світу перебувала під загрозою захворювання на малярію[8].
- За оцінками, у 2022 році було зареєстровано 249 млн випадків малярії, а оціночна кількість смертей від малярії становила 608 тисяч у 85 країнах[8].
- Африканський регіон ВООЗ несе непропорційно велику частку глобального тягаря малярії. У 2022 році в цьому регіоні було 94 % випадків малярії (233 мільйони) і 95 % (580 000) випадків смерті від малярії[8]. З решти країн 70 % випадків припадає на Індію, Бразилію, Шрі-Ланку, В'єтнам, Колумбію та Соломонові острови[9].

- Смертність від малярії досягла 608 000 у 2022 році, у порівнянні з 44 000 у 2016 році.
- Значна більшість померлих — це діти віком до 5 років[11].
- За 2010—2020 роки з третього місця за числом смертних випадків у рік (після пневмонії й туберкульозу) малярія вийшла на перше серед інфекційних захворювань.
- Щороку близько 30 000 відвідувачів небезпечних районів захворюють на малярію, 1 % з них помирає.
- Витрати на дослідження малярії у світі становлять 58 млн доларів США, або близько 0,02 % всіх витрат на дослідження з медицини.
- Загальне фінансування програми контролю та ліквідації малярії досягло приблизно 2,7 млрд доларів США у 2016 році. Внески урядів країн, які розвиваються, склали 800 млн доларів США, що становить 31 % фінансування[8]. На одну смерть від малярії припадає 65 доларів на лікування та дослідження (у світі). Для порівняння, на одну смерть від СНІДу припадає 3400 доларів[12].
У XXI столітті значущість цієї хвороби настільки велика, що навіть пропонується розглядати проблему захворювання в окремому розділі вчення про інфекційні хвороби — маляріології. Незважаючи на багаторічну історію боротьби проти малярії, успіхи в цьому у світі та в Україні, у зв'язку з глобальною зміною вигляду інфекційних захворювань, потеплінням клімату, що призводить до поширення переносників за межі їхнього звичайного проживання, а також розвитком резистентності до протималярійних препаратів це захворювання знову набуває актуальності, вимагає нових знань у діагностиці, лікуванні та профілактиці[13].
Існує гіпотеза, що значне поширення ракових захворювань наприкінці XIX і XX століть пов'язане з успіхом жарознижуючих і протималярійних стратегій і ліків за останні півтора століття, що могло привести до ненавмисного ефекту звільнення передракових новоутворень і неопластичних вогнищ від гальмівного впливу переміжної малярійної гарячки, адже адаптивна та терапевтична природа її була визнана століттями, і як місцева, так і системна термотерапія використовуються для підвищення ефективності як хіміотерапії, так і променевої терапії раку[14].
Передбачається, що внаслідок пандемії коронавірусної хвороби 2019 відбудеться значне погіршення ситуації з малярією у світі, особливо в ендемічних районах Африки, через обмеженість доступу до послуг охорони здоров'я, погіршення доступності лікувальних і профілактичних товарів і ліків та зменшення впливу на кампанії з профілактики малярії[15].
Історія[ред. | ред. код]
Стародавня історія[ред. | ред. код]
Вважається, що людина і малярія розвивалися разом. Найімовірніше за все, батьківщиною малярії є Західна (P. falciparum) та Центральна Африка (P. vivax). Предки малярійного плазмодія існували вже як мінімум пів мільярда років тому. Молекулярно-генетичні дані свідчать, що передпаразитичний предок плазмодія був вільноживучим найпростішим, здатним до фотосинтезу, який пристосувався жити в кишці водних безхребетних. Також він міг жити у личинках перших кровососних комах ряду двокрилих, які з'явилися 150—200 мільйонів років тому, скоро набувши здатності мати двох хазяїв. З появою людини розвилися малярійні паразити, здатні до переміщення між людиною та комарами роду Anopheles. Найстаріші знайдені скам'янілості комарів із залишками малярійних паразитів мають вік 30 мільйонів років[16].
P. falciparum близько пов'язаний зі збудником захворювання шимпанзе P. reichenowi та збудниками захворювання птахів, які виділилися в окрему лінію близько 130 млн років тому. P. falciparum виділився в окремий вид між 10 і 4 млн років тому, що приблизно збігалося із розходженням людини та інших великих людиноподібних мавп. Близько 100 млн років тому, виділилася ще одна група плазмодіїв, P. malariae, P. ovale, P. cynomolgi і P. vivax. Тоді як P. ovale заражає тільки людину, решта видів паразитують переважно на інших ссавцях. Колись предків людини заражав P. malariae, а P. vivax, який виділився до окремого виду близько 2—3 млн років тому, продовжує заражати людину і зараз[16].
З розвитком сільського господарства в Африці приблизно 8 тисяч років тому з'явилися дуже сприятливі умови для пристосування малярії винятково до людини. Велика щільність населення та наявність штучних або природних водойм поруч із житлом людини дали малярійним комарам стабільне джерело їжі, завдяки чому їхня кількість значно зросла, вони пристосувалися до людини, вслід за чим і плазмодій значно підвищив свою ефективність інфікування людини. В інших частинах світу раннє одомашнення тварин запобігло цьому процесу, де індекс антропофілії, тобто відсоток укусів людей порівняно із загальним числом укусів, становить 10—20 %. У Центральній Африці це число становить 80—100 %, що пояснює інтенсивність сучасних епідемій у цьому регіоні.
Свідчення про малярію існували у літературі дуже давно: починаючи з першої згадки у 27 році до н. е. у «Ней-Чінг», китайській роботі з медицини; вони зустрічаються у «Сушрута Самхіта», медичній роботі, написаній санскритом; роботах Геродота та багатьох інших.
Перші засоби лікування[ред. | ред. код]

Першим відомим засобом лікування був полин однорічний або цінхао (Artemisia annua L), який містить артемізинін, перша згадка про використання цієї рослини належить роботі Ге Конга 340 року до н. е.
З відкриттям Нового Світу з'явився новий засіб — кора хінного дерева, яку віками використовували індіанці як жарознижувальний засіб. 1638 року згідно із канонічною версією, Хуан дель Вего, особистий лікар іспанської графині Цинхон (Чінчон), дружини віцекороля Перу, вперше застосував кору хінного дерева, розтерту в порошок, для лікування малярії. Графиня на малярію заразилася в долині Ланавара на узбережжі Тихого океану, захворіла на тяжку форму, і лікар скористався відомостями, отриманими від тубільців Перу, які застосовували здавна кору дерева хин-хіни як засіб від болотяної гарячки. За іншою версією, саму кору віцекоролю передав коррехідор (губернатор) долини Лоха, якому її піднесли його підлеглі, які знали про лікувальні властивості кори. Графиня благополучно вилікувалася. У 1640 році вона і її лікар привезли з собою в Іспанію велику кількість дорогоцінної кори і роздали її жителям околиць Мадрида, які постійно страждали від малярії. Ліки стало відомим як «порошок графині». Через кілька років єзуїти, які діяли в Перу, передали кору в Рим, де її застосовували як ліки від малярії, і завдяки їм вона стала відома по всій Італії. На честь графині відомий натураліст Карл Лінней дав в 1742 році дереву хин-хіна наукову назву — Cinchona oficinalis[13].
Тубільне назва цього дерева «кава-хукку». Деревна кора мовою кечуа вимовляється як «кіна», а іспанською мовою пишеться як «quina». Тоді як лікувальну кору називали «корою всіх кор» — «хіна-хіна» (quina-quina). Ця назва швидко поширилася в Європі. Французи писали «фр. quinguina», італійці — «італ. quin-quina» та «італ. chin-china», але вимовляли як і французи «кін-кіна». Шведи і голландці писали «kina» і вимовляли «кіна», поляки — «пол. kwinkinna» (квінкінна). Англійці і росіяни довго називали кору просто «перуанська кора». Латиною ж кора кінкіни «лат. cortex chinae», читається — «кортекс хіні». Звідси і з'явилося слово «хіна», яке, власне, означає не кору, а «порошок кори». І дерево звідси стали називати хінним деревом[13].
Однак розповідь про графиню Цинхон — це красива легенда. У 1930 році знайшли щоденник віцекороля Перу графа де Цинхон. Цей щоденник суперечить тій історії, у якій саме дружина графа привезла хінний порошок у Європу. У щоденнику міститься інформація про те, що перша дружина віцекороля, Анна де Осоріо, померла ще до відбуття її чоловіка з Іспанії в Перу. Туди з графом вирушила його друга дружина Франциска Енрікес де Рібейра, і у неї не було проблем зі здоров'ям. Віцекороль мав кілька нападів гарячки, але сам ніколи не проходив лікування хінною корою. Також у його щоденнику міститься запис про те, що його друга дружина померла в Картахені, ще не повернувшись до Іспанії; таким чином, вона ніяк не могла доставити в цю країну кору хінного дерева. Тому нині обґрунтовано вважають, що перший опис властивостей кори хінного дерева дав видатний іспанський історик-натураліст Бернабе Кобо, єзуїтський місіонер і письменник, який 1632 року привіз її до Європи. Надалі кардинал Хуан де Луго, один із найвидатніших іспанських богословів і економістів свого часу, отримав доручення від Папи Римського Інокентія X зібрати інформацію про цілющу кору. Слідом за цим її вивчив папський придворний лікар Г. Фонсека, якого вельми зацікавили властивості порошку. Потім кардинал де Луго розгорнув широку кампанію за застосування хініну. У результаті ліки прозвали «єзуїтським», або «кардинальським» порошком, а люди в Римі якийсь час називали його «порошком де Луго»[17].
Ще одна версія свідчить, що єзуїт, аптекар за освітою, Агустино Салумбріно, який проживав на початку XVII століття в перуанській столиці Лімі, зацікавився властивостями порошку з хінного дерева, який при прийомі всередину зцілював від гарячки і «пропасниці»[18]. Надалі Салумбріно відправив кілька порошків до Риму, жителі якого страждали від місцевої малярії, і в якому багато кардиналів і понтифіків померли від цієї хвороби[19].
Ліки, які так завзято пропагували єзуїти, спочатку викликали недовіру. В Англії навіть поповзли чутки, що за гірким порошком нібито криється змова папістів. Коли англійський державний діяч і воєначальник Олівер Кромвель захворів 1658 року на малярію, він рішуче відмовився приймати «єзуїтське зілля», після чого швидко помер. Інші відомі особистості — англійській король Карл II і французький король Людовик XIV успішно вилікувалися за допомогою цілющого порошку[13].
Дослідження причин хвороби[ред. | ред. код]

У 1880 році французький військовий лікар Шарль Луї Альфонс Лаверан навів перші свідоцтва, що малярію спричинюють найпростіші, — перший випадок, коли найпростіші були ідентифіковані як причина хвороби. За це та інші відкриття його було нагороджено Нобелівською премією з фізіології та медицини в 1907 році. Тим самим він заклав основу для подальших успішних досліджень у галузі розробки методів боротьби з цією хворобою. Роком пізніше кубинський лікар Карлос Фінлей, який лікував хворих на жовту гарячку в Гавані, вперше припустив, що хвороба може бути передана людині комарами. Індійський лікар і паразитолог шотландського походження Сер Рональд Росс показав у 1898 році, що певні види комарів передають малярію птахам, і одержав у 1902 році Нобелівською премією з медицини за опис життєвого циклу цього паразита. Дані, одержані Фінлеєм, були визнані дещо пізніше, в 1900 році, коли були підтверджені медичною радою, очоленою Вальтером Рідом; рекомендації цієї ради були вперше і з великою ефективністю використані Вільямом Горгасом в оздоровчих заходах, здійснених протягом будівництва Панамського каналу.
Етіологія[ред. | ред. код]
При порівнянні ризику малярії для кількісної характеристики небезпеки для мандрівників використовують ентомологічний інокуляційний коефіцієнт (ЕІК). Це щорічна кількість інфікуючих комариних укусів, отриманих однією людиною. Так, ЕІК у Східному Таїланді становить близько 0,91, що, приблизно, еквівалентно одному інфікуючому комариному укусу в рік, тоді як у провінціях Танзанії ЕІК становить 667, що еквівалентно двом інфікуючим укусам за ніч. У ряді країн переважно тропічної Африки кожен житель, як і мандрівник, який там перебуває, піддаються щорічно від 40 до 120 і більше укусів заражених комарів. Більш інтенсивна передача малярії відбувається в тих місцях, де переносник воліє кусати людей, а не тварин. Зокрема Anopheles gambiae, що мешкає в Африці, є одним із найнебезпечніших переносників малярії. Це триваложивучі, антропофільні комарі, яким притаманна особливість жити поблизу людського житла[13].
| Регіон мандрівки | Можливий ризик |
|---|---|
| Європа, Північна Азія, Австралія, Нова Зеландія, Північна Америка, Близький Схід — регіони вкрай низького ризику |
1,0 |
| Карибський регіон | 3,8 |
| Північна Африка | 6,9 |
| Південна Америка | 8,3 |
| Південно-Східна Азія | 11,5 |
| Центральна Америка | 37,8 |
| Південна Азія | 53,8 |
| Океанія | 76,7 |
| Африка південніше Сахари (Суб-Сахарна Африка) | 207,6 |
На узбережжі океанів і морів ризик передачі малярії нижчий, ніж у континентальних районах. Комарі роду Anopheles здатні активно пересуватися горизонтально на відстань до 3 кілометрів, тоді як у висоту не більше ніж на 30 метрів. Тому на височинах їх, як правило, немає. Зазвичай, малярія не зустрічається вище 1500 метрів над рівнем моря за деякими винятками. У 1945 році було описано осередок вівакс-малярії на висотах 2750—2850 метрів у горах південного Таджикистану. Того ж року було показано, що передача її відбувається в болівійських Андах на висоті 2500 метрів. У 1948 році було виявлено осередок тропічної малярії на висоті 2600 метрів у горах Кенії. Комарів може далеко пасивно переносити вітер, вони можуть потрапляти на далекі відстані всередині автомобілів, вагонів потягів, суден, літаків. Завезення малярії до вільних від неї регіонів нерідко відбувається у вигляді так званої аеропортової малярії, тобто такої, яка виникає внаслідок випадкового транспортування літаками з ендемічних по малярії країн живих, інфікованих малярійними плазмодіями комарів. Аеропортова (а також багажна) малярія становить особливу загрозу для здоров'я населення, адже вона уражає людей, які живуть або працюють поблизу від міжнародних аеропортів, які за інших умов ніколи не піддавалися ризику зараження малярією. Наслідком цього часто виникають труднощі зі своєчасною постановкою діагнозу, що може привести до тривалої тяжкої хвороби або навіть смерті. Максимальна відома віддаленість виникнення випадку аеропортової малярії від летовища сягала 30 км. Можливо завезення малярії й морехідним способом у трюмах та інших приміщеннях кораблів[13].
Рідше відбувається інша передача малярії: з людською інфікованою кров'ю (гемоконтактний механізм передачі інфекції) при переливаннях кровепрепаратів і під час трансплантації органів. Зокрема, особливістю чотириденної малярії є така тривалість інфекції, яка іноді перетворюється навіть у довічну персистенцію. Зазвичай вона не супроводжується гарячкою, а перебігає у вигляді безсимптомного паразитоносійства. У таких людей як донорів можуть взяти кров із метою переливання і заразити реципієнта малярією. Найбільший відсоток інфікування таким способом доводиться якраз на чотириденну малярію. Були описані випадки в США і СРСР, коли плазмодієносійство чотириденної малярії зберігалось 30—70 років після приїзду з ендемічної малярійної місцевості або з моменту ліквідації малярії на певній території, де проживав носій.
Зараження внаслідок внутрішньовенного введення кустарно зроблених наркотичних речовин, отримання яких відбувається шляхом застосування крові наркодилера для безпосереднього осаду наркотику з сировини[13]. У США впродовж 1967—1974 років описано зараження понад 200 осіб тропічною малярією в результаті введення зараженого таким чином наркотичного засобу[22]. При грубому пошкодженні плаценти під час вагітності еритроцитарні шизонти здатні потрапити у кровоносну систему плода, і відбувається власне внутрішньоутробне зараження його (так звана антенатальна інфекція). Зараження за умови не пошкодженої плаценти можливе також під час пологів при її відшаруванні, коли змішуються кров матері та дитини, або під час проходження новонародженого через родові шляхи за наявності пологової травми — таким чином загалом реалізується вертикальний механізм передачі інфекції[13].
Географічне поширення різних видів малярії[ред. | ред. код]
Тропічна малярія[ред. | ред. код]
Тропічна малярія загалом поширена в країнах тропічного і субтропічного кліматичного поясу, географічний ареал її стабільно знаходиться між 40° пн. ш. і 20° пд. ш., хоча в певних умовах можливе просування збудника і північніше у помірні широти, аж до 61° пн. ш. Поширення тропічної малярії в країнах тропічного і субтропічного кліматичного поясу пояснюється тим, що у P. falciparum не виявлено біологічних властивостей, які мали б пристосувальний характер до існування поза межами жаркого клімату. Однак, в екваторіальній зоні Південної Америки за широтою розподілу P. falciparum в два рази поступається P. vivax. Близько 40 видів комарів роду Anopheles здатні передавати тропічну малярію. Водночас численні дослідження показують, що стійка передача в Європі тропічної малярії неможлива через те, що місцеві комарі не можуть переносити P. falciparum. Дослідження показали, що в Україні автохтонні види Anopheles не здатні заражатися гамонтами P. falciparum, а тропічні види комарів, здатні переносити гамонти збудника тропічної малярії, не виживають в Україні через відносну низьку температуру довкілля, у зв'язку з чим тропічна малярія в нашій країні нині ендемічно закріпитися не зможе. Однак прогресуючі кліматичні зміни на тлі глобального потепління, можуть сприяти появі на півдні Європи виду Anopheles superpictus, що створює умови для місцевої передачі P. falciparum[13].
Вівакс-малярія[ред. | ред. код]
Вівакс-малярія, яку спричинює P. vivax, є найпоширенішою у світі, вона зустрічається на всіх континентах, за винятком Антарктиди. На сьогодні у країнах Америки вільними від малярії взагалі й цього виду зокрема є Канада, США, Куба, Пуерто-Рико, Чилі та Уругвай, а найбільше число хворих реєструється у Болівії, Колумбії, Перу, Венесуелі, Еквадорі та Мексиці, найвищий рівень захворюваності — в Гаяні, Суринамі та Бразилії. Число хворих на вівакс-малярію на цьому континенті становить понад 1 млн випадків щорічно. На африканському континенті цей вид малярії постійно зустрічається в країнах східної та південної Африки в арабів, індійців, європейців, ефіопів. Північ Африки наразі є вільною від будь-якого виду малярії. В іншій частині африканського континенту, особливо в Західній Африці, вівакс-малярія не зустрічається через генетичну стійкість негроїдного населення до цього виду малярії. В Азії стійка передача вівакс-малярії існує в Афганістані, Бангладеш, Бутані, В'єтнамі, Ємені, Індії, Індонезії, Ірані, Іраку, Камбоджі, Лаосі, М'янмі, Непалі, Саудівській Аравії, Шрі-Ланці та Таїланді. Реальна захворюваність у кілька разів перевищує реєстроване число хворих. Загальна кількість хворих становить понад 10 млн. У тихоокеанському регіоні, куди входять частина Східної Азії і Океанії, вільні від цієї та будь-якої іншої малярії Австралія, Бруней, Монголія, Нова Зеландія, Сінгапур, Південна Корея, Японія, північ Китаю і частина островів Океанії. Число хворих у регіоні сягає 2,5 млн. З 50 країн Європи ендемічними по вівакс-малярії на цей момент умовно вважаються Вірменія і Грузія. У азійській частині Туреччини захворюваність становить 2—4 тисячі осіб щорічно.
У деяких країнах помірного клімату вівакс-малярія була і є єдиною або переважною формою. Це пояснюється здатністю, в порівнянні з іншими видами, розвиватися в організмі переносника при нижчих, ніж для інших плазмодіїв, температурах, а також тривалішим перебігом цього виду малярії. Пристосованість P. vivax до виживання в багатьох кліматичних регіонах обумовлена тим, що збудник тривалий час, протягом декількох місяців і навіть років, може зберігатися в організмі людини в пасивному стані, у вигляді гіпнозоїтів (брадізоїтов). У північних широтах із короткою влітку і тривалою сезонною перервою передачі малярії це забезпечує появу хвороби в наступному епідемічному сезоні після 6 місяців і більш тривалого латентного періоду, іноді аж до 3-х років (тривалий інкубаційний період). А от у субтропіках і тропіках у популяції P. vivax переважають тахізоїти, які спричинюють хворобу після короткого інкубаційного періоду — 10—21 день. Зараження ж спорозоїтами різних типів, як тахі-, так і брадизоїтами веде до розвитку вівакс-малярії після короткої інкубації з повторними проявами (рецидивами), зумовленими активізацією «дрімаючих» форм. Так проявляється бімодальна активність цього плазмодія[13].
Чотириденна малярія[ред. | ред. код]
Ареал чотириденної малярії в період максимального поширення був обмежений 58° північної широти (Нідерланди) і 29° південної широти (Аргентина). Характерною особливістю ареалу цього виду малярії, яку спричинює P. malariae, є його розірваність у географічних регіонах, де осередки чотириденної малярії розташовані гніздами. У багатьох осередках вівакс- і тропічної малярії циркуляція P. malariae відсутня. Чотириденна малярія на сьогодні зустрічається в Африці на південь від Сахари, на більшій частині Південно-Східної Азії, в Індонезії, на багатьох з островів західної частини Тихого океану і в районах басейну Амазонки в Південній Америці[13].
Овале-малярія[ред. | ред. код]
Найбільш своєрідним є ареал овале-малярії, який був вивчений станом на 1969 рік. P. ovale постійно реєструють тільки в західній частині тропічної Африки. Спорадичні випадки захворювання виявляють на островах Філіппін, Індонезії, у східній Індії, Пакистані та Південно-Східній Азії (В'єтнам, М'янма, Лаос, Кампучія, Таїланд). Обмеженість і розірваність ареалу на 2 регіони пояснюється тривалістю спорогонії (15—16 днів при температурі 20 °C), низькою і непостійною продукцією гамонтів, що зменшує можливість зараження переносника. Укоріненню овале-малярії в інших регіонах перешкоджає також відсутність найефективнішого переносника — A. gambiae. На сьогодні вид P. ovale поділяють на два підвиди — curtisi і wallikeri, але в клінічному плані перебіг захворювань, які спричинюють ці підвиди, не має відмінностей. Поширення цих двох підвидів у природі не вивчене[13].
Патогенез[ред. | ред. код]
Зміни в людському організмі під час тканинної шизогонії[ред. | ред. код]
Одразу після укусу комара спорозоїти вже через 30 хвилин досягають печінки, де в гепатоцитах відбувається перша фаза нестатевого циклу розвитку плазмодіїв — починається тканинна шизгонія, яка йде протягом інкубаційного періоду. Уперше в 1948 році британські науковці Г. Шортт і С. Гарнем виявили в біоптатах печінки мавп тканинні форми паразита. Надалі це було виявлено і в біоптатах печінки людей, хворих на малярію[23].
Було простежено всі етапи тканинної шизгонії у всіх видів плазмодіїв. Вторгнення спорозоїта в гепатоцит змінює властивості печінкової клітини. Її клітинна мембрана грубішає, а сама клітина змінює форму, стає значно жорсткішою — механізми цих змін поки що невідомі. Спорозоїт швидко губить свій «плащ» на апікальній поверхні й перетворюється в тканинний трофозоїт. Потім всередині вакуолі гепатоцита відбувається розвиток із трофозоїта тканинного шизонта. На цій стадії його ядро ділиться декілька разів зі збільшенням розмірів шизонта, але без його сегментування. Молекулярні механізми, які лежать в основі цього патологічного процесу, ще остаточно не з'ясовано. Надалі, після сегментації тканинного шизонта, паразит диференціюється в тканинний мерозоїт, а гепатоцит гине. Було прояснено, що з одного спорозоїта в гепатоциті утворюється від 2 до 40 тисяч тканинних мерозоїтів залежно від виду малярійного плазмодія[13].
Тканинні мерозоїти нездатні знову заразити гепатоцити. Через наявність у людини великої кількості здорових гепатоцитів гибель певної кількості їх через вихід із них мерозоїтів ніяк не впливає на функцію печінки і самопочуття людини. Тканинна шизогонія відповідає частині інкубаційного періоду хвороби. Тривалість тканинної шизогонії у P. falciparum складає 6 діб, в P. vivax — 8 діб (мінімально), у P. ovale — 9 діб (мінімально), у P. malariae — 15 діб[13].
При зараженні P. vivax і P. ovale було виявлено, що в ряді випадків захворювання розвивається через багато місяців і навіть років після факту укусу комаром на ендемічній території або перебування там. Це явище назвали тривалою латенцією. Вперше 1946 року було висунуто гіпотезу про нециклічний розвиток екзоеритроцитарної (тканинної) стадії в печінці з перервою або «сплячкою»[24]. Як було потім виявлено при дослідженні біоптатів печінки, не всі спорозоїти, які потрапили в гепатоцити, швидко перетворюються в мерозоїти, деякі зі спорозоїтів дуже тривалий час (іноді до 1,5 року) не виявляють активності всередині гепатоцита[25]. Їх назвали повільними, або сплячими, або дрімлючими спорозоїтами (брадизоїтами або гіпнозоїтами) на відміну від «звичайних» тахізоїтів (тобто швидких)[13].
Зміни при еритроцитарній шизогонії[ред. | ред. код]
Надалі гепатоцит гине, і тканинні мерозоїти потрапляють у кровоносне русло, проникаючи в еритроцити. Починається друга фаза нестатевого розвитку — еритроцитарна шизогонія. Однак не всі тканинні мерозоїти досягають своєї кінцевої мети, тому що більшість їх гине через дію захисних сил організму. Тому на початку еритроцитарної шизогонії уражено відносно невелику кількість еритроцитів. Тканинний мерозоїт, потрапивши впритул до еритроцита, відразу ж переорієнтовує кров'яну клітину таким чином, що його апікальний комплекс знаходиться в безпосередній близькості від мембрани еритроцита. Між паразитом і еритроцитом виникає щільний контакт. Згодом, по входженню мерозоїта всередину еритроцита, утворюється паразитоформна вакуоль (везикула), всередині якої надалі відбуваються усі стадії еритроцитарної шизогонії[13].
Механізм прикріплення паразита до еритроцита не до кінця прояснений. Значення в цьому процесі надають змінам електричного потенціалу еритроцита, що покращує прилипання тканинного мерозоїта, а також паразитарним білкам PfRh2a і PfRh2b. Вони є великими за масою, мають близько 3200 амінокислот. Білки відрізняються один від одного тільки на рівні останніх 500 амінокислот. Обговорюється велике значення в прикріпленні плазмодія до еритроцита малярійного білка PfRh5. Він взаємодіє з білком BSG на мембрані червоних кров'яних клітин. Якщо в еритроцитів немає білка BSG, то плазмодій ніяк не може приліпитися до них. Деякі плазмодії зв'язуються з еритроцитами за допомогою глікофорину А. Механіка процесу їхнього зв'язування була певною мірою прояснена: тканинні мерозоїти, які потрапили в кров'яне русло людини, на тлі низької концентрації калію в плазмі активують фермент фосфоліпазу C. Цей фермент ініціює підвищення концентрації внутрішньоклітинного кальцію, що, своєю чергою, запускає секрецію білків мікронема паразита, в тому числі й глікофорину А. Є думка, що поверхневий мерозоїтний білок MSP1 зв'язується, подібно гепарину, з еритроцитарними рецепторами, що є важливим кроком у процесі вторгнення мерозоїта в еритроцит. Є й інші шляхи можливої взаємодії — через білок PfRON2 плазмодія[13].
Під час еритроцитарної шизогонії плазмодій проходить послідовно два етапи розвитку — еритроцитарний трофозоїт (від грец. Τροφοζοιτ — істота, яка харчується), тобто зростаючий плазмодій, і еритроцитарний шизонт (від грец. σχιζοειδών — істота, яка розірве або роздере, мається на увазі еритроцит). Еритроцитарний трофозоїт у міру зростання частіше займає до 50 % обсягу еритроцита, але іноді може зайняти практично весь еритроцит. Після потрапляння в еритроцит, всередині паразітоформної везикули відбувається розвиток плазмодія, який втрачає свої апікальні органели. Плазмодій тоді при фарбуванні мазка крові морфологічно визначається у вигляді «кільця» або «персня». Тоді ж плазмодій починає харчуватися гемоглобіном і поглинає кисень, відкладаючи залишки свого процесу травлення в еритроциті у вигляді пігменту — гемомеланіну. Цей пігмент має особливості форми і розташування для кожного виду плазмодія, що розпізнається при особливому забарвленню мазка крові (плямистість Маурера, Шюффнера, Джеймса тощо). Для поглинання гемоглобіну плазмодій використовує набір ферментів, серед яких основне значення має протеаза аспарагінової кислоти. Паразит «з'їдає» до 70—80 % гемоглобіну еритроцитів, але тільки близько 15 % його використовує в ресинтезі своїх білків. Утилізацію тільки невеликої частини отриманих із гемоглобіну амінокислот пояснюють колоїдно-осмотичною теорією, яка передбачає, що надлишковий синтез білків із гемоглобіну підвищує осмотичний тиск всередині заражених еритроцитів, що призводить до їхнього передчасного розриву і подальшої ранньої загибелі паразита. Щоб уникнути цього, велика частина гемоглобіну перетравлюється і виділяється з еритроцита. Ця теорія була підтверджена експериментально[26].
Тривалість циклу еритроцитарної шизогонії у збудників тропічної, вівакс- і овале-малярії становить 48 годин, у збудника чотириденної малярії — 72 години. З одного тканинного мерозоїта в еритроциті формується в середньому до 12 (а у P. falciparum — іноді до 24) еритроцитарних мерозоїтів. Не всі вони надалі потрапляють у незаражені еритроцити, певна (різна в залежності від виду плазмодія) їхня частина гине під впливом різних захисних механізмів організму. Певна частка з них все ж проникає в незаражені еритроцити і в них знову починається новий цикл еритроцитарної шизогонії. Такі цикли можуть тривати без лікування досить довго. Після перших еритроцитарних циклів число загиблих еритроцитів і, відповідно, кількість пірогенів (факторів, які призводять до появи гарячки) недостатня для формування продуктивних клінічних проявів, тому інкубаційний період кожного виду малярії дорівнює не тільки тривалості тканинної шизогонії, але обов'язково включає і кілька еритроцитарних циклів, які перебігають безсимптомно. Так пірогенний потенціал P. falciparum становить 10 000 плазмодіїв в 1 мкл у неімунної людини і 100 000 в 1 мкл — в імунної. При вівакс-малярії пірогенний потенціал становить усього 100 паразитів в 1 мкл[13].
Патофізіологічні зміни по закінченню еритроцитарного циклу[ред. | ред. код]
Еритроцитарний шизонт, який ділиться, є нестатевою формою плазмодія. У середині сформованого шизонта (морули) утворюються еритроцитарні мерозоїти, після чого еритроцит розривається і вони виходять у кровотік, намагаючись проникнути в незаражені еритроцити. При загибелі еритроцита з нього виділяються також пірогенні фактори, які діють на центр терморегуляції людини, спричиняючи різкий підйом температури тіла. В основному, значення у формуванні гарячкового нападу (пароксизму) має комплекс пірогенів, який складають самі еритроцитарні мерозоїти, малярійний пігмент, вивільнені білки еритроцитів, фактор некрозу пухлин, цитокіни, фосфоліпідні фракції. Не спростовано гіпотезу про формування при малярії і якоїсь специфічної токсиноподібної речовини[13].
З наростанням внаслідок повторюваних циклів кількості уражених плазмодієм еритроцитів, що призводить до їхнього розпаду, на певному етапі у кровотік потрапляє така кількість пірогенних речовин, яка спричинює продуктивні клінічні прояви у вигляді гарячки, ознобу, жару, інших симптомів інтоксикації. З цього моменту при черговому надходженні у кровотік все більшого масиву пірогенів клінічні прояви кожен раз повторюються. Малярійні гарячкові напади (пароксизми) супроводжуються генералізованим звуженням периферичних судин під час стадії ознобу, яке у стадію жару змінюється різким їхнім розширенням. Ці зміни посилюють продукцію кінінів та інших речовин, що тільки збільшує запальні зміни. При перших нападах малярійної гарячки селезінка та печінка збільшуються внаслідок гострого кровонаповнення і значної інтенсифікації реакції системи моноцитарних фагоцитів цих органів на продукти розпаду еритроцитів і токсичні речовини самих плазмодіїв. При відкладанні великої кількості пигмента гемомеланіна в печінці та селезінці відбувається гіперплазія ендотелію, а при часто рецидивуючому перебігу хвороби — розростання сполучної тканини, що виражається індурацією цих органів[13].
При ураженні будь-яким із чотирьох видів збудників людської малярії еритроцити стають менш еластичними і більш схильними до їхнього захвату селезінкою. У міру стимулювання імунної системи захоплення еритроцитів селезінкою ще збільшується, при цьому уражені еритроцити піддаються тісному контакту з активованими макрофагами. Тут внутрішньоеритроцитарні плазмодії пошкоджуються або руйнуються секретованими макрофагами цитотоксинів і / або відбувається фагоцитоз самих еритроцитів. Цей процес має велике значення в імунній відповіді на малярію[27] Уражені еритроцити, які уникли захвату селезінкою, руйнуються в момент меруляції, що спричинює підвищення температури тіла хворого[13].
Особливості патофізіологічних зрушень при тропічній малярії[ред. | ред. код]

При паразитуванні збудника тропічної малярії в місцях скупчення специфічного антигену на мембрані еритроцита формуються електроннощільні горбки. Їхня кількість напряму залежить від штаму плазмодія, його географічної раси. Ці структури, ймовірно, беруть участь у прикріпленні інфікованих клітин до ендотелію капілярів і посткапілярних вен у внутрішніх органах тканинах, що призводить до внутрішньосудинної аглютинації і скупчення еритроцитів (утворення сладжів). У процесі дозрівання P. falciparum його білки вбудовуються в мембрану еритроцита. Високомолекулярний еритроцитарний мембранний протеїн 1 (ЕМП-1 або PfEMP1) плазмодія тропічної малярії є найбільш важливим лігандом для цітоадгезії. ЕМП-1 закріплюється на клітинній мембрані еритроцита за допомогою гістидинбогатого білка збудника. ЕМП-1 може зв'язуватися з декількома різними рецепторами адгезії ендотеліальних клітин, які активовані тромбоцитами і лімфоцитами, і таке зв'язування може відбуватися синергічно. Тромбоцити, які містять один із таких рецепторів CD36, можуть служити «липким мостом» між зараженими еритроцитами і клітинами ендотелію, що може бути вкрай важливим у розвитку церебральної форми тропічної малярії. Інфіковані еритроцити також гальмують рух неінфікованих еритроцитів, що призводить до утворення в судинах так званих розеток або сладжів. Цітоадгезія призводить до масивної секвестрації еритроцитів із плазмодіями всередині їх у різних органах. Однак секвестрація не відбувається рівномірно по всьому тілу, найбільш значуща вона в головному мозку, меншою мірою, але в клінічно значущому обсягу, спостерігається в серці, очах, печінці, нирках, кишках і жировій тканині, що обумовлює переважання певних клінічних проявів, притаманних тропічній малярії[13].
Результати досліджень за допомогою світлової та електронної мікроскопії показали, що хворі, які померли від церебральної форми тропічної малярії, мають більш помітну секвестрацію в мікроциркуляторному руслі головного мозку, мозочка, а також довгастого мозку, ніж пацієнти з тяжкою тропічною малярією без коми[28]. Водночас не виявлено зменшення припливу крові до головного мозку і низький кров'яний тиск при всіх випадках перебігу тяжкої форми тропічної малярії. Дослідження, проведені в африканських дітей із церебральною формою малярії показують збільшення проникності гематоенцефалічного бар'єра (ГЕБ) з одночасним руйнуванням ендотеліальних міжклітинних мембран[29][30]. Але, якщо у дітей при церебральній формі тропічної малярії відзначають набряк-набухання головного мозку і підвищення лікворного тиску, то у дорослих наявність вираженого набряку непереконлива, а лікворний тиск не підвищений. Справжня ж роль збільшення внутрішньочерепного тиску в патогенезі малярійної коми у дітей залишається неясною. Швидше за все, це не є її основною причиною, а більше особливістю пізньої стадії церебральної форми тропічної малярії у дітей[31][32]. Все це свідчить про деякі розбіжності в механізмах розвитку церебральної форми тропічної малярії в різних вікових категоріях[13].
Патоморфологічні дослідження у дітей, які загинули від церебральної форми тропічної малярії, показали, що, крім секвестрації контамінованих еритроцитів у судинної мережі мозкових структур, спостерігається і значне внутрішньосудинне нагромадження тромбоцитів, яке могло б пояснити швидкість розвитку коми при малярії у дітей значно більшою цітоадгезією, ніж у дорослих. Однак і у дорослих зустрічається фенотип, який запускає тромбоцитарну секвестрацію також призводить до розвитку тяжкої форми з виразними церебральними порушеннями. Секвестрація еритроцитів зі зростаючими плазмодіями тропічної малярії у внутрішніх органах і тканинах забезпечує їхню венозну мікроаерофілізацію, що покращує дозрівання паразитів, а адгезія до ендотелію дозволяє їм уникнути нагляду з боку селезінки та імунної системи. Висока варіабельність кодування фактори, які спричинюють адгезію еритроцитів, призводить до появи нових варіантів ЕМП-1 у 2 % особин P. falciparum у кожному новому циклі еритроцитарної шизогонії, і ця клональна антигенна мутація допомагає плазмодію уникнути імунної зачистки[33]. Усі ці фактори сприяють P. falciparum неприборкано збільшувати свою кількість у геометричній прогресії, тим самим здіймаючи показники кров'яного паразитарного навантаження на багато порядків вгору. Якщо спочатку цітоадгезія і розеткоутворення інфікованих і неінфікованих еритроцитів відбувається без порушення функції життєво важливих органів, то при подальшому розвитку процесу блокується кровотік, обмежується місцеве постачання киснем, порушується мітохондріальний синтез АТФ, стимулюється продукція цитокінів, що призводить до розвитку тяжкої тропічної малярії[13].
Секвестрація заражених еритроцитів знижує можливості кровопостачання життєво важливих органів. Крім того, при тяжкій малярії спостерігається чомусь виразна ригідність і незаражених еритроцитів, що також є підґрунтям порушень кровотоку, розвитку молочнокислого ацидозу і сприяє тяжким наслідкам аж до смерті. Лактат-ацидоз є сильним предиктором летальності при тяжкій тропічній малярії як у дорослих, так і у дітей. Розеткоутворення явно меншою мірою відбувається у людей із групою крові I(O), в порівнянні з іншими групами крові й, таким чином, особи з цією групою крові менше хворіють на тяжку тропічну малярію[13].
Особливості патофізіологічних змін при інших видах людської малярії[ред. | ред. код]
Цітоадгезія, секвестрація, розеткоутворення і агрегація лейкоцитів також були виявлені при інших видах малярії у людей, однак ці патологічні ефекти були виражені в набагато меншому ступені порівняно з тропічною малярією, і їхня роль у патофізіології ускладнень при цих видах малярії на сьогодні вивчається. Прозапальні цитокіни відіграють подвійну роль у патогенезі малярії. З одного боку, рання цитокінова відповідь ініціює гемостатичну дію і сприяє обмеженню інфекції — на початкових етапах цитокіни здатні пригнічувати ріст малярійного плазмодія[34]. З іншого боку, інтенсивне вивільнення прозапальних цитокінів стимулює бурхливу імунну відповідь організму, сприяючи розвитку ускладнень. Надмірні рівні цитокінів здатні знизити використання кисню мітохондріями і збільшення рівня лактату в крові, стимулювати цітоадгезіі, активації лейкоцитів і тромбоцитів, сприяючи прокоагулянтній активності, що спричинює, своєю чергою, обструкцію дрібних судин і посилення гіпоксії[35]. Разом зі зниженням еластичності еритроцитів, порушенням місцевого кровотоку, це посилює тканинну гіпоксію. Також відбувається зменшення глюконеогенезу, розвиток гіпоглікемії, депресії міокарда та серцевої недостатності, втрата ендотеліальної цілісності й пошкодження судин легенів і головного мозку. Молекули міжклітинної адгезії перекручують селективну регуляцію судинного тонусу, зокрема, в головному мозку і плаценті, що призводить до формування церебральної форми малярії і плацентарної дисфункції. Таким чином, можна сказати, що кінцевий результат малярійної інфекції для організму, як і більшості інших інфекційних захворювань, визначає баланс між активністю про- і анти- запальних цитокінів[13].
Особливості імунної відповіді[ред. | ред. код]
Імунна відповідь проти малярійної інфекції розвивається повільно і є дуже слабкою, практично не захищає проти повторних заражень. Набутий імунітет розвивається після декількох захворювань малярії за декілька років. Цей імунітет — специфічний відносно стадії захворювання, видів та навіть штамів плазмодія. Він має слабкий стерилізуючий ефект на паразитів, тому в імунних дорослих хвороба все ж таки розвивається. Проте клінічні прояви і симптоми зменшуються з розвитком клінічного імунітету. При цьому утворення антитіл проти гамонтів зменшує заразність такого хворого як джерела інфекції.
Були запропоновані різні пояснення цих спостережень. Серед можливих пояснень такої слабкої імунної відповіді розглядають знаходження плазмодія у клітинах протягом більшої частини його життєвого циклу, загальне ослаблення імунної системи, присутність антигенів, які не розпізнаються T-клітинами і тому не можуть спричинити імунної відповіді, придушення проліферації B-лімфоцитів, значний плеоморфізм плазмодія і швидку зміну потенційних антигенів на його поверхні.
Клінічні ознаки[ред. | ред. код]
Класифікація[ред. | ред. код]
Відповідно до МКХ-10 виділяють:
- В50 Малярія, яку спричинює P. falciparum;
- В50.0 Малярія, яку спричинює P. falciparum, з церебральними ускладненнями;
- В50.8 Інші види тяжкої та ускладненої малярії, яку спричинює P. falciparum;
- В50.9 Малярія, яку спричинює P. falciparum, не уточнена;
- В51 Малярія, яку спричинює P. vivax;
- В51.0 Малярія, яку спричинює P. vivax, з розривом селезінки;
- В51.8 Малярія, яку спричинює P. vivax, з іншими ускладненнями;
- В51.9 Малярія, яку спричинює P. vivax, без ускладнень;
- В52 Малярія, яку спричинює P. malariae;
- В52.0 Малярія, яку спричинює P. malariae, з нефропатією;
- В52.8 Малярія, яку спричинює P. malariae, з іншими ускладненнями;
- В52.9 Малярія, яку спричинює P. malariae, без ускладнень;
- В53 Інші види паразитологічно підтвердженої малярії;
- В53.0 Малярія, яку спричинює P. ovale;
- В53.1 Малярія, яку спричинюють плазмодії мавп[36];
- В53.8 Інші паразитарні підтверджені малярії, не класифіковані в інших рубриках;
- В54 Малярія не уточнена;
Така значна увага в МКХ-10 до малярії віддзеркалює її велике значення в захворюваності в усьому світі. При цьому ВООЗ закликає відійти від формулювання діагнозу «триденна малярія», вважаючи цей термін застарілим. Його можна нетривало використовувати тільки на етапі до лабораторного підтвердження виду малярії.
Загальні риси малярійної інфекції[ред. | ред. код]
У клінічному плані виділяють наступні стадії малярійної інфекції:
- Первинна атака:
- продром;
- ініціальна гарячка;
- період типових гарячкових пароксизмів (нападів).
- Ранній латентний період.
- Ближні рецидиви (еритроцитарні).
- Пізній латентний період.
- Віддалені рецидиви (тканинні).
Така стадійність характерна для класичного клінічного перебігу в неімунних осіб та у тих, хто не приймав хіміопрофілактику. У імунних осіб, в тих, хто недостатньо приймав препарати для хіміопрофілактики, у маленьких дітей клінічні прояви, особливо у стадії первинної атаки, нерідко виходять за межи класичних[13]. Зокрема, дуже часто застосування жарознижувальних засобів під час гарячки спотворює стадійність гарячкового нападу, по-іншому перебігає стадія жару тощо.
Первинна атака[ред. | ред. код]
Розвивається після інкубаційного періоду, який різний за тривалістю в залежності від виду збудника. У окремих людей може бути продром: деякий час (від декількох годин до декількох діб) турбує немотивована слабкість, іноді — ломота в тілі, підвищується до невисоких цифр температура тіла (субфебрилітет). Однак частіше продрома не буває і хвороба починається з ініціальної гарячки. Це пояснюється тим, що, як правило, з численними укусами комарів в організм людини потрапляють різні генерації плазмодіїв, які дозрівають у різний час доби. Відповідно, неодночасно відбувається і розрив еритроцитів із виходом пірогенних речовин у кров, що призводить до появи гарячки постійного типу, яку раніше навіть називали «малярійним тифоїдом». Крім гарячки, хворі скаржаться на інші інтоксикаційні симптоми: головний біль, нудоту, міалгії і артралгії. Тривалість ініціальної гарячки в середньому від 2 до 10 діб, однак при тропічній малярії — іноді до 1 місяця.
Гарячковий пароксизм[ред. | ред. код]
З моменту знищення захисними силами організму слабших генерацій плазмодіїв залишається одна провідна, яка надалі й визначає появу типових гарячкових пароксизмів. При цьому формується класична для малярії стадійність пароксизму: озноб, жар, піт:
- на стадії ознобу спочатку у хворих відбувається різке, «ракетоподібне» підвищення температури тіла до 39—41 °C, що супроводжується сильним ознобом, який знаменує собою вихід значної кількості пірогенів як наслідок одночасного дозрівання плазмодіїв і руйнування еритроцитів, в яких вони розвивалися. Озноб при малярійному пароксизмі зазвичай триває не більше години, але він такий сильний, що «зуб на зуб не попадає», при цьому хворого неможливого ніяк зігріти, навіть замотавши його безліччю теплих ковдр. У медицині нерідко відчутний озноб при інших хворобах (наприклад, при урологічному сепсисі) порівнюють саме з малярійним, настільки при цьому захворюванні він яскравий за своїми проявами. Це супроводжується рядом компенсаторних патофізіологічних проявів. Звуження периферичних судин спричинює похолодання кінцівок і блідість. У хворих з'являється «гусяча» шкіра за рахунок скорочення м'язів, що випрямляють волосяні фолікули, підвищується артеріальний тиск, виникає тахікардія. Також турбує виражена слабкість, ломота в тілі, різкий головний біль і артралгії, дихання стає прискореним, може бути багаторазове блювання. Ця стадія триває від 15 хвилин до 2 годин.
- на стадії жара, коли надходження пірогенів зі зруйнованих еритроцитів закінчується, озноб зникає, але при цьому пірогени продовжують циркулювати в крові, в результаті чого розвивається друга стадія малярійного пароксизму. Хворим стає жарко, вони скидають з себе те, чим намагалися зігрітися на попередній стадії ознобу. Температура тіла залишається високою, але надалі вже не зростає. Обличчя хворого червоніє, шкіра на дотик є гарячою. Пацієнти скаржаться на головний біль, спрагу, нудоту, наростає тахікардія. Артеріальний тиск знижується досить відчутно, майже у всіх хворих відзначається помірне здуття живота, сечовипускання рідкісне. Ця стадія триває від 2 до 12 годин.
- на стадії поту пірогени практично одночасно залишають кровоносне русло через нирки, метаболізуються до неактивних метаболітів у печінці, частково виводяться через шкіру і легені. Зменшується і концентрація цитокінів у крові. Внаслідок цього температура тіла різко знижується, найчастіше до норми, рідше — нижче 35 °C, іноді (у молодих жінок) до субфебрильних цифр. Таке зниження відбувається протягом 1—2 годин, супроводжуючись характерним рясним (профузним) потовиділенням.
Весь пароксизм триває в середньому до 10—12 годин (хоча при тропічній малярії нерідко немає чіткої його стадійності, а сама гарячка приймає постійний характер). Після нападу гарячки хворі, як правило, знесилено засипають. Менш інтенсивні за своїми проявами малярійні напади характерні для осіб, які раніше хворіли на малярію, або ж проводили (хоч й нерегулярно або неправильно) хіміопрофілактику захворювання. Між нападами настає спокійний період, коли хворі не відчувають особливих скарг, навіть іноді вважають себе вже здоровими. Малярійні пароксизми виникають при малярії, яку спричинюють P. vivax, P. ovale і P. falciparum через день нормальної температури (апірексії), тоді як при малярії, яку породжує P. malariae — через два дні на третій. Через 1—2 пароксизми збільшується печінка і селезінка, поступово наростає анемія. Надалі пароксизми малярії стають клінічно чітко окресленими, виникають через рівні інтервали часу і часто в один і той же час доби (з можливим відхиленням у часі назад або вперед не більше, ніж на одну годину). При тропічній малярії така чітка окресленість пароксизму формується рідко. Хворі звикають до часу появи ознобу і попереджають про це оточуючих. Зазвичай, без лікування, при первинній атаці малярії в період типових гарячкових пароксизмів кількість нападів становить 10—14[13].
Ранній латентний період[ред. | ред. код]
Якщо хворого не лікувати протималярійними препаратами, то в результаті постійного антигенного навантаження у нього підвищується рівень захисних сил, що призводить до зменшення інтенсивності еритроцитарної шизогонії, внаслідок чого пароксизми зникають, тому що невелика кількість пірогенів не здатна дратувати гіперподразнений центр терморегуляції. Настає так званий ранній латентний період, який характерний для всіх видів малярії. Тривалість його різна, як правило, не більше 2,5—3 місяців[13].
Ближні рецидиви (еритроцитарні)[ред. | ред. код]
Надалі у різні терміни під дією різноманітних інтеркурентних чинників (зміна клімату, переохолодження, перегрівання, загострення супутньої патології, приєднання інших інфекційних хвороб тощо) інтенсивність еритроцитарної шизогонії збільшується до того рівня, який був на початку хвороби, і починається період ближніх або еритроцитарних рецидивів. При цьому відразу ж формується звичний для хворого до того ритм типових малярійних пароксизмів без ініціальної гарячки. Якщо хворий не отримує специфічне лікування, то таких нападів буває від 5 до 10, після чого внаслідок активації імунного захисту організму зрештою відбувається одужання при тропічній або чотириденній малярії. Але статися це може тільки в тому випадку, коли хвороба перебігає вже на території, вільної від циркуляції малярійного плазмодія або плазмодіїв. У разі продовження перебування на ендемічній по малярії території повторні потрапляння збудника через укуси комарів призводять до повторюваних атак, і, відповідно, тривалішого перебігу захворювання без латентного періоду[13].
Пізній латентний період і пізні рецидиви[ред. | ред. код]
При вівакс- і (значно рідше) овале-малярії після періоду ближніх еритроцитарних рецидивів може бути різної тривалості (іноді до 3-х років) пізній латентний період, після якого можливі віддалені (тканинні) рецидиви. При їх виникненні у хворого відразу встановлюється звичний ритм типових гарячкових пароксизмів. Тільки після цього при малярії, яку спричинює P. vivax і Р. ovale, людина одужує (якщо до цього її не лікували), і знову за умови того, що напади тривають вже на території, вільної від стабільної циркуляції цих плазмодіїв[13].
Особливості перебігу тропічної малярії[ред. | ред. код]
Особливістю людської малярії, яку спричинює P. falciparum, тобто тропічної малярії, є переважання у неімунних осіб тяжкого клінічного перебігу над легшим, у них практично відразу виникають загрозливі для життя стани. Багато в чому це пов'язано з особливістю самого збудника, його своєрідним розвитком в організмі людини. Під час тканинної шизогонії при тропічній малярії утворюється до 40 тисяч тканинних мерозоїтів всередині однієї шизонтної морули в гепатоциті. Таким чином, при інших рівних умовах у разі тропічної малярії в кровотік надходить значно більше число тканинних мерозоїтів, які впроваджуються в еритроцити, ніж при інших видах людської малярії.
Основними особливостями є:
- поширена лише у тропічних районах;
- основною тяжкою формою є церебральна, яка при інших видах людської малярії не відбувається;
- найбільша летальність — 98 % від всієї летальності від малярії;
- виражена анемія — можливе ураження до 40 % еритроцитів організму;
- найбільша кількість ускладнень через те, що еритроцитарна шизогонія перебігає у капілярах внутрішніх органів;
- тривалість тропічної малярії без лікування близько 1 року.
Клінічні ознаки церебральної форми[ред. | ред. код]
Часто початку розладів вищої нервової діяльності передують продромальні явища, у тому числі найчастіше відбувається запаморочення, інтенсивний головний біль в області чола, ретроорбітальний біль. Традиційно виділяють три стадії розвитку ураження вищої нервової діяльності при церебральній формі тропічної малярії:
- Сомноле́нція (прекома) — характерні збудження і метушливість, або, навпаки, апатія, сонливість, сплутаність свідомості, дезорієнтація. Зазвичай хворі односкладово і неохоче відповідають на запитання, швидко виснажуються і знову занурюються в загальмований стан. Лежать хворі майже нерухомо і тільки у деяких із них спостерігається виражене тією чи іншою мірою рухове збудження. Уже в цей період іноді відзначають судомні, швидко минучі скорочення окремих груп м'язів, частіше кінцівок. Іноді виявляють незначну ригідність потиличних м'язів, нерідко вдається виявити зниження сухожилкових і черевних рефлексів. При об'єктивному обстеженні: шкіра бліда, із землисто-жовтим відтінком, суха. Кон'юнктиви і склери субіктерічні. Відзначають тахікардію і незначну артеріальну гіпотонію. Тони серця приглушені. Дихання поверхневе, часте. Язик сухий, обкладений.
- Сопор (глибока прекома зі слабкими проблисками свідомості) — розвивається через кілька годин від появи сомноленції, характеризується посиленням усіх ознак першої стадії. У цей період свідомість втрачається, нерідко спостерігається психомоторне збудження. Обличчя пастозне, міміка його бідна. Очі напіввідкриті або повністю закриті. Погляд байдужий. Губи сухі, рот напіввідкритий, жувальні м'язи судомно скорочені. У частини хворих відзначають клонічні судоми окремих груп м'язів, зазвичай кінцівок, іноді загальні тетанічні або епілептиформні судоми. У більшості пацієнтів спостерігають ригідність м'язів потилиці, а при положенні хворого на боці голова може трохи закидатися назад. Підвищуються сухожилкові рефлекси, черевні рефлекси, як правило, відсутні. У деяких хворих відбувається крововилив у сітківку. Реакція зіниць на світло млява. Відзначають звуження зіниць і згасання зіничного рефлексу. Забарвлення шкіри воскове з вираженим жовтуватим відтінком. Губи спраглі. Температурна крива приймає постійний або переміжний характер. Межі серця розширені, тони глухі, прогресує тахікардія. Артеріальний тиск знижується нижче 90/50 мм рт. ст. Дихання часте поверхневе. Язик обкладений, сухий. У більшості випадків є діарея.
- Справжня кома з повним виключенням свідомості — не реагує на зовнішні подразники, лежить нерухомо. Шкірні покриви блідо-жовтуваті. Очі напіввідкриті або повністю закриті. Зіниці широкі, їхня реакція на світло невпинно згасає. Характерні тахікардія 130—150 ударів за хвилину, ниткоподібний пульс. АТ нижче 70/30 мм рт. ст. Тони серця глухі, систолічний шум на верхівці, межі розширені. Дихання шумне, періодично по типу Чейн-Стокса. Прогресує артеріальна гіпотонія і дифузний ціаноз. Язик залишається вкрай сухим, густо обкладений нашаруванням. Живіт роздутий, при пальпації болючий, відзначається затримка випорожнень. Селезінка збільшена, чутлива при пальпації. Печінка також збільшена. Відзначають м'язовий гіпертонус, тризм, позитивні симптоми Керніга, Брудзинського, нерідко виявляють патологічні знаки Гордона, Бабінскі. Період глибокої передсмертної коми проявляється в повній арефлексії. Незважаючи на наявність менінгеальних симптомів, істинного менінгіту у таких хворих немає, що підтверджує дослідження спинномозкової рідини. Наявність менінгеальних симптомів пов'язано з набряком-набуханням головного мозку, який наростає в міру прогресування церебральної форми[13].
Особливості перебігу вівакс-малярії[ред. | ред. код]
- При цьому виді людської малярії первинна атака, як правило, проявляється невеликим підйомом температури без ознобу.
- Чим південніше місце зараження хворого, тим частіше проявляється ініціальна гарячка без ознобу, яка триває 2—5 діб.
- Напади гарячки починаються в першу половину доби.
- Більшість летальних випадків при цій малярії, особливо в помірних широтах, обумовлено активацією тяжких фонових хвороб внаслідок властивого всім видам малярії імуносупресивного впливу.
- Без лікування захворювання іноді триває до 3 років.
- У тропічних і субтропічних країнах описують випадки тяжкого, ускладненого перебігу вівакс-малярії. При високій температурі довкілля, значній вологості та інших факторах, які спостерігаються у вищезгаданих регіонах низьких широт, будь-яке гарячкове захворювання з вираженими порушеннями гомеостазу перебігає тяжче, ніж у помірних широтах.
- Деякі з ускладнень вівакс-малярії можуть бути пов'язані з цітокіновою реакцією, яка спричинює більшу запальну реакцію, ніж при тропічній малярії, як при однаковому, так і меншому рівні паразитемії в результаті більшої концентрації прозапальних цитокінів.
- Пірогенний поріг також є нижчим при ураженні P. vivax, внаслідок чого температура тіла підвищується при низьких рівнях паразитемії. Є структурні відмінності у P. vivax, в порівнянні з іншими плазмодіями, в GPI (глікозил-фосфадітіл-інозитол), що обумовлює його велику пірогенність.
- Також вважають, що холестерин / тригліцерідвмістні ліпіди (фосфоліпіди) мають більшу активність, ніж GPI, і вони були запропоновані як передбачуваний унікальний гіпотетичний токсин вівакс-малярії, який спричинює її більшу потенцію пірогенності[13].
Особливості перебігу чотириденної малярії[ред. | ред. код]
- Перебігає без клінічно виразної анемії, оскільки P. malariae уражає тільки зрілі форми еритроцитів і рівень паразитемії є низьким.
- При цьому виді малярії внаслідок імунокомплексного механізму часто відбувається ураження нирок у вигляді аутоімунного гломерулонефриту.
- Характерною для розпалу чотириденної малярії вважають інтервал гарячки — пароксизм триває до 12—14 годин і після цього настає дводенний період апірексії.
- При чотириденній малярії із закінченням продуктивних клінічних проявів іноді еритроцитарна шизогонія залишається довічно на субмікроскопічному рівні, продовжуючись у хворого і без подальшого екзогенного зараження. Збудник чотириденної малярії спричинює субклінічне захворювання виключно великої тривалості, незважаючи на відсутність персистуючої екзоеритроцитарної стадії. Вважають, що це пов'язано з тривалим виживанням еритроцитарних форм збудника, концентрація яких буває настільки низька, що вони не виявляються у звичайних мазках крові. Яким чином збудник вислизає від впливу людської імунної системи, невідомо, однак при малярії у мавп, яку спричинюють філогенетично близькі збудники, видалення селезінки (спленектомія) швидко веде до згасання інфекційного процесу, що свідчить про можливу захисної ролі Т-супресорів у селезінці[37]. Внаслідок такої тривалості персистенції шизонтна малярія, яка розвивається при переливанні крові, в період пологів тощо, часто обумовлена саме P. malariae. Така малярія має короткий інкубаційний період. Перші пароксизми виникають через 6—14 днів, перебіг захворювання доброякісний, можливе одужання без лікування.
- У зв'язку з відсутністю сплячих тканинних форм плазмодія віддалених (тканинних) рецидивів не спостерігають[13].
Особливості перебігу овале-малярії[ред. | ред. код]
- P. ovale, швидше за все, здатний, на відміну від P. vivax, постійно впроваджуватися в еритроцити, позбавлені антигену Даффі (як це робить і P. falciparum), що й обумовлює більше поширення овале-малярії в Африці, ніж вівакс-малярії.
- Інкубаційний період цієї малярії частіше коливається від 12 до 20 днів.
- Наявність гіпнозоїтів, як і при вівакс-малярії, призводить при овале-малярії до того, що в окремих випадках рецидив хвороби може виникнути через декілька років після зараження, описано рецидивування навіть через 53 місяці[38].
- Овале-малярія має серед інших видів людської малярії найлегший клінічний перебіг:
- у хворих високий відсоток спонтанного раннього одужання,
- гарячкові напади відбуваються в другу половину дня,
- часто при цьому температура не вище 39 °C.
Водночас є повідомлення про тяжкий перебіг овале-малярії з розвитком респіраторного дистрес-синдрому дорослих і гострої ниркової недостатності[13].
Перебіг малярії у людей, яку спричинюють P. knowlesi та інші «мавпячі» види плазмодіїв[ред. | ред. код]
Хоча на сьогодні описано багато випадків малярії, яку спричинюють плазмодії, які є зоонозними, тобто зазвичай циркулюють серед тварин, переважно мавп, але загалом для вивчення закономірностей перебігу для кожного виду такої кількості випадків явно недостатньо. Більш-менш вивчено перебіг малярії, яку спричинює P. knowlesi. Вважається, що джерелом цієї малярії є азійські довгохвості (Macaca fascicularis) і свинохвості (Macaca nemestrina) макаки. Циркуляція збудника характерна для зоонозів. Передача малярії шляхом заражена людина — комар — сприйнятлива людина не доведена. Крім того, ті види комарів роду Anopheles, які передають P. knowlesi, менше кусають людей, ніж макак. На 2017 рік P. knowlesi спричинює захворювання у людей тільки в тих регіонах Південно-Східної Азії, де склалися умови досить тісного співіснування людей і макак внаслідок значної вирубки лісів. Особливо це відчутно в Малайзії, де, наприклад, в штаті Саравак 70 % випадків малярії у людей спричинюється саме цим збудником. Часто зараження цим плазмодієм відбувається в тих місцях, де відсутня стабільна циркуляція збудників людської малярії. В Африці та Південній Америці цей вид малярії не зустрічається, тому що там немає його хазяїв — макак. Захворювання зазвичай починається приблизно через 11 днів після укусу зараженого комара, тоді ж можна знайти і паразитів у крові. Основні прояви цієї малярії у людей: головний біль, гарячку, озноб і профузний холодний піт, рідше — кашель, нудоту, блювання і діарею. У ряді випадків при зараженні людей спостерігали щоденну гарячку, як при тропічної малярії. Загалом, за даними спостережень різних дослідників, прогноз при цій малярії сприятливий, смерть настає рідко.
Останнім часом висловлюється твердження, що всі збудники людської малярії мають аналоги в мавпячих популяціях. Ці мавпячі збудники відрізняються від людських такими незначними відмінностями, як відрізняються один від одного штами одного виду. Так, згідно з цим припущенням P. falciparum є аналогом P. reichenowi, паразита шимпанзе і горил. Людський P. malariae мало відрізняється від P. brasilianum, P. vivax — від P. simium мавп Нового Світу і від P. simiovale, паразита макак у Старому Світі, а P. ovale — від P. schwetzi[13].
Малярія у ВІЛ-інфікованих[ред. | ред. код]
Станом на 2017 рік малярія та ВІЛ-інфекція є двома найбільш смертоносними глобальними проблемами в області світової охорони здоров'я. У зв'язку з цим, їхня коінфекція має серйозні наслідки для суспільної охорони здоров'я. Згідно з положеннями ВООЗ, ВІЛ-інфікованих людей взагалі і ВІЛ-інфікованих вагітних необхідно вважати особливо уразливими перед малярією, під час допологового спостереження необхідно вживати заходів профілактики щодо обох хвороб і враховувати взаємодію призначених препаратів. Крім того, при малярії існує підвищений ризик передачі ВІЛ-інфекції від матері до дитини. Також необхідно приділяти особливу увагу гарячковим станам у цих пацієнтів і призначати неодноразові спеціальні дослідження на малярію. У районах із високим рівнем поширення малярії, ВІЛ-інфекція підвищує ризик її розвитку у дорослих, особливо у тих, в кого є виражена імуносупресія. У поселеннях із низьким рівнем поширення малярії у ВІЛ-інфікованих дорослих відзначають високий ризик розвитку ускладненої і тяжкої малярії, пов'язаних із нею смертей. Дослідження показують, що невдачі в лікуванні малярії частіше виникають у ВІЛ-інфікованих осіб із низьким рівнем CD-4 клітин порівняно з неінфікованими ВІЛ-інфекцією пацієнтами.
Нині відомо, що, з одного боку, малярійні напади спричинюють тимчасове посилення реплікації ВІЛ та підвищують кількість вірусу в плазмі крові; з іншого боку, відсутні дані про те, що малярія має суттєвий вплив на клінічне прогресування ВІЛ-інфекції, відповідь на противірусну терапію або сприяє більш інтенсивної передачі інфекції. Результати когортного дослідження, проведеного в Уганді, регіоні з високим поширенням малярії, показують, що ВІЛ-інфіковані пацієнти мають високий рівень асимптомної паразитемії, у порівнянні з не ВІЛ-інфікованими пацієнтами. Дані того ж дослідження вказують на підвищення частоти виявлення епізодів паразитемії у ВІЛ-інфікованих пацієнтів у міру прогресування зниження рівня CD-4 клітин. Крім того, ВІЛ-інфіковані пацієнти мають більший ризик розвитку клінічно вираженої малярії, який зростає з посиленням імуносупресії.
Фізіологічний імунодефіцит вагітних робить таких жінок більш схильними до малярійної інфекції, що особливо проявляється у жінок, що народжують вперше. Але ВІЛ-інфекція знижує стійкість до малярії у багатонароджуючих вагітних, але не впливає на первісток. Небезпечна взаємодія малярії і ВІЛ не тільки на материнське здоров'я, але і на здоров'я новонароджених. ВІЛ-інфекція погіршує здатність організму вагітної жінки контролювати тропічну малярію. У цих жінок частіше розвивається клінічно виражене ураження плаценти, частіше визначається вищий рівень паразитемії. Вагітні жінки з коінфекцією ВІЛ і малярією мають більший ризик розвитку анемії, передчасних пологів, внутрішньоутробної затримки розвитку плода, в порівнянні з моноінфікованими ВІЛ або малярією вагітними жінками. Наявність ВІЛ-інфекції призводить до погіршення відповіді як на лікування, так і на профілактику малярії під час вагітності. Вплив ВІЛ-інфекції на перебіг малярії наочно показано на показниках смертності новонароджених дітей: при поєднанні цих двох хвороб під час вагітності дитяча смертність у 6 разів вище, ніж у дітей, що народилися від здорових матерів[13].
Малярія і вагітність[ред. | ред. код]
| Частина серії | ||||||
| Жіноче здоров'я | ||||||
|---|---|---|---|---|---|---|
|
||||||
|
Нерепродуктивне здоров'я |
||||||
|
Фактори
|
||||||
|
Портал | ||||||
Щорічно вагітність наступає приблизно у 50 мільйонів жінок, що живуть в ендемічних по малярії країнах. Більше половини з них мешкають у тропічних районах Африки, де інтенсивно поширюється тропічна малярія. За оцінками, 10 000 цих жінок і 200 000 їхніх дітей грудного віку щорічно помирають внаслідок зараження жінок малярією під час вагітності, 5—12 % всіх пологів закінчуються народженням дітей із низькою масою тіла, половина з них гинуть у ранньому віці через тяжку анемію. Тривалість пологів вкорочується, якщо інфікування малярією відбулося безпосередньо перед пологами, і подовжується у жінок, які перенесли первинну атаку малярії задовго до пологів. У післяпологовому періоді відзначають часті маткові кровотечі. З інших ускладнень післяпологового періоду відбуваються часті розриви промежини, причому у більше ніж половини жінок із таким ускладненням вони гоїлися вторинним натягом. Відзначають збільшення частоти післяпологової захворюваності та ваги посліду. У імунних жінок перша і друга вагітності пов'язані з найбільшим ризиком для них самих і плода, тоді як при наступних вагітностях малярія перебігає з помірними проявами. У неімунних жінок усі вагітності супроводжуються високим ризиком тяжкого перебігу малярії[13].
Існує ряд теорій, які намагаються пояснити тяжкий перебіг малярії у вагітних[39]. Згідно з однією з них, під час вагітності утворюється так звана «щілина» у фізіологічному бар'єрі організму жінки, в результаті чого імунна система зіштовхується з невідомим збудником, що проник через неї. Ця теорія пояснює появу сприйнятливості до малярії у жінок у маляріогенних регіонах, які до вагітності були нечутливі до цього захворювання. У них особливо високий ризик розвитку тяжкої і ускладненої малярії[40]. Відповідно до другої теорії, вагітність супроводжується розвитком імуносупресивного стану, що може в ряді випадків привести до втрати набутого імунітету до малярії[41]. Також існує третя теорія, згідно з якою у вагітних жінок переважає активація гуморальної імунної відповіді над клітинною, оскільки остання може поставити під загрозу життєздатність плоду[42].
Відзначається, що у вагітних, хворих на малярію, селезінка або не збільшується зовсім, або збільшується незначно, незважаючи на те, що злоякісні її форми, що перебігають із розвитком малярійної коми, зустрічаються у вагітних частіше. На сьогодні є обмежена кількість даних про вплив P. vivax на перебіг вагітності. Більшість із них стосується можливості розвитку материнської анемії і народження дітей із низькою масою тіла, що є основною причиною смерті новонароджених. Під час вагітності, особливо в другій її половині, клінічні прояви малярії нерідко атипові. Гарячка буває невисокою, тримається недовго, і тільки близько 10 % страждають на тяжку малярію. Найчастішим ускладненням у вагітних є тяжка анемія, оскільки поряд із гемолізом інфікованих еритроцитів, організм вагітної має збільшену потребу в залозі і фолієвої кислоти. Анемія підвищує перинатальну смертність і материнську захворюваність.
Чітко встановлений факт частого інфікування плоду плазмодіями під час вагітності. Якщо воно відбулося, то при морфологічному дослідженні плаценти виявляють зміни запального і деструктивного характеру в її оболонках, що сприяє внутрішньоутробному інфікуванню. Відомо, що плацента є також одним із головних місць секвестрації P. falciparum. Плазмодії, що уражають плаценту, забивають її ворсинки, тому у плода відбувається значний дефіцит кисню і поживних речовин. Однією з теорій, що висунута для пояснення цього явища, є підвищена концентрація естрогенів у плаценті. Також існує думка, що в ході тропічної малярії плацентарні клітини зазнають структурних змін, через що вони можуть істотно змінити свої функції, морфологію й антигенну потенцію. Зокрема утворюються щільні виступи — так звані ручки. Внаслідок цієї складної реорганізації нові рецептори експресуються на поверхні клітин плаценти і це дозволяє плазмодіям прикріплятися і розвиватися[13].
Особливості перебігу вродженої малярії[ред. | ред. код]
Зараження еритроцитарними мерозоїтами P. falciparum (шизонтна малярія) іноді (до 2 %) відбувається через плаценту під час вагітності й призводить до розвитку вродженої малярії, зазвичай, в ендемічних осередках тропічної малярії. Плацентарна секвестрація плазмоїдів може призвести у плоду до дефіциту кисню та поживних речовин. Навіть при невираженій периферичній паразитемії, небезпечна для плоду гіперплазмоїдоемія може бути обумовлена плацентарним скупченням плазмоїдів. Плацентарна недостатність, гіпоглікемія, анемія та інші порушення можуть бути небезпечними для життя. Вагітність супроводжується підвищеним ризиком викидню, внутрішньоутробного відставання у вазі, дефіцитом маси тіла при народженні тощо. З іншого боку при слабкому ураженні плаценти внаслідок високої експресії деяких прозапальних цитокінів відзначається тільки субмікроскопічне ураження плоду.
Клінічні ознаки вродженої малярії, як правило, виявляють не відразу після народження дитини, а через декілька тижнів або навіть місяців. Зазвичай немовлята, що народилися від матерів, хворих на малярію, фізично слабше розвинені та менш життєздатні, ніж діти здорових жінок. У новонароджених із вродженою малярією спостерігають значне збільшення печінки і селезінки, в крові виявляють численні плазмодії. Гарячкові напади починаються, як правило, не з ознобу, а з похолодання кінцівок і ціанозу. Гарячка має неправильний або постійний характер. Іноді відзначають субфебрильну температуру, зрідка хвороба перебігає і зовсім без підвищення температури тіла. Часто спостерігають блювання, диспепсичні розлади, нерідко виникають судоми[13].
Класичні ускладнення малярійної інфекції[ред. | ред. код]
До таких ускладнень малярії відносять:
- анемію,
- гемоглобінурійну гарячку (англ. Blackwater Fever),
- гостру легеневу недостатність,
- гостру ниркову недостатність,
- малярійний алгід,
- малярійний гепатит,
- розрив селезінки[43].
Анемія[ред. | ред. код]
Тяжкість анемії при гострій малярії часто перевершує передбачувану, яка могла б розвинутися через загибель тільки інфікованих плазмодіями еритроцитів. Цю розбіжність пояснюють рядом факторів. Секвестрація еритроцитів у селезінці призводить до заниження оцінки загального числа уражених еритроцитів. Пригнічується еритропоез, і, поряд із цим, як неінфіковані, так й інфіковані еритроцити виходять із кровообігу. Часто відзначають тромбоцитопенію як результат депонування крові в селезінці, так і скорочення терміну життя тромбоцитів. Розвиток «неадекватною» анемії часто відзначають у вигляді прогресуючого зниження гемоглобіну вже після зникнення паразитів із периферичної крові. Одна з причин цього є підвищена руйнівна функція крові СМФ, особливо гіперплазованої селезінки, коли поряд з інфікованими руйнуються і фагоцитуються у великій кількості й неінфіковані еритроцити[44][45][46]. Іншою причиною розвитку непропорційно тяжкої анемії при невисокій паразитемії є аутоімунні процеси[47]. Збереженню анемії після зникнення паразитів із крові сприяє і зменшення їхнього утворення в результаті пригнічення кісткового мозку.
Гемоглобінурійна гарячка[ред. | ред. код]
Є одним з ускладнень, яке може зустрічатися практично при всіх видах людської малярії. При цьому гарячка і гострий гемоліз можуть бути паразитарного або медикаментозного (через лікування деякими протималярійними препаратами, зазвичай, у осіб із дефектами ферментних циклів еритроцита) походження і вимагають різного лікування. Гемоглобінурійная гарячка розвивається з масивним розпадом еритроцитів із появою тяжкої гемолітичної жовтяниці та виділення гемоглобіну з сечею (гемоглобінурії). Починається раптово з ознобу, підвищення температури тіла до фебрильних цифр, головного болю, різкої слабості, інтенсивного болю в поперековій ділянці, супроводжується значними міалгіями, артралгіями, може бути повторне блювання, оліго- і анурія. Основним проявом гемоглобінурії є виділення сечі чорного кольору через наявність у ній оксигемоглобіну, а в сечі, що постояла, — метгемоглобіну. Також у сечі постійно визначають значну альбумінурію, уробілінурію і білірубінурію (остання виникає в результаті вторинного гепатиту). При стоянні сеча поділяється на два шари: верхній — прозорий, забарвлення «червоного вина», і нижній — темно-коричневий, що містить детрит і циліндри. Дуже швидко розвивається анемія, кількість еритроцитів падає до 1 — 1,5 млн в 1 мкл крові. Визначають лейкоцитоз із моноцитозом. Плазмодіїв у периферичній крові мало, бо інвазовані ними еритроцити розпадаються першочергово. Селезінка та печінка збільшені, при пальпації чутливі. Нерідко малярійна гемоглобінурія призводить до блоку нирок і загибелі хворого від гострої ниркової недостатності. Основною причиною гострого ураження нирок є аноксія ниркового епітелію внаслідок порушення ниркового кровотоку. Летальність сягає 20—30 %. У осіб, які перенесли такий напад гемоглобінурійної гарячки, можливі повторні випадки гемолізу в разі подальшого зараження малярією. Поряд із тяжкими формами ускладнення описані легкі та середньої тяжкості прояви[13].
Гостра легенева недостатність[ред. | ред. код]
Розвивається за типом гострого респіраторного дистрес-синдрому або гострого пошкодження легенів із розвитком справжнього набряку. При малярії часто буває як наслідок надмірного введення рідини (гіпергідратація) на тлі судинних порушень або загострення фонової хронічної серцево-легеневої недостатності. Гостра легенева недостатність може розвинутися як до початку антималярійної терапії, так і до 3—4-го дня лікування. Вона служить причиною смерті приблизно 80 % хворих на малярію з цим ускладненням. Хоча у деяких пацієнтів причиною даного синдрому є гіпергідратація, тиск заклинювання в легеневих капілярах у багатьох випадках залишається в нормі. Основним патогенетичним механізмом у дітей можна розглядати зміни в руслі легеневих капілярів, що не схоже на гострий респіраторний дистрес-синдром. Як показали патоморфологічні дослідження, в осіб, які померли від дихальної недостатності при малярії, відзначають виражений набряк клітин легеневого ендотелію, звуження просвіту капілярів, септальний набряк і наявність інтерстиціальних макрофагів, що містять фагоцитований малярійний пігмент[13].
Гостра ниркова недостатність[ред. | ред. код]
Розвивається при тропічній, зрідка при чотириденній малярії. При тропічній малярії виникає внаслідок порушення мікроциркуляції в нирках за рахунок блокування капілярів органу інвазованими еритроцитами — розвивається тубулярний некроз. Часто це ускладнення спостерігається при злоякісному перебігу тропічної малярії в поєднанні з церебральною формою, алгідом, гострим гемолізом. При чотириденній малярії особливу роль у виникненні ураження нирок відіграють аутоімунні реакції, ускладнення відбувається на 2—3-му тижні хвороби. Ураження нирок проявляється олігурією, альбумінурією, мікрогематурією, циліндрурією, азотемією, гіперкаліємією і ацидозом. При ранньому початку лікування, як правило, спостерігається відновлення функції нирок. Однак при чотириденній малярії часто формується хронічний нефрит[13].
Малярійний алгід[ред. | ред. код]
Зустрічається відносно рідко, зазвичай при тропічній малярії в африканців, у більшості випадків закінчується смертю. Досить часто це відбувається при ураженні східноафриканськими штамами P. falciparum. У патогенезі цього ускладнення, як вважають, лежать гіпертермія, гостра ішемія в результаті спазму дрібних судин кишечника і закупорка їх зараженими еритроцитами, іноді гостра надниркова недостатність. Є припущення, що саме вищезгаданим штамам притаманні якісь токсичні субстанції, що породжують алгід, або вони володіють великою здатністю створювати «цитокіновий шквал». Досить часто алгід відбувається при поєднанні малярії з кишковими інфекційними хворобами, на тлі дефіцитів вітамінів. Для алгіду характерні: різка слабкість, загальмованість, що переходить у прострацію, іноді кома. Шкіра блідо-сірого забарвлення з жовтуватим відтінком, холодна, покрита липким потом. Риси обличчя загострені, очі глибоко западають, оточені синюшними колами. Температура тіла знижується до 35 °C і нижче. Тургор шкіри різко знижений, дистальні ділянки кінцівок ціанотичні. Пульс слабкого наповнення, часто ниткоподібний, тахікардія, артеріальний тиск низький. Тони серця глухі. Дихання поверхневе, прискорене. Часто спостерігають нудоту, блювання і діарею. Діурез різко знижується. У крові величезна кількість паразитів на всіх стадіях розвитку. Якщо не провести адекватне лікування, смерть настає на тлі явищ гострої серцевої та ниркової недостатності[13].
Малярійний гепатит[ред. | ред. код]
Виникає виключно при тропічній малярії через притаманне їй ураження капілярів внутрішніх органів. Часто гепатит розігрується на тлі фонових хвороб печінки. В органі відбуваються вогнищеві ішемічні розлади, після чого виникають фокальні некрози. У хворих печінка стає збільшеною значніше, ніж при звичайному перебігу малярії. Жовтяниця супроводжується підвищенням активності АлАТ і АсАТ, збільшенням рівня прямого білірубіну. Порушення функції печінки веде до зменшення синтезу факторів згортання крові, зниження кліренсу протималярійних препаратів, зрушень глюконеогенеза і сприяє розвитку жовтяниці, характерної для тяжкої тропічної малярії. Значно рідше відзначають більш глибокі порушення, що ведуть до розвитку печінкової недостатності[13].
Розрив селезінки[ред. | ред. код]
Вважається найбільш рідкісним ускладненням. Воно можливе у тих хворих, які хворіють вперше, при швидкому і значному збільшенні раніше незміненого органу (спленомегалії). При хронічній спленомегалії, яка буває у людей, що часто хворіли на малярію, переважно в ендемічних регіонах, розрив селезінки менш імовірний у зв'язку з розвитком фіброзу в ній і періспленіта (фіброз капсули селезінки). Це ускладнення розвивається в основному у неімунних дорослих, і зусилля по ліквідації малярії можуть парадоксальним чином збільшити частку пацієнтів, які страждають від цього небезпечного для життя стану[13].
Інші ускладнення[ред. | ред. код]
Як правило, при малярії тромбогеморагічних утворень не буває, крім термінальної стадії тропічної малярії у неімунних осіб. Описуваний раніше інфекційно-токсичний шок при малярії самі плазмодії не спричинюють, а шок розвивається внаслідок активації грамнегативних бактерій у кишечнику, сечовивідних шляхах внаслідок імуносупресивної дії плазмодіїв, переважно P. falciparum[13].
Наприкінці XX століття збільшилася кількість даних про те, що малярія є одним із факторів, що грають роль у розвитку лімфоми Беркітта, пухлини, яку спричинює вірус Епштейна — Барр[48]. Вважають, що тривала стимуляція лімфоїдної системи при хронічній малярії сприяє тому, що вона стає більш схильною до неопластичних трансформацій за наявності цього вірусу[49].
Новим зареєстрованим ускладненням тяжкого перебігу малярії є ретинопатія, що має дві унікальні особливості — білі плями на сітківці та фокальні зміни кольору судин, що вельми специфічне для малярії[50][51].
Діагностика[ред. | ред. код]
Загальні правила[ред. | ред. код]
Основним клінічним критерієм є поява гарячки під час перебування в ендемічному районі або після приїзду з нього. Симптоми малярії не є специфічними, тому необхідно при будь-якому підйомі температури в перші 3 роки після приїзду з ендемічної по малярії зоні проводити специфічне обстеження на малярію. Так само потрібно досліджувати кров на малярію при гарячці тривалістю понад 5 діб, якщо її не можна нічим пояснити клінічно, при появі гарячки протягом 14 днів після переливання еритроцитарних препаратів крові.
Загальнолабораторні зміни[ред. | ред. код]
У клінічному аналізі крові в залежності від виду малярії, ступеня тяжкості та розвитку ускладнень відмічають той чи інший рівень анемізації, тромбоцитопенії, лейкопенії, зміну лімфоцитів крові, підвищення ШОЕ. При деяких ускладненнях спостерігається лейкоцитоз. При тропічній малярії, у дітей молодшого віку і вагітних, можливий розвиток гіпоглікемії, що вимагає обов'язкового контролю рівня глюкози в крові та оцінці змін при призначенні патогенетичної терапії. Рекомендують у людей, які повернулися з ендемічних районів, визначати рівень тромбоцитів, атипових лімфоцитів і активність сумарної лактатдегідрогенази (ЛДГ) крові як скринінгових змін при малярії. Експерти ВООЗ вважають, що виявлення тромбоцитопенії, підвищеного рівня атипових лімфоцитів, збільшеної активності ЛДГ має спонукати до проведення специфічного дослідження на малярію у такої людини[13].
Специфічна діагностика[ред. | ред. код]
Паразитоскопія[ред. | ред. код]
Діагноз ставлять на основі виявлення паразитів за допомогою світлової мікроскопії (паразитоскопія) у забарвлених мазках крові. Дослідження на малярію здійснюють фахівці діагностичних лабораторій, які пройшли відповідну підготовку з мікроскопічної діагностики цього захворювання. Обов'язково використовують два типи мазків — тонкий та товстий («товста крапля»).
- «Товста крапля» дозволяє лаборанту проглянути більший об'єм крові й тому вона є в одинадцять разів чутливіша, ніж тонкі мазки, але морфологія паразита через відсутність фіксації і дію фарби набагато спотворена і не дає змогу легко відрізняти різні види малярії. При аналізі «товстої краплі» досвідчений лаборант може при перегляді 100—150 полів зору виявити близько 8 паразитів в 1 мкл крові. Завдяки розподілу більшого об'єму крові на меншій площі й дегемоглобінізації еритроцитів у «товстій краплі», за один і той же проміжок часу можна переглянути в 30—40 разів більше крові, ніж у «тонкому мазку». Це збільшує можливість виявлення плазмодіїв, особливо при низькій паразитемії. Метод «товстої краплі» ще називають методом концентрації паразитів.
- Якщо у «товстій краплі» було знайдено плазмодія, то лаборант має обов'язково досліджувати тонкий мазок. Тонкі мазки подібні до звичайних мазків крові й тільки вони дозволяють визначити різні види плазмодіїв, тому що морфологія паразита найкраще збережена при цьому методі, адже їх піддають фіксації, що зберігає не тільки морфологічні риси плазмодія, але і його пігмент, форму еритроцитів, у яких знаходять плазмодія, що дозволяє ефективно розрізнити окремі види паразита[52].
Після цього можна видати кінцевий результат про виявлення відповідного вигляду плазмодії та навіть кількісних його характеристик. Оцінка кількості плазмодіїв у крові йде згідно з настановами ВООЗ. Якщо лабораторія видає висновок про велику кількість плазмодіїв (в ++++ або +++++), то це підказка лікарю про наявність в обстежуваного хворого тяжкої форми малярії. Якщо при тропічній малярії і такої інтенсивності паразитемії ще в крові присутні всі стадії еритроцитарних форм — трофозоїти і шизонти, то це абсолютна ознака церебральної чи іншої ускладненої форми цієї малярії. Паразітоскопія також служить методом контролю лікування хворого: якщо на 3-тю добу терапії зберігається такий же рівень паразитемії, як і перед її початком, або навіть зростає, то це ознака стійкості паразита до протималярійного препарату, який застосовується.
Мікроскопічний діагноз може бути ускладненим, тому що при низькому рівні паразитемії знайти окремих паразитів важко, потрібно проглядати багато полів зору, багато шарів еритроцитів. Остаточно підтвердити або виключити діагноз «малярія» у пацієнта можливо тільки після мікроскопічного паразитологічного дослідження препаратів крові. Необхідно підкреслити, що не буває активної малярії без наявності плазмодіїв у крові — за наявності малярійних нападів плазмодіїв у периферичної крові виявляють постійно. Паразити можуть бути присутніми в крові не тільки під час гарячкових нападів і проміжків між нападами, що йдуть один за одним, але і протягом тривалих латентних періодів, протягом яких не спостерігають підвищення температури тіла. Природно, що рівень паразитемії найбільш високий перед початком нападу гарячки. Кров для дослідження беруть із пальця руки, у новонароджених — з великого пальця ноги. У хворого з обґрунтованою клінічно і епідеміологічно підозрою на малярію, при отриманні первинного негативного результату, взяття периферичної крові та її дослідження слід проводити багаторазово через 6—12 годин протягом 2 діб, незалежно від підйомів температури тіла[13].
Експрес-методи[ред. | ред. код]
З огляду на деякі проблеми традиційної паразитоскопії — необхідність тривалого огляду препарату, дотримання всіх технологічних стадій приготування мазка, проведення численних досліджень в ендемічних районах, серйозне психофізіологічне навантаження на лаборанта при проведенні великої кількості досліджень тощо, зусилля сучасної медицини спрямовані на пошук і впровадження таких засобів діагностики малярії, які б дали можливість швидкої і недорогий масової діагностики. Хоча паразитоскопія при малярії залишається «золотим стандартом» діагностики експрес-тести показали високу ефективність для діагностики у хворих на симптомну малярію. Діагностична точність їх була високою в порівнянні з мікроскопією. Це вказує на те, що експрес-методи мають прийнятну чутливість і специфічність для використання в умовах обмежених ресурсів як альтернативного методу діагностики малярії для мікроскопії. Полімеразна ланцюгова реакція (ПЛР), ізотермічна ДНК-ампліфікація показали високу чутливість і специфічність. Крім того, необхідність мінімального обладнання та відносно короткий час для отримання результатів можуть зробити їх однією з найкращих альтернатив, особливо для точної діагностики безсимптомної малярії[53]. Магнітно-оптичне визначення малярійного пігменту (гемозоїн) є поки що недоступним методом для більшості країн, ендемічних із малярії.
Тому в сучасних умовах ВООЗ рекомендує масове проведення експрес-методів на основі імуногістохімічних методів визначення антигенів плазмоїдів в осередках малярії для швидкої і повноцінної діагностики, почала невідкладного лікування. Експрес-методи при малярії ґрунтуються на проведенні реакції антиген-антитіла на жорсткому целюлозному стрижні з нанесенням смужки іммобілізованих моноклональних антитіл, утворених гібридіомами з клітинами селезінки мишей, які були імунізовані одним із двох антигенів P. falciparum: PfHRP2 або паразитарної ЛДГ. Є тести, що основані на визначенні паразитарної альдолази. Виробники в деяких тестах використовують кон'югат коллоїдного золота та рекомбінантні антигени Plasmodium. ВООЗ сертифікувало багато таких методів, їх широко застосовують у вискоендемічних країнах, при великій кількості хворих. Вони не потребують проведення світлової мікроскопії, результат їх може оцінити навіть не лікар вже через 15—30 хвилин після застосування[13]. На сьогодні доступними є діагностичні тести GeneXpert, які дають можливість підтвердження діагнозу «малярія» в крові в польових умовах протягом 1 години, що також застосовують для діагностики туберкульозу, ВІЛ-інфекції, хвороби, яку спричинює вірус Ебола тощо[54]. Для експрес-тестів притаманні як переваги, так і недоліки, тому на сьогодні роль паразитоскопії залишається великою. ВООЗ надає суттєву підтримку проєктам оперативних досліджень щодо подальшого удосконалення експрес-тестів[13]. Хибнонегативні результати їх, які спричинюють генетичні варіації генів багатих гістидином P. falciparum (pfhrp2/3), загрожують існуючим зусиллям по боротьбі з малярією та її контролю[55].
Водночас взяття крові для паразитоскопії чи експрес-методів є інвазивною маніпуляцією і створює потенційні ризики для пацієнтів і медичних працівників, що виникають внаслідок контакту з потенційно інфекційними рідинами організму. Менш або взагалі неінвазивні діагностичні тести, що ґрунтуються на сечі, слині або не потребують забору зразків, можуть створити менший дискомфорт для пацієнта й запропонувати простіші та менш ризиковані процедури тестування, що можуть безпечно виконувати некваліфікований персонал або навіть самостійно хворий[56].
Серологічна діагностика[ред. | ред. код]
На сучасному етапі ВООЗ не вважає доцільним використовувати для діагностики малярії серологічні методи, засновані на виявленні антитіл у крові. Вони не спрацьовують в ендемічних регіонах як маркери гострого процесу через наявність великого прошарку людей, що мають нестерильний імунітет. Тому ці методи застосовують виключно в широкомасштабних епідеміологічних дослідженнях[57].
Лікування[ред. | ред. код]
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Головним напрямком лікування малярії є етіотропна терапія — призначення препаратів, які діють безпосередньо на малярійного плазмодія в організмі людини.
Класифікація протималярійних препаратів[ред. | ред. код]
Відповідно до рекомендацій ВООЗ виділяють протималярійні засоби для переривання клінічних проявів малярії, а також для радикального і попереднього лікування хвороби. Усі існуючі препарати ділять на 3 стратегічні (основні) групи:
- гематошизотропні (ті, які чинять згубну дію на еритроцитарні шизонтні форми плазмодіїв): хлорохін, гідроксихлорохін, мефлохін, хінін, хінідин, амодіахін, галофантрін, люмефантрін, хлорпрогуаніл (бігуанід), піронарідін, сульфадоксин + піріметамін, атовахін (атоваквон) + прогуаніл, тетрациклін, доксициклін, кліндаміцин, препарати артемізиніну (артеметр, артезунат, дігідроартемізин, артемотіл).
- гістошизотропні (ті, які вбивають тканинні шизонтні форми плазмодіїв): примахін, тафенохін (тафеноквін), слабкіше — піріметамін, прогуаніл і хлорпрогуаніл. Ці препарати доцільні тільки при вівакс- і овале-малярії, при яких існують брадізоїти в гепатоцитах і можуть виникати пізні прояви.
- гамонтотропні (ті, які знешкоджують гамонти і блокують спорогонію): піріметамін, примахін, хінін, хлорохін, гідрооксихлорохін. Боротьба з гамонтами доцільна при тропічній малярії, тому що саме гамонти цього виду можуть існувати в крові 5—7 діб навіть після закінчення еритроцитарної стадії, тоді як гамонти інших збудників малярії, якщо не потрапили в організм комара, гинуть вже через кілька годин після їхнього утворення.
Лікування малярії на цей час є багатогранною проблемою, яку намагаються вирішити за допомогою різних протималярійних препаратів, яким притаманні різні механізми дії на малярійні плазмодії. Проводяться численні дослідження, спрямовані на пошук нових точок прикладання лікарських засобів і розробку нових препаратів.
За основною мішенню дії на плазмодій та хімічною будовою використовувані на цей час протималярійні препарати належать до різних груп:
- інгібітори полімеризації гематина в гемозоїн:
- 4-амінохіноліни: амодіахін, хлорохін, гідроксихлорохін;
- 8-амінохіноліни: примахін, тафенохін (тафеноквін);
- 4-метанолхінолони: хінін, хінідин, мефлохін;
- 9-аміноакрідіни (деривати бензонафтірідіна): піронарідин;
- бісхіноліни: піперахін (піпераквін);
Препарати групи інгібіторів полімеризації гематина в гемозоїн не дають можливості плазмодію утворити безпечний для себе продукт життєдіяльності, в результаті чого гематин, що накопичується, чинить токсичну дію на паразита і перешкоджає його життєдіяльності в еритроциті[58]. Окремі групи інгібіторів гемозоїну мають додаткові механізми впливу. Так 4-амінохіноліни здатні порушувати редуплікацію ДНК і синтез РНК[59]. Піронарідин пригнічує глютатіонзалежну деградацію гема[60]. Подібний механізм притаманний і піперахіну (піпераквіну)[61].
- антіфолати:
- інгібітори дигідрофолатредуктази: піріметамін (діамінопірімідин), прогуаніл, хлорпрогуаніл (бігуанід);
- сульфаніламіди: сульфадоксин, сульфаметоксипіразін (сульфален);
Серед антифолатів інгібітори дигідрофолатредуктази запобігають біосинтезу пуринів і пірімідинів, тим самим зупиняючи процес реплікації ДНК, поділ плазмодіїв і його розмноження[62]. Сульфаніламіди є специфічними інгібіторами дигідроптероатсинтетази в тетрагідрофолат. Вони є структурними аналогами параамінобензойної кислоти і конкурують із нею, блокуючи перетворення її в дигідрофолієву кислоту[63].
- терпенлактони (пероксиди):
- препарати артемізиніну: артеметр, артезунат, дігідроартемізин, артемотіл;
Вони генерують в організмі плазмодіїв вільні радикали, що призводить до швидкої загибелі його[64].
- інші:
- гідроксинафтохінони: атовахін (атоваквон);
- антибіотики тетрациклінової групи: тетрациклін, доксициклін;
- лінкозаміди: кліндаміцин;
- фенатренметаноли: люмефантрін, галофантрін.
У цій групі у препаратів різні точки прикладання. Так атовахін (атоваквон) спричинює інгібіцію цитохром-С-оксидази[65]. Тетрацикліни інгібують білкову трансляцію паразита[66]. Кліндаміцин також ймовірно діє на цей механізм, маючи ще додатково дію на апікопласт плазмодія[67]. Фенантренметаноли утворюють цитотоксичні комплекси з феррітопорфіріном IX плазмодіїв, що призводить до швидкого пошкодження мембрани паразита[68]. Ймовірно, їхній вплив пов'язаний із блокадою плазмепсіна лізосом плазмодія[69].
Особливості механізму дії протималярійних препаратів різних хімічних груп детермінують неоднакову їхню ефективність стосовно різних стадій розвитку плазмодіїв. Цим же ймовірно пояснюються відмінності в здатності гематошизотропних препаратів діяти на різні вікові стадії плазмодіїв під час еритроцитарної шизогонії. Так, для сульфаніламідів найбільш характерними є пошкодження тих плазмодіїв, що знаходяться на різних етапах поділу ядра. Хінін діє переважно на форми плазмодіїв віком 30—38 годин[13]. Порушення, які породжують хіміотерапевтичні препарати різних груп, можуть бути виявлені при морфологічному дослідженні плазмодіїв. При дії похідних 4-амінохіноліну цитоплазма шизонтів збирається у вакуолі, блідне, стискається і поступово зникає, ядро піддається ущільненню (пікноз) і деякий час ще зберігається після повного зникнення цитоплазми. Характерним для дії цих препаратів є злипання зерен пігменту в цитоплазмі плазмодія. Пігмент збирається до купок, які витісняються до периферії плазмодія, а потім випадають за межі клітини. Такі купки пігменту часто виявляють і всередині тих лейкоцитів, що фагоцитували вільні плазмодії в кровотоку. Сульфаніламіди чинять руйнування ядер тих зрілих шизонтів, що вступили у період свого поділу, та їхній розпад на безліч грудочок, які яскраво забарвлюються за Романовським — Гімзою. Подібні зміни спричинює й хінін, але вони виявляються у більш молодих форм[13].
Показано, що протималярійні препарати можуть модулювати функцію фагоцитозу імунної клітини хворого. Так хлорохін, амодіахін, доксициклін і мефлохін можуть зменшувати фагоцитоз, тоді як артемезинін, хінін, примахін та піриметамін можуть посилювати його, що є додатковим механізмом у лікуванні малярії[27].
Проблема стійкості плазмодіїв до лікувальних препаратів[ред. | ред. код]
Станом на друге десятиліття XXI століття лікування малярії, особливо тропічної, має серйозні проблеми через високий рівень розвитку стійкості до хіміопрепаратів. Зростаюча стійкість плазмодіїв поширюється настільки швидкими темпами, що підриває значні зусилля по боротьбі з малярією. Встановлено, що мутації в паразитарних генах pfcrtT76 і pfmdr1 відповідальні за розвиток хіміорезистентності. Так, практично повсюдно у світі поширилася стійкість P. falciparum до хлорохіну, до комбінації сульфадоксин + піріметамін. Коли комбінацію цих двох препаратів у 1977 році стали застосовувати для лікування тропічної малярії в Таїланді, ефективність була практично абсолютною (100 %), але через п'ять років внаслідок виникнення стійкості склала всього 10 %. Крім того, така резистентність швидко поширилася і в Субсахарській Африці. Стійкість плазмодіїв на кордоні Таїланду і Камбоджі почалася з хлорохіну, потім відбулась відносно сульфадоксину + піріметаміну і мефлохіну. Внаслідок своєї легкої доступності ці препарати широко використовують для лікування малярії, хоча з різних частин світу, особливо Африки і Азії, надходять повідомлення про резистентність до них P. falciparum. Резистентність до атовахіну (атоваквону) сформувалася протягом лише одного року з початку його застосування в 1997 році[13]. 2017 року в Камбоджі виявлені окремі штами, які є мультірезистентними, що викликає серйозне занепокоєння[70].
З 2005 року у широкомасштабну клінічну практику для лікування малярії була впроваджена так звана артемізинін-комбінована терапія (АКТ), яка передбачає комбіноване використання компонентів екстракту рослини полину однорічного (Artemisia annua) і будь-якого іншого протималярійного препарату, крім хлорохіну, у зв'язку з високою стійкістю до нього малярійних паразитів. Ефективність АКТ багато в чому залежить від другого використовуваного препарату. ВООЗ рекомендує країнам, де паразит малярії став стійкий до застосовуваних монопрепаратів більш ніж у 10 % випадків, використовувати саме таку комбіновану терапію. Однак, у 2008 році в Камбоджі були зареєстровані випадки малярії, які не піддавалися лікуванню артемізиніном, який до того часу вважався чудодійним препаратом. Така малярія швидко поширилася в регіоні. Проведений ВООЗ аналіз цього явища виявив порушення при призначенні протималярійної терапії, а саме, комбінована терапія замінювалася на монотерапію артемізиніном, що є неприпустимим. Так, при лікуванні монопрепаратом на основі артемізиніну пацієнти переривали лікування рано у зв'язку зі швидким зникненням симптомів малярії. При такому частковому лікуванні в крові пацієнтів залишалися стійкі до препарату плазмодії. Без другого препарату як компонента комбінованої терапії ці стійкі паразити виживають і можуть бути передані комару, а потім й іншій людині. Тому, монотерапія є основною причиною поширення стійкості до артемізиніну, що є вкрай загрозливим явищем. Вважається, що якщо до артемізиніну розвинеться значна резистентність, яка пошириться на інші великі географічні райони, як це сталося раніше з хлорохіном, наслідки для здоров'я людей можуть бути катастрофічними, адже альтернативних протималярійних ліків у найближчому майбутньому не з'явиться. У зв'язку з цим ВООЗ у 2006 році звернулася з проханням до фармацевтичних компаній припинити торгівлю протималярійними «моноліками», які містять артемізинін, для запобігання розвитку стійкості малярійних паразитів до цих лікарських препаратів. Відтоді стійкі до артемізиніну плазмодії були також виявлені в М'янмі, Таїланді, В'єтнамі, Мозамбіку[71], Нігерії[72], Руанді. Хоча дослідження в Малі цього не виявили. Тому робиться висновок, що для виявлення факту резистентності потрібно робити рандомізовані широкомасштабні дослідження в кожній ендемічній країні[73].
Висока вартість і обмежена біодоступність артемізиніну стимулювала пошук його замінників — синтетичних пероксидів, отримані при цьому 1,2,4,5-тетраоксани є найбільш перспективним класом для розробки на їхній основі протималярійних ліків. Також вивчається дія перспективних протималярійних препаратів — триоксиферрохінів, нафтоамінохінонів та імідазолопіперазинів. Іде постійний пошук нових протималярійних препаратів. Проведені за останні роки дослідження показують непогані перспективи застосування проти плазмодіїв відомих ліків, які застосовують при інших хворобах, зокрема, метиленового синього, деяких інгібіторів метілглютарил-СоА редуктази («статинів»), фенофібрату, макролідів, астемізолу, деяких протигрибкових препаратів (похідних імідазолу і тріозолу[13]. Проведене дослідження виявило відсутність прогресу у відкритті та розробці нових протималярійних препаратів з африканських лікарських рослин. Незважаючи на обнадійливий ефект, продемонстрований рослинами in vitro, менше рослин було оцінено in vivo. Активність деяких рослин, як от Alchornea cordifolia[en], Azadirachta indica та Zanthoxylum chalybeum, була стабільно дуже хорошою. При цьому токсичність рослин зменшувалася зі збільшенням антиплазмодійної активності. Зроблено висновок, що існує потреба в продовженні відкриття та розробки нових протималярійних препаратів, щоб підірвати зростаючу стійкість до основних протималярійних препаратів у світі[74].
Ефективність протималярійних засобів потрібно регулярно контролювати, використовуючи стандартний протокол ВООЗ[75]. Він передбачає оцінку клінічних і паразитологічних результатів лікування протягом щонайменше 28 днів після лікування, а також моніторинг появи плазмодіїв у крові. Аби відрізнити невдачу лікування від нового зараження, рекомендується використовувати ПЛР-генотипування. Якщо неуспіх лікування перевищує граничний показник (≥10 %), ВООЗ рекомендує змінити у регіоні національну політику лікування малярії[76].
Загальні дані про лікарські протималярійні препарати[ред. | ред. код]
Таким чином, на сьогодні є етіотропні препарати, які використовують для лікування та профілактики малярії. Багато з них можуть бути використані для обох цілей, з підвищенням дози для лікування. Їхнє застосування залежить переважно від стійкості малярійних паразитів у регіоні, де використовують той чи інший препарат.
| Препарат | Англ. назва | Профілактика | Лікування | Примітки |
|---|---|---|---|---|
| Артеметер-люмефантрин | Artemether-lumefantrine | − | + | комерційна назва Коартем |
| Артезунат-амодіахін | Artesunate-amodiaquine | |||
| Атоваквон-прогуаніл | Atovaquone-proguanil | + | + | комерційна назва Маларон |
| Хінін | Quinine | − | + | |
| Хлорохін | Chloroquine | + | + | після появи резистентності використання обмежене |
| Котрифазид | Cotrifazid | + | + | |
| Доксициклін | Doxycycline | + | + | |
| Мефлохін | Mefloquine | + | + | комерційна назва Ларіам |
| Прогуаніл | Proguanil | − | + | |
| Примахін | Primaquine | + | − | |
| Сульфадоксин + піріметамін | Sulfadoxine-pyrimethamine | + | + |
Основні комбінації антималярійних препаратів діляться на фіксовані (наприклад, артеметр + люмефантрін (20/120 мг)), що випускаються в одній лікарській формі (таблетці, капсулі тощо), і нефіксовані (наприклад, хінін + доксициклін), що призначаються у вигляді окремих компонентів. Крім того, ще виділяють комбінації з артемізиніновими похідними і комбінації без артемізинінових похідних.
Хоча протималярійні ліки є на ринку, хвороба зберігає загрозу для людей, що живуть в ендемічних областях, де не існує належного доступу до ефективних препаратів. Згідно з даними організації «Лікарі без кордонів», середні витрати на лікування людини, зараженої малярією, у деяких африканських країнах становлять 0,25—2,40 дол. США[77].
2015 року китайська хімік та фармацевт Ту Юю отримала Нобелівську премію з фізіології або медицини за відкриття та застосування артемізиніну як препарату для лікування малярії[78][79].
Лікування тропічної малярії[ред. | ред. код]
Через високий пресинг цього виду малярії у світі проблема її лікування є найзначнішою в малярієлогії. Високий відсоток стійкості штамів P. falciparum до протималярійних препаратів призводить до частої зміни їх у схемах лікування саме цього виду малярії. Нерідко це відбувається тому, що стійкість малярійного плазмодія була пов'язана не з особливостями самого збудника, а із застосуванням неякісних контрафактних препаратів.
Запобігання або відтермінування резистентності має важливе значення для успіху як національних, так і глобальних стратегій контролю та остаточної ліквідації малярії. Щоб захистити наявні та майбутні протималярійні ліки, усі випадки тропічної малярії слід лікувати принаймні двома ефективними протималярійними препаратами з різними механізмами дії, що складає сутність комбінованої терапії[80]. Продовження застосування артемізиніну або будь-якого з препаратів-партнерів окремо скомпрометує цінність лікування малярії через зростання стійкості до ліків[81].
Лікування неускладненої нетяжкої тропічної малярії[ред. | ред. код]
У дорослих використовують:
- артеметр + люмефантрін (20/120 мг) — по 4 таблетки 2 рази в 1-шу добу, далі по 4 таб. 1 раз у 2-гу і 3-тю добу;
- артезунат + амодіахін (100/270 мг) — 2 таб. на день протягом 3 діб;
- артезунат + мефлохін (200/500 мг) — по 1 таб. 3 доби;
- артезунат + сульфадоксин / піриметамін (50/500/25 мг) — по 2 таб. 2 рази в 1 добу, потім по 2 таб. 1 раз на добу ще 2 доби поспіль.
Препарати у фіксованих дозах призначаються залежно від регіону через різну стійкість збудника до неартемізинінової складової АКТ. Також зараз існують комбінації другої лінії — дігідроартемізин + піпераквін (піперахін), артемотіл із мефлохіном або люмефантріном.
Лікування малярії, яку спричинюють P. knowlesi та інші види малярійних плазмодіїв, що циркулюють серед мавп, рекомендують проводити так, як для тропічної малярії.
Лікування тяжкої або затяжної тропічної малярії[ред. | ред. код]
Застосовують:
- артезунат (2 мг/кг 1 раз на добу) + доксициклін (3—5 мг/кг 1 раз на добу) або кліндаміцин (10 мг/кг 2 рази на добу) протягом 7 діб;
- хінін (10 мг солі / кг 3 рази на добу) + доксициклін (3—5 мг/кг 1 раз на добу) або кліндаміцин (10 мг/кг 2 рази на добу) протягом 7 діб.
Лікування церебральної форми тропічної малярії та інших її ускладнень[ред. | ред. код]
Використовують хінін 20 мг солі/кг, потім кожні 8 годин по 10 мг солі/кг + доксициклін (3—5 мг/кг 1 раз на добу) або артеметр 3,2 мг/кг в/в або ректально. Хінін хоча і має велику кількість побічних ефектів, але краще його через гематоенцефалічний бар'єр не проникає жоден із протималярійних препаратів (крім хінідину), тому на цей час для лікування церебральної форми він завжди застосовується, але через недостатній його ефект елімінації плазмодія обов'язково додають інші препарати[13].
Велике значення у цій ситуації належить патогенетичній інтенсивній терапії. Хворих у коматозному стані слід класти на бік, оскільки у них часто бувають блювання і судоми. Ректальна температура не повинна перевищувати 38,5 °C, для цього використовують усі можливі способи фізичного зниження температури і з обережністю застосовують жарознижувальні препарати, при цьому ацетилсаліцилова кислота протипоказана, адже здатна нівелювати первинну захисну роль тромбоцитів, які спроможні на ранніх етапах негативно діяти на внутрішньоеритроцитарні форми плазмодіїв[82][83]. Слід забезпечити погодинний контроль за сечовиділенням. При наявності змін, які свідчать про погіршення водного балансу, вводять центральний венозний катетер і обережно проводять регідратацію для підтримки сечовиділення. Занадто енергійне, надмірне введення рідини може призвести до набряку легенів, центральний венозний тиск (ЦВТ) слід підтримувати на рівні не вище 5 см водного стовпа. Хворим із гострою нирковою недостатністю показано проведення гемодіалізу (ефективність перитонеального діалізу при тропічній малярії визнана низькою). Переливання препаратів крові доцільне лише при зниженні гематокриту нижче 20 %. Тяжка тропічна малярія може супроводжуватися кишковою кровотечею, однак частота виникнення її зменшилася з того часу, як відмовилися від використання при малярії гепарину і глюкокортикостероїдів (ГКС). Тромбоцитопенія при малярії явище досить часте, але клінічно виражений синдром дисемінованого внутрішньосудинного згортання (ДВЗ-синдром) практично не зустрічається. ГКС, манітол і гепарин не тільки неефективні при лікуванні церебральної малярії, але й негативно впливають на стан хворого, тому застосовувати зазначені препарати не слід[84][85][86].
Ефективність лікування оцінюють по зміні клінічного стану хворого (наприклад, відновлення свідомості при церебральній формі), зниженню температури тіла, зникненню плазмодіїв із крові. Визначення рівня паразитемії слід проводити 2 рази на добу аж до її повного зникнення, при рецидиві гарячки дослідження крові на наявність малярійних плазмодіїв повторюють. Якщо стан хворого не поліпшується або погіршується раптово на тлі цього лікування не можна виключити можливість гіпоглікемії. Корекція її утруднена, вона схильна до рецидиву, особливо за наявності гіперінсулінемії, яку часто спричинює хінін[13].
Лікування малярії, яку спричинюють P. vivax, P. ovale чи P. malariae[ред. | ред. код]
На сучасному етапі лікування вівакс- і овале-малярії використовують три основні схеми:
- використовують хлорохін 25 мг/кг / добу 3 дні + примахін 0,25 мг/кг 1 раз на добу 14—21 днів.
- при наявності хлорохін-резистентних плазмодіїв переходять на резервну схему: амодіахін 30 мг/кг / добу 3 дні + примахін 0,25 мг/кг 1 раз на добу 14—21 днів.
- якщо вівакс- або овале-малярія виникла в країнах Південно-Східної Азії і Океанії, застосовують хлорохін 25 мг/кг / добу 3 дні + примахін у дозі 0,5 мг/кг 1 раз на добу 14—21 днів.
На даний час накопичено дані, які свідчать про те, що доза примахіну 0,25 мг/кг на добу не забезпечує повну санацію печінки від гіпнозоїтів, що призводить до значного відсотка рецидивів малярії, у зв'язку з чим все ширше розглядається необхідність застосування дози 0,5 мг/кг / добу і навіть ще більші[87]. При лікуванні чотириденної малярії застосовують хлорохін 25 мг/кг / добу 3—5 діб або амодіахін 30 мг/кг / добу. Використання примахіну при цьому виді малярії недоцільне[13].
Лікування малярії у вагітних[ред. | ред. код]
Згідно з рекомендаціями ВООЗ, малярія під час вагітності має бути вилікувана негайно. При цьому слід пам'ятати, що ризик самої малярії для плода значно більший, ніж вплив на нього протималярійних препаратів. Але необхідно при цьому прагнути призначати препарати, найбільш нешкідливі для перебігу вагітності. Похідні артемізиніну станом на 2010-ті роки мають найбільшу терапевтичну цінність, коли лікування жінок на різних термінах вагітності є неминучим. До сьогодні не було зареєстровано несприятливих наслідків застосування похідних артемізиніну в другому і третьому триместрах вагітності, отримані також обмежені дані про успішне використання цього препарату в першому триместрі вагітності[13]. Лікування малярії протималярійними препаратами необхідно починати якомога раніше, одразу ж після виявлення малярії, і здійснювати його систематично і наполегливо. Існує така класифікація протималярійних препаратів для використання при малярії у вагітних:
- безпечні: хлорохін, амодіахін, кліндаміцин, хінін (хоча висока доза може стати причиною викидня), сульфадоксин / піриметамін (хоча не слід призначати в останні місяці вагітності через ризик виникнення у плода ядерної желтухі), прогуаніл, дапсон / піриметамін, піриметамін, мефлохін, похідні артемізиніну;
- препарати з обмеженими даними: маларон, хлорпрогуаніл-дапсон, деякі комбінації артемізиніну з іншими препаратами;
- протипоказані: тетрациклін, доксициклін, прімахін, фенохін, галофантрин[88].
При лікуванні вагітної з вівакс-малярією, призначення примахіну має бути відкладено до післяпологового періоду, або взагалі до закінчення грудного вигодовування народженої дитини. У цей період показана супресивна хіміопрофілактіка хлорохіном (0,5 г щотижня). У безпечний період слід провести повний курс хлорохіну і примахіну[89]. При вираженій анемії (рівень гемоглобіну <70—80 г/л) показано переливання крові. Зважуючи на підвищений обсяг позаклітинної рідини під час вагітності, доцільно переливати еритроцитарну масу. Пацієнтки повинні перебувати у відділенні інтенсивної терапії та отримувати необхідні рідини, кисень, діуретики і штучну вентиляцію за показаннями. Іншим ускладненням у вагітних при малярії є гіпоглікемія, яка може спричинити викликати дистрес-синдром у плода. У всіх вагітних із тропічною малярією, особливо тих, хто отримує хінін, слід кожні 4—6 годин здійснювати моніторинг глюкози крові[90]. Деякі автори вважають за доцільне переривання вагітності при тяжкому перебігу малярії, абсолютним показанням до переривання є розвиток злоякісної анемії[91].
Лікувальна стратегія SBET[ред. | ред. код]
SBET (англ. Standby emergency treatment) — прийом лікарського засобу без контролю з боку лікаря, самолікування протималярійними засобами при підозрі на малярію в разі, коли надання кваліфікованої медичної допомоги неможливо протягом 24 годин від появи перших симптомів хвороби. Ця стратегія може бути застосована тільки як невідкладна допомога при життєвих показаннях. Запроваджена стратегія у 1988 році[92]. Згідно з існуючими положеннями, лікування засобами SBET необхідно починати за таких умов:
- при наявності у мандрівника в ендемічну по малярії зону гарячки вище 37,5 °C і / або таких симптомів, як загальне нездужання, головний і м'язовий біль, озноб чи симптоми ураження шлунково-кишкового тракту;
- з моменту в'їзду на ендемічні території має пройти більше 6 днів;
- надання кваліфікованої медичної допомоги неможливо протягом 24 годин від появи перших ознак хвороби, або при підтвердженні діагнозу малярії в разі, якщо мандрівник може проводити лікування самостійно препаратами, придбаними до від'їзду;
- можливе самостійне зниження температури тіла завдяки застосуванню фізичних методів (кондиціювання, вентиляція тощо), парацетамолу.
- необхідно надати мандрівникові кваліфіковану медичну допомогу при першій нагоді — з метою продовження лікування і виключення інших причин гарячки[93].
Застосування препаратів у стратегії SBET має бути простим і достатньо зрозумілим, щоб зменшити кількість помилок у дозуваннях і дотриманні режиму прийому. Вибір основного препарату для проведення SBET має детермінувати кожна країна по своєму, в залежності від наявності того чи іншого лікарського засобу. ВООЗ рекомендує використовувати для проведення SBET усі протималярійні препарати, що застосовуються для лікування неускладнених форм хвороби.
Використання азитроміцину[ред. | ред. код]
Було показано, що азитроміцин знижує дитячу смертність від усіх причин у країнах Африки на південь від Сахари. Одним із потенційних механізмів цього ефекту є протималярійний ефект азитроміцину, який може допомогти в лікуванні або запобіганні малярії[94][95][96]. Проте в іншому рандомізованому дослідженні не було доказів впливу одноразової пероральної дози азитроміцину на наслідки малярії у дітей віком до 5 років. Індивідуальне лікування дітей азитроміцином одноразовою дозою може бути недостатнім, щоб вплинути на передачу малярії[97].
Виявлено, цей антибіотик сприяє фагоцитозу апоптотичних клітин альвеолярними макрофагами, що дає додаткові можливості в очищенні організму хворого від малярійних плазмодіїв[27].
Профілактика[ред. | ред. код]
Методи, які використовують для запобігання поширення хвороби або щоб захиститися від неї в областях, де малярія ендемічна, включають профілактичні ліки, знищення комарів та запобігання укусам комарів. Наразі немає вакцини проти малярії, але ведуться активні дослідження для її створення. Основи індивідуальної профілактики малярії, особливо для мандрівників в ендемічні райони, в міжнародному медичному просторі описуються як англомовна абревіатура «ABCD»:
- Awareness («обізнаність» — усвідомлення того, що існує ризик малярії);
- Bites («укуси» — попередження і запобігання укусам комарів):
- без нагальної потреби не виходити з приміщень після заходу сонця, при необхідності виходу — використання подовженого одягу для максимально можливого захисту відкритих ділянок шкіри;
- протимоскітна обробка шкіри на ніч, просочення тканин одягу репелентами;
- антимоскітні сітки, просочені перітріном на вікнах, завіси з марлі на входах;
- застосування інсектицидних аерозолів, випарників;
- примусова вентиляція;
- Compliance («прихильність» — спонукання до дії згідно хіміопрофілактичних рекомендацій):
- прийом хлорохіну по 0,5 1 раз на тиждень у регіонах, де поширена нетропічна малярія, починаючи за тиждень до поїздки і весь період перебування там. Подальший прийом після повернення ВООЗ вважає недоцільним без проведення лабораторної діагностики;
- прийом інших протималярійних препаратів у регіонах поширення тропічної малярії або хлорохін-стійкої іншої малярії згідно з рекомендаціями ВООЗ для кожного регіону;
- Diagnosis («діагностика» — при певних ознаках хвороби негайно звертатися до лікарів, особливо там, де поширена тропічна малярія, щоб отримати швидку діагностику і негайне лікування)[98][99].
Профілактичні ліки[ред. | ред. код]
Декілька препаратів, більшість із яких також використовують для лікування малярії, можуть вживатися для профілактики. Загалом, ці ліки приймають щодня або щотижня в нижчій дозі, ніж для лікування. Використання профілактичних ліків рідко практичне для мешканців ендемічних областей і, звичайно, обмежене до короткочасних відвідувачів малярійних областей завдяки потенційно високій вартості та побічним ефектам цих ліків.
З початку XVII століття для профілактики використовували хінін. Поява ефективніших із точки зору профілактики альтернативних препаратів скоротила використання хініну. З набуттям Plasmodium falciparum резистентності до хлорохіну, хінін повернувся, але не для профілактики малярії, а для лікування тропічної малярії.
Сучасні ліки для профілактики включають мефлохін, доксициклін та атовахін-прогуаніл гідрохлорид. Вибір, який препарат приймати, звичайно залежить від резистентності паразитів в області та побічних ефектів. Профілактичний ефект не проявляється негайно, тому слід починати приймати профілактичні ліки за 1—2 тижні до прибуття до небезпечної зони та продовжувати 1—4 тижні після повернення.
Знищення комарів[ред. | ред. код]

Зусилля зі знищення малярії шляхом усунення комарів досягли успіху в деяких областях. Колись малярія була поширена в Сполучених Штатах і Південній Європі, але висушування боліт і покращення санітарії, разом із контролем і лікуванням заражених людей, вивели ці області з ряду небезпечних. Наприклад, у 2002 році у США було зареєстровано 1 059 випадків малярії, зокрема 8 смертей. Проте ці зусилля були поки що не в змозі викорінити малярію в багатьох частинах світу, що розвиваються — проблема найпоширеніша в Африці.
Ефективним засобом проти комарів зарекомендував себе ДДТ. Він був розроблений під час Другої світової війни як перший сучасний інсектицид. Тоді як його спочатку використовували проти малярії, він розповсюдився і на сільське господарство. Згодом контроль сільськогосподарських шкідників замість контролю комарів став переважати у використанні ДДТ, особливо в країнах, що розвиваються. Протягом 1960-х усвідомлення негативних наслідків його нерозбірливого використання збільшилося, і кінець кінцем привело до заборони в багатьох країнах в 1970-х. До того часу його широке використання вже привело до еволюції стійкого до ДДТ комара в багатьох областях. Але зараз є перспектива його можливого повернення. Всесвітня організація охорони здоров'я (ВООЗ) зараз радить використання ДДТ проти малярії в ендемічних областях. Наприклад, ефективне нанесення ДДТ на внутрішні стіни кімнат, де сідають комарі. ВООЗ також рекомендує альтернативні інсектициди в областях, де комарі стійкі до ДДТ, щоб уповільнити еволюцію резистентності[100].
Протикомарині сітки і запобігання укусам[ред. | ред. код]

Протикомарині сітки допомагають відокремити комарів від людей, і тому значно зменшити передачу малярії. Сітки — не ідеальний бар'єр, тому їх часто використовують разом з інсектицидом, якого розпилюють задля того, щоб убити комарів перед тим, як вони знайдуть шлях крізь сітку. Тому сітки, просочені інсектицидами, набагато ефективніші[101].
Для персонального захисту також ефективні закритий одяг та репеленти.
Репеленти — субстанції, які наносять на шкіру або одяг для запобігання контакту з комарами. Вони тільки відганяють, але не вбивають комарів. Репеленти класифіковані у дві категорії: природні і хімічні. Поширені природні репеленти — ефірні олії деяких рослин: цитронемова, німова та лимонникова олії.
Приклади хімічних репелентів включають:
Трансгенні комарі[ред. | ред. код]
Метод безплідних комах розглядають як потенційний метод контролю над комарами. Зараз досягнуто значного прогресу у напрямку розроблення трансгенного або генетично зміненого комара, стійкого до малярії. У 2002 році дві групи вже повідомили про розробку перших зразків подібних комарів[102][103].
Вакцинація[ред. | ред. код]
Зараз багато вакцин проти малярії різного типу дії знаходяться на стадії розробки, проте ефективної вакцини все ще не існує. Перші обнадійливі результати були отримані у 1967 році, коли миші, інфіковані обробленими радіацією плазмодіями, в 60 % випадків були стійкими до повторної інфекції здоровими плазмодіями[104]. З того часу були здійснені подібні дослідження на людях, проте за оцінками для виробітку захисту людина повинна бути вкушена ослабленими комарами понад 1000 разів, що не є практичним[105].
На початку 21 століття були розроблені методи виділення кількості паразитів, еквівалентних великому числу комариних укусів, у чистому вигляді, на клінічні дослідження яких компанія Sanaria [Архівовано 5 вересня 2008 у Wayback Machine.] отримала значні кошти від уряду США та благодійних фондів[106].
Також багато зусиль спрямовано на дослідження процесів утворення імунітету, зокрема було з'ясовано, що найчастіше імунна система утворює антитіла проти білка CSP (англ. circumsporozoite protein) на поверхні спорозоїту[107], що запобігають зараженню гепатоцитів[108]. Зараз на основі CSP ведеться велике число праць із розробки антималярійної вакцини.
Серед потенційно ефективних типів вакцин найбільшою групою є прееретроцитні вакцини (що діють на протозоїв до зараження еритроцитів), включаючи засновані на CSP. Інші кандидати включають ті, що запобігають поширенню протозоїв на стадії зараження крові, ті, що запобігають адгезії до стінок кровоносних судин і плаценти, та ті, що зупиняють розвиток паразиту вже після попадання до тіла комара[109].
Першою вакциною, що вже пройшла через серію клінічних випробувань, є SPf66, розроблена Мануелем Елкіном Патарройо в 1987 році. Ця вакцина являє собою комбінацію антигенів проти паразитів на стадіях спорозоїту та мерозоїту. Кілька випробувань, проведених із моменту розробки до 1993 року, показали досить різноманітні результати, з числом вилікуваних пацієнтів від 0 до 75 %, через що ефективність вакцини все ще залишається недоведеною. Суперечки щодо ефективності цієї вакцини придбали політичного забарвлення, зі звинувачуванням розвинутих країн із боку представників країн, що розвиваються, у неповазі до дослідників з останніх країн.
Другою вакциною стала вакцина, розроблена на основі CSP та білка (Asn-Ala-Pro15Asn-Val-Asp-Pro)2-Leu-Arg(R32LR), зв'язаного з токсином A9 Pseudomonas aeruginosa, проте цього разу результати клінічних досліджень були навіть менш успішними.
Найдовший період клінічних досліджень мала вакцина RTS S/AS02A, розроблена в колаборації «PATH Malaria Vaccine Initiative» (на гроші Фонду Гейтсів), фармацевтичної компанії GlaxoSmithKline і військового інституту Вольтера Ріда[110]. У цій вакцині частини CSP були зв'язані з імуногенним «S-антигеном» вірусу гепатиту B; цей рекомбінантний білок вводився разом з AS02A[109]. У жовтні 2004 року дослідники заявили, що у випробуванні фази IIb на 2 тис. пацієнтів із Мозамбіку вакцина знизила ризик зараження приблизно на 30 % та в понад 50 % випадків знизила важкість захворювання[111]. Випробування I/IIb фази 2007 року на 214 мозамбіцьких дітей від 10 до 18 місяців показало зниження інфекцій на 62 %[112]. Наступні результати випробувань цієї вакцини очікуються в 2011 році[113].
Впровадження перших вакцин у клінічну практику призвело до формування нових стратегій боротьби з малярією, що застопорилася в ряді африканських країн, бо для цих регіонів необхідні нові підходи до боротьби з хворобою. Обнадійливі результати дослідження 2021 року, проведеного серед дітей раннього віку в Буркіна-Фасо та Малі, у якому комбінація вакцини від малярії RTS S/AS01E та сезонної хіміопрофілактики малярії призвела до значного зниження клінічних випадків малярії, тяжкої форми її та летальності від неї. Поєднання вакцинації з періодичним профілактичним лікуванням малярії у немовлят, з періодичною профілактикою малярії під час вагітності шляхом вакцинації жінок репродуктивного віку до чи під час вагітності або з хіміопрофілактикою малярії при лікуванні дітей, госпіталізованих із тяжкою анемією, показало високу ефективність. Іншим потенційним застосуванням комбінації є профілактика малярії у дітей з особливою небезпекою перебігу її. Комбінація вакцини від малярії до розвитку еритроцитарної стадії з ефективною схемою хіміопрофілактики може сприяти контролю та елімінації малярії в різних клінічних або епідеміологічних ситуаціях, і потенціал цього підходу до боротьби з малярією необхідно досліджувати[114].
Примітки[ред. | ред. код]
- ↑ Disease Ontology — 2016.
- ↑ а б в г United States National Library of Medicine Medical Subject Headings
- ↑ Rogerson S. J., Mkundika P., Kanjala M. K. et al. Diagnosis of Plasmodium falciparum malaria at delivery: comparison of blood film preparation methods and of blood films with histology // J. Clin. Microbiol. — ASM, 2003. — Vol. 41, Iss. 4. — P. 1370–1374. — ISSN 0095-1137; 1098-660X; 1070-633X — doi:10.1128/JCM.41.4.1370-1374.2003
- ↑ а б в г д е NDF-RT
- ↑ Inxight: Drugs Database
- ↑ Inxight: Drugs Database
- ↑ History of Malaria: Famous Victims. Malaria Site. Архів оригіналу за 20 червня 2013. Процитовано 13 липня 2008.
- ↑ а б в г WHO. Malaria. Fact sheet. Updated 4 December 2023. [1](англ.)
- ↑ «Malaria Fact Sheet». World Health Organization. Updated April 2017. [Архівовано 3 вересня 2014 у Wayback Machine.] (англ.)
- ↑ В яких країнах можна заразитися малярією. карта ендемічних країн [Архівовано 21 травня 2021 у Wayback Machine.] ЦГЗ МОЗ У(08.05.2019)
- ↑ Greenwood BM, Bojang K, Whitty CJ, Targett GA. Malaria // Lancet. — 2005. — Т. 365. — С. 1487-1498. — PMID 15850634.
- ↑ Malaria Site Сайт з малярії [Архівовано 17 березня 2007 у Wayback Machine.] (англ.)
- ↑ а б в г д е ж и к л м н п р с т у ф х ц ш щ ю я аа аб ав аг ад ае аж аи ак ал ам ан ап ар ас ат ау аф ах ац аш ащ аю ая ба бб бв бг бд бе бж би бк бл бм Голубовская О. А., Шкурба А. В., Колос Л. А. Малярия: монография К. : ВСИ «Медицина», 2015. — 288 с., в тому числі 32 с. цв. вкл. ISBN 978-617-505-419-2
- ↑ S. Braude, J. Varghese The oncoprotective fever hypothesis: Have antibiotics, antimalarials and antipyrectics contributed to the global rise in cancer over the past century? Medical Hypotheses Volume 158, January 2022, 110720 [2] [Архівовано 4 грудня 2021 у Wayback Machine.] (англ.)
- ↑ Anna-Katharina Heuschen, Guangyu Lu, Oliver Razum, Alhassan Abdul-Mumin, Osman Sankoh, Lorenz von Seidlein, Umberto D'Alessandro, Olaf Müller Public health-relevant consequences of the COVID-19 pandemic on malaria in sub-Saharan Africa: a scoping review. Malaria Journal volume 20, Article number: 339 (August 2021) [3] [Архівовано 25 листопада 2021 у Wayback Machine.] (англ.)
- ↑ а б History of Malaria Parasite And Its Global Spread. Malaria Site. Архів оригіналу за 20 червня 2013. Процитовано 13 липня 2008. (англ.)
- ↑ Bruce−Chwatt LJ (1988). «Three hundred and fifty years of the Peruvian fever bark». Br Med J (Clin Res Ed) 296 (6635): 1486–7. doi:10.1136/bmj.296.6635.1486. PMC 1833449. PMID 3134079
- ↑ В українській мові так часто називають гарячку з сильним ознобом.
- ↑ Kaufman T, Rúveda E (2005). «The quest for quinine: those who won the battles and those who won the war». Angewandte Chemie (International Edition in English) 44 (6): 854–85
- ↑ [4] [Архівовано 15 березня 2015 у Wayback Machine.] (англ.)
- ↑ Freedman D. New Engl J Med 2008;359:603–612
- ↑ Myron G. Schultz. Imported malaria. Bull World Health Organ. 1974; 50(3−4): 329—336 (англ.)
- ↑ Пункційну біопсію проводили на 7-й день захворювання у добровольців, яких за тиждень до цього 2 дні поспіль кусали 1728 комарів, заражених P. vivax. Shortt, H. E., Fairley, N. H., Covell, G., Shute, P. G., and Garnham, P. C. C., The pre−erythrocytic stage of Plasmodium falciparum. 1951. Trans. Roy. Soc. Trop. Med. & Hyg. 44 : 405−419. (англ.)
- ↑ Shute P. G. Latency and long−term relapses in benign tertian malaria // Trans. Roy. Soc. Trop. Med. Hyg. 1946. Vol. 40. P. 189−200. (англ.)
- ↑ Krotoski WA, Collins WE, Bray RS, Garnham PCC, Cogswell FB, Gwadz RW, Killick−Kendrick R, Wolf R, Sinden R, Koontz LC, Stanfill PS (1982). «Demonstration of hypnozoites in sporozoite−transmitted Plasmodium vivax infection». Am J Trop Med Hyg 31 (6): 1291–3. (англ.)
- ↑ Esposito, A et al. (2008). Schnur, Joel M.. ed. «FRET Imaging of Hemoglobin Concentration in Plasmodium falciparum−Infected Red Cells». PloS ONE 3 (11): e3780. DOI: 10.1371/journal.pone.0003780. PMC 2582953. PMID 19023444. (англ.)
- ↑ а б в Caroline Lin Lin Chua, Ida May Jen Ng, Bryan Ju Min Yap, Andrew Teo Factors influencing phagocytosis of malaria parasites: the story so far. Malaria Journal volume 20, Article number: 319 (2021). [5] [Архівовано 19 грудня 2021 у Wayback Machine.] (англ.)
- ↑ Silamut K, Phu NH, Whitty C, Turner GD, Louwrier K, Mai NT, Simpson JA, Hien TT, White NJ. A quantitative analysis of the microvascular sequestration of malaria parasites in the human brain. Am J Path 1999; 155: 395−419. (англ.)
- ↑ Brown H, Rogerson S, Taylor T, Tembo M, Mwenechanya J, Molyneux M, Turner G. Bloodbrain barrier function in cerebral malaria in Malawian children. Am J Trop Med Hyg 2001; 64: 207−13. (англ.)
- ↑ Adams S, Brown H, Turner G. Breaking down the blood−brain barrier: signaling a path to cerebral malaria? Trends Parasitol 2002; 18: 360−6 (англ.)
- ↑ Looareesuwan S, Warrell DA, White NJ, Sutharasamai P, Chanthavanich P, Sundaravej K, Juel−Jensen BE, Bunnag D, Harinasuta T. Do patients with cerebral malaria have cerebral oedema? A computed tomography study. Lancet 1983; 1: 434−7. (англ.)
- ↑ Newton CR, Peshu N, Kendall B, Kirkham FJ, Sowunmi A, Waruiru C, Mwangi I, Murphy SA, Marsh K. Brain swelling and ischaemia in Kenyans with cerebral malaria. Arch Dis Child 1994; 70: 281−7. (англ.)
- ↑ Roberts DJ, Craig AG, Barendt AR, Pinches R, Nash G, Marsh K, Newbold CI. Rapid switching to multiple antigenic and adhesive phenotypes in malaria. Nature 1992; 357: 689−92.(англ.)
- ↑ Iñigo Angulo and Manuel Fresno. Cytokines in the Pathogenesis of and Protection against Malaria. Clin Vaccine Immunol November 2002 vol. 9 no. 6 1145−1152. (англ.)
- ↑ Mamoru Niikura, Shin−Ichi Inoue, and Fumie Kobayashi Role of Interleukin−10 in Malaria: Focusing on Coinfection with Lethal and Nonlethal Murine Malaria Parasites. Journal of Biomedicine and Biotechnology. Volume 2011 (2011), Article ID 383962, 8 pages. (англ.)
- ↑ Сюди, зокрема, класифікують малярію, яку спричинює P. knowlesi.
- ↑ William E. Collins and Geoffrey M. Jeffery Plasmodium malariae: Parasite and Disease. Clin. Microbiol. Rev. October 2007, vol. 20, n. 4, 579−592. (англ.)
- ↑ Rojo−Marcos G, Cuadros−González J, Gete−García L, Gómez−Herruz P, López−Rubio M, Esteban−Gutierrez G. Plasmodium ovale infection: description of 16 cases and a review. Enferm Infecc Microbiol Clin. 2011 Mar;29(3):204−8. (англ.)
- ↑ Umbers AJ, Aitken EH, Rogerson SJ. Malaria in pregnancy: small babies, big problem. Trends Parasitol. 2011 Apr;27(4):168−75. (англ.)
- ↑ Brabin BJ, Romagosa C, Abdelgalil S, Menéndez C, Verhoeff FH, McGready R, Fletcher KA, Owens S, D'Alessandro U, Nosten F, Fischer PR, Ordi J. The sick placenta−the role of malaria. Placenta. 2004 May;25(5):359−78. (англ.)
- ↑ Rogerson SJ1, Hviid L, Duffy PE, Leke RF, Taylor DW. Malaria in pregnancy: pathogenesis and immunity. Lancet Infect Dis. 2007 Feb;7(2):105−17. (англ.)
- ↑ Patrick Emmet Duffy, Michal Fried Pregnancy malaria: cryptic disease, apparent solution. Mem. Inst. Oswaldo Cruz vol.106 supl.1 Rio de Janeiro Aug. 2011. (англ.)
- ↑ Sarkar PK, Ahluwalia G, Vijayan VK, Talwar A (2009). «Critical care aspects of malaria». Journal of Intensive Care Medicine 25 (2): 93–103. (англ.)
- ↑ Kanjaksha Ghosh, Kinjalka Ghosh Pathogenesis of anemia in malaria: a concise review. Parasitology Research. November 2007, Volume 101, Issue 6, pp 1463−1469. (англ.)
- ↑ Ekvall, Hakan. Malaria and anemia. Current Opinion in Hematology: March 2003 — Volume 10 — Issue 2 — pp 108−114. (англ.)
- ↑ G. N. Jakeman, A. Saul, W. L. Hogarth and W. E. Collins Anaemia of acute malaria infections in non−immune patients primarily results from destruction of uninfected erythrocytes. Parasitology/ Volume 119 / Issue 02 / August 1999, pp 127−133. (англ.)
- ↑ Claudio T Daniel−Ribeiro, Graziela Zanini Autoimmunity and malaria: what are they doing together? Acta Tropica. Volume 76, Issue 3, 2 October 2000, Pages 205—221. (англ.)
- ↑ Anton Geser, Glen Brubaker and Chris C. Draper. Effect of a malaria suppression program on the incidence of african burkitt's lymphoma. Am. J. Epidemiol. (1989) 129 (4): 740−752. (англ.)
- ↑ K.M.C. Lam, N. Syed, D.H. Crawford, H. Whittle Circulating Epstein−Barr virus−carrying B cells in acute malaria. The Lancet. Volume 337, Issue 8746, 13 April 1991, Pages 876—878. (англ.)
- ↑ Beare NA, Taylor TE, Harding SP, Lewallen S, Molyneux ME (2006). «Malarial retinopathy: a newly established diagnostic sign in severe malaria». American Journal of Tropical Medicine and Hygiene 75 (5): 790–7. (англ.)
- ↑ Richard J. Maude, Nicholas A.V. Beare, Abdullah Abu Sayeed, Christina C. Chang, Prakaykaew Charunwatthana, M. Abul Faiz, Amir Hossain, Emran Bin Yunus, M. Gofranul Hoque, Mahtab Uddin Hasan, Nicholas J. White, Nicholas P.J. Day, and Arjen M. Dondorp. The spectrum of retinopathy in adults with Plasmodium falciparum malaria. Trans R Soc Trop Med Hyg. Jul 2009; 103(7): 665—671. (англ.)
- ↑ Warhurst DC, Williams JE. Laboratory diagnosis of malaria // J Clin Pathol. — 1996. — Т. 49. — С. 533–38. — PMID 8813948. (англ.)
- ↑ Daniel Getacher Feleke, Yonas Alemu, Nebiyou Yemanebirhane Performance of rapid diagnostic tests, microscopy, loop-mediated isothermal amplification (LAMP) and PCR for malaria diagnosis in Ethiopia: a systematic review and meta-analysis. September 2021. Malaria Journal volume 20, Article number: 384 (2021). [6] [Архівовано 25 жовтня 2021 у Wayback Machine.](англ.)
- ↑ New technology allows for rapid diagnosis of Ebola in the Democratic Republic of the Congo [7] [Архівовано 7 червня 2017 у Wayback Machine.] (англ.)
- ↑ Gezahegn Solomon Alemayehu, Alebachew Messele, Kayla Blackburn, Karen Lopez, Eugenia Lo, Daniel Janies, Lemu Golassa Genetic variation of Plasmodium falciparum histidine-rich protein 2 and 3 in Assosa zone, Ethiopia: its impact on the performance of malaria rapid diagnostic tests. Malaria Journal volume 20, Article number: 394. October 2021. [8] [Архівовано 21 жовтня 2021 у Wayback Machine.] (англ.)
- ↑ Ewurama Dedea Ampadu Owusu, Ana Campillo, Jennifer Daily, Xavier C. Ding Acceptance and perceived value of non-invasive malaria diagnostic tests in malaria-endemic countries. Malaria Journal volume 20, Article number: 379 (September 2021) [9] [Архівовано 28 жовтня 2021 у Wayback Machine.] (англ.)
- ↑ Universal access to malaria diagnostic testing. An operational manual. World Health Organization. © Ingram Publishing, November 2011, revised in February 2013. ISBN 978 92 4 150209 2 (NLM classification: WC 750) (англ.)
- ↑ Hempelmann E. (2007). «Hemozoin biocrystallization in Plasmodium falciparum and the antimalarial activity of crystallization inhibitors». Parasitol Res 100 (4): 671–6. (англ.)
- ↑ Pussard E, Verdier F. «Antimalarial 4−aminoquinolines: mode of action and pharmacokinetics». Fundam Clin Pharmacol. 1994; 8(1):1−17. (англ.)
- ↑ Simon L Croft, Stephan Duparc, Sarah J Arbe−Barnes, J C Craft, Chang−Sik Shin, Lawrence Fleckenstein, Isabelle Borghini−Fuhrer and Han−Jong Rim «Review of pyronaridine anti−malarial properties and product characteristics». Malaria Journal 2012, 11:270. (англ.)
- ↑ Davis TM, Hung TY, Sim IK, Karunajeewa HA, Ilett KF (2005). «Piperaquine: a resurgent antimalarial drug». Drugs 65 (1): 75–87. (англ.)
- ↑ Cowman AF, Lew AM (November 1989). «Antifolate drug selection results in duplication and rearrangement of chromosome 7 in Plasmodium chabaudi». Mol. Cell. Biol. 9 (11): 5182–8. (англ.)
- ↑ Jeffrey D. Chulay, William M. Watkins, and David G. Sixsmith «Synergistic Antimalarial Activity of Pyrimethamine and Sulfadoxine against Plasmodium falciparum In Vitro». Am J Trop Med Hyg May 1984 33:325−330. (англ.)
- ↑ «Artemisinin and a new generation of antimalarial drugs». Education in Chemistry. July 2006. http://www.rsc.org/Education/EiC/issues/2006July/Artemisinin.asp [Архівовано 6 жовтня 2015 у Wayback Machine.] (англ.)
- ↑ Aaron L. Baggish and David R. Hill «Antiparasitic Agent Atovaquone». Antimicrob Agents Chemother. 2002 May; 46(5): 1163—1173. (англ.)
- ↑ Mehta, Akul (2011−05−27). «Mechanism of Action of Tetracyclines». Pharmaxchange.info. Retrieved 2012−06−07. (англ.)
- ↑ Lell B, Kremsner PG (2002). «Clindamycin as an Antimalarial Drug: Review of Clinical Trials». Antimicrobial Agents and Chemotherapy 46 (8): 2315–20. (англ.)
- ↑ de Villiers KA, Marques HM, Egan TJ (2008). «The crystal structure of halofantrine−ferriprotoporphyrin IX and the mechanism of action of arylmethanol antimalarials». J. Inorg. Chem. 102 (8): 1660–7. (англ.)
- ↑ Friedman R, Caflisch A. «Discovery of plasmepsin inhibitors by fragment−based docking and consensus scoring». ChemMedChem. 2009 Aug;4(8):1317−26. (англ.)
- ↑ Gabriele Rossi, Martin De Smet, Nimol Khim, Jean-Marie Kindermans, Didier Menard Emergence of Plasmodium falciparum triple mutant in Cambodia. The Lancet. Volume 17, No. 12, p1233, December 2017 (англ.)
- ↑ Arlindo Chidimatembue, Samaly S. Svigel, Alfredo Mayor, Pedro Aíde, Abel Nhama, Lídia Nhamussua and auth. Molecular surveillance for polymorphisms associated with artemisinin-based combination therapy resistance in Plasmodium falciparum isolates collected in Mozambique, 2018. Malaria Journal volume 20, Article number: 398 (2021). [10] [Архівовано 16 жовтня 2021 у Wayback Machine.] (англ.)
- ↑ Moses Ikegbunam, Johnson A. Ojo, Kossiwa Kokou, Ugonna Morikwe, Chukwuemeka Nworu, Chibuzo Uba, et al. Absence of Plasmodium falciparum artemisinin resistance gene mutations eleven years after the adoption of artemisinin-based combination therapy in Nigeria. Malaria Journal volume 20, Article number: 434 (November 2021) [11] [Архівовано 10 листопада 2021 у Wayback Machine.] (англ.)
- ↑ Fatoumata O. Maiga, Mamadou Wele, Sounkou M. Toure, Makan Keita, Cheick Oumar Tangara, Randi R. Refeld et al. Artemisinin-based combination therapy for uncomplicated Plasmodium falciparum malaria in Mali: a systematic review and meta-analysis. Malaria Journal volume 20, Article number: 356 (August 2021)[12] [Архівовано 15 листопада 2021 у Wayback Machine.] (англ.)
- ↑ Elahe Tajbakhsh, Tebit Emmanuel Kwenti, Parya Kheyri, Saeed Nezaratizade, David S. Lindsay, Faham Khamesipour Antiplasmodial, antimalarial activities and toxicity of African medicinal plants: a systematic review of literature. Malaria Journal volume 20, Article number: 349 (August 2021). [13] [Архівовано 22 листопада 2021 у Wayback Machine.] (англ.)
- ↑ WHO. Methods for surveillance of antimalarial drug efficacy. Geneva, World Health Organization, 2009. Available from: [14][недоступне посилання]. (англ.)
- ↑ Dawit Getachew Assefa, Gizachew Yismaw, Eyasu Makonnen Efficacy of dihydroartemisinin-piperaquine versus artemether-lumefantrine for the treatment of uncomplicated Plasmodium falciparum malaria among children in Africa: a systematic review and meta-analysis of randomized control trials. Malaria Journal volume 20, Article number: 340 (August 2021). [15] [Архівовано 7 грудня 2021 у Wayback Machine.] (англ.)
- ↑ Medecins Sans Frontieres, «What is the Cost and Who Will Pay?[недоступне посилання з квітня 2019]»
- ↑ Нобелівська премія з фізіології та медицини — 2015 // Elementy.ru/ — 7/10/2015 [Архівовано 21 травня 2021 у Wayback Machine.](рос.)
- ↑ Формулювання Нобелівського комітету «англ. for her discoveries concerning a novel therapy against Malaria». Ту Юю є фахівцем з традиційної китайської медицини, а своє відкриття вона зробили ще під час правління Мао Цзе Дуна
- ↑ WHO Guidelines for malaria. 16 October 2023. 451 p. / 151 P. [16] (англ.)
- ↑ WHO Guidelines for malaria. 16 October 2023. 451 p. / 161 P. [17] (англ.)
- ↑ Hemmer CJ, Kern P, Holst FG, Nawroth PP, Dietrich M Neither heparin nor acetylsalicylic acid influence the clinical course in human Plasmodium falciparum malaria: a prospective randomized study. The American Journal of Tropical Medicine and Hygiene, 1991, 45(5):608−612. (англ.)
- ↑ Brendan J. McMorran, Vikki M. Marshall, Carolyn de Graaf, Karen E. Drysdale, Meriam Shabbar, Gordon K. Smyth, Jason E. Corbin, Warren S. Alexander, Simon J. Foote Platelets Kill Intraerythrocytic Malarial Parasites and Mediate Survival to Infection. Science 6 February 2009: Vol. 323 no. 5915 pp. 797−800. (англ.)
- ↑ Trampuz A, Jereb M, Muzlovic I, Prabhu R (2003). «Clinical review: severe malaria». Critical Care 7 (4): 315–23. (англ.)
- ↑ Beatrice Namutangula, Grace Ndeezi, Justus S Byarugaba and James K Tumwine Mannitol as adjunct therapy for childhood cerebral malaria in Uganda: A randomized clinical trial. Malaria Journal 2007, 6:138. (англ.)
- ↑ N.J. White The Treatment of Malaria. N Engl J Med 1996; 335:800−806 (англ.)
- ↑ George K John, Nicholas M Douglas, Lorenz von Seidlein, Francois Nosten, Kevin J Baird, Nicholas J White and Ric N Price. Primaquine radical cure of Plasmodium vivax: a critical review of the literature Malaria Journal 2012, 11:280 Doi: 10.1186/1475−2875−11−280 (англ.)
- ↑ THE USE OF ANTIMALARIAL DRUGS. Report of an Informal Consultation. World Health Organization, Geneva. Copyright 2001 by Roll Back Malaria/World Health Organization. — 141 р. (англ.)
- ↑ C. Menendeza, A.F. Fleming, P.L. Alonso Malaria−related Anaemia. Parasitology Today. Volume 16, Issue 11, 1 November 2000, Pages 469—476. (англ.)
- ↑ Clara Menendeza, Alfredo Mayor. Congenital malaria: The least known consequence of malaria in pregnancy. Seminars in Fetal and Neonatal Medicine. Volume 12, Issue 3, June 2007, Pages 207—213. (англ.)
- ↑ Soubra, Said H. Guntupalli, Kalapalatha K. Critical illness in pregnancy: An overview. Critical Care Medicine: October 2005 − Volume 33 − Issue 10 − pp S248−S255. (англ.)
- ↑ Standby Emergency Treatment of Malaria in Travelers [18] [Архівовано 10 травня 2017 у Wayback Machine.] (англ.)
- ↑ Francesco Castelli, Silvia Odolini, Beatrice Autino, Emanuele Foca and Rosario Russo. Malaria Prophylaxis: A Comprehensive Review. Pharmaceuticals (Basel). 2010 Oct; 3(10): 3212–3239. (англ.)
- ↑ Keenan JD, Bailey RL, West SK, Arzika A, Hart J, Weaver J, et al. Azithromycin to reduce childhood mortality in sub-Saharan Africa. N Engl J Med. 2018;378:1583–92.(англ.)
- ↑ Dahl EL, Rosenthal PJ. Multiple antibiotics exert delayed effects against the Plasmodium falciparum apicoplast. Antimicrob Agents Chemother. 2007;51:3485–90. (англ.)
- ↑ Rosenthal PJ. Azithromycin for malaria? Am J Trop Med Hyg. 2016;95:2–4. (англ.)
- ↑ Boubacar Coulibaly, Ali Sié, Clarisse Dah, Mamadou Bountogo, Mamadou Ouattara, Adama Compaoré, Moustapha Nikiema et al. Effect of a single dose of oral azithromycin on malaria parasitaemia in children: a randomized controlled trial. Malaria Journal volume 20, Article number: 360 (August 2021) (англ.)
- ↑ Malaria Prophylaxis. Authored by Dr Laurence Knott, 23 Jul 2014 [19] [Архівовано 13 листопада 2017 у Wayback Machine.] (англ.)
- ↑ WHO. International travel and health. Malaria [20] [Архівовано 6 листопада 2017 у Wayback Machine.] (англ.)
- ↑ WHO frequently asked questions on DDT use for disease vector control (PDF). Архів оригіналу (PDF) за 21 лютого 2007. Процитовано 15 липня 2006.
- ↑ Hull, Kevin. (2006) «Malaria: Fever Wars». PBS Documentary. Архів оригіналу за 11 лютого 2009. Процитовано 6 травня 2020.
- ↑ Imperial College, London, «Scientists create first transgenic malaria mosquito [Архівовано 26 вересня 2006 у Wayback Machine.]», 2000-06-22.
- ↑ Jacobs-Lorena et al, «Researchers genetically alter mosquitoes to impair malaria transmission [Архівовано 23 квітня 2006 у Wayback Machine.]», Case-Western, 2002.
- ↑ Nussenzweig R, Vanderberg J, Most H, Orton C (1967). Protective immunity produced by the injection of x-irradiated sporozoites of plasmodium berghei. Nature. 216 (5111): 160—2. doi:10.1038/216160a0. PMID 6057225.
- ↑ Hoffman SL, Goh LM, Luke TC та ін. (2002). Protection of humans against malaria by immunization with radiation-attenuated Plasmodium falciparum sporozoites. J. Infect. Dis. 185 (8): 1155—64. doi:10.1086/339409. PMID 11930326.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Sanaria Press and Publications. Архів оригіналу за 8 жовтня 2007. Процитовано 19 січня 2009.
- ↑ Zavala F, Cochrane A, Nardin E, Nussenzweig R, Nussenzweig V (1983). Circumsporozoite proteins of malaria parasites contain a single immunodominant region with two or more identical epitopes. J Exp Med. 157 (6): 1947—57. doi:10.1084/jem.157.6.1947. PMID 6189951.
- ↑ Hollingdale M, Nardin E, Tharavanij S, Schwartz A, Nussenzweig R (1984). Inhibition of entry of Plasmodium falciparum and P. vivax sporozoites into cultured cells; an in vitro assay of protective antibodies. J Immunol. 132 (2): 909—13. PMID 6317752.
- ↑ а б Matuschewski K (2006). Vaccine development against malaria. Curr Opin Immunol. 18 (4): 449—57. doi:10.1016/j.coi.2006.05.004. PMID 16765576.
- ↑ Heppner DG, Kester KE, Ockenhouse CF та ін. (2005). Towards an RTS,S-based, multi-stage, multi-antigen vaccine against falciparum malaria: progress at the Walter Reed Army Institute of Research. Vaccine. 23 (17-18): 2243—50. doi:10.1016/j.vaccine.2005.01.142. PMID 15755604.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Alonso PL, Sacarlal J, Aponte JJ та ін. (2004). Efficacy of the RTS,S/AS02A vaccine against Plasmodium falciparum infection and disease in young African children: randomised controlled trial. Lancet. 364 (9443): 1411—20. doi:10.1016/S0140-6736(04)17223-1. PMID 15488216.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Aponte JJ, Aide P, Renom M та ін. (November 2007). Safety of the RTS,S/AS02D candidate malaria vaccine in infants living in a highly endemic area of Mozambique: a double blind randomised controlled phase I/IIb trial. Lancet. 370 (9598): 1543—51. doi:10.1016/S0140-6736(07)61542-6. PMID 17949807.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Africa: Malaria — Vaccine Expected in 2011. [Архівовано 11 січня 2007 у Wayback Machine.] Accra Mail. [Архівовано 27 лютого 2019 у Wayback Machine.] 9 January 2007. Accessed 15 January 2007.
- ↑ Brian Greenwood, Matthew Cairns, Mike Chaponda, R. Matthew Chico et al. Combining malaria vaccination with chemoprevention: a promising new approach to malaria control. Malaria Journal volume 20, Article number: 361 (September 2021) [21] [Архівовано 1 листопада 2021 у Wayback Machine.] (англ.)
Джерела[ред. | ред. код]
- Голубовская О. А., Шкурба А. В., Колос Л. А. Малярия: монография К. : ВСИ «Медицина», 2015. — 288 с., в тому числі 32 с. цв. вкл. ISBN 978-617-505-419-2 (рос.)
- Інфекційні хвороби (підручник) (за ред. О. А. Голубовської). — Київ: ВСВ «Медицина» (2 видання, доповнене і перероблене). — 2018. — 688 С. + 12 с. кольор. вкл. (О. А. Голубовська, М. А. Андрейчин, А. В. Шкурба та ін.) ISBN 978-617-505-675-2 / с. 420—441
- Thomas E Herchline, Ryan Q Simon Malaria. Updated: May 11, 2023. Medscape //Drugs & Diseases // Infectious Diseases // Chief Editor Michael Stuart Bronze [22] (англ.)
- WHO Home/Health topics/Malaria [23] (англ.)
- David A. Warrell, Janet Hemingway, Kevin Marsh, Robert E. Sinden, Geoffrey A. Butcher and Robert W. Snow Malaria // Oxford Textbook of Medicine. Edited by David A. Warrell, Timothy M. Cox and John D. Firth. May 2010. ch. 7. e-ISBN 9780199570973 (англ.)
- WHO Guidelines for malaria. 16 October 2023. 451 p. [24] (англ.)
- WHO. Malaria. Key facts. 4 December 2023 [25] (англ.)
Література[ред. | ред. код]
- Малярія: паразитологія, епідеміологія, імунітет, діагностика та лікування: навч. посібник / К. І. Бодня [та ін.]; Центральний методичний кабінет з вищої медичної освіти, Харківська медична академія післядипломної освіти. — Х.: [б. в.], 2003. — 124 с.: рис., табл. — Бібліогр.: с. 123. — ISBN 966-623-311-8
- Протималярійні лікарські засоби: Хінін та його аналоги за фармакологічною дією: навч. посіб. / С. І. Коваленко, О. В. Кривошей, О. Ю. Воскобойнік та ін. — Запоріжжя: ЗДМУ, 2018. — 328 с. — ISBN 966-417-161-1.
- T V Rajan Textbook of Medical Parasitology. BI Publications Pvt Ltd, 2008—200 pages. ISBN 978-81-7225-317-2 (англ.)
- Сучасні підходи до лікування різних видів малярії з урахуванням засад доказової інфектології. А. С. Сидорчук, В. Д. Москалюк // Клінічна та експериментальна патологія. 2020. Т. 19, № 3 (73). — С. 202—207. DOI: https://doi.org/10.24061/1727-4338.XIX.3.73.2020.28 (англ.)
- ПОСТАНОВА, 07.11.2011 N 19 Про заходи щодо профілактики малярії в Україні [Архівовано 21 травня 2021 у Wayback Machine.] ДСЕС(21/05/2021)
Посилання[ред. | ред. код]
- Малярія на сайті Likar.org.ua
- Малярія в Україні [недоступне посилання з листопада 2018]
- Пропасниця, лихоманка, трясця, трясовиця (про малярію) // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Накладом Адміністратури УАПЦ в Аргентині. — Буенос-Айрес, 1963. — Т. 6, кн. XII : Літери По — Риз. — С. 1516-1517. — 1000 екз.
- Сайт ВООЗ про малярію [Архівовано 25 лютого 2012 у Wayback Machine.] (англ.)
- Презентація на тему: Малярія [Архівовано 25 серпня 2021 у Wayback Machine.]
| ||||||||||||||||||||||||||||||||||
|
|
|
Ця стаття належить до вибраних статей Української Вікіпедії. |

